病原細菌受體介導的c-di-GMP信號傳導及其調控機制
楊鳳環, 田 芳, 陳華民, 何晨陽
(中國農業科學院植物保護研究所, 植物病蟲害生物學國家重點實驗室, 北京 100193)
病原細菌受體介導的c-di-GMP信號傳導及其調控機制
楊鳳環, 田 芳, 陳華民, 何晨陽*
(中國農業科學院植物保護研究所, 植物病蟲害生物學國家重點實驗室, 北京 100193)
細菌第二信使環二鳥苷酸(c-di-GMP)信號網絡系統主要涉及信號代謝、識別、接受、傳遞、功能表達和調控。c-di-GMP胞內水平受到鳥苷酸環化酶(DGC)和磷酸二酯酶(PDE)的控制。c-di-GMP信號受體類型多樣,包括轉錄調控因子、PilZ結構域蛋白、退化的GGDEF和EAL結構域蛋白、核糖體開關、多核苷酸磷酸化酶和新發現的蛋白激酶等。c-di-GMP受體接受信號后,可以在轉錄、翻譯以及翻譯后水平上對下游靶標進行調控,從而影響細菌的毒性、運動性、生物膜形成、細胞分裂等生理生化過程。本文結合本實驗室對水稻白葉枯病菌的研究結果,綜述了近年來國內外在c-di-GMP信號受體介導的調控機制等方面的研究進展。
c-di-GMP; 信號代謝; 受體; 傳導; 調控
在復雜的生境中,細菌需要感知、轉導、傳遞來自細胞內外的信號。第二信使小分子核苷酸是細菌細胞信號傳遞的重要載體,可將外界信號轉換成胞內受體可感知的化學小分子[1]。環二鳥苷酸(c-di-GMP)是20世紀80年代在葡糖酸醋酸桿菌中發現的纖維素合成酶異構激活因子[2]。隨后的研究表明,c-di-GMP是細菌中普遍存在的全新第二信使[3-6]。含有GGDEF結構域的鳥苷酸環化酶(DGC)和含有EAL或者HD-GYP結構域的磷酸二酯酶(PDE)分別控制了信號合成和降解[7]。c-di-GMP信號分子可通過與受體結合,從而調控細菌生物膜形成、運動性和毒性等重要的生物學表型[3-6]。c-di-GMP信號代謝、受體感應及調控機制的研究是病原細菌研究領域的熱點之一。近年來,在c-di-GMP受體介導的調控機制方面取得了重要的研究進展。本文結合本實驗室對水稻白葉枯病菌Xanthomonasoryzaepv.oryzaec-di-GMP受體功能的研究結果,綜述了近年來國內外該領域的最新進展。
1 c-di-GMP信號途徑的組成
c-di-GMP信號網絡主要包括4個組成部分:含有GGDEF結構域的DGC、含有EAL或者HD-GYP結構域的PDE、信號受體以及下游靶標蛋白[3-5](圖1)。在c-di-GMP信號途徑中,DGC或PDE可感應來自胞內外的環境信號,影響其c-di-GMP代謝酶活性,進而影響胞內c-di-GMP水平,下游通過信號受體的感應、實現c-di-GMP信號的輸出,即調控下游基因或靶標蛋白的表達[6]。c-di-GMP信號網絡的4個組成部分在細菌中廣泛存在。因此,不同細菌中的調節過程也復雜多樣。
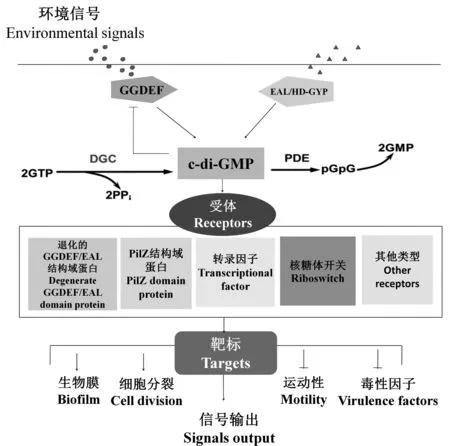
圖1 細菌c-di-GMP信號調控網絡模式[3-6]Fig.1 Bacterial c-di-GMP signaling pathway[3-6]
2 c-di-GMP信號代謝的調控網絡
在葡糖酸醋酸桿菌Acetobacterxylinum研究中發現,c-di-GMP可作為纖維素合成酶的異構激活因子[2]。在細菌體內c-di-GMP的代謝水平主要受到DGC和PDE的控制[8]。DGC可將兩分子GTP合成一分子c-di-GMP,PDE將c-di-GMP降解為線性的二核苷酸pGpG、進而降解為GMP。許多DGC或PDE具有REC、PAS和HAMP等感應結構域,可感應來自環境的小分子、氧化還原、光、磷酸化、營養和抗生素等信號,從而調控胞內c-di-GMP水平[9]。一般細菌可同時編碼多個GGDEF和EAL結構域蛋白[7]。目前已經鑒定出多個具有DGC和PDE酶活性的相關蛋白,例如新月柄桿菌Caulobactercrescentus的鳥苷酸環化酶PleD、銅綠假單胞菌Pseudomonasaeruginosa的鳥苷酸環化酶WspR、DgcP和磷酸二酯酶DipA、霍亂弧菌Vibriocholerae的磷酸二酯酶VieA等[10-14]。水稻白葉枯病菌PXO99A共有26個c-di-GMP代謝相關蛋白,14個蛋白具有信號感應結構域。其中含有GGDEF、EAL和REC結構域蛋白PdeR具有PDE活性,與上游組氨酸激酶PdeK組成一對雙組分調控系統,參與c-di-GMP代謝和病菌毒性的調節[15]。
3 c-di-GMP信號受體介導的調控機制
c-di-GMP通過與信號受體結合,改變受體空間構象及其功能,影響下游基因表達或相關酶活性,從而調控細菌生物膜形成、細胞分裂、運動性及毒性因子表達等生理生化過程[1,3-5]。已鑒定的信號受體包括轉錄調控因子、 PilZ結構域蛋白、退化的GGDEF和EAL結構域蛋白、 核糖體開關、多核苷酸磷酸化酶(PNPase)以及新發現的蛋白激酶六類。c-di-GMP受體接受信號后可以在轉錄、翻譯以及翻譯后水平對下游靶標進行調控[5, 16]。
3.1 轉錄調控因子受體介導的轉錄調控作用
轉錄調控因子可作為c-di-GMP受體,通過與調控序列的結合調控基因轉錄,形成c-di-GMP轉錄水平上的調控網絡。銅綠假單胞菌FleQ 蛋白是第一個被鑒定的、作為信號受體的轉錄調控因子。FleQ不僅通過激活鞭毛合成基因轉錄、調控鞭毛的產生,而且通過AAA結構域與c-di-GMP結合,抑制了FleQ與調控胞外多糖產生的pel啟動子結合,從而調控細菌胞外多糖產生[17]。另外一種作為c-di-GMP受體的轉錄調控因子為CRP 家族蛋白。CRP/FNR家族蛋白C端具有cNMP結構域和N端具有HTH結構域。與FleQ作用方式不同,與c-di-GMP的結合可使CRP 蛋白行使轉錄因子活性,增強其與靶標DNA的結合作用。大腸桿菌EscherichiacoliCRP蛋白、霍亂弧菌CRP家族蛋白VpsT以及克雷伯氏肺炎桿菌KlebsiellapneumoniaePliZ結構域轉錄因子MrkH與c-di-GMP結合后行使轉錄調控活性[18-22];新洋蔥伯克霍爾德菌BurkholderiacenocepaciaCRP/FNR家族蛋白成員Bcam139則通過與c-di-GMP結合,加強了與靶標DNA的結合作用[23]。
水稻白葉枯病菌轉錄調控因子Clpxoo蛋白與cAMP受體CRP蛋白同源,可與c-di-GMP結合,參與細菌鞭毛運動性、胞外多糖產生、H2O2抗性以及毒性的調控[24-25]。采用ChIP-seq方法,從病菌基因組中鑒定了78個與Clpxoo結合的基因啟動子,這些基因的功能涉及毒性因子產生、核苷酸代謝、蛋白分泌、信號感應以及鞭毛合成等(待發表資料)。
3.2 PilZ蛋白受體介導的翻譯后調節作用
PilZ結構域是最早發現可以與c-di-GMP結合的結構域,隨后試驗進一步從銅綠假單胞菌中鑒定出來,命名為PilZ結構域[26]。PliZ結構域中保守殘基RXXXR和D/NXSXXG是與c-di-GMP結合的關鍵位點[26]。c-di-GMP 與PilZ 蛋白結合后會引起蛋白結構發生改變,從而激活受體;通過蛋白與蛋白的互作、調控目標基因表達或蛋白活性和功能。YcgR和BcsA是兩個最早證實作為c-di-GMP 受體的PliZ家族成員。大腸桿菌和沙門氏菌YcgR通過與鞭毛的啟動成分FliG和FliM 互相作用調控運動性,而BcsA在與c-di-GMP結合的情況下具有調控纖維素合成的酶活性[27]。細菌基因組通常編碼一個或多個PilZ結構域蛋白,不同蛋白在與c-di-GMP結合時調控不同的生物學功能。銅綠假單胞菌有7個PilZ結構域蛋白,其中2個參與調控細菌運動性,而Alg44參與調控海藻酸的產生[28-29];霍亂弧菌存在5個PilZ結構域蛋白,其中3個參與調控細菌的運動性以及生物膜的形成[30]。
水稻白葉枯病菌有3個PilZ蛋白,其中PXO_00049和PXO_02374具有保守的PilZ結構域,作為受體與c-di-GMP結合,而PXO_02715不能直接與c-di-GMP結合[31]。3個PilZ蛋白對病菌毒性和運動性的調控功能也不盡相同。例如PXO_00049負向調控毒性、正向調控運動性,PXO_02374負向調控毒性和運動性,PXO_02715正向調控毒性、負向調控運動性。然而,這些PilZ蛋白均不參與病菌EPS產生和生物膜形成的調控。PXO_00049 和PXO_02374定位細菌兩極和中間位置,而PXO_02715卻定位于細菌周身。PXO_02374可能通過與下游蛋白的互作,參與病菌毒性調控(待發表資料)。
3.3 退化的GGDEF/EAL蛋白受體介導的蛋白質-蛋白質互作
一些具有退化的GGDEF或EAL結構域蛋白不具有DGC或者PDE活性,但可通過GGDEF結構域中變構的I位點(RXXD殘基)、或者EAL結構域中的接觸位點與c-di-GMP結合,行使信號受體的功能。新月柄桿菌GGDEF結構域蛋白PopA、霍亂弧菌GGDEF結構域蛋白CdgG都可通過其I位點與c-di-GMP結合,參與調控細菌細胞周期進程、菌體褶皺狀態、生物膜形成以及運動性[32-33]。最新研究發現,在大腸桿菌、沙門氏菌SalmonellaLignieres和克雷白氏桿菌Klebsiellapneumoniae的BcsE蛋白GIL結構域中,RxGD殘基與GGDEF結構域中的I位點類似,同樣可與c-di-GMP結合[34]。熒光假單胞菌PseudomonasfluorescensLapD、銅綠假單胞菌和柑橘潰瘍病菌Xanthomonascampestrispv.citriFimX都可通過退化的EAL結構域與c-di-GMP結合;FimX還可與下游退化的PilZ結構域蛋白互作,與菌毛合成相關蛋白形成復合體,從而影響運動性[35-38]。
水稻白葉枯病菌Filp蛋白含有退化的GGDEF和EAL結構域,不具有c-di-GMP代謝酶活性,但是可以通過EAL結構域與c-di-GMP進行結合。Filp可通過與下游PilZ結構域蛋白PXO_02715互作,調控了病菌毒性和致敏性[39]。最新的蛋白組學分析發現,Filp和PXO_02715共調控了100多個下游靶標蛋白的表達,包括雙組分調控系統激酶、c-di-GMP代謝相關蛋白以及TonB類受體等(待發表資料)。這些蛋白功能的解析將有助于闡明c-di-GMP受體介導的毒性調控機理。
3.4 核糖體開關受體介導的轉錄后調節作用
核糖體開關(riboswitch)是一類存在于mRNA中的非編碼部分,作為c-di-GMP非蛋白類受體在細菌中普遍存在[40]。核糖體開關可直接結合c-di-GMP,導致mRNA二級結構發生改變,從而調控基因轉錄過程的mRNA元件。目前已發現來自霍亂弧菌的Class I和來自艱難梭狀芽胞桿菌Clostridiumdifficile的Class II兩類核糖體受體[41-43],這兩類核糖體開關與c-di-GMP結合的保守序列和結構完全不同,其中Class I是細菌中c-di-GMP信號主要的核糖體開關受體[41-42]。c-di-GMP與核糖體開關的結合,不僅豐富了c-di-GMP所調控的基因種類,也實現了c-di-GMP對相關基因的轉錄后調控。
3.5 PNPase受體介導的RNA代謝催化作用
多核苷酸磷酸化酶(PNPase)在細菌體內可行使3′多聚核糖核苷酸聚合酶活性,或者3′-5′的核糖核酸外切酶活性,參與mRNA反轉錄和核糖體RNA前體合成[44-45]。在大腸桿菌中,PNPase可與DosC(氧感應DGC)和DosP(氧感應PDE)形成復合體。當環境中氧信號水平降低時,PNPase從與DosC-DosP的復合體上解離,DosC呈現DGC酶活性,增加了胞內的c-di-GMP水平,PNPase與c-di-GMP結合激活其核糖核酸外切酶活性;當環境中氧信號水平上升時,DosC與DosP相互結合,激活DosP的PDE酶活性,降低c-di-GMP水平,PNPase失去催化能力[43]。PNPase通過與c-di-GMP的結合,調控了細菌中依賴于氧信號的RNA加工。
3.6 蛋白激酶受體介導的細胞分化調控作用
蛋白激酶CckA是在新月柄桿菌中最新發現的c-di-GMP受體。c-di-GMP可直接與CckA結合,從而抑制后者的蛋白激酶活性,促進磷酸酶活性,加速其從激酶到磷酸酶的過渡[46]。在細菌分化階段,c-di-GMP利用對CckA的空間調控設置未來子細胞復制的不對稱。新月柄桿菌雙組分系統中反應調控蛋白PleD、感應激酶DivL、反應調控蛋白DivK都參與細菌的分化調控[47],使CckA在不同的調控模式間轉換。當PleD定位于游動細胞時,PleD和DivK處于脫磷酸化狀態,CckA與DivL直接作用激活下游的CtrA,從而阻礙復制的開始;當感應激酶DivJ出現在柄狀細胞時,PleD和DivK磷酸化,使CckA進入磷酸酶模式,不能激活CtrA。c-di-GMP在柄桿菌細菌中是一個細胞周期蛋白相似分子,可協調細胞形態形成過程中染色體的復制。此外,在根癌農桿菌Agrobacteriumtumefaciens中也存在c-di-GMP通過全局調控因子調控細菌毒性和生存的機制[48]。可見c-di-GMP對細菌周期及其分化的調控可能是一個普遍的調控機制。
4 結語
c-di-GMP信號作為在細菌中廣泛存在的第二信使,在生物學進程的調控中發揮了至關重要的作用,已經成為細菌中研究最為廣泛和深入的信號分子之一。盡管對c-di-GMP信號代謝及其與受體互作的分子機制已經有了一定的認識,但是對于c-di-GMP新受體的結構與功能鑒定、c-di-GMP信號在不同水平上的調控差異和級聯效應、c-di-GMP與其他信號系統的整合等都是未來需要解決的關鍵科學問題。本實驗室多年來的研究表明,在水稻白葉枯病菌中存在一個c-di-GMP信號產生/降解、識別、接受和傳遞、表型和功能表達的調控途徑。3種不同類型的信號受體(Filp、PilZ和Clpxoo)的鑒定及其介導的毒性調控機理的解析,為揭示水稻白葉枯病菌c-di-GMP信號分子機制奠定了堅實的基礎(圖2)。進一步運用組學等方法,對信號受體的全局性調控作用以及它們在c-di-GMP信號網絡中的交互和協同作用進行解析,可為全面闡明揭示水稻白葉枯病菌c-di-GMP信號途徑及其對毒性表達的調控機制提供更多的科學依據。
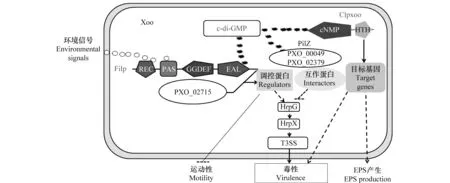
圖2 水稻白葉枯病菌c-di-GMP受體介導的調控作用模式Fig.2 A working model for c-di-GMP receptor-mediated regulation in Xanthomonas oryzae pv. oryzae
[1] Hengge R, Grundling A, Jenal U, et al. Bacterial signal transduction by c-di-GMP and other nucleotide second messengers [J]. Journal of Bacteriology, 2016, 198:15-26.
[2] Ross P, Weinhouse H, Aloni Y, et al. Regulation of cellulose synthesis inAcetobacterxylinumby cyclic diguanylic acid [J]. Nature, 1987, 325: 279-281.
[3] Romling U, Gomelsky M, Galperin M Y. C-di-GMP: the dawning of a novel bacterial signalling system [J]. Molecular Microbiology, 2005, 57: 629-639.
[4] Hengge R. Principles of c-di-GMP signalling in bacteria [J]. Nature Reviews Microbiology, 2009, 7:263-273.
[5] Romling U, Galperin M Y, Gomelsky M. Cyclic di-GMP: the first 25 years of a universal bacterial second messenger [J]. Microbiology and Molecular Biology Reviews, 2013, 77(1): 1-52.
[6] Sondermann H, Shikuma N J, Yildiz FH. You’ve come a long way: c-di-GMP signaling [J]. Current Opinion in Microbiology, 2012, 15:140-146.
[7] Schirmer T, Jenal U. Structural and mechanistic determinants of c-di-GMP signalling [J]. Nature Reviews Microbiology, 2009, 7(10): 724-735.
[8] Bordeleau E, Fortier L C, Malouin F, et al. c-di-GMP turn-over inClostridiumdifficileis controlled by a plethora of diguanylate cyclases and phosphodiesterases [J]. PLoS Genetics, 2011, 7:e1002039.
[9] Simm R, Morr M, Kader A, et al. GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility [J]. Molecular Microbiology, 2004, 53:1123-1134.
[10]Paul R, Abel S, Wassmann P, et al. Activation of the diguanylate cyclase PleD by phosphorylation-mediated dimerization [J]. The Journal of Biological Chemistry, 2007, 282: 29170-29177.
[11]Goymer P, Kahn S G, Malone J G, et al. Adaptive divergence in experimental populations ofPseudomonasfluorescensII. Role of the GGDEF regulator WspR in evolution and development of the wrinkly spreader phenotype [J]. Genetics, 2006, 173(2): 89-99.
[12]Aragon I M, Perez-Mendoza D, Moscoso J A, et al. Diguanylate cyclase DgcP is involved in plant and humanPseudomonasspp. infections [J]. Environmental Microbiology,2015,17(11):4332-4351.
[13]Dey A K, Bhagat A, Chowdhury R. Host cell contact induces expression of virulence factors and VieA, a cyclic di-GMP phosphodiesterase inVibriocholerae[J]. Journal of Bacteriology, 2013, 195: 2004-2010.
[14]Roy A B, Petrova O E, Sauer K. The phosphodiesterase DipA (PA5017) is essential forPseudomonasaeruginosabiofilm dispersion [J]. Journal of Bacteriology, 2012, 194: 2904-2915.
[15]Yang Fenghuan, Tian Fang, Sun Lei, et al. A novel two-component system PdeK/PdeR regulates c-di-GMP turnover and virulence ofXanthomonasoryzaepv.oryzae[J]. Molecular Plant-Microbe Interactions, 2012, 25(10):1361-1369.
[16]Chou S H, Galperin M Y. Diversity of c-di-GMP-binding proteins and mechanisms [J].Journal of Bacteriology, 2015, doi:10.1128/JB.00333-15.
[17]Hickman J W, Harwood C S. Identification of FleQ fromPseudomonasaeruginosaas a c-di-GMP-responsive transcription factor [J]. Molecular Microbiology, 2008, 69(2):376-389.
[18]Jonas K, Melefors O, Romling U. Regulation of c-di-GMP metabolism in biofilms [J]. Future Microbiology, 2009, 4(3): 341-358.
[19]Krasteva P V, Fong J C, Shikuma N J, et al.VibriocholeraeVpsT regulates matrix production and motility by directly sensing cyclic di-GMP [J]. Science, 2010, 327: 866-868.
[20]Wilksch J J, Yang J, Clements A, et al. MrkH, a novel c-di-GMP-dependent transcriptional activator, controlsKlebsiellapneumoniaebiofilm formation by regulating type 3 fimbriae expression [J]. PLoS Pathogens, 2011, 7: e1002204.
[21]Yang J, Wilksch J J, Tan J W, et al. Transcriptional activation of the mrkA promoter of theKlebsiellapneumoniaetype 3 fimbrial operon by the c-di-GMP-dependent MrkH protein [J]. PLoS ONE, 2013, 8:e79038.
[22]Tan J W, Wilksch J J, Hocking D M, et al. Positive autoregulation of mrkHI by the cyclic di-GMP-dependent MrkH protein in the biofilm regulatory circuit ofKlebsiellapneumoniae[J]. Journal of Bacteriology, 2015, 197: 1659-1667.
[23]Fazli M, O’Connell A, Nilsson M, et al. The CRP/FNR family protein Bcam1349 is a c-di-GMP effector that regulates biofilm formation in the respiratory pathogenBurkholderiacenocepacia[J]. Molecular Microbiology, 2011, 82: 327-341.
[24]管文靜,吳茂森,何晨陽.水稻白葉枯病菌核苷酸信號受體蛋白Clpxoo的分子鑒定及其功能分析 [J].微生物學報,2009, 49(1): 32-37.
[25]李波,田芳,陳華民,等.c-di-GMP 抑制轉錄調控因子Clpxoo與葡聚糖酶基因啟動子的結合 [J].微生物學報,2013, 53(11): 1116-1171.
[26]Amikam D, Galperin M Y. PilZ domain is part of the bacterial c-di-GMP binding protein [J].Bioinformatics, 2006, 22(1):3-6.
[27]Ryjenkov D A, Simm R, Romling U, et al. The PilZ domain is a receptor for the second messenger c-di-GMP: the PilZ domain protein YcgR controls motility in enterobacteria [J].The Journal of Biological Chemistry, 2006, 281(41): 30310-30314.
[28]Merighi M, Lee V T, Hyodo M, et al. The second messenger bis-(3′-5′)-cyclic-GMP and its PilZ domain-containing receptor Alg44 are required for alginate biosynthesis inPseudomonasaeruginosa[J]. Molecular Microbiology, 2007, 65(4): 876-895.
[29]Whitney J C, Whitfield G B, Marmont L S, et al. Dimeric c-di-GMP is required for post-translational regulation of alginate production inPseudomonasaeruginosa[J]. The Journal of Biological Chemistry, 2015, 290:12451-12462.
[30]Pratt J T, Tamayo R, Tischler A D, et al. PilZ domain proteins bind cyclic diguanylate and regulate diverse processes inVibriocholerae[J]. The Journal of Biological Chemistry, 2007, 282(17): 12860-12870.
[31]Yang Fenghuan, Tian Fang, Chen Huamin, et al. TheXanthomonasoryzaepv.oryzaePilZ-domain proteins function differentially in cyclic di-GMP binding, and regulation of virulence and motility [J]. Applied and Enviromental Microbiology, 2015, 81(13): 4358-4367.
[32]Ozaki S, Schalch-Moser A, Zumthor L, et al. Activation and polar sequestration of PopA, a c-di-GMP effector protein involved inCaulobactercrescentuscell cycle control [J]. Molecular Microbiology, 2014, 94: 580-594.
[33]Beyhan S, Odell L S, Yildiz F H. Identification and characterization of cyclic diguanylate signaling systems controlling rugosity inVibriocholerae[J]. Journal of Bacteriology, 2008, 190: 7392-7405.
[34]Fang X, Ahmad I, Blanka A, et al. GIL, a new c-di-GMP-binding protein domain involved in regulation of cellulose synthesis in enterobacteria [J]. Molecular Microbiology, 2014, 93: 439-452.
[35]Newell P D, Monds R D, O’Toole G A. LapD is a bis-cyclic dimeric GMP-binding protein that regulates surface attachment byPseudomonasfluorescensPf0-1 [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106: 3461-3466.
[36]Guzzo C R, Salinas R K, Andrade M O, et al. PILZ protein structure and interactions with PILB and the FIMX EAL domain: implications for control of type IV pilus biogenesis [J].Journal of Molecular Biology, 2009, 393(4): 848-866.
[37]Guzzo C R, Dunger G, Salinas R K, et al. Structure of the PilZ-FimXEAL-c-di-GMP complex responsible for the regulation of bacterial Type IV pilus biogenesis [J]. Journal of Molecular Biology, 2013, 425(12): 2174-2197.
[38]Navarro M V, De N, Bae N, et al. Structural analysis of the GGDEF-EAL domain-containing c-di-GMP receptor FimX [J]. Structure, 2009, 17(8): 1104-1116.
[39]Yang Fenghuan, Tian Fang, Li Xiaotong, et al. The degenerate EAL-GGDEF domain protein Filp functions as a cyclic di-GMP receptor and specifically interacts with the PilZ-domain protein PXO_02715 to regulate virulence inXanthomonasoryzaepv.oryzae[J]. Molecular Plant-Microbe Interactions, 2014, 6(27): 578-589.
[40]Lee E R, Baker J L, Weinberg Z, et al. An allosteric self-splicing ribozyme triggered by a bacterial second messenger [J]. Science, 2010, 329(5993): 845-848.
[41]Smith K D, Lipchock S V, Livingston A L, et al. Structural and biochemical determinants of ligand binding by the c-di-GMP riboswitch [J]. Biochemistry, 2010, 49:7351-7359.
[42]Smith K D, Lipchock SV, Ames TD, et al. Structural basis of ligand binding by a c-di-GMP riboswitch [J]. Nature Structural & Molecular Biology, 2009, 16:1218-1223.
[43]Bordeleau E, Purcell E B, Lafontaine D A, et al. Cyclic di-GMP riboswitch-regulated type IV pili contribute to aggregation ofClostridiumdifficile[J]. Journal of Bacteriology, 2015, 197: 819-832.
[44]Tuckerman J R, Gonzalez G, Gilles-Gonzalez M A, et al. Cyclic di-GMP activation of polynucleotide phosphorylase signal-dependent RNA processing [J]. Journal of Molecular Biology, 2011, 407(5): 633-639.
[45]Wang Y C, Chin K H, Chuah M L, et al. Crystallization and preliminary X-ray diffraction studies ofXanthomonascampestrisPNPase in the presence of c-di-GMP [J]. Acta Crystallographica Section F, 2012, 68(10): 1247-1250.
[46]Lori C, Ozaki S, Steiner S, et al. Cyclic di-GMP acts as a cell cycle oscillator to drive chromosome replication [J]. Nature, 2015, 523(7559): 236-239.
[47]Tsokos C G, Perchuk B S, Laub M T. A dynamic complex of signaling proteins uses polar localization to regulate cell-fate a symmetry inCaulobactercrescentus[J]. Developmental Cell, 2011, 20(3): 329-341.
[48]Barnhart D M, Su S, Farrand S K. A signaling pathway involving the diguanylate cyclase CelR and the response regulator DivK controls cellulose synthesis inAgrobacteriumtumefaciens[J]. Journal of Bacteriology, 2014, 196: 1257-1274.
(責任編輯:田 喆)
Cyclic di-GMP signal receptor-mediated regulation of bacterial behaviors
Yang Fenghuan, Tian Fang, Chen Huamin, He Chenyang
(StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
The bacterial second message c-di-GMP signaling pathways mainly involve signal metabolism, signal recognition by receptor, reception and transduction, and phenotype expression and regulation. The intracellular level of c-di-GMP is precisely controlled by diguanylate cyclases (DGC) and phosphodiesterase (PDE) via biosynthesis or degradation, respectively. Several c-di-GMP receptors have been identified and characterized from various bacterial species, including transcription regulator, PilZ-domain protein, degenerate GGDEF or EAL domain protein, polynucleotide phosphorylase (PNPase), riboswitch and kinase, etc. The c-di-GMP receptors exert their regulatory functions at the transcription, translation, and post-translation levels, and regulate multiple bacterial properties including virulence, biofilm formation, motility and cell division. The recent progresses in c-di-GMP receptor-mediated regulation of bacterial behaviors were here reviewed, in combination with some of our findings on the bacterial blight pathogen of riceXanthomonasoryzaepv.oryzae.
c-di-GMP; signal metabolism; receptor; transduction; regulation
2016-12-18
2016-12-21
國家自然科學基金(31671990,31400117,31370160,31100947)
Q 78
A
10.3969/j.issn.0529-1542.2017.01.002
* 通信作者 E-mail:hechenyang@caas.cn

