免疫球蛋白輕鏈型心臟淀粉樣變性的心臟磁共振縱向弛豫時間定量1例及文獻回顧
張旻,崔亞東,羅曉捷,陳敏*
淀粉樣變性(amyloidosis)是不可溶性淀粉樣物質在細胞外組織中沉積、浸潤引起的系統性疾病,心臟是常見受累器官,是導致患者死亡的主要原因。心內膜下心肌活檢(endomyocardial biopsy,EMB)是診斷心臟淀粉樣變性(cardiac amyloidosis,CA)的金標準,但因其為有創檢查,應用受到很大限制。心臟磁共振(cardiac magnetic resonance,CMR)成像是心臟淀粉樣變性的重要影像學檢查方法,可以全面評價心腔大小、房室壁厚度、心肌運動及心功能狀態,延遲強化(late gadolinium enhancement,LGE)有特征性。縱向弛豫時間定量成像(T1 mapping)技術是能夠直接進行T1定量,無創地評價心肌纖維化、水腫及異常物質沉積(脂肪、鐵、淀粉樣物質)等改變,尤其對彌漫改變有很好的提示作用,基于T1 mapping技術的細胞外容積(extracellular volume,ECV)是較T1 mapping技術更為穩定的參數指標。T1 mapping技術及ECV是近年來CMR的心肌組織特征評價的研究熱點,在CA的評價中也顯示了其價值。
1 臨床資料
男性,72歲,就診于北京醫院。慢性心功能不全一年,反復出現心衰,日常活動受影響,生活自理能力明顯下降,陣發性夜間呼吸困難,心功能紐約心臟病協會分級(New York Heart Association,NYHA)Ⅲ級,予以利尿等治療。無高血壓病史。查體:血壓80~110/60~70 mmHg,舌體肥大,頸靜脈無怒張,兩下肺中量濕羅音,肝脾不大,雙下肢水腫。心電圖顯示房顫,QTc 474 ms。3年來多次進行超聲心動檢查,提示左心房進行性增大,室間隔進行性增厚,厚度達25 mm,左心室舒張功能降低,收縮心功能自65%逐漸下降至25%,診斷為非對稱性肥厚型非梗阻性心肌病;本次心衰加重入院,超聲心動可見左心房血栓。胸片顯示心衰肺水腫,兩側胸腔積液。各項實驗室檢查:紅細胞壓積(hematocrit,HCT)為0.26,堿性磷酸酶為294 U/L,血肌酐增高,為5715 μmol/L;免疫球蛋白減低,IgA 0.58 g/L及IgM 0.27 g/L;NT-proBNP增高,為25653.4 ng/L;肌鈣蛋白T升高,為0.121 ng/mL,肌紅蛋白103.7 ng/mL,肌酸激酶同工酶4.9 ng/mL,D-二聚體增高,為1071 ng/mL。血清游離輕鏈κ鏈6.92 mg/L,λ鏈535 mg/L,κ鏈/λ鏈0.0129;血清免疫固定電泳為λ鏈;尿輕鏈κ鏈0.92 mg/dl,尿輕鏈λ鏈測定為8.2 mg/dl。
2 CMR檢查
2.1 CMR圖像采集
采用荷蘭Philips ACHIVA 3.0 T超導MR掃描,患者仰臥位,采用32通道表面相控陣線圈,MR兼容的心電向量心電門控R波觸發成像。采用節段性填充K空間穩態自由進動序列進行屏氣的心室短軸電影成像,TR 3.3 ms,TE 1.7 ms,反轉角45°,采用并行采集SENCE,加速因子1.6,層厚8 mm,層間距2 mm,覆蓋二尖瓣根部至心尖的整個心室,共11層。對比劑采用Gd-DTPA,0.15 mmol/kg,注射8 min后進行Look IR TFE序列進行反轉時間(time of inversed,TI) SCOUT成像,TR 8.0 ms,TE 3.2 ms,反轉角7°;延遲10 min進行LGE成像,采用心電門控屏氣、快速小角度激發序列進行相位敏感反轉恢復(phasesensitive inversion recovery,PSIR)成像,TR 6.1 ms,TE 3.0 ms,反轉角25°,采用并行采集SENCE,加速因子1.4,于四腔心上自TI=180 ms逐漸遞增20 ms直至TI=320 ms,連續進行四腔心掃描,層厚8 mm,然后設定TI=280 ms進行左心室短軸層面掃描,層厚8 mm,層間距0 mm,覆蓋二尖瓣根部至心尖的整個心室,共9層,圖像進行幅值圖(M)、相位敏感重建。T1 mapping掃描參數:屏氣狀態下采用改良的Look-Locker反轉恢復(modified Look-Locker inversion recovery,MOLLI)序列進行掃描,掃描層面為選擇基底段、中間段及心尖段與短軸同層的3層及四腔心層面,FOV 300 mm×300 mm,圖像矩陣256×256,層厚10 mm,像素1.17 mm×1.17 mm×10 mm,TR 2.1 ms,TE 0.95 ms,反轉角20°,反轉脈沖次數2,初次反轉時間350 ms,反轉時間增量109.9 ms,采用并行采集SENCE,加速因子2;注射對比劑前進行初始T1 mapping掃描,LGE掃描完成后,即注射對比劑后20 min進行增強T1 mapping掃描。
2.2 CMR數據分析
在Philips磁共振掃描儀工作站(Extended MR WorkSpace 2.6.3.4)上進行測量。在短軸電影圖像測量舒張末期心肌厚度;手工描記舒張末期及收縮末期左心室心內、外膜輪廓,計算左心室舒張末期容積(left ventricular end-diastolic volume,LVEDV)、左心室收縮末期容積(left ventricular end-systolic volume,LVESV)、左心室射血分數(left ventricular ejection fraction,LVEF)、每搏輸出量(stroke volume,SV)、左心室質量(left vetricular mass,LV mass) (不包括乳頭肌)等參數。LGE于PSIR圖像上進行評價。初始及增強后心肌及心腔的T1值分別于增強前后的T1 mapping圖像的四腔心層面測量室間隔中間段的心肌及心腔,分別測量3次取平均值,通過公式計算ECV,計算公式為:△R1=強化后1/T1-強化前1/T1,心肌ECV=(1-HCT)×(心肌ΔR1/血液ΔR1)。
2.3 CMR結果
按照3.0 T MR心功能正常范圍[1],本例CMR顯示左心室心肌不對稱增厚,厚度約18~27 mm(圖1),室間隔中間段增厚最為明顯;心肌運動彌漫減弱;LVEDV、LVESV正常范圍,LVEDV 100.6 ml,LVESV 65.9 ml,左心室收縮功能減低,LVEF 34.5%,SV明顯減低,SV 18.4 ml,左心室心肌質量明顯增加,LV mass 296.6 g,LV indexed mass 182.0 g/m2;右心室受累,心肌增厚約7 mm,右心室收縮功能減低,右心室射血分數(right ventricular ejection fraction,RVEF)為32.4%,SV明顯減低,為18.4 ml。LGE掃描之前進行SCOUT掃描難以尋找適合的TI數值,心肌較心腔提前抑制,LGE掃描自TI=180~320 ms,每20 ms遞增設置TI數值的四腔心層面,TI=280 ms時左心室短軸連續層面均不能抑制心肌,并可見心腔對比劑廓清迅速,呈暗血池改變,左心室心肌呈彌漫心內膜下異常強化,向肌間延伸,呈斑馬狀(圖2);右心室、左心房可見LGE強化。心肌初始T1值1424 ms,增強后T1值為450 ms,心腔初始T1值為1747ms,增強后T1值為575 ms,ECV為0.65(圖3、4);心包少量積液,兩側中等量胸腔積液,腹腔積液,左心房巨大血栓,延續至右下肺靜脈,右肺動脈及右上葉肺動脈栓塞。
3 病理結果
骨髓活檢顯示增生性骨髓象,漿細胞占6%。舌體活檢顯示黏膜下血管壁顯著增厚,可見大量均質粉染無定形物質沉積,剛果紅染色呈陽性(圖5),偏光鏡下呈雙折射蘋果綠(圖6);免疫組化顯示為克隆性免疫球蛋白,免疫組化:CD31陽性,CD138陰性,IgG陽性,κ鏈陽性,λ鏈陽性。診斷為原發性免疫球蛋白輕鏈型淀粉樣變性(immunoglobulin light-chain amyloidosis,AL)
4 討論
關于心肌淀粉樣變性的T1 mapping及ECV的報道不多,中文文獻以“心肌淀粉樣變性”“縱向弛豫”或“細胞外容積”為關鍵詞搜索到報道一篇,英文文獻在Pubmed以“Cardiac amyloidosis and T1 mapping”為關鍵詞搜索到15篇,中英文文獻共16篇322例,其中英國皇家自由醫院及倫敦心臟病院的團隊有8篇文獻,病例數量不等(20~250例),16篇文獻中2篇為個案。
AL患者早期有30%累及心臟,晚期可出現于大多數患者,預后差。CA是AL的主要死因,中位生存期為8個月,目前藥物治療可緩解CA、明顯延長生存期,因此CA的早期診斷很重要。心內膜下心肌活檢是診斷CA的金標準,但是僅限于少數有資質的醫療機構開展,EMB是有創檢查,可能合并嚴重并發癥,活檢取樣隨機及盲目導致敏感性不高,趙蕾等[2]研究發現,EMB活檢陽性率為60% (3/5);因CA組織學上不均質、斑片狀分布的特點,EMB后小的病理切片也不能反映淀粉樣物質的心肌負荷。目前,CA的診斷主要依賴于臨床表現、心臟超聲及心臟以外的其他部位活檢。生物學標志物如NT-probe和肌鈣蛋白可評估預后,但是早期升高也缺乏特異性。超聲心動圖顯示左室壁增厚、左房增大,心肌內顆粒樣回聲是特征性改變,舒張功能減低,收縮功能可保持或降低;但往往在CA已經進展到晚期才有以上表現,而且鑒別肥厚型心肌病(hypertrophic cardiomyopathy,HCM)及CA有困難。而心外組織活檢不能動態監測病程進展以及隨訪評價治療效果。
CMR是無創性檢查方法,較超聲心動圖重復性好,可提供形態、功能、組織特征等信息,在CA的診斷中起重要作用。常規CMR掃描中,CA的突出表現是心肌肥厚、心肌質量增加,可表現為向心性肥厚、正常、離心性肥厚,最常見的為向心性肥厚(60%)[3];不同的疾病階段,LVEF值可從正常進展到明顯減低。
Gd-DTPA為非特異性細胞外間隙對比劑,引起T1弛豫時間縮短,CA的病理改變為淀粉樣物質沉積于細胞外間隙,導致細胞外間隙容積增大,增強掃描后Gd-DTPA沉積于擴大的細胞外間隙,可出現延遲強化。CA的典型LGE表現為:(1) LGE彌漫全層心內膜下或透壁強化;(2)對比劑從血池中廓清迅速,心腔呈暗血池表現;(3) TI SCOUT掃描中,心肌較心腔提前抑制。LGE不但可以用于CA診斷,還可以反映淀粉樣物質的分布情況,提示淀粉樣物質的心肌負荷,是獨立的預后因素。LGE的特征性強化模式,還可以與缺血性心肌病的瘢痕及非缺血心肌病的心肌纖維化進行鑒別。心肌梗死瘢痕LGE表現為心內膜下、心內膜下至中層或透壁強化,延遲強化心肌節段與狹窄的冠狀動脈供血區域對應,且梗死心肌厚度變薄;肥厚型心肌病也表現為心肌肥厚、心肌質量增加,75%的患者出現延遲強化,LGE的典型表現為心肌肥厚區域肌壁間多發斑片狀強化,以室間隔及左室游離壁交界處為著;擴張型心肌病表現為心室擴大,心肌變薄,肌小梁增加,收縮功能顯著降低,LGE表現為肌壁間條狀延遲強化,多出現于室間隔基底段;心肌炎急性期LGE可見心外膜下斑片狀強化,以左心室游離壁最多見;而CA在TI SOUT上心肌較心腔提前抑制及無法確定合適的TI時間,這一特點不出現在缺血性心肌病及其他非缺血性心肌病。由此可見,LGE在CA的鑒別診斷中也起到重要作用。
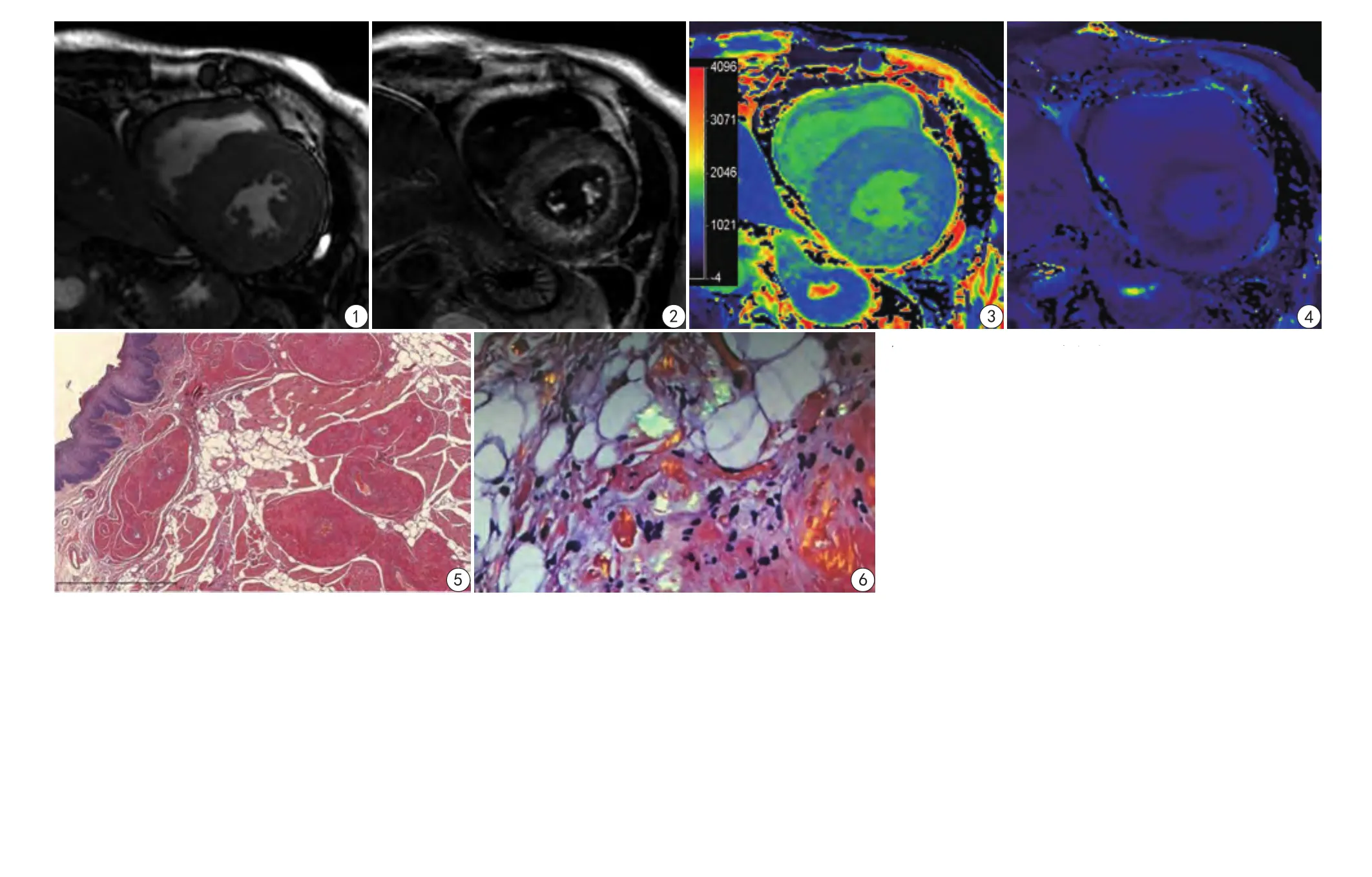
圖1 電影序列顯示心室短軸中間段左、右心室心肌增厚,以室間隔明顯,厚度25 mm,右心室心肌厚度7 mm 圖2 LGE示心室短軸中間段可見彌漫心內膜下異常強化,向肌間延伸,呈斑馬狀 圖3 初始T1 mapping圖像,心肌初始T1值為1424 ms,心腔初始T1值為1747 ms 圖4 增強后T1圖像,心肌增強后T1值為450 ms,心腔增強后T1值為575 ms 圖5 舌體活檢病理,顯示黏膜下血管壁顯著增厚,可見大量均質粉染無定形物質沉積,剛果紅染色陽性(剛果紅染色×50) 圖6 舌體活檢病理,剛果紅染色在偏振光鏡下顯示蘋果綠雙折射Fig.1 Short axis view of cine sequence in the middle segment of left ventricle, shows thickening of myocardium of both left and right ventricular walls with interventricular septum predominance. Fig.2 Short axis view of late gadolinium enhancement in middle segment of left ventricle, shows diffused sub-endocardium LGE expanding to the inter-myocardial spaces presenting as “zebra pattern”. Fig.3 Initial T1 mapping image, shows myocardial T1 value 1424 ms, and cardiac chamber T1 value 1747 ms. Fig.4 With contrast enhance T1 mapping image, shows myocardial T1 value 450 ms, and cardiac chamber T1 value 575 ms. Fig.5 Corpora linguae specimen, shows submucosal vascular wall thickening with accumulation of large quantities of amorphous homogeneous material, presenting congo red stained positive (×50 ). Fig.6 Corpora linguae specimen, shows polarized light apple-green appearance with congo red staining on microscopy.
CA的LGE也有從正常無強化至心內膜下強化到透壁性強化發展的趨勢,因此,強化模式變化很大,典型表現發生于疾病晚期,早期病變可以無LGE。AL患者很多同時有腎臟受累,不能進行增強掃描;初始T1 mapping技術不需要對比劑,可以直接測量心肌的T1值,評價心肌纖維化,用于淀粉樣變性浸潤程度檢測及療效、預后的評估。但是初始T1 mapping技術因磁共振掃描儀不同場強等因素影響存在不穩定性,而增強后T1值存在更大不穩定性。由初始及增強后T1值衍生的ECV值較T1值更加穩定。ECV指細胞外間質容積占心肌組織的容積百分比,即不包括心肌組織的體積分數,正常人的ECV為24%~28%[4]。ECV的計算糾正了技術因素對T1值的影響,反映了心肌組織的內在特征,只與心肌間質狀態改變尤其是膠原心外比例的增加相關。CA的ECV值顯著高于非CA的心肌病患者及健康志愿者,而且ECV與LGE節段分布有明顯一致性,在臨床上懷疑CA時ECV的升高對早期受累較LGE敏感,ECV比T1值的變化更加明顯,可以作為評估CA嚴重程度的新指標[4]。
初始T1值可以對CA進行診斷。Karamitsos等[5]研究發現,AL型CA初始T1值閾值為1020 ms,診斷準確性為92%,其與收縮及舒張功能障礙有明顯相關性,提示T1 mapping技術在CA的診斷上有很高的準確性,明顯升高的T1值可以反映心臟淀粉樣物質負荷。在Fontana等[6]的研究中,CA的初始T1值較HCM及正常志愿者高,程召平等[7]研究顯示T1值較正常約增加16%,且與心臟收縮和舒張功能有相關關系。初始T1值對疾病的早期改變更敏感[8],T1值延長、ECV增高先于心肌肥厚、LGE及血液指標等改變。T1值增加可以反映病情的嚴重程度、心肌負荷[8-9]。T1值還可以用來進行治療監測[10-11],Siepen等[10]研究發現,7例患者服用綠茶提取物治療12個月后LV mass下降,伴隨T1值及ECV的下降,提示淀粉樣物質的心肌負荷降低。Banypersad等[12]研究顯示,ECV>0.45與死亡率有明顯相關關系(HR=4.41),ECV可以作為AL型CA的生物學指標預測預后,初始T1值與ECV有相似的預測價值,可以評價不能應用對比劑的患者情況。
AL型和遺傳性轉甲狀腺素蛋白型(transthyretin amyloidosis,ATTR)是CA的兩種亞型,對心臟影響的機制不同,臨床上AL心衰較ATTR嚴重。AL型及ATTR型的治療方案不同,應進行亞型鑒別。雖然存在困難及挑戰,T1 mapping及ECV也可幫助鑒別CA亞型。在Fontana等研究中[6,13],AL型的初始T1值較ATTR型高,有顯著性差異。T1 mapping及ECV研究對揭示CA亞型的發病機制也有幫助。Fontana等[13]研究發現,AL型及ATTR型的T1值、ECV值均升高,但AL型較ATTR型T1值高,而ATTR型的ECV值較AL型高,提示AATR型的浸潤較AL型廣泛,細胞外間隙擴大明顯,但ATTR型細胞內容積較AL型高18%,提示ATTR型可能僅有間質浸潤,伴細胞代償肥大增生,而AL的細胞內容積沒有增加,提示AL無細胞肥大增生,或者細胞增生與淀粉樣物質的心肌細胞毒性作用導致細胞減少同時發生,推測AL型的致病因素不單純是淀粉樣物質沉積,AL型的絲狀纖維還有細胞毒性,共同作用導致AL型的心臟病生理改變。
由此可見,CMR檢查應用T1 mapping與ECV技術可以提高CA診斷的準確性、定量淀粉樣物質負荷、區分CA類型、預測預后,以利于臨床選擇適合的個體化治療方案,還可以用于隨診患者的治療反應。CMR有望成為潛在CA患者的主要診斷方法及淀粉樣變性累及心臟的有效評價手段。
[References]
[1] Le T, Tan RS, Deyn MD, et al. Cardiovascular magnetic resonance reference ranges for the heart and aorta in Chinese at 3.0 T. J Cardiovas Mag Reson, 2016, 18(1): 21-33.
[2] Zhao L, Tian Z, Fang Q. Clinical characteristics and cardiac imaging features with cardiac amyloidosis. Chin J Cardiol, 2015, 43(11):960-964.趙蕾, 田莊, 方全. 心肌淀粉樣變性臨床特點及影像學特征. 中華心血管病雜志, 2015, 43(11): 960-964.
[3] Pozo E, Kanwar A, Deochand R, et al. Cardiac magnetic resonance evaluation of left ventricular remodelling distribution in cardiac amyloidosis. Heart, 2014, 100(21): 1688-1695.
[4] Salerno M, Kramer CM. Advances in parametric mapping with CMR imaging. J Am Coll Cardiol Img, 2013, 6(7): 806-822.
[5] Karamitsos TD, Piechnik SK, Banypersad SM, et al. Noncontrast T1 mapping for the diagnosis of cardiac amyloidosis. J Am Coll Cardiol Img, 2013, 6(4): 488-497.
[6] Fontana M, Banypersad SM, Treibel TA, et al. Native T1 mapping in transthyretin amyloidosis. J Am Coll Cardiol Img, 2014, 7(2):157-165.
[7] Cheng ZP, Lu MJ, Yin G, et al. Native T1 mapping for the diagnosis of cardiac amyloidosis: a pilot research. Chin J Radiol, 2016, 50(12):935-939.程召平, 陸敏杰, 尹剛, 等. 縱向弛豫時間定量成像在心肌淀粉樣變性診斷中的初步研究.中華放射學雜志, 2016, 50(12): 935-939.
[8] Barison A, Aquaro GD, Pugliese NR, et al. Measurement of myocardial amyloid deposition in systemic amyloidosis: insights from cardiovascular magnetic resonance imaging. J Intern Med,2015, 277(5): 605-614.
[9] Banypersad SM, Sado DM, Flett AS, et al. Quantification of myocardial extracellular volume fraction in systemic AL amyloidosis:an equilibrium contrast cardiovascular magnetic resonance study.Circ Cardiovas imaging, 2013, 6(1): 34-39.
[10] Siepen F, Buss SJ, Andre F, et al. Extracellular remodeling in patients with wild-type amyloidosis consuming epigallocatechin-3-gallate:preliminary results of T1 mapping by cardiac magnetic resonance imaging in a small single center study. Clinical Research in Cardiol,2015, 104(8): 640-647.
[11] Hur DJ, Dicks DL, Huber S, et al. Serial native T1 mapping to monitor cardiac response to treatment in light-chain amyloidosis.Circ Cardiovasc Imag, 2016, 9(10): e004770.
[12] Banypersad SM, Fontana M, Maestrini V, et al. T1 mapping and survival in systemic light-chain amyloidosis. Eur Heart J, 2015,36(4): 244-251.
[13] Fontana M, Banypersad SM, Treibel TA, et al. Differential myocyte responses in patients with cardiac transthyretin amyloidosis and light-chain amyloidosis: a cardiac MR imaging study. Radiology,2015, 277(2): 388-397.

