不同環境因子對海洋細菌Pseudoalteromonasissachenkonii HZ引導糖基轉移酶基因表達的影響
盧曉平,許艷蕊,范秋蘋,郝魯江
(齊魯工業大學山東省微生物工程重點實驗室,山東濟南 250353)
?
不同環境因子對海洋細菌PseudoalteromonasissachenkoniiHZ引導糖基轉移酶基因表達的影響
盧曉平,許艷蕊,范秋蘋,郝魯江*
(齊魯工業大學山東省微生物工程重點實驗室,山東濟南 250353)
為了研究海洋細菌PseudoalteromonasissachenkoniiHZ所產多糖的生物合成基因簇,首先需要克隆到在多糖合成中起關鍵作用的引導糖基轉移酶基因。通過設計引物,采用PCR技術從海洋細菌PseudoalteromonasissachenkoniiHZ成功克隆到該基因,并通過實時熒光定量PCR技術檢測了溫度、pH及海鹽濃度對引導糖基轉移酶基因表達量的影響。結果表明:低溫有利于引導糖基轉移酶的表達,隨著溫度的上升,引導糖基轉移酶基因的表達量先增后減,在20 h時,引導糖基轉移酶的表達量急劇上升,15 ℃和35 ℃引導糖基轉移酶表達量分別是20 ℃表達量的5.2倍、5.8倍;海鹽濃度為4.5%時引導糖基轉移酶的表達量為海鹽濃度3.5%的2.5倍,海鹽濃度為5.5%時引導糖基轉移酶的表達量為海鹽濃度3.5%的2.0倍;10 h時pH為8、9的培養基中引導糖基轉移酶的表達量分別為pH為7的1.64和1.67倍。該結果為探究菌體環境適應性機制提供了一定的基礎。
海洋細菌PseudoalteromonasissachenkoniiHZ,引導糖基轉移酶,實時熒光定量PCR
海洋環境的特殊性,賦予海洋細菌所產多糖結構的多樣性以及功能的特殊性。盡管已有大量文獻報道海洋細菌多糖的特殊功能,但人們對于研究生產胞外多糖的海洋細菌的興趣方興未艾[1]。近幾年,隨著對微生物多糖研究的深入,世界上微生物多糖的產量和增長量均在10%以上,而一些新興多糖年增長量在30%以上,到目前為止已經大量投產的微生物多糖有黃原膠、結冷膠、小核菌葡聚糖、短梗霉多糖等[2]。海洋微生物處于低溫、高鹽、高壓、寡營養、高溫度梯度及高毒性濃度的特殊環境,具有產生結構新穎、功能獨特的新型活性多糖的潛力[3],是開發多糖類海洋新藥的重要資源,一些假交替單胞菌能夠分泌胞外多糖(exopolysaccharides,EPS),EPS可以增加產生菌及某些其它海洋生物在特定環境中的存活機會。一株假交替單胞菌S9無論是在液體還是固體培養狀態下穩定期都能夠產生EPS,促進產生菌定居在無脊椎動物幼蟲的表面[4]。Corsaro等報道P.haloplanktisTAC125能夠分泌EPS,并且不同的培養溫度對EPS的成分也有影響[5]。近年來,已有很多關于海洋微生物代謝產物的研究文獻,但有關環境因子調控海洋細菌多糖的合成及相關基因的研究鮮見報道。
目前多種細菌產生的胞外多糖的結構已經被鑒定[6],雖然這些多糖的結構或者活性有所不同,但是多糖的生物合成途徑基本相同,甚至于LPS的O抗原和合成途徑相似,即通過引導糖基轉移酶將單糖從糖核苷酸順序性轉移而裝配到脂類載體上形成重復單元,隨后是這些重復單元的聚合和輸出,形成細胞表面多糖[7-8]。有些基因簇涉及特殊糖核苷酸合成的基因,但所有的基因簇都具有編碼特異引導糖基轉移酶的基因、參與聚合和輸出過程的基因[9]。在多糖合成過程中,催化糖基轉移到脂載體上的引導糖基轉移酶在G+和G-均有較高的同源性,其也是胞外多糖合成的限速酶之一。因此,根據以上特性,從同源菌中設計相應的引物,從海洋細菌PseudoalteromonasissachenkoniiHZ基因組中擴增出引導糖基轉移酶基因。
本研究所用菌株為皺紋盤鮑采苗板上分離得到的高產胞外多糖菌株PesudoalteromonasissachenkoniiHZ,其胞外多糖的合成與環境因子之間是否存在聯系以及兩者之間的相應關系還不清楚,而對該問題的研究可為闡明胞外多糖在環境適應性中的機制提供新的科學依據。
本實驗室前期已對海洋細菌PseudoalteromonasissachenkoniiHZ產多糖的發酵條件進行了優化,將以此為基礎研究在發酵過程中引導糖基轉移酶基因的表達變化。
1 材料和方法
1.1 材料與儀器
海洋細菌Pseudoalteromonasissachenkonii502A 為實驗室保藏菌種;固體培養基Zobell 2216E培養基 蛋白胨5 g/L,酵母膏1 g/L,海鹽35 g/L,瓊脂20 g/L,調pH7.6~7.8;種子培養基Zobell 2216E培養基 蛋白胨5 g/L,酵母膏1 g/L,海鹽35 g/L,調pH7.6~7.8;發酵培養基 葡萄糖45 g/L,硫酸銨2.5 g/L,海鹽45 g/L,調pH7.8~8.0;細菌基因組DNA快速抽提試劑盒、柱式細菌總RNA抽提純化試劑盒、Low MW DNA Marker-A、DNA maker-G、Taq酶、引物 上海生工生物工程有限公司;λ-Hind Ⅲ digest、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBR? Premix Ex TaqTMⅡ(Tli RNaseH Plus) 寶生物工程(大連)有限公司;實驗所用試劑 均為分析純。
PCR儀基因擴增儀 Bio-RAD;實時熒光定量PCR儀 Rotor-Gene Q;ZF-1B型三用紫外分析儀 上海播顯科學儀器有限公司。
1.2 實驗方法
1.2.1 菌種活化 取出甘油管中保藏的海洋細菌PseudoalteromonasissachenkoniiHZ,劃線接種于Zobell 2216E固體培養基平板上,25 ℃靜置培養24 h長出單菌落后,取單菌落再次劃線培養,保存備用。
1.2.2 DNA的提取 將活化好的細菌接種于Zobell 2216E液體培養基中,25 ℃、100 r/min培養8 h。利用細菌基因組DNA快速抽提試劑盒提取DNA,經1%瓊脂糖凝膠電泳檢測后于-20 ℃保存備用[10]。
1.2.3 引物的設計與合成 利用Primer Primer 5.0,根據GenBank中PseudoalteromonashaloplanktisTAC125(NC_007482.1)的引導糖基轉移酶設計一對引物GF(5′-ATGAAAAAAGTGCTGGTAATTGG-3′)和GR(5′-TTAATCTAATTTTTTATTTTTTTCAGCTATCC),由上海生工生物工程有限公司合成。
1.2.4 PCR反應體系與程序 PCR擴增體系為25 μL,具體組成見表1。

表1 PCR擴增體系
擴增程序為:94 ℃、5 min,94 ℃、30 s,44~51 ℃、30 s,72 ℃、2 min,35 cycle;72 ℃、10 min。其中使用溫度梯度PCR擴增引導糖基轉移酶基因,退火溫度的選擇參考引物上下游引物退火溫度,PCR擴增產物經1%的瓊脂糖凝膠電泳檢測,取3 μL PCR產物與1 μL 6×上樣緩沖液點樣,70 V、40 min,利用ZF-1B型三用紫外分析儀進行觀察。挑取單一明亮條帶的PCR產物送往上海生工有限公司進行測序,得到序列后,將序列輸入到NCBI數據庫(http://blast.ncbi.nlm.gov)進行序列比對,比較引導糖基轉移酶序列的同源性。
1.2.5 溫度變化對引導糖基轉移酶基因表達的影響 將海洋細菌PseudoalteromonasissachenkoniiHZ接種到種子培養基中,25 ℃、100 r/min培養8 h。按照8%的接種量接種到發酵培養基中,分別在15、20、25、30、35 ℃的恒溫培養振蕩器中培養,并在10、20、34、44 h分別取樣,備用。
1.2.6 海鹽濃度對引導糖基轉移酶基因表達的影響 將海洋細菌PseudoalteromonasissachenkoniiHZ種子液接種到海鹽濃度分別為3.5%、4.5%、5.5%的發酵培養基中,置于25 ℃恒溫培養振蕩器中培養,并在10、20、34 h分別取樣,備用。
1.2.7 pH對引導糖基轉移酶基因表達的影響 pH對引導糖基轉移酶基因表達的影響 將海洋細菌PseudoalteromonasissachenkoniiHZ種子液接種到pH分別為7、8、9的發酵培養基中,置于25 ℃恒溫培養振蕩器中培養,并在10、20、34 h分別取樣,備用。
1.2.8 RNA的提取及cDNA的反轉錄合成 使用柱式細菌總RNA提取純化試劑盒提取細菌的RNA,使用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)合成cDNA第一鏈,具體操作參照使用說明書。
1.2.9 熒光定量PCR體系的建立 以測得的引導糖基轉移酶序列為靶序列,運用primer primer5.0軟件設計一對熒光定量PCR引物SGF(5′-TTTGGCTGGC GTGTAGATAA-3′)和SGR(5′-GCGTTTTGCTATGT CTGAATG-3′)。以16S rDNA為內參基因,引物序列為16S rDNA-F(5′-TGTAGCGGTGAAATGCGTA-3′)和16S rDNA-R(5′-AGGGTATCTAATCCTGTTTGCTC-3′)[11]。并進行引物特異性檢測。PCR體系為25 μL,見表2。

表2 熒光定量PCR體系
擴增程序:95 ℃、30 s;95 ℃、5 s,54 ℃、30 s,72 ℃、30 s,50次循環;溶解曲線70~99 ℃。反應在QIAGEN Rotor-GeneQ熒光定量PCR儀上進行,以上反應條件均經過了一系列溫度梯度PCR優化[12],每個濃度梯度同時做三個平行重復,以不加模板的反應液為空白對照。
1.2.10 實驗數據的處理 使用熒光定量PCR儀附帶軟件采用2-ΔΔCT算法對實驗數據進行分析處理[13],并導出內參基因與目的基因的擴增曲線、溶解曲線。
2 結果與分析
2.1 基因組DNA的提取
利用細菌基因組DNA快速抽提試劑盒提取海洋細菌PseudoalteromonasissachenkoniiHZ基因組DNA,經瓊脂糖凝膠電泳,結果如圖1所示:位于23 kb處有一明亮條帶,可用于后續PCR反應等。

圖1 提取的細菌基因組DNA Fig.1 Extracted bacterial genome DNA注:M:λ-Hind Ⅲ digest。
2.2 引導糖基轉移酶基因的擴增
以提取的海洋細菌PseudoalteromonasissachenkoniiHZ DNA為模板,以GF和GR為引物進行PCR擴增,結果如圖2。
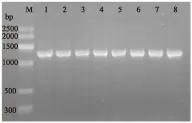
圖2 引導糖基轉移酶基因的擴增Fig.2 Glycosyltransferase gene amplification注:M為DNA maker-G,泳道1~8為44~51 ℃下所擴增的引導糖基轉移酶基因。
圖2中泳道8中的PCR產物明亮、條帶單一,無引物二聚體,因此將泳道8中的PCR產物送往上海生工生物工程有限公司進行測序。將翻譯得到的蛋白質序列在NCBI中進行比對,其與Pseudoalteromonassp.MW4237引導糖基轉移酶的蛋白質序列相似度為89%,與Pseudoalteromonassp.P1-11相似序列為88%,與Pseudoalteromonasaqarivorans相似度為87%,推測該序列為引導糖基轉移酶序列。
2.3 細菌總RNA的提取
使用柱式細菌總RNA提取純化試劑盒提取細菌的RNA,電泳結果如圖3。由圖3可知提取的RNA條帶完整,滿足下一步實驗要求。電泳結束后參照使用說明書合成cDNA第一鏈。

圖3 細菌總RNA的提取Fig.3 Extraction of total RNA from bacteria
2.4 引物特異性分析
以合成的cDNA為模板,以SGF和SGR為引導糖基轉移酶保守片段上下游引物,以16S rDNA-F和16S rDNA-R為內參基因上下游引物,進行普通PCR擴增,檢測引物特異性。結果見圖4,可知產物單一,無引物二聚體,可進行下一步實驗。
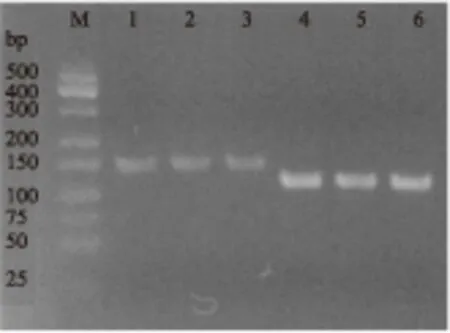
圖4 普通PCR引物特異性分析Fig.4 Normal PCR primers specific analysis注:M-Low MW DNA Marker-A;1~3泳道為引導糖基轉移酶保守片段;4~6泳道為內參16S rRNA片段。
由圖4可知,SGF/SGR和16S rDNA-F/16S rDNA-R均能擴增出單一條帶且無引物二聚體,引物特異性良好,使用該兩對引物進行熒光定量PCR實驗,溶解曲線(圖5和圖6)顯示只有單一吸收峰,表明引物特異性良好。
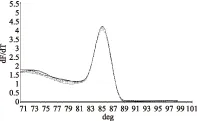
圖5 引導糖基轉移酶溶解曲線Fig.5 Glycosyltransferase dissolution profile注:不同形狀的曲線表示各孔中引導糖基轉移酶基因的擴增。

圖6 16S rRNA溶解曲線Fig.6 16S rRNA dissolution profile注:不同形狀的曲線表示各孔中16S rRNA基因的擴增。
2.5 引導糖基轉移酶基因對溫度變化的響應
以16S rDNA為內參基因,引導糖基轉移酶為目的基因,以10 h取樣的25 ℃作為對照組,采用2-ΔΔCT算法計算不同溫度下目的基因的相對表達量。結果如圖7所示。

圖7 溫度變化對引導糖基轉移酶的影響Fig.7 Temperature changes affect the glycosyltransferase
PseudoalteromonasissachenkoniiHZ在不同溫度下培養20 h后,引導糖基轉移酶的表達量隨溫度的上升而增加。在20 h時,引導糖基轉移酶的表達量急劇上升,15 ℃和35 ℃引導糖基轉移酶表達量分別是20 ℃表達量的5.2倍、5.8倍。34 h和44 h時引導糖基轉移酶的表達量差異不大。
2.6 引導糖基轉移酶對海鹽濃度變化的響應
以16S rDNA為內參基因,引導糖基轉移酶為目的基因,以10 h取樣的海鹽濃度4.5%作為對照組,采用2-ΔΔCT算法計算不同海鹽濃度下目的基因的相對表達量,結果如圖8所示。
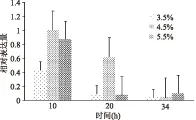
圖8 海鹽濃度對引導糖基轉移酶表達的影響Fig.8 Salt concentration changes affect the glycosyltransferase
在10 h時,海鹽濃度為4.5%引導糖基轉移酶的表達量為海鹽濃度3.5%的2.5倍,海鹽濃度為5.5%引導糖基轉移酶的表達量為海鹽濃度3.5%的2.0倍,10 h之后引導糖基轉移酶的表達量都減少,34 h后不同海鹽濃度中引導糖基轉移酶的表達量無明顯變化。此外引導糖基轉移酶的表達情況也與前期發酵培養基優化參數相吻合,從分子角度證明了最優培養基中海鹽濃度的選擇,即當海鹽濃度為4.5%時,培養基中多糖產量最大。
2.7 引導糖基轉移酶對pH變化的響應
以16S rDNA為內參基因,引導糖基轉移酶為目的基因,以10 h取樣的pH8作為對照組,采用2-ΔΔCT算法計算不同pH條件下目的基因的相對表達量。pH變化對引導糖基轉移酶表達的影響如圖9所示。

圖9 pH變化對引導糖基轉移酶表達的影響Fig.9 pH changes affect the glycosyltransferase
pH對引導糖基轉移酶的影響與海鹽濃度對引導糖基轉移酶的影響相似,即在10 h時pH為8和pH為9的培養基中引導糖基轉移酶的表達量分別為pH為7的1.64和1.67倍。隨著培養時間的延長,引導糖基轉移酶的表達量都降低。
3 討論與結論
在海冰和海水界面存在著大量產生胞外多糖的細菌,高濃度的胞外多糖使得細菌在惡劣的寒冬條件和高鹽度中生存,并對冰晶對細菌的傷害起到緩沖作用[14]。Mancuso等從南極海冰和海水中分離得到兩株海洋細菌CAM025和CAM036,經過16S rDNA鑒定為Pseudoalteromonas屬,對其胞外多糖研究發現,其在-2、10 ℃時胞外多糖的產量是20 ℃的30倍[15]。李江等考察了溫度對多糖合成關鍵酶基因ugd的影響,也發現低溫有利于胞外多糖的合成,其在2、10 ℃時基因的表達量是20 ℃的4倍[11]。這些研究結果支持了胞外多糖在低溫下對微生物區系具有重要作用。
胞外多糖在細菌極端環境適應性中具有重要作用,并引起了越來越多學者的關注。細菌胞外多糖的生物合成的產量受外部因素的影響,因此通過熒光定量PCR檢測了溫度、pH、海鹽濃度對引導糖基轉移酶表達的影響,發現低溫有利于引導糖基轉移酶的表達,在不同培養溫度下培養20 h時,引導糖基轉移酶的表達量急劇上升,15 ℃引導糖基轉移酶表達量是20 ℃表達量的5.2倍,由此可知細菌在低溫環境下會通過大量分泌胞外多糖來適應環境,免受冰晶的傷害,鹽度和pH的改變也會影響引導糖基轉移酶的表達,通過提高引導糖基轉移酶基因的表達量來促進細菌胞外多糖的合成量,以緩沖鹽度和pH對菌體的脅迫作用,通過控制胞外多糖的合成可能是菌體環境適應性的策略之一。
[1]Chi Zhenming,FangYan.Exopolysaccharides from Marine
Bacteria[J].Journal of Ocean University of China,2005(4):67-74.
[2]崔艷紅,黃現清.微生物胞外多糖研究進展[J].生物技術通報,2006(2):25-29.
[3]孫紅梅,張星星,白玉,等.海洋假單胞菌胞外多糖的抗氧化性[J].大連工業大學學報,2012(31):395-398.
[4]Holmstr?m C,Kjelleberg S. Marine Pseudoalteromonas species are associated with higher organisms and produce biologically active extracellular agents[J]. FEMS Microbiology Ecology,1999,30:285-293.
[5]Corsaro MM,Lanzetta R,Parrill iE,et al. Influence of growth temperature on lipid and phosphate contents of surface polysaccharides from the antarctic bacterium Pseudoalteromonas haloplanktis TAC 125[J].Journal of Bacteriology,2004,186(1):29-34.
[6]張珊珊,王長云,魏曉蕾,等.海洋微生物胞外多糖結構與生物活性研究進展[J].微生物學通報,2007(34):153-156.
[7]Katsuhide Miyake,shinji Iijima.Bacterial capsular polysaccharide and sugar transferases[J].Adv Biochem Engin/Biotechnol,2004,90:89-111.
[8]Kolkman MA,van der Zeijst BA,Nuijten PJ.Function analysis of glycosyltransferases encoded by the capsular polysaccharide biosynthesis locus of streptococcus pneumoniae serotype 14[J]. Journal of Biological Chemistry,1997,272(31):19502-19508.
[9]Taylor WH,Juni E.Pathways for biosynthesis of a bacterial capsular polysaccharide I characterization of the organism and polysaccharide[J].Journal of Acteriology,1961,81(5):688-693.
[10]姆布魯克等著.黃培堂等譯.分子克隆實驗指南(上冊)/(美)[M]. 3版. 北京:科學出版社,2002:385-387.
[11]李江,沈繼紅,何培青,等.環境因子對南極菌Pseudoalteromonassp. S-15-13多糖合成關鍵酶UGD基因表達的影響[J].海洋與湖沼,2010,41(6):824-828.
[12]Torben LS,Niels BR,Carola H,et al.Real-time quantitative PCR for assessment of abundance of Pseudoalteromonas species in marine samples[J].Applied and Environmental Microbiology,2004,70(4):2373-2382.
[13]Kenneth JL,Thomas DS.Analysis of Relative Gene Expression Data Using Real-time Quantitative PCR and the 2-ΔΔCTMethod[J].METHODS,2001(25):402-408.
[14]Krembs C,Eicken H,Junge K,et al.High concentrations of exopolymeric substances in Arctic winter sea ice:implications for the polar ocean carbon cycle and cryoprotection of diatoms[J]. Deep Sea Research,2002,49(12):2163-2181.
[15]Mancuso CA,Garon S,Bowman JP,et al.Production of exopolysaccharides by Antarctic marine bacterial isolates[J]. Journal of Applied Microbiology,2004,96(5):1057-1066.
The impact of environmental factors on marine bacteriaPseudoalteromonasissachenkoniiHZ glycosyltransferase gene expression
LU Xiao-ping,XU Yan-rui,FAN Qiu-ping,HAO Lu-jiang*
(Qilu University of Technology,Shandong Provincial Key Laboratory of Microbial Engineering,Jinan 250353,China)
To study the biosynthesis gene cluster of the polysaccharide produced by marine bacteriumPseudoalteromonasissachenkoniiHZ,and to clone the gene which plays a key role in the synthesis of polysaccharide. Glycosyltransferase gene was amplified by designing primers using PCR technology from marine bacteriaPseudoalteromonasissachenkoniiHZ,and examined the effect of temperature,pH and salt concentration of glycosyltransferase gene expression by real-time fluorescence quantitative PCR. The results showed that the low temperature was in favor of the expression of the glycosyltransferase. With the increase of the temperature,the expression of the gene of the glycosyltransferase increased first and then decreased. It was showed that glycosyltransferase gene expression level increased rapidly,and the glycosyltransferase gene expression level ofPseudoalteromonasissachenkoniiHZ grown at 15 and 35 ℃ were 5.2,5.8 times higher than grown at 20 ℃,respectively. 4.5% salt concentration could increase the expression level of glycosyltransferase gene 2.5 times compared to that of 3.5% salt concentration,while 5.5% salt concentration glycosyltransferase gene expression level was 2 times compared to 3.5% salt concentration. The glycosyltransferase gene expression level ofPseudoalteromonasissachenkoniiHZ grown at pH8 and 9 were 1.64、1.67 times higher than grown at pH7,respectively. The research on glycosyltransferase gene ofPseudoalteromonasissachenkoniiHZ laid a foundation for exploring the mechanism of adaptation to the environment.
marine bacteriaPseudoalteromonasissachenkoniiHZ;glycosyltransferase;real-time PCR
2016-04-14
盧曉平(1992-),男,碩士研究生,研究方向:微生物酶資源的開發與利用,E-mail:15288863082@163.com。
*通訊作者:郝魯江(1972-),男,博士,副教授,研究方向:海洋細菌活性物質的篩選,微生物酶資源的開發,E-mail:lujiang_hao@163.com。
山東省自然科學基金(ZR2012CM019)。
TS201.1
B
1002-0306(2016)22-0212-05
10.13386/j.issn1002-0306.2016.22.033

