水稻基腐病菌flhDC和fliA基因的功能
陳雪鳳,余成鵬,劉瓊光
(華南農業大學農學院/廣東省微生物信號與作物病害重點實驗室,廣州510642)
水稻基腐病菌flhDC和fliA基因的功能
陳雪鳳,余成鵬,劉瓊光
(華南農業大學農學院/廣東省微生物信號與作物病害重點實驗室,廣州510642)
【目的】水稻細菌性基腐病(致病菌Dickeya zeae)是水稻重要細菌病害之一。細菌的鞭毛是重要的運動器官,迄今有關水稻基腐病菌的鞭毛系統、flhDC和fliA基因功能及其調控機理尚不清楚,明確這些鞭毛基因的功能,有利于進一步了解D. zeae的致病性綜合調控網絡、開發新型藥物作用靶標以及制定病害防控策略。論文旨在明確D.zeae鞭毛系統中flhDC和fliA在致病性中的作用。【方法】以D. zeae野生型致病菌株EC1基因組DNA為模板,設計一系列引物,PCR擴增待敲除的目標基因flhDC和fliA各自的上、下游片段,再以混合的上、下游片段為模板,擴增得到缺失flhDC和fliA的融合片段,雙酶切純化后連接到自殺性載體pKNG101上,構建帶有反向篩選標記基因sacB的自殺重組質粒pKNG-ΔflhDC和pKNG-ΔfliA,通過三親轉化方法分別將重組質粒導入野生型菌株EC1中,通過兩次等位基因同源重組,PCR檢測和測序驗證,最終獲得目標基因flhDC和fliA缺失突變體ΔflhDC和ΔfliA;測定并比較突變體與野生菌的胞外酶活性、毒素活性、運動性、生物膜形成能力,以及對水稻的致病力和對煙草的過敏性反應(HR);進一步提取細菌總RNA,以16SrDNA為內參來校正目標基因的表達量,采用實時熒光定量PCR(qRT-PCR)方法,比較野生菌和突變體ΔflhDC和ΔfliA下游基因flhD、flhC、fliA和fliC的表達量差異。【結果】通過基因操作手段成功構建了基因缺失突變體ΔflhDC和ΔfliA。表型測定結果顯示,野生菌EC1的運動性和形成生物膜的能力很強,而基因缺失菌株ΔflhDC和ΔfliA的運動性和形成生物膜的能力明顯下降;野生菌株EC1對水稻種子萌發具有很強的抑制作用,而突變體ΔflhDC和ΔfliA則顯著降低了對水稻種子萌發的抑制作用;接種野生菌株EC1的水稻植株產生大面積褐色病斑,且腐爛程度嚴重,而接種突變體ΔflhDC和ΔfliA的水稻植株只在接種的針刺部位周圍出現水漬狀褐色病斑,腐爛程度輕微,說明突變體菌株ΔflhDC和ΔfliA顯著降低了對水稻植株上的致病力。進一步的表型測定結果顯示,突變體菌株ΔflhDC和ΔfliA與野生菌EC1在產生胞外致病酶、毒素以及引起煙草HR能力等方面沒有顯著差異。qRT-PCR分析結果顯示,在突變體菌株ΔflhDC中,flhD和flhC不表達,fliA和fliC的表達量較野生菌明顯下降;而在突變體ΔfliA中,flhD、flhC和fliA均不表達,fliC表達明顯下降。【結論】調控細菌鞭毛基因表達的主調控因子flhDC操縱子,以及表達鞭毛特異性因子σ28基因fliA,是細菌鞭毛系統基因簇的重要組分。flhDC和fliA顯著影響D. zeae的運動性和生物膜形成能力,并顯著影響水稻種子的萌發功能,在水稻基腐病菌的致病性中起重要作用。
水稻基腐病菌;flhDC;fliA;運動性;致病性
0 引言
【研究意義】水稻細菌性基腐病是由玉米狄克氏菌(Dickeya zeae,異名Erwinia chrysanthemi pv. zeae)引起的水稻重要細菌病害之一[1]。D. zeae已成為世界性重要植物病原細菌,發生范圍不斷擴大[2-3]。該病原菌相關致病因子主要包括胞外酶、胞外多糖、毒素和hrp基因簇。細菌的鞭毛是重要的運動器官,然而,迄今有關D. zeae的鞭毛系統、flhDC和fliA基因功能及其調控機理尚不清楚。明確這些鞭毛基因的功能,有利于進一步了解D. zeae的致病性調控機理,同時,對于完善植物病原細菌的致病性綜合調控網絡和開發新型藥物作用靶標以及制定病害防控策略均具有重要意義。【前人研究進展】細菌的鞭毛是重要的運動器官,它不僅在對環境適應、營養尋找、躲避不良因素傷害等過程中具有重要功能,而且在趨化性、黏附、定殖、生物膜形成和毒性因子產生等過程中也發揮著重要作用[4]。已有研究表明,超過50個基因參與了細菌鞭毛的生物合成以及細菌的運動,它們成簇排列共同構成鞭毛生物合成的級聯調控系統[5]。早期研究比較清楚的周生鞭毛病原菌代表大腸桿菌(Escherichia coli)或沙門氏菌(Salmonella typhimurium),其鞭毛基因操縱子通常被分為3個轉錄調節等級,即級別Ⅰ、級別Ⅱ和級別Ⅲ,根據基因表達的先后順序,相應地分為早期、中期和晚期,其基因表達受到精細的調控[6]。flhDC操縱子編碼調控細菌鞭毛基因表達的主調控因子FlhDC,由flhD和flhC組成,位于鞭毛調控系統的最高一級,其編碼產物FlhD和FlhC共同組成FlhD4-FlhC2異六聚體結構,屬于轉錄激活蛋白,激活第二等級基因的轉錄[7-8],而由編碼調控蛋白FliA(σ28)、鞭毛基體和鉤狀體等成分的基因則組成第二等級,負責Ⅲ級基因如鞭毛素蛋白FliC、鞭毛鉤相關蛋白、馬達蛋白和趨化蛋白等的轉錄表達[9-10]。細菌的鞭毛除了作為運動器官之外,還有許多其他重要的功能,如黏附、生物膜形成和病原菌的侵入等[11-14]。在一些病原細菌中,毒性因子向胞外分泌,必須依賴于鞭毛分泌裝置[15-16],細菌胞外部分的鞭毛是一個類似于III型分泌系統(TTSS)的分泌裝置,某些毒性因子是由鞭毛的轉運系統來分泌的[17-18]。【本研究切入點】然而,上述以大腸桿菌為代表的鞭毛系統在周生鞭毛中并不都適用,甚至不適用于所有的大腸桿菌,而在D. zeae中有關鞭毛系統的基因功能尚未見報道。【擬解決的關鍵問題】從D. zeae基因組中尋找分析flhDC和fliA,用同源重組無痕基因敲除的方法構建缺失突變株,qRT-PCR方法分析D. zeae鞭毛基因表達和調控層次,并測定野生菌與突變體的運動性、致病酶、毒素、致病力等表型,分析鞭毛調控基因 flhDC和fliA在該細菌中的功能。
1 材料與方法
試驗于 2013年在華南農業大學農學院植物細菌研究室完成。
1.1 供試材料
1.1.1 供試菌株、質粒及培養條件 本研究所用菌株和質粒見表1,其中載體質粒pKNG101和pRK2013由上海交通大學陳功友教授惠贈,D. zeae強致病力菌株EC1及其他菌株均由華南農業大學植物細菌研究室保存提供。D. zeae野生菌EC1及其突變菌培養于LB或MM培養基[19]中,適宜生長溫度為30℃;大腸桿菌培養用LB培養基,適宜生長溫度為37℃。培養基中相應抗生素濃度為利福平(Rif)50 μg·mL-1,硫酸鏈霉毒(Sm)50 μg·mL-1,卡那霉素(Km)50 μg·mL-1。水稻品種特秈 13是基腐病感病寄主,煙草品種為K326,種植于溫室,馬鈴薯購自附近超市。
1.1.2 主要試劑及引物 PrimerSTARTMHS DNA Polymerase、Taq DNA Polymerase、T4 DNA Ligase、限制性內切酶 Spe I、Bam HI、D2000 DNA Ladder Marker、Star Prep Plasmid Miniprep Kit、Universal DNA Purification Kit、DNA Fragment Purification Kit、PrimeScriptTMRT Master Mix(for Real Time)和SYBR? Premix Ex TaqTMII(Tli RNaseH Plus)均購自TaKaRa公司;SV Total RNA Isolation System、RQ1 RNase-Free DNase購自Promega公司。所有引物合成和測序由上海英駿生物技術有限公司完成,引物見表2。
1.2 基因缺失突變體的構建
利用兩次同源重組的方法構建基因缺失突變體。以D. zeae野生型菌株EC1基因組DNA為模板,分別利用引物 flhDC-U-F、flhDC-U-R以及 flhDC-D-F、flhDC-D-R擴增得到 flhDC的上、下游片段;再以flhDC-U-F和flhDC-D-R為引物對,以上、下游片段1∶1比例為模板PCR擴增得到缺失flhDC的融合片段,雙酶切純化后連接到自殺性載體pKNG101上,45 s熱擊轉入的E. coli K12 CC118感受態細胞中,篩選得到陽性重組質粒pKNG-ΔflhDC。三親結合方法將重組質粒、輔助質粒 pRK2013以及受體菌 EC1共培養12 h,將混合液涂布于含硫酸鏈霉素Sm但不含蔗糖的MM平板上培養48 h進行第1次同源重組,獲得的單交換子稀釋涂布于不含硫酸鏈霉素Sm但含10%蔗糖的MM平板上再培養48 h進行第2次同源重組,挑取雙交換子進行PCR和測序驗證,獲得正確的突變體ΔflhDC。用相同的方法構建突變體ΔfliA。

表1 本研究所用的菌株、質粒Table 1 Bacterial strains and plasmids used in this study

表2 本研究所用引物及其序列Table 2 Primers used for genes knocking out and qRT-PCR
1.3 細菌運動性、生物膜形成能力、毒素和胞外酶活性測定
按照SHEN等[20]的方法測定細菌的運動性;按照YAP等[21]的方法測定細菌生物膜的形成能力;按照ZHOU 等[22]的方法測定細菌產生毒素的能力;按照CHATTERJEE等[23]的方法分別測定細菌產生的果膠酶、纖維素酶和蛋白酶活性。
1.4 細菌對水稻種子萌發影響
各取50粒水稻種子于50 mL的滅菌離心管中,分別加入25 mL培養至OD600=0.5的待測菌液,室溫靜置5 h,棄去菌液,用無菌水沖洗種子3次,置于墊有濾紙(無菌水濕潤)的培養皿中,30℃保濕培養,以LB空白培養液為對照(CK),每處理3個重復,4 d后測量胚根與胚芽的長度。
1.5 煙草過敏反應和水稻致病性測定
接種細菌培養和菌液準備:將野生菌和突變菌分別用含有相應抗生素的LB 30℃下培養12—24 h,離心收集菌體,調節菌體濃度至OD600約為0.5,備用,以空白LB為對照(CK)。其中煙草過敏性反應(HR)測定是采用無菌注射器將菌液注入煙草葉片,24 h觀察 HR;水稻致病性測定采用菌液灌根法接種,先用滅菌的針頭刺傷水稻莖基部,然后往盆里各倒入 20 mL的菌液,每個菌株接種共9株水稻,3次重復,48 h后開始觀察水稻癥狀。
1.6 flhDC和fliA的轉錄調控分析
采用試劑盒SV Total RNA Isolation System的方法提取細菌的RNA,經瓊脂糖凝膠電泳和核酸分析儀檢測質量,RQ1 RNase-Free DNase去除基因組DNA,然后按照反轉錄試劑盒為 PrimeScriptTMRT Master Mix(for Real Time)的方法合成cDNA。以EC1、ΔflhDC和ΔfliA的cDNA為模板進行實時定量PCR反應,采用 SYBR? Premix Ex TaqTMII(Tli RNaseH Plus)試劑盒,試驗儀器 Thermal Cycler Dice? Real Time System(TaKaRa Code:TP800),以16SrDNA為內參,檢測野生型和突變體鞭毛相關基因的轉錄表達。
2 結果
2.1 flhDC、fliA基因缺失突變體構建及驗證
通過融合PCR獲得缺失目的基因的融合片段,連接在質粒 pKNG101上,獲得了重組質粒 pKNGΔflhDC和 pKNG-ΔfliA。三親轉化方法將重組質粒分別導入野生型菌株EC1發生雙交換后,以雙交換子的菌落DNA為模板,分別以flhDC-U-F和flhDCD-R、fliA-U-F和fliA-D-R進行PCR,ΔflhDC和ΔfliA分別擴增出大小為1 191、1 099 bp的條帶,而EC1中對應擴增出2 123、1 762 bp的條帶(結果未顯示),再將擴展片段送上海英駿生物技術有限公司測序驗證,獲得了正確的基因缺失突變體 ΔflhDC和ΔfliA。
2.2 ΔflhDC和ΔfliA的運動性、生物膜形成能力、毒素和胞外酶活性
分別對野生菌和突變菌株進行了運動性、毒素和胞外酶活性測定。結果表明,ΔflhDC和ΔfliA在半固體培養基上的泳動能力明顯減弱(圖 1-A),形成生物膜的能力顯著降低(圖1-B),但EC1、ΔflhDC和ΔfliA都產生毒素(圖1-C),并且果膠酶(圖1-D)、蛋白酶(圖1-E)和纖維素酶(圖1-F)的產生能力在不同菌株之間均無明顯差異。

圖1 EC1、ΔflhDC和ΔfliA菌株的運動性、生物膜、毒素和胞外酶活性測定Fig. 1 Determination of mobility, biofilm, toxin, and extracellular enzymes of EC1, ΔflhDC and ΔfliA strains
2.3 基因缺失突變均降低對水稻種子的抑制作用
水稻基腐病菌具有抑制水稻種子萌發生根的作用[1],本研究顯示,野生菌株EC1對水稻種子萌發具有很強的抑制作用,其處理后種子萌發基本上不長根,而突變體ΔflhDC和ΔfliA則顯著降低了對水稻種子萌發的抑制作用,其處理后水稻種子萌發的根、芽長度與對照CK基本相似(圖2),表明flhDC和fliA具有影響水稻種子萌發的作用。
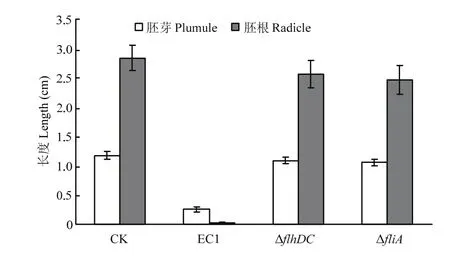
圖2 EC1、ΔflhDC和ΔfliA對水稻種子萌發的影響Fig. 2 The inhibition on rice seed germination by EC1, ΔflhDC and ΔfliA
2.4 ΔflhDC和ΔfliA對煙草的過敏反應和水稻的致病力
HR測定結果顯示,ΔflhDC、ΔfliA同野生型菌株EC1一樣,能夠在煙草上激發HR反應(圖3)。然而,水稻苗期灌根接種的結果顯示,接種野生菌株EC1的水稻莖基部出現大面積的黑褐色病斑,且病部腐爛程度較嚴重,而接種突變體的水稻植株只在針刺部位的周圍產生水漬褐斑,且腐爛程度輕微(圖4),說明ΔflhDC、ΔfliA突變體顯著降低了對水稻的致病力。
2.5 ΔflhDC和ΔfliA中下游基因表達調控分析

圖3 EC1、ΔflhDC和ΔfliA的煙草過敏性反應Fig. 3 Hypersensitive response of EC1, ΔflhDC and ΔfliA on tobacco

圖4 EC1、ΔflhDC和ΔfliA接種水稻1周后癥狀Fig. 4 Symptoms on rice plant after one week inoculation by EC1, ΔflhDC and ΔfliA
瓊脂糖凝膠電泳(未顯示)和核酸定量檢測結果(A260/A280為2.0左右,A260/A230>2.0)表明,所提取的細菌總RNA質量高,可用于后續相對表達量分析。相對定量基因表達結果顯示,flhDC基因缺失突變后,細菌的flhD和flhC不能轉錄,但fliA和fliC的表達量明顯下降;然而,在突變體菌株ΔfliA中,flhD、flhC和fliA等3個基因均不能轉錄,fliC表達明顯下調(圖5)。推測編碼鞭毛特異性σ28因子fliA也許通過影響flhDC,從而調節flhD、flhC和fliC。
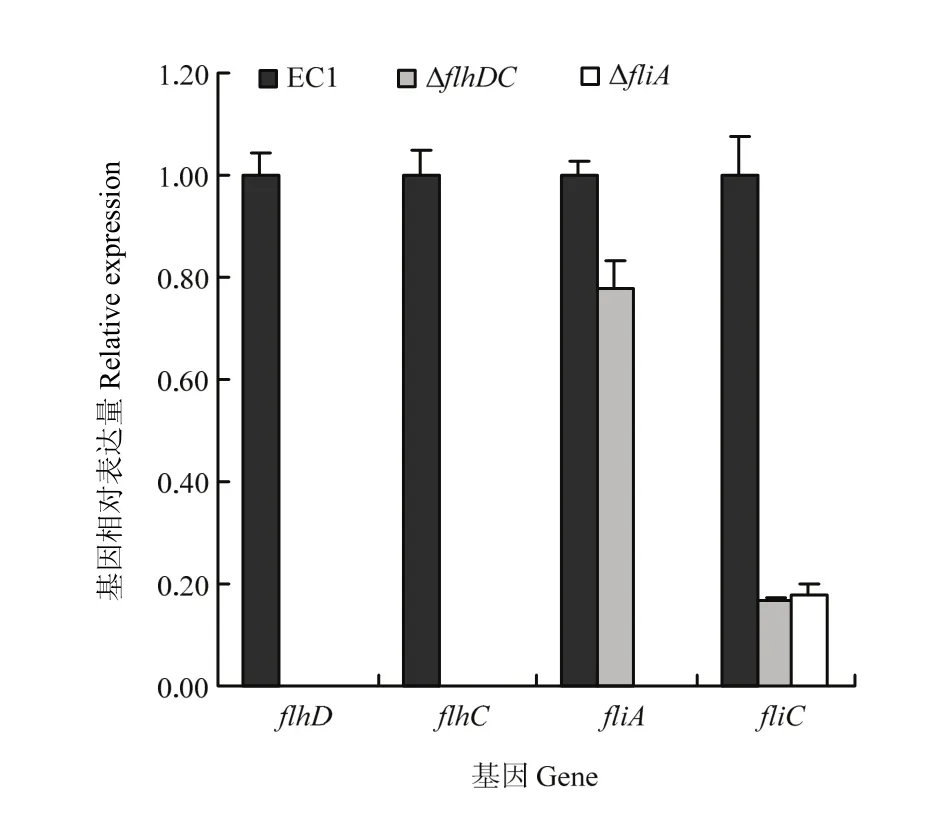
圖5 qRT-PCR檢測ΔflhDC和ΔfliA 中的flhD、flhC、fliA及fliC的相對表達量Fig. 5 Relative expression of flhD, flhC, fliA and fliC in ΔflhDC and ΔfliA by qRT-PCR
3 討論
鞭毛是細菌的重要組成結構,也是動植物病原細菌重要的毒性因子[24-25]。大量研究表明,鞭毛的有無對細菌的運動性和生物膜形成有至關重要的作用。王瑤等[26]研究證實了假結核耶爾森氏菌(Yersinia pseudotuberculosis)的 flhDC對細菌運動性和第二級調控基因fliA的調控作用,發現了FlhDC具有調控細菌運動性和生物膜形成的功能。本研究中水稻基腐病菌flhDC、fliA基因突變體同樣引起細菌的運動性減弱,生物膜減少等表型的變化,其原因可能由于細菌鞭毛的破壞所引起的生物學表型的變化。然而,有些不運動的細菌也能形成很強的生物膜,在大腸桿菌K-12菌株中,鞭毛的運動性對黏附的起始和生物膜的發育并不是必需的[27]。對于D. zeae,是其運動性本身還是鞭毛的有無對生物膜的影響,有待于進一步研究。
不少研究證明,鞭毛基因家族是細菌潛在的致病因子[28]。在根癌土壤桿菌(Agrobacterium tumefaciens)中,失去鞭毛的突變體在向日葵上的致病力減弱[29];在類鼻疽伯克氏菌(Burkholderia pseudomallei)強毒株KHW中研究發現,fliC缺失突變株沒有鞭毛,在半固體培養基上無運動性,且毒力顯著減弱[30]。本研究發現,突變體ΔflhDC和ΔfliA對水稻的致病力減弱、且運動性和生物膜形成的能力,相對野生菌也表現明顯地減弱,但相關致病因子,如毒素、果膠酶、蛋白酶和纖維素酶等活性卻與野生型菌株差異不顯著,并能引起煙草 HR,因此,筆者認為水稻基腐病菌的致病力降低可能由于flhDC與fliA的基因突變導致鞭毛的缺失,影響細菌的運動性和黏附性,從而影響病原菌的早期侵染,還需進一步驗證。
細菌的鞭毛具有非常復雜的結構,由很多基因參與其合成調控。已知參與E. coli鞭毛合成的基因就有50多個,成簇排列共同構成鞭毛生物合成的級聯調控系統[5];參與水稻黃單胞菌(Xanthomonas oryzae pv. oryzae)鞭毛組裝與調控的基因位于一個由60個基因組成的鞭毛基因簇中,fleQ作為一個主要的調控因子,與 σ54協同作用調控細菌鞭毛的合成或運動性[31-32]。前人研究發現,表達鞭毛特異性因子 σ28的基因 fliA具有非常重要的作用,在它的控制下,晚期基因能夠表達從而組裝后一階段的鞭毛結構,σ28不僅對晚期基因表達是必需的,它的過量表達還能夠增強所有中期基因的表達,而在缺少fliA時,flhDC操縱子能夠自我抑制[7,33]。另據研究表明,σ28也能夠激活自身啟動子[34],因此,環境信號刺激flhDC操縱子表達產生的σ28能夠激活flhDC操縱子的進一步表達而產生更多的包括σ28在內的中期基因的表達,而過量的σ28在轉錄晚期基因的同時又刺激flhDC操縱子及中期基因的表達,這就形成了完整的循環[34]。本研究中,flhDC基因缺失突變后細菌的flhD和flhC不能轉錄,fliA和fliC表達下調;但fliA基因缺失突變后,flhD、flhC和fliA均不能轉錄,fliC表達下調。由此,筆者推測編碼鞭毛特異性σ28因子fliA也許通過影響flhDC操縱子,從而調節flhD、flhC、fliC及下游基因,與缺少fliA時,flhDC操縱子能夠自我抑制[7,34]的結果相符,但flhDC、fliA對其他鞭毛基因的影響,還需進一步研究驗證。
4 結論
調控細菌鞭毛基因表達的主調控因子flhDC操縱子,以及表達鞭毛特異性因子σ28基因fliA,是細菌鞭毛系統基因簇的重要組分。flhDC和fliA顯著影響水稻基腐病菌的運動性、生物膜形成能力和對水稻種子萌發的功能,在該病菌的致病性中起重要作用。
[1] 劉瓊光, 張慶, 魏楚丹. 水稻細菌性基腐病研究進展. 中國農業科學, 2013, 46(14): 2923-2931.
LIU Q G, ZHANG Q, WEI C D. Advances in research of rice bacterial foot rot. Scientia Agricultura Sinica, 2013, 46(14): 2923-2931. (in Chinese)
[2] STEAD D E, PARKINSON N, BEW J, HENNESSY J, WILSON J K. ELPHINSTONE J G. The first record of Dickeya zeae in the UK. Plant Pathology, 2010, 59: 401.
[3] LIU Q G, YUAN Y, LIANG J J,WEI C D, ZHANG Q, LI H P. Physiological and biochemical characteristics and multilocus sequence analysis of banana soft rot bacteria in China. Journal of Plant Pathology, 2015, 97(1): 69-75.
[4] JOSENHANS C, SUERBAUM S. The role of motility as a virulence factor in bacteria. International Journal of Medical Microbiology, 2002, 291(1): 605-614.
[5] SOUTOURINA O A, BERTIN P N. Regulation cascade of flagellar expression in Gram-negative bacteria. FEMS Microbiology Reviews, 2003, 27(4): 505-523.
[6] CHILCOTT S G, HUGHES K T. Coupling of flagellar gene expression to flagellar assembly in Salmonella enterica serovar Typhimurium and Escherichia coli. Microbiology and Molecular Biology Reviews, 2000, 64(4): 694-708.
[7] KUTSUKAKE K. Hook-length control of the export-switching machinery involves a double-locked gate in Salmonella typhimurium flagellar morphogenesis. Journal of Bacteriology, 1997, 179(4): 1268-1273.
[8] WANG S Y, FLEMING R T, WESTBROOK E M, MATSUMURA P, MCKAY D B. Structure of the Escherichia coli FlhDC complex, a prokaryotic heteromeric regulator of transcription. Journal of Molecular Biology, 2006, 355: 798-808.
[9] KUTSUKAKE K, OHYA Y, IINO T. Transcriptional analysis of the flagellar regulon of Salmonella typhimurium. Journal of Bacteriology, 1990, 172(2): 741-747.
[10] MACNAB R M. Genetics and biogenesis of bacterial flagella. Annual Review of Genetics, 1992, 26: 131-158.
[11] O’TOOLE G A, KOLTER R. Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development. Molecular Microbiology, 1998, 30(2): 295-304.
[12] TOMICH M, HERFST C A, GOLDEN J W, MOHR C D. Role of flagella in host cell invasion by Burkholderia cepacia. Infection and Immunity, 2002, 70(4): 1799-1806.
[13] KIROV S M, CASTRISIOS M, SHAW J G. Aeromonas flagella (polar and lateral) are enterocyte adhesins that contribute to biofilm formation on surfaces. Infection and Immunity, 2004, 72(4): 1939-1945.
[14] LEE J H, RHO J B, PARK K J, KIM C B, HAN Y S, CHOI H, LEE K H, PARK S J. Role of flagellum and motility in pathogenesis of Vibrio vulnificus. Infection and Immunity, 2004, 72(8): 4905-4910.
[15] BLOCKER A, KOMORIYA K, AIZAWA S. Type III secretion systems and bacterial flagella: insights into their function from structural similarities. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(6): 3027-3030.
[16] MACNAB R M. How bacteria assemble flagella. Annual Review of Microbiology, 2003, 57: 77-100.
[17] MAJANDER K, ANTON L, ANTIKAINEN J, LIANG H, BRUMMER M, KORHONEN T K, WESTERLUND-WIKSTR?M B. Extracellular secretion of polypeptides using a modified Escherichia coli flagellar secretion apparatus. Nature Biotechnology, 2005, 23(4): 475-481.
[18] WARREN S M, YOUNG G M. An amino-terminal secretion signal is required for YplA export by the Ysa, Ysc, and flagellar type III secretion systems of Yersinia enterocolitica biovar 1B. Journal of Bacteriology, 2005, 187(17): 6075-6083.
[19] 陳雪鳳, 魏楚丹, 張慶, 劉瓊光. 水稻基腐病菌HrpX/HrpY在致病性中的功能分析. 中國農業科學, 2014, 47(4): 675-684.
CHEN X F, WEI C D, ZHANG Q, LIU Q G. Functional analysis of HrpX/HrpY in Dickeya zeae virulence. Scientia Agricultura Sinica, 2014, 47(4): 675-684. (in Chinese)
[20] SHEN Y, CHERN M, SILVA F G, RONALD P. Isolation of a Xanthomonas oryzae pv. oryzae flagellar operon region and molecular characterization of flhF. Molecular Plant-Microbe Interactions, 2001, 14(2): 204-213.
[21] YAP M N, YANG C H, BARAK J D, JAHN C E, CHARKOWSKI A O. The Erwinia chrysanthemi type III secretion system is required for multicellular behavior. Journal of Bacteriology, 2005, 187(2): 639-648.
[22] ZHOU J, ZHANG H, WU J, LIU Q, XI P, LEE J, LIAO J, JIANG Z, ZHANG L H. A novel multidomain polyketide synthase is essential for zeamine production and the virulence of Dickeya zeae. Molecular Plant-Microbe Interactions, 2011, 24(10): 1156-1164.
[23] CHATTERJEE A, CUI Y, LIU Y, DUMENYO C K, CHATTERJEE A K. Inactivation of rsmA leads to overproduction of extracellularpectinases, cellulases, and proteases in Erwinia carotovora subsp. carotovora in the absence of the starvation/cell density-sensing signal, N-(3-oxohexanoyl)-L-homoserine lactone. Applied and Environmental Microbiology, 1995, 61(5): 1959-1967.
[24] MACNAB R M. The bacterial flagellum: reversible rotary propellor and type Ⅲ export apparatus. Journal of Bacteriology, 1999, 181(23): 7149-7153.
[25] PALLEN M J, PENN C W, CHAUDHURI R R. Bacterial flagellar diversity in the post-genomic era. TRENDS in Microbiology, 2005, 13(4): 143-149.
[26] 王瑤, 丁莉莎, 胡楊波, 張勇, 楊寶玉, 陳士云. 假結核耶爾森氏菌flhDC基因影響細菌運動性和生物膜形成. 中國科學: 生命科學, 2007, 37(5): 516-523.
WANG Y, DING L S, HU Y B, ZHANG Y, YANG B Y, CHEN S Y. flhDC genes affect the motility and biofilm formation in Yersinia pseudotuberculosis. Scientia Sinica Vitae, 2007, 37(5): 516-523. (in Chinese)
[27] PRIGENT-COMBARET C, PRENSIER G, LE THI T T, VIDAL O, LEJEUNE P, DOREL C. Developmental pathway for biofilm formation in curli-producing Escherichia coli strains: role of flagella, curli and colanic acid. Environmental Microbiology, 2000, 2(4): 450-464.
[28] OLIVEIRA D M, GOUVEIA J J, DINIZ N B, PACHECO A C, VASCONCELOS E J, DINIZ M C, VIANA D A, FERREIRA T D, ALBUQUERQUE M C, FORTIER D C, MAIA A R, COSTA L A, MELO J O, DA SILVA M C, WALTER C A, FARIA J O, TOME A R, GOMES M J, OLIVEIRA S M, ARAúJO-FILHO R, COSTA R B, MAGGIONI R. Pathogenomics analysis of Leishmania spp. flagellar gene families of putative virulence factor. OMICS, 2005, 9(2): 173-193.
[29] CHESNOKOVA O, COUTINHO J B, KHAN I H, MIKHAIL M S, KADO C I. Characterization of flagella genes of Agrobacterium tumefaciens, and the effect of a bald strain on virulence. Molecular Microbiology, 1997, 23(3): 579-590.
[30] CHUA K L, CHAN Y Y, GAN Y H. Flagella are virulence determinants of Burkholderia pseudomallei. Infection Immunity, 2003, 71(4): 1622-1629.
[31] 張靜, 許景升, 吳茂森, 何晨陽. 水稻白葉枯病菌轉錄調控因子基因 fleQxoo和 σ54因子基因 rpoNxoo的分子鑒定. 植物病理學報, 2008, 38(5): 449-455.
ZHANG J, XU J S, WU M S, HE C Y. Molecular identification of the transcriptional regulator fleQxoo and the alternative σ54factor gene rpoNxoo of Xanthomonas oryzae pv. oryzae, the casual pathogen of bacterial blight in rice. Acta Phytopathologica Sinica, 2008, 38(5): 449-455. (in Chinese)
[32] LEE B M, PARK Y J, PARK D S, KANG H W, KIM J G, SONG E S, PARK I C, YOON U H, HAHN J H, KOO B S, LEE G B, KIM H, PARK H S, YOON K O, KIM J H, JUNG C H, KOH N H, SEO J S, GO S J. The genome sequence of Xanthomonas oryzae pathovar oryzae KACC10331, the bacterial blight pathogen of rice. Nucleic Acids Research, 2005, 33(2): 577-586.
[33] YANAGIHARA S, IYODA S, OHNISHI K, IINO T, KUTSUKAKE K. Structure and transcriptional control of the flagellar master operon of Salmonella typhimurium. Gene and Genetic Systems, 1999, 74: 105-111.
[34] LIU X, MATSUMURA P. Differential regulation of multiple overlapping promoters in flagellar class II operons in Escherichia coli. Molecular Microbiology, 1996, 21(3): 613-620.
(責任編輯 岳梅)
Functional Analysis of flhDC and fliA in Dickeya zeae
CHEN Xue-feng, YU Cheng-peng, LIU Qiong-guang
(College of Agriculture/Key Laboratory of Microbial Signals and Disease Control, Guangdong Province, South China Agricultural University, Guangzhou 510642)
【Objective】 Rice foot rot, caused by Dickeya zeae, is one of the important bacterial diseases on rice. Bacterialflagella is an important movement organ, so far, the mechanism of the flagellar system, flhDC and fliA and their regulatory mechanisms are unclear in D. zeae. To clarify the function of these flagellum genes is helpful for further understanding the pathogenicity of integrated control network in D. zeae, developing new drug action targets and making disease prevention and control strategies. The objective of this study is to investigate the function of flagellar system of flhDC and fliA in D. zeae.【Method】A set of primers were designed based on the genomic DNA of wild strain EC1 of D. zeae. The upstream and downstream fragments of target genes flhDC and fliA to be knocked out were amplified by PCR, respectively. The upstream and downstream fragments were mixed as a template, and then the fusion fragments that lack of flhDC and fliA were obtained by PCR. After dualenzyme digestion and purification, the fusion fragments were connected to the suicide vector pKNG101, suicide recombinant plasmids pKNG-ΔflhDC and pKNG-ΔfliA with reverse selection marker gene sacB were constructed, then transferred into wild strain EC1, respectively, by tri-parental mating, so the gene deletion mutants ΔflhDC and ΔfliA were constructed after two alleles homologous recombination screening and PCR detection and sequencing verification. The biological characteristics such as extracellular enzyme, toxin, motility, biofilm, virulence to rice and HR on tobacco were compared and analyzed. In addition, bacterial total RNA was extracted, and a real-time quantitative PCR (qRT-PCR) was carried out using 16SrDNA as internal control for normalization. Then the expression of downstream genes flhD, flhC, fliA and fliC in ΔflhDC and ΔfliA was compared.【Result】Two target gene deletion mutants ΔflhDC and ΔfliA were constructed successfully by genetic manipulation. Phenotypic test results showed that the motility and biofilm formation of wild strain EC1 were very strong, while the motility and biofilm formation of the ΔflhDC and ΔfliA were decreased obviously. The wild strain EC1 had a strong inhibitory effect on rice seed germination, while ΔflhDC and ΔfliA significantly reduced the inhibition of rice seed germination. The rice plants inoculated with the wild strain EC1 showed a brown spot and a large extent of rottenness, while rice plants with ΔflhDC and ΔfliA inoculation only showed water-brown lesions around the inoculated sites. It indicated that ΔflhDC and ΔfliA significantly reduced the virulence to rice plant. Further phenotypic results showed that the activities of extracellular enzymes, toxin and the ability to cause HR on tobacco were not different significantly between the mutants and the wild strain. The results of qRT-PCR showed that in the mutant ΔflhDC, the flhDC and the fliA did not express, while the expressions of the fliA and the fliC decreased obviously compared with the wild strain; In addition, the flhD, flhC and the fliA in the mutant ΔfliA did not express, but the expressions of the fliC decreased obviously. 【Conclusion】The flhDC operon, which regulates the expression of the bacterial flagellum genes, and the fliA, which expresses flagellin specific factor σ28, are important components of the bacterial flagellar system gene cluster. The genes flhDC and fliA significantly affect the motility, biofilm and the germination of rice seeds, and play an important role involving in the virulence in D. zeae.
Dickeya zeae; flhDC; fliA; motility; virulence
ntia Agricultura Sinica
10.3864/j.issn.0578-1752.2016.24.005
2016-08-30;接受日期:2016-10-18
國家自然科學基金(31371903)
聯系方式:陳雪鳳,E-mail:gxchenxuefeng@163.com。通信作者劉瓊光,E-mail:qgliu@scau.edu.cn

