水稻茉莉酸響應基因的分析
季科研,樊凌志,Bella akoa gilles marius,蒲首丞,孫梅好
(浙江師范大學化學與生命科學學院,浙江金華321004)
水稻茉莉酸響應基因的分析
季科研,樊凌志,Bella akoa gilles marius,蒲首丞,孫梅好
(浙江師范大學化學與生命科學學院,浙江金華321004)
茉莉酸是植物體內天然的調節劑,在植物生長發育過程及響應外界環境脅迫方面具有重要的作用。為了分析水稻中茉莉酸的響應基因,設計了OsPDF1.2,OsVSP2,OsJAZ8的定量PCR引物,利用100 μmol/L茉莉酸和100 μmol/L菲尼酮(內源茉莉酸合成抑制劑)處理的葉片為材料,分析了OsJAZ8,OsPDF1.2,OsVSP2等3個基因對茉莉酸的響應情況。結果表明,OsJAZ8,OsPDF1.2隨著茉莉酸處理時間的延長,表達量逐漸升高,隨著菲尼酮處理時間的延長,表達量逐漸降低,而OsVSP2則與之相反;OsJAZ8對于茉莉酸的響應較OsPDF1.2,OsVSP2這2個基因更加敏感。據此結果認為,OsJAZ8的表達量可以作為水稻葉片中茉莉酸相對含量的指標。
茉莉酸;水稻;RT-PCR;相對轉錄水平
水稻(Oryza sativa L)是世界上最重要的糧食作物,世界上超過90%的水稻集中種植在亞洲,供給了地球上60%人們的糧食需求。高鹽、干旱和堿性環境,包括高濃度的Na+、過高的pH值、高濃度的CO32-和HCO3-等,是抑制植物生長與發育的主要環境壓力,其中,高鹽影響了20%的灌溉農業用地[1],導致農作物產量嚴重損失,每年造成永久性虧損150萬hm2,因此,科學家一直將提高植物的抗性作為重要的研究方向。在各種環境壓力下,植物已進化出不同的機制來感應、應對各種環境壓力[2-4]。
茉莉酸(jasmonic acid,JA)及其甲酯是天然的植物生長調節劑。從1962年發現茉莉酸至今,人們對茉莉酸的合成途徑已經較為清楚。當植物受到脅迫時,亞麻酸從葉綠體膜釋放后經脂氧合酶途徑氧化為13(S)-氫過氧-亞麻酸,再在丙二烯氧化合成酶和丙二烯氧化環化酶的作用下生成12-氧-植物二烯酸(OPDA),然后離開葉綠體進入過氧化物酶體形成茉莉酸,最后代謝為茉莉酸甲酯(JAMe)、茉莉酸氨基酸結合物等衍生物[5]。JA調節水稻的生長發育(如發芽、莖的伸長、根的生長、開花、衰老等),參與對環境脅迫的響應(光形態建成、向地性、非生物脅迫的適應等),參與生物脅迫(微生物、線蟲以及食草動物等)的防御反應[6]。內源JA的測定方法主要是LC-MS,RT-PCR等。Spoel等[7-8]分別利用JA響應基因PDF1.2與VSP2分析了擬南芥JA的相對含量。OsJAZ8是水稻茉莉酸結構域蛋白,參與了水稻內源茉莉酸響應過程,Yamada等[9]研究發現,其表達與JA呈明顯的正相關性。目前,利用水稻響應基因分析JA的相對含量尚未見報道。
本研究以水稻日本晴為研究材料,以擬南芥茉莉酸響應基因PDF1.2和VSP2的水稻同源基因以及水稻OsJAZ8為目標,探討外源茉莉酸、內源茉莉酸合成抑制劑——菲尼酮[10]處理對OsPDF1.2,Os-VSP2,OsJAZ8表達的影響,分析茉莉酸與這3個基因表達的相關性。
1 材料和方法
1.1 植物材料和生長條件
供試材料為水稻日本晴種子。種子經10%(V/V)次氯酸鈉表面消毒30 min,無菌蒸餾水漂洗5次后,于37℃發芽。取露白種子置于96孔板中,在光照培養箱中水培(晝/夜溫度為28℃/26℃,光照14/10 h)。三葉期后,用3.3 mmol/L硫酸鹽的半培養液(全培養液∶水=1∶1)培養7 d,之后用3.3 mmol/L全培養液培養7 d,在培養期間增添被蒸發和吸收的水。
1.2 JA響應基因的篩選和引物設計
根據擬南芥 VSP2和 PDF1.2序列,利用BLAST同源比對(www.ncbi.nlm.nih.gov)獲得水稻粳稻的OsPDF1.2,OsVSP2序列。經oligo(dT)primers軟件設計OsPDF1.2,OsVSP2,OsJAZ8的引物,利用溶解曲線峰檢測引物特異性,從而篩選出特異性引物(表1)。
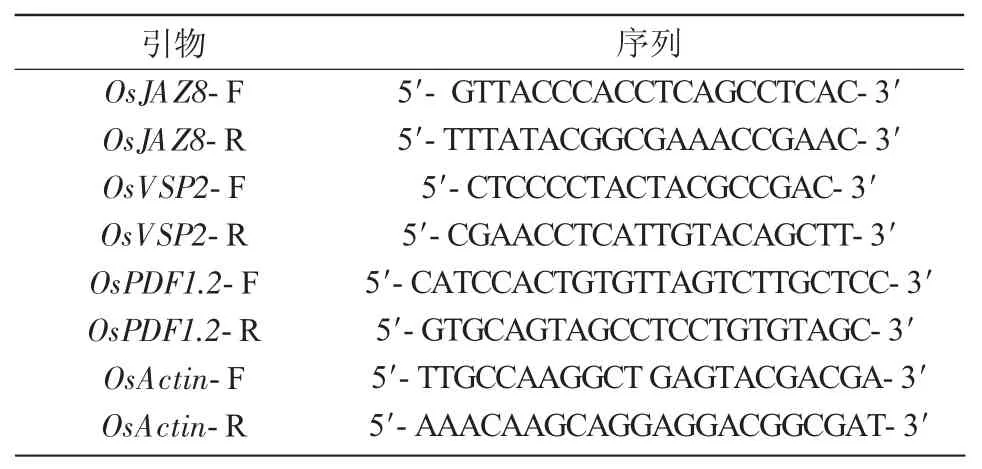
表1 RT-PCR以及半定量PCR引物
1.3 RNA提取和cDNA合成
21 d幼苗經外源茉莉酸(100 μmol/L)以及菲尼酮(100 μmol/L)處理不同時間后,取葉片0.5 g置于液氮中充分研磨至粉末,經Trizol法[9]提取RNA,并存放于-80℃中保存。
逆轉錄反應體系20 μL為:RNA放入65℃熱變性5 min后,立即置于冰上冷卻,并分別加入RNA1 μg,5×RTBuffer 4 μL,RTEnzyme Mix1 μL, primerMix1μL,用Nuclease-freewater定容至20 μL(濃度50 ng/μL),水浴37℃15 min,98℃5 min,反應結束后存放于-20℃。
1.4 實時定量RT-PCR和半定量分析
定量RT-PCR(ABI 7500)采用20 μL反應體系:10 μL 2×SYBR Green RT-PCR Master Mix(Toyobo),引物各0.5 μL,模板cDNA 1 μL,50× ROX0.4 μL,加入ddH2O定容至20 μL。擴增條件:95℃預變性5 min;95℃變性15 s,62℃退火30 s,72℃延伸20 s,40個循環。
以水稻基因作為內參,并采用2-ΔΔCt法進行定量分析。半定量PCR設3次重復,條件相同,采用20μL反應體系,30個循環,反應擴增條件:95℃預變性5 min;95℃變性15 s,62℃退火30 s,72℃延伸20 s,35個循環;72℃延伸10 min。反應結束后,PCR產物采用2%TAE瓊脂糖凝膠電泳檢測。
2 結果與分析
2.1 蛋白質同源性分析
通過蛋白質中氨基酸序列對比可知,擬南芥中JA響應基因PDF1.2和VSP2與水稻同源類似物(NM_001185895.1,NM_001063282.1)的氨基酸序列相似度分別為43%和33%。
2.2 OsPDF1.2轉錄表達分析
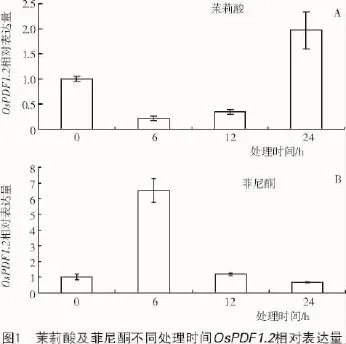
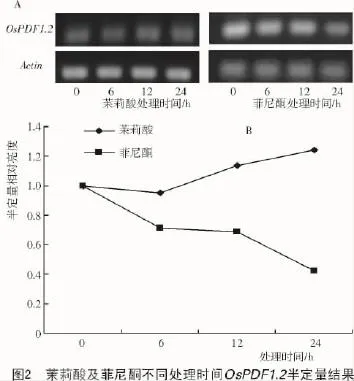
經過外源茉莉酸(100 μmol/L)以及菲尼酮(100 μmol/L)分別處理0,6,12,24 h后,利用定量PCR的方法分析水稻葉片中OsPDF1.2的轉錄水平,結果表明,隨著茉莉酸處理時間的延長,其相對轉錄量增多(圖1-A),處理24 h后其相對轉錄量是對照的1.8倍,而菲尼酮處理可降低其轉錄量(圖1-B)。半定量RT-PCR的結果同樣表明,茉莉酸和菲尼酮處理分別可以促進和降低OsPDF1.2的轉錄表達(圖2)。
2.3 OsVSP2轉錄表達分析
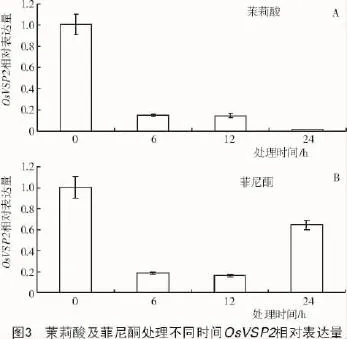
經過外源茉莉酸(100 μmol/L)以及菲尼酮(100 μmol/L)分別處理0,6,12,24 h后,利用定量PCR的方法分析水稻葉片中OsVSP2的轉錄水平,結果表明,隨著茉莉酸處理時間的延長,其相對轉錄量下降(圖3-A),與OsPDF1.2相反,當處理24 h后其相對轉錄量是對照的0.05倍,而菲尼酮處理卻增加其轉錄量(圖3-B)。半定量RT-PCR的結果同樣表明,茉莉酸和菲尼酮分別可以降低和促進OsVSP2的轉錄表達(圖4)。
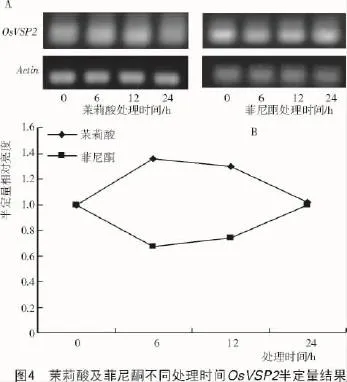
2.4 OsJAZ8轉錄表達分析
經過外源茉莉酸(100 μmol/L)以及菲尼酮(100 μmol/L)分別處理0,6,12,24 h后,利用定量PCR的方法分析水稻葉片中OsJAZ8的轉錄水平,結果表明,隨茉莉酸處理時間延長,其相對轉錄量增加(圖5-A),與OsPDF1.2相同,但與OsVSP2卻相反,處理24 h后其相對轉錄量是對照的13倍,而菲尼酮處理卻降低其轉錄量(圖5-B)。半定量RT-PCR的結果同樣表明,茉莉酸和菲尼酮分別可以促進和降低OsJAZ8的轉錄表達(圖6)。
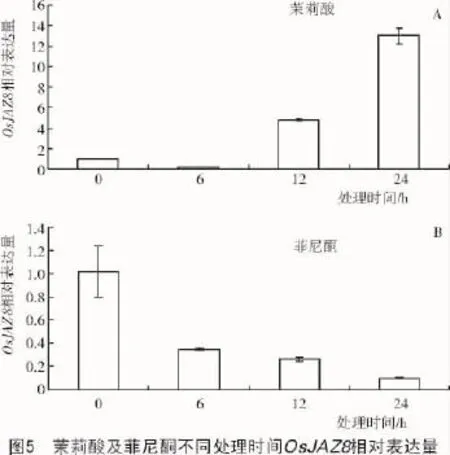
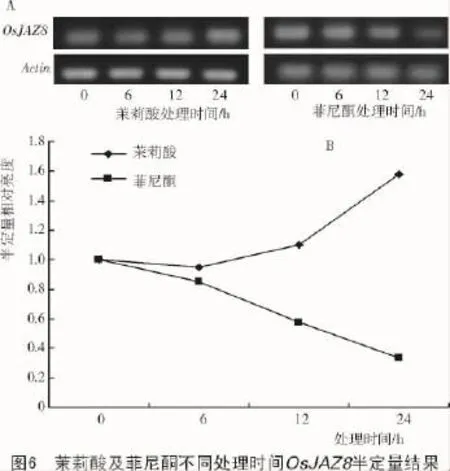
3 討論
植物體內激素是植物生命活動的主要承擔者,當外界生物環境發生變化,其體內激素也會產生相應的變化,以調節自身的生長發育。近年來,植物生長調節劑被認為在改善植物逆境受損方面具有一定的作用,可以提高作物的產量和質量[11-12]。茉莉酸(JA)及其茉莉酸甲酯,是天然存在的植物生長調節劑,調節植物的形態建成及生理生化代謝過程[12-13]。許多研究表明,茉莉酸在非生物環境壓力下,對植物起到了保護的作用[14]。茉莉酸(JA)及茉莉酸甲酯(MeJA)廣泛存在于植物體內,與抗性關系密切相關,能夠顯著增強植物在機械傷害、低溫、鹽害、干旱等非生物環境脅迫和病蟲害等生物脅迫中的抗性[15]。
擬南芥的茉莉酸響應基因OsPDF1.2和OsVSP2序列與水稻蛋白序列的相似性分別達到43%,33%。為了分析水稻的茉莉酸響應基因,本研究選擇了OsPDF1.2,OsVSP2,OsJAZ8為目標基因,分析了茉莉酸及其生物合成抑制劑對其表達的影響,結果表明,經100 μmol/L外源茉莉酸處理,可以提高水稻葉片中OsPDF1.2,OsJAZ8的表達,而降低了OsVSP2的表達;經100 μmol/L的菲尼酮處理,降低了OsPDF1.2,OsJAZ8的表達,提高了OsVSP2的表達。經24h的茉莉酸處理,OsPDF1.2,OsJAZ8的表達分別是對照的2.8倍和14倍,而OsVSP2降低至對照的5%。此結果表明,OsPDF1.2,OsJAZ8是水稻茉莉酸的正相關基因,而OsVSP2是茉莉酸的負相關基因,且OsJAZ8對于茉莉酸的敏感性較OsPDF1.2,OsVSP2更加敏感。半定量RT-PCR結果及相對亮度計算也得到了一致的結果。
OsJAZ8與OsPDF1.2對茉莉酸的轉錄表達響應,與擬南芥同源蛋白的表達調控是一致的[9,16]。Spoel等[16]研究發現,擬南芥VSP表達量隨著外施茉莉酸處理時間的增加而升高,是茉莉酸的正響應基因,與擬南芥AtVSP2的轉錄調控相反,本研究結果表明,水稻OsVSP2是茉莉酸的負調控基因,但引起此差異的機理尚不清楚。此結果也表明,不同植物同源基因的表達調控未必一致。
茉莉酸作為植物激素在植物體內發揮著重要的作用,參與調控了植物的生長發育以及抗生物及非生物脅迫的過程。本研究以OsJAZ8,OsPDF1.2,OsVSP2為目標基因,分析了其對茉莉酸的響應及敏感程度,結果發現,OsJAZ8是茉莉酸的正相關基因且較為敏感,推測可以利用OsJAZ8的相對表達量來反映水稻內源茉莉酸的相對含量。
[1]FAO.Land and plant nutrition management service[EB/OL]. [2008-04-25].http://www.fao.org/ag/agl/agll/spush.
[2]Xiong L,Schumaker K S,Hu J K.Cell signaling during cold,drought,and salt stress[J].Plant Cell,2002,14(Suppl):165-183.
[3]Zhu J K.Salt and drought stress signal transduction in plants[J].Annu Rev Plant Biol,2002,53:247-273.
[4]Fonyo A,Szende L,Meei I.The reversible activation of mitochondrial ATPase by high pH[J].Biochem Biophys Res Commun,1966,22(5):511-517.
[5]Wasternack C.Jasmonates:an update on biosynthesis,signal transduction and action in plant stress response,growth and development [J].Ann Bot,2007,100(4):681-697.
[6]Liu Z,Zhang S,Sun N,et al.Functional diversity of jasmonates in rice[J].Rice,2015,8(1):42.
[7]Spoel S H,Johnson J S,Dong X.Regulation of tradeoffs between plant defenses against pathogens with different lifestyles[J].Proc Natl Acad Sci USA,2007,104(47):18842-18847.
[8]Koornneef A,Leon-Reyes A,Ritsema T,et al.Kinetics of salicylate-mediated suppression of jasmonate signaling reveal a role for redoxmodulation[J].Plant Physiol,2008,147(3):1358-1368.
[9]Yamada S,KanoA,Tamaoki D,et al.Involvement ofOsJAZ8 in jasmonate-induced resistance to bacterial blight in rice[J].Plant Cell Physiol,2012,53(12):2060-2072.
[10]Radhika V,Kost C,Boland W,et al.The role of jasmonates in floral nectar secretion[J].PLoSOne,2010,5(2):9265.
[11]Seo H S,Kim S K,Jang S W,et al.Effect of jasmonic acid on endogenous gibberellins and abscisic acid in rice under NaCl stress[J].Biologia Plantarum,2005,49(3):447-450.
[12]Mahmood M,Bidabadi S S,Ghobadi C,et al.Effect of methyl jasmonate treatments on alleviation of polyethylene glycol-mediated water stress in banana(Musa acuminata cv.'Berangan',AAA)shoot tip cultures[J].Plant Growth Regul,2012,68:161-169.
[13]Anjum S A,Wang L,Farooq M,et al.Methyl jasmonate-induced alteration in lipid peroxidation,antioxidative defence system and yield in soybean under drought[J].Journal of Agronomy and Crop Science,2011,197(4):296-301.
[14]Takeuchi K,Gyohda A,Tominaga M,et al.RSOsPR10 expression in response to environmental stresses is regulated antagonistically by jasmonate/ethylene and salicylic acid signaling pathways in rice roots[J].Plant Cell Physiol,2011,52(9):1686-1696.
[15] Taniguchi S,Miyoshi S,Tamaoki D,et al.Isolation of jasmonate-induced sesquiterpene synthase of rice:product of which has an antifungal activity against Magnaporthe oryzae[J].J Plant Physiol,2014,171(8):625-632.
[16]Spoel S H,Koornneef A,Claessens S M,et al.NPR1 modulates cross-talk between salicylate-and jasmonate-dependent defense pathways through a novel function in the cytosol[J].Plant Cell,2003,15(3):760-770.
Analysis of Jasmonic Acid Response Gene in Rice
JI Ke-yan,FAN Ling-zhi,Bella akoa gilles marius,PU Shou-cheng,SUN Mei-hao
(College of Chemistry&Life Science,Zhejiang Normal University,Jinhua 321004,China)
Jasmonic acid,one of the plant hormones,plays vital roles in plant developments and dealing with biotic and abiotic stresses.To analyze rice marker genes for jasmonic acid,three genes(OsPDF1.2,OsVSP2,OsJAZ8)were selected,and their relative transcription levels were studies by quantitative PCR(qPCR)and semi-quantitative RT-PCR(sqRT-PCR),using rice leaves treated with jasmonic acid or its biosynthesis inhibitor,phenidone as materials.The results of qPCR demonstrated that transcription of OsJAZ8 and OsPDF1.2 were upregulated by jasmonic acid,while they were both downregulated by phenidone.On the contrary,the transcription of OsVSP2 was downregulated by jasmonic acid,and upregulated by phenidone.Transcription of OsJAZ8 was also found more sensitive than OsPDF1.2 and OsVSP2 to jasmonic acid signal.According to the results,the relative transcription levels of OsJAZ8 could be used to indicate relative content of jasmonic acid in rice leaves.
jasmonic acid;rice;RT-PCR;relative transcription levels
S511
A
1002-2481(2016)05-0587-05
10.3969/j.issn.1002-2481.2016.05.05
2016-01-26
國家自然科學基金項目(31070055);浙江省本科院校中青年學科帶頭人學術攀登項目(pd2013060)
季科研(1990-),男,安徽宿州人,在讀碩士,研究方向:蛋白質結構與功能。孫梅好為通信作者。

