miRNA-22在卵巢癌組織的表達及其對卵巢癌細胞增殖、遷移與侵襲的影響
李 楓, 姚 麗, 張喜紅, 夏玉紅, 程 劼, 婁雪玲, 姜秋慧
(鄭州人民醫院婦科, 河南 鄭州 450000)
miRNA-22在卵巢癌組織的表達及其對卵巢癌細胞增殖、遷移與侵襲的影響
李 楓△, 姚 麗, 張喜紅, 夏玉紅, 程 劼, 婁雪玲, 姜秋慧
(鄭州人民醫院婦科, 河南 鄭州 450000)
目的: 觀察在不同卵巢組織中miRNA-22的表達,并研究上調miRNA-22表達對卵巢癌細胞株SKOV-3增殖、遷移與侵襲的影響。方法:實時熒光定量PCR(qPCR)檢測不同卵巢組織樣本miRNA-22的表達;隨機將SKOV-3細胞分為正常對照組(control組)、空白載體組(miRNA-22-NC組)和轉染miRNA-22-mimic組(miRNA-22-m組),qPCR檢測各組細胞miRNA-22的表達,CCK-8法檢測細胞存活率,劃痕實驗與Transwell小室法分別檢測細胞的遷移與侵襲能力,Western blot法檢測VEGF和P53蛋白表達。結果:卵巢癌組織中miRNA-22的水平顯著低于正常卵巢組織;與control組相比,miRNA-22-m組細胞miRNA-22的表達顯著增加,細胞存活率顯著降低,細胞遷移數和侵襲數下降,VEGF和P53的蛋白表達水平顯著下降。結論:miRNA-22的低表達可能與卵巢癌的發生發展有關。過表達miRNA-22能夠抑制卵巢癌細胞株的增殖、遷移和侵襲,其機制可能與下調VEGF和P53的蛋白表達有關。
miRNA-22; 卵巢癌; 細胞增殖; 細胞遷移; 細胞侵襲
卵巢上皮性癌(簡稱卵巢癌)是女性最常見的婦科惡性腫瘤之一,死亡率極高,轉移快,侵襲能力強,復發性高,晚期患者五年生存率不及30%[1]。由于早期卵巢癌發病時無明顯癥狀,臨床上缺乏特異性高且敏感的診斷方法,70%以上的患者確診時已經到達晚期[2]。
在人類癌癥中,miRNA的功能可根據靶基因的作用不同調控腫瘤發生發展,具有癌基因或抑癌基因的作用[3]。miRNA通過與靶基因的3’非翻譯區結合,誘導mRNA降解,抑制蛋白質翻譯[4]。miRNA-22在多種腫瘤中表達異常,研究表明,miRNA-22在胃癌、肺癌、結腸癌及乳腺癌組織中低表達,在白血病和前列腺癌中高表達。本實驗擬分析卵巢癌組織中miRNA-22的水平,并通過研究過表達miRNA-22對卵巢癌漿液性乳頭狀囊腺癌細胞株SKOV-3增殖、遷移及侵襲能力的影響,探討miRNA-22的表達是否能為卵巢癌的臨床治療具有指導意義。
材 料 和 方 法
1 實驗材料
人卵巢癌漿液性乳頭狀囊腺癌細胞株SKOV-3購自中國科學院上海細胞所;胎牛血清購自Gibco;RPMI-1640培養基和脂質體LipofectamineTM2000購自Invitrogen;miRNA-22-mimic購自上海吉瑪制藥技術有限公司;VEGF、P53和β-actin抗體購自Santa Cruz。
2 實驗樣本
組織樣本來自鄭州人民醫院2010年8月~2015年8月的正常卵巢組織40例,卵巢癌旁組織42例,卵巢癌卵巢組織41例,病例平均年齡(40.43±2.57)歲。各組織樣本均由本院病理學專家檢查并確認,經本院倫理委員會同意。各樣本提取后立刻置于-80℃液氮中保存。
3 實驗方法
3.1 實時熒光定量PCR(qPCR)檢測miRNA-22 mRNA表達水平 嚴格按照TRIzol試劑說明書要求,提取相應組織的總RNA,蛋白定量后逆轉錄合成cDNA,采用PCR儀進行擴增, miRNA-22引物購于ABI PRISM。擴增條件:93 ℃ 30 s,64 ℃ 30 s,73 ℃ 40 s,共34個循環;72 ℃8 min。實驗結果在熒光定量操作系統中進行分析對比,采用2-ΔΔCt對目標基因miRNA-22的mRNA表達進行相對定量。
3.2 細胞培養、分組與轉染 將SKOV-3細胞株置于含10%胎牛血清的RPMI-1640培養基中,置于37 ℃、5% CO2的培養箱中孵育至細胞融合約80%左右,進行傳代。將細胞隨機分為3組:正常對照組(control組)、空白載體組(miRNA-22-NC組)和轉染miRNA-22-mimic組(miRNA-22-m組)。取對數生長期的細胞,以5×105的密度接種于96孔培養板,37 ℃、5% CO2的培養箱中孵育至約60%,用脂質體LipofectamineTM2000轉染,操作按照LipofectamineTM2000說明書進行,37 ℃、5% CO2的培養箱培養6 h后,更換含血清的正常生長培養基,37 ℃、5% CO2繼續培養24~72 h。
3.3 CCK-8法檢測細胞存活率 收集處于對數生長期的各組細胞,調整為細胞懸液,按每孔2×105個,加入48孔板中,置于37 ℃、5% CO2培養箱孵育12 h、24 h、36 h和48 h后,分別取各階段的細胞,加入10 μL CCK-8溶液,37 ℃孵育4 h,利用酶標儀測定于450 nm波長處的吸光度(A),計算細胞存活率,存活率(%)=實驗組A值/空白組A值×100%。
3.4 劃痕實驗 收集各組細胞,以2×108/L接種于48孔板中,待細胞融合到80%~90%,用槍頭沿著與皿底垂直方向劃痕,PBS洗滌細胞3次,加入無血清培養基,置于37 ℃、5% CO2培養箱培養24 h后,觀察細胞遷移軌跡,記錄細胞影像數據,計數。
3.5 Transwell法檢測細胞侵襲 Transwell小室的上室加入50 μL稀釋的Matrigel,孵育1 h使凝固。細胞轉染24 h后,吸盡培養液,更換無血清培養基培養24 h,胰酶消化,制成密度為2×108/L的細胞懸液。上室加入100 μL細胞懸液,下室加入500 μL 含1%胎牛血清的DMEM培養基,于37 ℃、5% CO2孵箱中培養24 h,棉簽擦除上室上面的非侵襲細胞,另一面用5 mL甲醇/醋酸(3∶1)固定20 min,0.5%結晶紫染色10 min,倒置于顯微鏡下觀察小室面的細胞個數,實驗重復3次。
3.6 免疫印跡法 細胞轉染24 h后,收集各組細胞,用RIPA細胞裂解液裂解,提取總蛋白后定量,調整蛋白濃度。取適量裂解產物,上樣后進行SDS-PAGE電泳,電轉至硝酸纖維素膜,加入5%脫脂牛奶室溫封閉1 h,孵育相應Ⅰ抗,4 ℃搖床過夜,室溫孵育相應Ⅱ抗1 h, 化學發光法顯色,成像掃描分析系統測定蛋白條帶的積分吸光度。
4 統計學處理
實驗結果以均數±標準差(mean±SD)表示,實驗數據兩組間均數比較時采用Bonferroni校正的t檢驗,所有數據均在SPSS 15.0統計軟件中進行統計,以P<0.05為差異有統計學意義。
結 果
1 正常卵巢組織、卵巢癌旁組織與卵巢癌卵巢組織miRNA-22的表達
實時熒光定量PCR檢測結果顯示,正常卵巢組織中miRNA-22的表達顯著高于卵巢癌卵巢組織,差異具有統計學意義(P<0.05),卵巢癌旁組織與正常卵巢組織miRNA-22的表達差異無統計學意義(P>0.05),見圖1。

Figure 1.The expression of miRNA-22 in normal ovarian tissues (40 cases), para-carcinoma tissues (42 cases) and ovarian cancer tissues (41 cases). Mean±SD.*P<0.05vsnormal ovarian tissue.
圖1 各卵巢組織中miRNA-22的表達
2 轉染miRNA-22-mimic后各組細胞miRNA-22的表達
轉染miRNA-22-mimic后,miRNA-22-m組miRNA-22的表達顯著上升(P<0.05),miRNA-22-NC組miRNA-22的表達無顯著變化(P>0.05),提示miRNA-22轉染成功,見圖2。

Figure 2.The expression of miRNA-22 after transfection of miRNA-22-mimic. Mean±SD.n=6.*P<0.05vscontrol.
圖2 轉染miRNA-22-mimic后各組SKOV-3細胞miRNA-22的表達水平
3 過表達miRNA-22對SKOV-3細胞存活率的影響
CCK-8法檢測結果顯示,control組和miRNA-22-NC組的細胞存活率隨時間推移迅速增長,與control組相比,miRNA-22-m組的細胞存活率隨時間增長的幅度明顯減少(P<0.05),見圖3。

Figure 3.Survival rate of SKOV-3 cells after transfection of miRNA-22-mimic. Mean±SD.n=3.*P<0.05vscontrol.
圖3 轉染miRNA-22-mimic后各組SKOV-3細胞存活率變化
4 過表達miRNA-22對SKOV-3細胞遷移能力的影響
劃痕實驗檢測SKOV-3細胞的遷移能力,與control組相比,轉染miRNA-22-mimic后,SKOV-3細胞的遷移速率顯著減少,差異具有統計學意義(P<0.05),control組和miRNA-22-NC之間差異無統計學意義(P>0.05),見圖4。
5 過表達miRNA-22對SKOV-3細胞侵襲能力的影響
Transwell侵襲實驗結果顯示,與control組相比,轉染miRNA-22-mimic后,SKOV-3細胞發生侵襲的細胞數顯著下降,差異具有統計學意義(P<0.05),control組和miRNA-22-NC之間差異無統計學意義,見圖5。
6 過表達miRNA-22對VEGF和P53蛋白表達的影響
Western blot法結果顯示,與control組相比,轉染miRNA-22-mimic后,VEGF和P53的蛋白表達水平顯著下降,差異具有統計學意義(P<0.05),control組和miRNA-22-NC之間差異無統計學意義,見圖6。
討 論
miRNA是長度約為22個堿基大小的非編碼RNA,通過抑制靶基因的功能或降解靶基因,從而在轉錄后水平調節基因表達。研究表明miRNA參與多種復雜的生物過程,如胚胎發育、器官形成等。miRNA具有組織特異性,可以準確地界定分化腫瘤[5]。多項研究發現miRNA-22具有抑癌基因的作用效果,對多種腫瘤具有調控作用。我們研究結果顯示,miRNA-22在卵巢癌卵巢組織中表達顯著低于正常卵巢組織,表明miRNA-22在卵巢組織的低表達提示有卵巢癌的可能性。miRNA-22通過轉錄后修飾ErbB3,抑制肺癌細胞系A549和H1299的增殖和侵襲能力[6]。此外,報道指出miRNA-22通過阻止雌激素信號通路來抑制乳腺癌細胞的生長[3,7],通過調控EVI-1癌基因的表達,從而抑制乳腺癌的轉移[8]。miRNA-22通過抑制肝癌細胞的HDAC4基因,從而抑制HCC細胞系的增殖,通過抑制NF-κB的表達從而抑制肝癌生成[10]。我們研究結果顯示,過表達miRNA-22后,SKOV-3細胞的存活率、遷移能力和侵襲能力降低,提示miRNA-22過表達具有抑制卵巢癌細胞的增殖,遷移和侵襲能力。
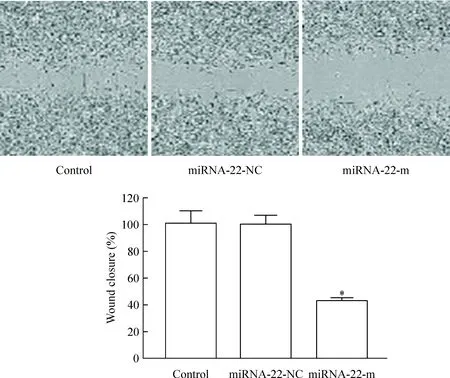
Figure 4. The number of migratory SKOV-3 cells after transfection of miRNA-22-mimic. Mean±SD.n=3.*P<0.05vscontrol.
圖4 轉染miRNA-22-mimic后各組SKOV-3細胞遷移數變化

Figure 5. Invasive ability of SKOV-3 cells after transfection of miRNA-22-mimic. Mean±SD.n=3.*P<0.05vscontrol.
圖5 轉染miRNA-22-mimic后各組SKOV-3細胞侵襲能力變化

Figure 6.Protein expression of VEGF and P53 after transfection of miRNA-22-mimic. Mean±SD.n=3.*P<0.05vscontrol.
圖6 轉染miRNA-22-mimic后VEGF和P53蛋白表達變化
VEGF是高度特異的血管生長因子,能夠增加血管通透性,刺激內皮細胞的分裂和增殖,進一步促進血管的形成[11],另一方面增加血管通透性導致腫瘤患者形成腹水。國外學者研究發現[12],測定血清中VEGF的含量水平有助于斷定卵巢腫瘤的良性與惡性。國內報道指出卵巢上皮性癌組織中VEGF呈高表達,惡化速度快,在腫瘤發生后迅速進入晚期,生存率低[13]。P53基因野生型為抑癌基因,對細胞生長具有抑制作用,突變型具有致癌的活性,是腫瘤形成的原因之一。報道指出卵巢上皮性癌中P53突變型達到44%~62%[14-15]。我們研究結果顯示,過表達miRNA-22后,SKOV-3細胞的VEGF和P53蛋白表達顯著降低,提示過表達miRNA-22后,可能與VEGF和P53的3’端UTR結合,從而促進VEGF和P53的降解,從而抑制癌癥細胞的生長、遷移和侵襲,從而具有抑制卵巢癌的作用。當然,進一步具體的詳細機制還需進行下一步實驗進行確定。
本研究表明,miRNA-22的表達對卵巢癌的診斷具有提示作用,在指導臨床治療方面具有重要意義。
[1] Sankaranarayanan R, Ferlay J. Worldwide burden of gynaecological cancer: the size of the problem[J]. Best Pract Res Clin Obstet Gynaecol, 2006, 20(2): 207-225.
[2] Liu CG, Calin GA, Meloon B, et al. An oligonucleotide microchip for genome-wide microRNA profiling in human and mouse tissues[J]. Proc Natl Acad Sci U S A, 2004,101(26):9740-9744.
[3] Xiong J, Yu D, Wei N, et al. An estrogen receptor alpha suppressor, microRNA-22, is downregulated in estrogen receptor alpha-positive human breast cancer cell lines and clinical samples[J]. FEBS J, 2010, 277(7):1684-1694.
[4] Farazi TA, Spitzer JI, Morozov P, et al. miRNAs in human cancer[J]. J Pathol, 2011, 223(2):102-115.
[5] Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers[J]. Nature, 2005, 435(7043): 834-838.
[6] Ling B, Wang GX, Long G, et al. Tumor suppressor miR-22 suppresses lung cancer cell progression through post-transcriptional regulation of ErbB3[J]. J Cancer Res Clin Oncol, 2012, 138(8):1355-1361.
[7] Pandey DP, Picard D. miR-22 inhibits estrogen signaling by directly targeting the estrogen receptor alpha mRNA[J]. Mol Cell Biol, 2009, 29(13): 3783-3790.
[8] Patel JB, Appaiah HN, Burnett RM, et al. Control of EVI-1 oncogene expression in metastatic breast cancer cells through microRNA miR-22[J]. Oncogene, 2011, 30(11):1290-1301.
[9] Takata A, Otsuka M, Kojima K, et al. MicroRNA-22 and microRNA-140 suppress NF-κB activity by regulating the expression of NF-κB coactivators[J]. Biochem Biophys Res Commun, 2011, 411(4):826-831.
[10]殷建瑞, 張 波, 譚麗華, 等.丁苯酞對缺氧缺糖條件下血管內皮細胞VEGF和HIF-1α表達的影響[J].中國病理生理雜志, 2011, 27(4):643-647.
[11]Cooper BC, Ritchie JM, Broghammer CL, et al. Preope-rative serum vascular endothelial growth factor levels: significance in ovarian cancer[J]. Clin Cancer Res, 2002, 8(10):3193-3197.
[12]申桂華, 張 毅.卵巢上皮性癌中p53和VEGF表達的相互關系及其臨床意義[J].中國腫瘤臨床與康復,2006, 13(3):209-211.
[13]Fallow S, Price J, Atkinson RJ, et al. p53 mutation does not affect prognosis in ovarian epithelial malignancies[J]. J Pathol, 2001, 194(1):68-75.
[14]陳 默, 殷嘯俊, 堯良清, 等. 缺氧誘導上皮卵巢癌細胞分化逆轉機制的實驗研究[J].中國病理生理雜志,2011, 27(5):848-852.
(責任編輯: 林白霜, 羅 森)
Expression of miRNA-22 in ovarian cancer and effect of miRNA-22 over-expression on SKOV-3 ovarian cancer cell proliferation, migration and invasion
LI Feng, YAO Li, ZHANG Xi-hong, XIA Yu-hong, CHENG Jie, LOU Xue-ling, JIANG Qiu-hui
(DepartmentofGynaecology,ZhengzhouPeople’sHospital,Zhengzhou450000,China.E-mail:lifeng198104@163.com)
AIM: To examine the expression of miRNA-22 in the ovarian tissues and the effect of miRNA-22 over-expression on the proliferation, migration and invasion in SKOV-3 cells. METHODS: The expression levels of miRNA-22 in different ovarian tissues and SKOV-3 cells were determined by qPCR. miRNA-22 was over-expressed by transfection of miRNA-22 mimic. The cell viability was examined by CCK-8 assay. The cell migration was measured by wound healing test. The cell invasion was analyzed by Transwell assay. The protein expression levels of VEGF and P53 were determined by Western blot. RESULTS: Compared with the normal ovarian tissue, the expression level of miRNA-22 was remarkably decreased in the ovarian tumor tissues. After transfection with miRNA-22 mimic, the expression level of miRNA-22 in the SKOV-3 cells was significantly increased, while the cell viability, migration and invasion were obviously decreased. Moreover, the protein expression of VEGF and P53 was dramatically inhibited after over-expression of miRNA-22. CONCLUSION: The decreased miRNA-22 expression may be correlated with the development of ovarian can-cer. Over-expression of miRNA-22 decreases the cell viability, migration and invasion by reducing the protein expression of VEGF and P53.
miRNA-22; Ovarian cancer; Cell proliferation; Cell migration; Cell invasion
1000- 4718(2016)12- 2251- 05
2016- 05- 23
2016- 09- 26
R730.23
A
10.3969/j.issn.1000- 4718.2016.12.021
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0371-67077037; E-mail: lifeng 198104@163.com

