阿米福汀對苯并[a]芘誘導腹主動脈瘤形成的作用*
陶潞淵, 吳少澤, 王嬌妮, 王國強, 薛楊靜, 徐志強, 汪 潔, 唐疾飛, 季亢挺
(溫州醫科大學附屬第二醫院心血管內科,浙江 溫州 325027)
阿米福汀對苯并[a]芘誘導腹主動脈瘤形成的作用*
陶潞淵, 吳少澤, 王嬌妮, 王國強, 薛楊靜, 徐志強, 汪 潔, 唐疾飛, 季亢挺△
(溫州醫科大學附屬第二醫院心血管內科,浙江 溫州 325027)
目的: 研究阿米福汀對苯并[a]芘(BaP)誘導C57BL/6J小鼠腹主動脈瘤(AAA)形成的作用,并探討相關機制。方法:體外培養RAW264.7單核巨噬細胞,分為正常對照組,溶劑對照組(即DMSO組),BaP組,低劑量(1 μmol/L)阿米福汀組,中劑量(5 μmol/L)阿米福汀組及高劑量(25 μmol/L)阿米福汀組,應用Western blot法檢測體外培養的RAW264.7單核巨噬細胞基質金屬蛋白酶(MMP)-9、MMP-12、TNF-α、NF-κB表達。48只C57BL/6J小鼠(8月齡,雄性)隨機分為對照組、模型組(AngⅡ+BaP組)、低劑量(50 mg/kg)阿米福汀組、高劑量(100 mg/kg)阿米福汀組。6周后取腹主動脈察看標本形態;行HE、 Masson染色觀察血管形態結構;測定腹主動脈的血管周長。Western blot、免疫組化法評價腹主動脈組織中的巨噬細胞浸潤情況及MMP-9、MMP-12、TNF-α、NF-κB的表達。結果:Western blot發現 BaP刺激使巨噬細胞MMP-9、MMP-12、TNF-α、NF-κB的表達升高,而阿米福汀對此有顯著抑制作用,且呈劑量依賴性(P<0.05)。動物實驗可見對照組成瘤率為0,高劑量阿米福汀組成瘤率為16.67%,與模型組(58.33%)和低劑量阿米福汀組(33.33%)相比顯著降低(P<0.05)。免疫組化結果顯示高劑量阿米福汀組腹主動脈壁的巨噬細胞浸潤程度及TNF-α、MMP-9、MMP-12、NF-κB的表達較模型組和低劑量阿米福汀組相比顯著下降(P<0.05)。Western blot實驗結果證實高劑量阿米福汀組腹主動脈壁TNF-α、MMP-9、MMP-12、NF-κB的表達較模型組和低劑量阿米福汀組相比顯著下降(P<0.05)。結論:阿米福汀可以抑制BaP誘導的巨噬細胞的活化,同時可以抑制BaP誘導的小鼠腹主動脈瘤發生、發展,其機制可能跟抑制NF-κB途徑、巨噬細胞浸潤及MMPs、TNF-α的表達有關。
阿米福汀; 腹主動脈瘤; 苯并[a]芘; 巨噬細胞; 基質金屬蛋白酶
腹主動脈瘤(abdominal aortic aneurysm,AAA)是各致病因素下,腹主動脈中層彈性纖維退化斷裂,血管壁變薄,在長期血壓壓力沖擊下局部向外擴張,形成的瘤體,其破裂后死亡率高達90%。目前針對AAA的治療主要為手術和介入治療,但費用高并發癥多,因此對腹主動脈的藥物治療需求日益迫切。
AAA的主要病理特征是腹主動脈壁炎癥反應、巨噬細胞浸潤、彈性纖維及膠原蛋白的降解和血管平滑肌細胞的凋亡[1]。目前的觀點認為是動脈壁上的炎癥反應啟動AAA的整個病理過程[2],而巨噬細胞在此過程中起關鍵作用[3],炎癥發生后,隨之而來的是彈性纖維和膠原蛋白的降解[4],主要原因是血管壁中基質金屬蛋白酶(matrix metalloproteinases,MMPs)活性增加。
吸煙是腹主動脈瘤的高危因素[5]。吸煙者患AAA的風險比不吸煙者高8倍,戒煙后患AAA的風險降低4倍[6]。苯并[a]芘(benzo[a]pyrene,BaP)是香煙煙霧的重要組成部分[7]。研究表明,BaP可使正常血管發生病理改變[8],使巨噬細胞浸潤增加、MMPs的表達升高、核因子-κB (nuclear factor-κB,NF-κB) 活化[9-10]。BaP誘導的病理學改變與AAA發展中的病理改變極其相似。我們的前期實驗發現[11],在BaP協同血管緊張素II(angiotensin II,Ang II)作用下,C57BL/6J小鼠AAA的發生率顯著高于單獨AngII處理的小鼠。
阿米福汀(amifostine)是一種放化療輔助用藥,能夠減輕放、化療對正常組織的損傷,在堿性磷酸酶作用下,阿米福汀轉化為WR-1065,能夠抑制過氧化從而使得細胞氧化損傷減輕。 Chok等[12]在腎臟的缺血再灌注模型中發現阿米福汀可以通過清除氧自由基、抗炎、減少細胞凋亡來減輕再灌注損傷。我們的前期實驗發現阿米福汀抑制BaP誘導的巨噬細胞的活化和炎癥因子的表達。故設計此實驗研究阿米福汀對腹主動脈瘤形成的作用及其相關機制,為腹主動脈瘤的藥物治療提供新的策略。
材 料 和 方 法
1 研究對象
1.1 實驗細胞 RAW264.7細胞為小鼠白血病單核細胞,購自上海中科院細胞庫。
1.2 實驗動物 無特定病原體(specific pathogen free, SPF)級C57BL/6J雄性小鼠(購自于北京維通利華實驗動物技術有限公司),8月齡,體重28~32 g。放置于溫州醫科大學附屬第二醫院科研中心SPF級動物房中飼料喂養。飲用無菌純凈水,無菌飼料喂養,自由飲食。晝夜變化規律,室內恒溫、恒濕。
2 主要材料、藥物和試劑
藥物微量滲透泵(0.15 μL/h)購自Alzet;阿米福汀注射液購自大連美羅大藥廠;DMEM培養液、胎牛血清(fetal bovine serum,FBS)、血管緊張素Ⅱ和苯并[a]芘均購自Sigma;中鏈甘油三酯購自GATTEFOSSE;抗MMP-12、MMP-9、CD68、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和NF-κB p65抗體購自Abcam;蘇木素伊紅染色(hematoxylin and eosin staining,HE staining)試劑盒和馬松染色(Masson staining)試劑盒購自北京索萊寶科技有限公司。
3 主要方法
3.1 細胞實驗 (1)細胞培養: RAW264.7細胞經復蘇后培養于10% DMEM培養液中并在倒置顯微鏡下觀察細胞生長情況。當細胞生長達培養瓶底面積的80%時,使用吸管吹下。待90%以上細胞脫落時,將細胞懸液轉移至15 mL離心管中,1 000 r/min離心5 min,棄去上清液。吸取9 mL 10% DMEM完全培養液至上述含有細胞沉淀的離心管中,吹打成細胞懸液。分別吸取3 mL細胞懸液至預先裝好1 mL 10% DMEM完全培養液的25 cm3的培養瓶中,輕輕搖晃混勻。將培養瓶重新置于飽和濕度培養箱中孵育。(2)實驗分組:正常對照(control)組不做任何處理;溶劑對照組(即DMSO組)的DMSO終濃度為0.01%;BaP組的BaP終濃度為20 μmol/L,BaP先溶于DMSO;低(1 μmol/L)、中(5 μmol/L)、高(25 μmol/L)劑量阿米福汀組:先分別將1 、5、25 μmol/L的阿米福汀作用細胞2 h后,再用20 μmol/L的BaP作用細胞24 h。(3)取材:將各組RAW264.7巨噬細胞培養24 h后提取總蛋白,各組實驗重復5次。
3.2 動物實驗分組和模型建立 C57BL/6J小鼠共分為對照(control)組、模型組(即Ang II+BaP組)、低劑量阿米福汀組、高劑量阿米福汀組,每組12只。對照組的動物接受腹腔注射中鏈甘油三酯5 mL/kg,每周1次,給藥6周。Ang II+BaP組:戊巴比妥鈉(2%,40 mg/kg)腹腔注射麻醉,在背部切一長約1 cm的切口,將灌注Ang II溶液的ALZET泵通過切口埋入皮下(Ang Ⅱ溶于生理鹽水,每只泵注入168 μL的Ang II溶液,微量緩釋泵持續釋放Ang II 0.9 mg·kg-1·d-1,釋放速度為0.15 μL/h,持續6周,植入前,先將藥物緩釋泵放置于37 ℃水浴箱中12 h,腹腔注射BaP(10 mg/kg),將BaP溶解于中鏈甘油三酯中,制成濃度為2 g/L的溶液,以5 mL/kg腹腔注射,每周1次,共給藥6周。低劑量阿米福汀組:植入Ang II微量滲透泵,腹腔注射阿米福汀注射液(50 mg/kg),30 min后腹腔注射BaP,每周1次。高劑量阿米福汀組:植入Ang II微量滲透泵,腹腔注射阿米福汀注射液(100 mg/kg),30 min后腹腔注射BaP,每周1次。
3.3 腹主動脈標本制備 各組小鼠處理6周后,用戊巴比妥鈉(80 mg/kg)腹腔注射麻醉致死,取腹主動脈,部分存于液氮中行Western blot檢測,部分存于4%多聚甲醛中行HE染色、Masson染色和免疫組化檢測。
3.4 組織包埋、切片 取小鼠腹主動脈標本,常規二甲苯透明、浸蠟、脫水、包埋,以4 μm為厚度切片。
3.5 HE染色 常規烤片、脫蠟。染色:蘇木素染色液滴于玻片組織上2 min,自來水沖洗,PBS溶液浸泡5 s返藍,清水沖洗,伊紅染色液滴于玻片組織上5 min,清水沖洗。再脫水、透明、封片、鏡下觀察。
3.6 Masson染色 常規烤片、脫蠟、染色(具體步驟按照試劑盒說明書進行);再脫水、透明、封片、鏡下觀察。
3.7 免疫組織化學染色 常規烤片、脫蠟、水合。用MMP-12、MMP-9、CD68、TNF-α和NF-κB p65各抗體行免疫組化染色,采用SP法,具體操作步驟按照試劑盒說明書進行。
3.8 Western blot測定目的蛋白 檢測各組TNF-α、NF-κB、MMP-9、MMP-12和GAPDH蛋白的表達情況。上樣總蛋白量為40 μg, 室溫下SDS-PAGE分離蛋白,濕轉法轉目的蛋白到PVDF膜上,常規洗膜封閉,分別孵育Ⅰ抗(TNF-α抗體1∶1 000稀釋,NF-κB抗體1∶1 000稀釋,MMP-9抗體1∶1 000稀釋,MMP-12抗體1∶1 000稀釋,GAPDH抗體1∶10 000稀釋)和Ⅱ抗(1∶10 000),然后化學發光,Bio-Rad凝膠成像儀曝光。圖像處理軟件 AlphaEaseFC對Western blot圖像進行分析。
3.9 動脈瘤形成的判定 首先肉眼判定瘤體形成情況,再取染色切片,在顯微鏡下,每張切片均以相同的設置拍照。觀察血管切片染色情況(細胞核呈藍色,細胞質呈粉紅色,彈力蛋白纖維呈亮粉紅色)。在每只小鼠腹主動脈取不同位置的12張切片,運用ImageJ圖像分析軟件檢測每張切片腹主動脈周長,繼而算出各組小鼠腹主動脈的平均周長;只要小鼠的腹主動脈的最大周長大于對照組小鼠平均周長的50%,就可以認為此只小鼠腹主動脈瘤形成。
4 統計學處理
所有統計資料采用SPSS 21.0軟件處理。經處理后得到實驗數據均以均數±標準差(mean±SD)描述。使用單因素方差分析、SNK-q法檢驗各組資料。實驗中成瘤率的比較采用卡方檢驗。以P<0.05為差異有統計學意義。
結 果
1 阿米福汀抑制BaP誘導的巨噬細胞TNF-α、MMP-9、MMP-12和NF-κB的表達
各實驗組單核巨噬細胞Western blot檢測結果顯示,BaP組TNF-α、MMP-9、MMP-12和NF-κB的表達較正常對照組顯著升高(P<0.05);阿米福汀組上述蛋白表達受到顯著抑制;高劑量阿米福汀組巨噬細胞TNF-α、MMP-9、MMP-12和NF-κB的表達較BaP組、低劑量阿米福汀組和中劑量阿米福汀組有顯著的下降(P<0.05),見圖1。
2 阿米福汀抑制BaP誘導的小鼠腹主動脈瘤形成
各組小鼠處理6周后解剖,分離腹主動脈觀察形態,見模型組腹主動脈局部有瘤樣突出,視為肉眼瘤體形成。行HE染色,運用ImageJ圖像分析軟件檢測各組小鼠的腹主動脈平均周長,腹主動脈瘤形成標準為血管最大周長大于對照組動脈平均周長的50%。對照組的腹主動脈平均周長為(954±103)μm,各實驗組小鼠腹主動脈的最大周長只要大于1 431 μm,即可視為動脈瘤的形成。結果顯示模型組的AAA形成率為58.33%,動脈平均血管周長為(1 401±230)μm;低劑量阿米福汀組的AAA形成率為33.33%,平均血管周長為(1 322±211)μm;高劑量阿米福汀組的AAA形成率為16.67%,腹主動脈平均血管周長為(1 023±102)μm。高劑量阿米福汀組的AAA形成率與模型組和低劑量阿米福汀組相比顯著降低(P<0.05),見圖2。
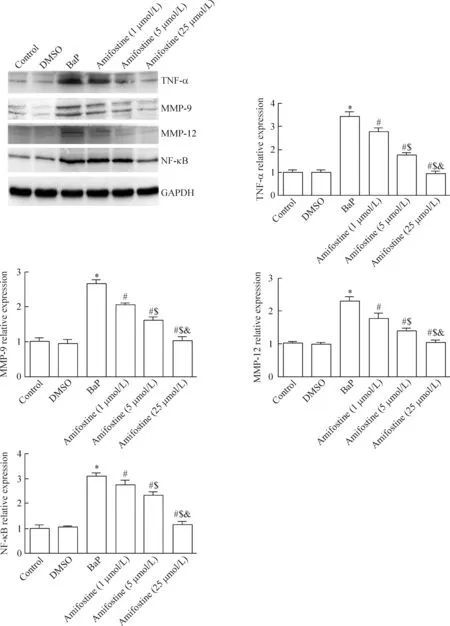
Figure 1.Amifostine attenuated BaP-induced expression of TNF-α, MMP-9, MMP-12 and NF-κB in the RAW246.7 macrophages. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsBaP group;$P<0.05vsamifostine (1 μmol/L) group;&P<0.05vsamifostine (5 μmol/L) group.
圖1 阿米福汀抑制BaP誘導的巨噬細胞TNF-α、MMP-9、MMP-12和NF-κB 表達
3 腹主動脈組織學的改變
HE染色和Masson染色切片可見模型組腹主動脈壁中膜彈力纖維有顯著降解、斷裂;膠原蛋白溶解、丟失,血管中膜彈力層斷裂,血管正常結構破壞,符合典型的動脈瘤組織病理學特征,高劑量阿米福汀組血管結構破壞程度較模型組、低劑量阿米福汀組有顯著改善,見圖3。
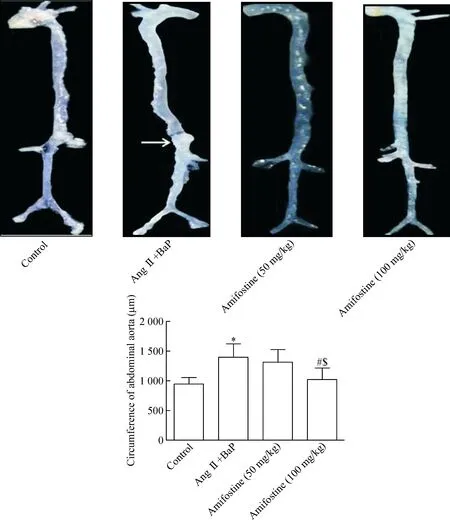
Figure 2.Amifostine reduced BaP-induced abdominal aortic circumference in mice. Mean±SD.n=12.*P<0.05vscontrol group;#P<0.05vsAng Ⅱ+BaP group;$P<0.05vsamifostine (50 mg/kg) group.
圖2 阿米福汀降低BaP刺激小鼠的腹主動脈周長
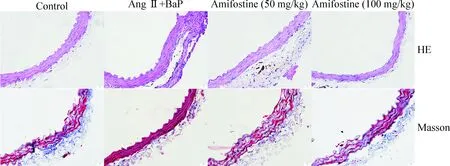
Figure 3.Amifostine inhibited BaP-induced abdominal aortic damage in mice (×400).
圖3 阿米福汀抑制BaP誘導的小鼠腹主動脈壁結構的破壞
4 阿米福汀減輕BaP誘導的腹主動脈血管壁巨噬細胞的浸潤
運用羊抗鼠CD68抗體對各組血管切片進行免疫組化染色,觀察血管壁巨噬細胞的浸潤情況(圖4)。與對照組相比,模型組腹主動脈血管壁巨噬細胞的浸潤顯著增加(P<0.05),阿米福汀呈劑量依賴性減輕BaP誘導的血管壁巨噬細胞的浸潤程度(P<0.05),見圖4、表1。

Figure 4.Amifostine inhibited BaP-induced abdominal aortic augment on CD68, TNF-α, MMP-9, MMP-12 and NF-κB expression in abdominal aorta wall of each group (×400).
圖4 阿米福汀抑制BaP誘導的小鼠腹主動脈壁CD68、TNF-α、MMP-9、MMP-12和NF-κB的表達
5 阿米福汀抑制BaP誘導的血管壁NF-κB、TNF-α、MMP-9和MMP-12的表達
我們對小鼠腹主動脈切片進行NF-κB、MMP-9、MMP-12和TNF-α免疫組化染色(圖4),同時對各組腹主動脈組織行Western blot檢測。免疫組化染色可見,與對照組相比,模型組腹主動脈壁NF-κB、TNF-α、MMP-9和MMP-12的表達顯著增加(P<0.05),而阿米福汀對腹主動脈壁NF-κB、TNF-α、MMP-9和MMP-12的表達有顯著抑制作用,并呈劑量依賴性(P<0.05),見表1。Western blot檢測結果與免疫組化結果一致,高劑量阿米福汀組腹主動脈壁NF-κB、TNF-α、MMP-9和MMP-12的表達較低劑量阿米福汀組和模型組均顯著減少(P<0.05),見圖5。
表1 各組小鼠腹主動脈壁MMPs、TNF-α和NF-κB表達的免疫組化結果
Table 1.The expression of MMPs, TNF-α and NF-κB in abdominal aorta of each group detected by immunohistochemisty (Mean±SD.n=12)

GroupCD68TNF-αMMP-9MMP-12NF-κBControl0.14±0.050.12±0.030.13±0.040.12±0.040.11±0.05AngⅡ+BaP0.61±0.11*0.45±0.12*0.51±0.12*0.48±0.13*0.45±0.13*Amifostine(50mg)0.48±0.09#0.29±0.06#0.35±0.09#0.35±0.06#0.38±0.09#Amifostine(100mg)0.31±0.07#$0.19±0.04#$0.23±0.06#$0.21±0.05#$0.25±0.07#$
*P<0.05vscontrol group;#P<0.05vsAng Ⅱ+BaP group;$P<0.05vsamifostine (50 mg/kg) group.
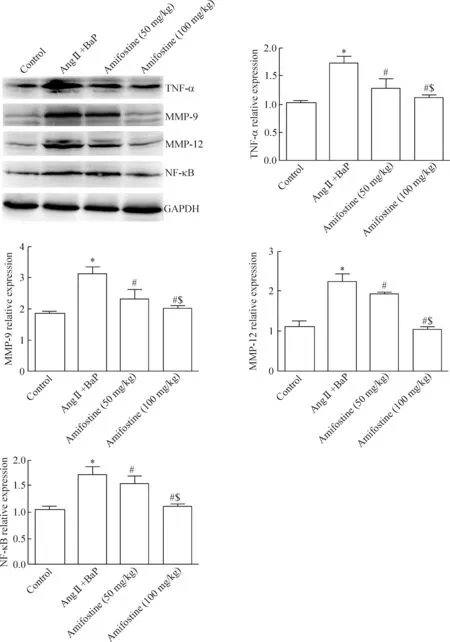
Figure 5.The results of Western blot showed that amifostine attenuated BaP-induced TNF-α, MMP-9, MMP-12 and NF-κB expression of mice abdominal aorta. Mean±SD.n=12.*P<0.05vscontrol group;#P<0.05vsAng Ⅱ+BaP group;$P<0.05vsamifostine (50 mg/kg) group.
圖5 阿米福汀抑制BaP誘導的小鼠腹主動脈壁TNF-α、MMP-9、MMP-12和NF-κB 表達
討 論
腹主動脈瘤目前有效的主流治療方法包括外科手術治療和血管介入治療,兩者的圍術期并發癥和手術死亡率均較高。在腹主動脈瘤瘤體較小的時候,早期應用藥物抑制腹主動脈瘤體的增大可以避免手術和介入治療,對于腹主動脈瘤患者有重要的臨床意義。
腹主動脈瘤的早期病理特征為炎癥反應[13-15],局部巨噬細胞浸潤增加,彈性纖維降解斷裂,彈力蛋白和膠原退變[16-19]等。主動脈壁上血管平滑肌細胞減少,腹主動脈壁炎癥反應是腹主動脈瘤病理過程關鍵因素。大量的流行病學調查顯示吸煙是腹主動脈瘤的高危因素,而BaP是吸煙煙霧中重要成分,炎癥細胞尤其是巨噬細胞的活化在吸煙誘發AAA中起重要作用,我們前期實驗[11]也發現BaP促進Ang Ⅱ誘導的AAA發展 。抑制炎癥反應可顯著抑制瘤體的生長速度,Lawrenece等[20]報道雷帕霉素可顯著降低瘤體的直徑。阿米福汀是一種細胞保護劑,廣泛用于放化療的輔助治療,減輕正常組織細胞的損傷,相關研究[12]表明阿米福汀能夠抑制炎癥反應、清除氧自由基。在本次實驗研究阿米福汀對BaP誘導的腹主動脈瘤的作用中顯示:低劑量、高劑量阿米福汀組AAA的形成分別為33.33%、16.67%,都小于模型組AAA的形成率(58.33%),高劑量阿米福汀組AAA的形成率更低。各組小鼠HE、Masson染色示:高劑量阿米福汀組小鼠腹主動脈壁彈性纖維斷裂,膠原蛋白的缺失情況較模型組和低劑量阿米福汀組顯著改善。
本實驗證實阿米福汀顯著抑制BaP誘導巨噬細胞NF-κB和TNF-α細胞因子的表達。NF-κB和TNF-α細胞因子在AAA的血管壁的炎癥反應中起重要作用,Ren等[21]在穿心蓮內酯抑制AAA作用的實驗中,發現穿心蓮內酯能夠抑制AAA的發生、發展,且伴隨著TNF-α表達下調和NF-κB活化的抑制。核轉錄因子NF-κB與免疫應答,炎癥反應,細胞增生、凋亡等多種病理生理過程密切相關,在許多疾病中發揮著著重要作用。血管壁細胞外基質彈性纖維和膠原蛋白退化降解的過程中,MMPs的激活和表達增加被認為是主要因素。在人類腹主動脈瘤標本中檢測到MMP-1、MMP-2、MMP-9、MMP-12和 MMP-13的表達均增加[16-19]。有研究顯示在AAA的病理過程中,NF-κB是巨噬細胞遷移和MMPs表達重要的調節介質。吡咯烷二巰基氨甲酸具有抑制NF-κB活力的作用,在其作用下,AAA發生率降低,表明NF-κB途徑與AAA顯著相關[13]。有研究設計用嵌合體誘導寡核苷酸來阻止NF-κB發揮作用,腹主動脈瘤的發展受到抑制,同時觀察到巨噬細胞浸潤減少和MMPs表達下降[22]。Chase等[23]通過體外培養人單核細胞源性巨噬細胞,以重組腺病毒介導相關基因表達,抑制NF-κB活性能使MMP-9及MMP-1的表達下降,這進一步說明NF-κB對巨噬細胞及MMPs的表達起著調控作用。在我們前期實驗中[11],我們也觀測到在腹主動脈瘤發生、發展的過程中,NF-κB活化的同時,巨噬細胞浸潤及MMP表達均增加。相關研究表明對血管壁炎癥反應的控制可減少MMP-2、MMP-9、MMP-12的表達并抑制AAA的發生、發展[24]。巨噬細胞可以分泌NF-κB、TNF-α,作為炎癥反應的關鍵因子,兩者可以相互作用,增加血管壁巨噬細胞浸潤及血管壁MMP-9、MMP-12的表達,加強炎癥反應,促進細胞外基質的退化降解,促進腹主動脈的形成。
在細胞實驗中我們發現:應用阿米福汀預保護后可以顯著減輕BaP刺激引起的巨噬細胞NF-κB、TNF-α、MMP-9、MMP-12的表達。同時在動物實驗中我們發現相比于對照組,NF-κB的表達在模型組顯著增加,同時伴隨巨噬細胞浸潤、MMP-9/-12及TNF-α表達增加,高劑量阿米福汀可顯著逆轉上述作用。由此,我們推測阿米福汀可能通過抑制NF-κB途徑,從而抑制巨噬細胞浸潤、MMP、TNF-α的表達,最終抑制腹主動脈瘤的發生。
本次實驗中,我們證實阿米福汀可以抑制BaP誘導的巨噬細胞的活化,并且可以抑制BaP誘導的小鼠腹主動脈瘤發生發展,其機制可能跟抑制NF-κB途徑、巨噬細胞浸潤、MMPs及TNF-α的表達有關。
[1] Crawford CM, Hurtgen-Grace K, Talarico E, et al. Abdominal aortic aneurysm: an illustrated narrative review[J]. J Manipulative Physiol Ther, 2003, 26(3): 184-195.
[2] Paravastu SC, Murray D, Ghosh J, et al. Inflammatory abdominal aortic aneurysms (IAAA): past and present[J]. Vasc Endovasc Surg, 2009, 43(4): 360-363.
[3] Turner GH, Olzinski AR, Bernard RE, et al. Assessment of macrophage infiltration in a murine model of abdominal aortic aneurysm[J]. J Magn Reson Imaging, 2009, 30(2):455-460.
[4] Tsuruda T, Kato J, Hatakeyama K, et al. Adventitial mast cells contribute to pathogenesis in the progression of abdominal aortic aneurysm[J]. Circ Res, 2008, 102(11):1368-1377.
[5] Forsdahl SH, Singh K, Solberg S, et al. Risk factors for abdominal aortic aneurysms: a 7-year prospective study: the Tromso Study, 1994-2001[J]. Circulation, 2009, 119(16): 2202-2208.
[6] Sauerbeck LR, Hornung R, Moomaw CJ, et al. The effects of study participation in the Familial Intracranial Aneurysm Study on cigarette smoking[J]. J Stroke Cerebrovasc Dis, 2008, 17(6):370-372.
[7] Guo X, Luo L, Ma Y, et al. Sorption of polycyclic aromatic hydrocarbons on particulate organic matters[J]. J Hazardous Materials, 2010, 173(1-3):130-136.
[8] Curfs DM, Lutgens E, Gijbels MJ, et al. Chronic exposure to the carcinogenic compound benzo[a]pyrene induces larger and phenotypically different atherosclerotic plaques in ApoE-knockout mice[J]. Am J Pathol, 2004, 164(1): 101-108.
[9] Sharma A, Neekhra A, Gramajo AL, et al. Effects of Benzo(e)Pyrene, a toxic component of cigarette smoke, on human retinal pigment epithelial cellsinvitro[J]. Invest Ophthalmol Visual Sci, 2008, 49(11):5111-5117.
[10]Weng MW, Hsiao YM, Chen CJ, et al. Benzo[a]pyrene diol epoxide up-regulates COX-2 expression through NF-kappa B in rat astrocytes[J]. Toxicol Lett, 2004, 151(2):345-355.
[11]Ji K, Zhang Y, Jiang F, et al. Exploration of the mechanisms by which 3,4-benzopyrene promotes angiotensin II-induced abdominal aortic aneurysm formation in mice[J]. J Vasc Surg, 2014, 59(2):492-499.
[12]Chok MK, Conti M, Almolki A, et al. Renoprotective potency of amifostine in rat renal ischaemia-reperfusion[J]. Nephrol Dialysis Transplantation, 2010, 25(12): 3845-3851.
[13]Dalainas I, Nano G, Ranucci M, et al. Inflammatory abdominal aortic aneurysms. A 20-year experience[J]. J Cardiovasc Surg, 2007, 48(3):305-308.
[14]Forester ND, Cruickshank SM, Scott DJ, et al. Functional characterization of T cells in abdominal aortic aneurysms[J]. Immunol, 2005, 115(2):262-270.
[15]Lawrence DM, Singh RS, Franklin DP, et al. Rapamycin suppresses experimental aortic aneurysm growth[J]. J Vasc Surg, 2004, 40(2):334-338.
[16]Nishimura K, Ikebuchi M, Kanaoka Y, et al. Relationships between matrix metalloproteinases and tissue inhibitor of metalloproteinases in the wall of abdominal aortic aneurysms[J]. Int Angiol, 2003, 22(3):229-238.
[17]Daugherty A, Cassis LA. Mechanisms of abdominal aortic aneurysm formation[J]. Current atherosclerosis reports, 2002, 4(3): 222-227.
[18]Halloran BG, Baxter BT. Pathogenesis of aneurysms[J]. Semin Vasc Surg, 1995, 8(2):85-92.
[19]吳建秋, 景在平.基質金屬蛋白酶及其抑制劑在腹主動脈瘤發病中的作用[J].中國病理生理雜志,2001, 17(6):580-583
[20]Lawrenece DM , Singh RS, Franklin DP, et al. Rapamycin suppresses experimental aortic aneurysm growth[J]. J Cardiovasc Surg, 2004, 40(2): 334-338.
[21]Ren J, Liu Z, Wang Q, et al. Andrographolide ameliorates abdominal aortic aneurysm progression by inhibiting inflammatory cell infiltration through downregulation of cytokine and integrin expression[J]. J Pharmacol Exp Ther, 2016, 356(1):137-147.
[22]Nakashima H, Aoki M, Miyake T, et al. Inhibition of experimental abdominal aortic aneurysm in the rat by use of decoy oligodeoxynucleotides suppressing activity of nuclear factor kappa B and ets transcription factors[J] .Circulation, 2004, 109(1): 132-138.
[23]Chase AJ, Bond M, Crook MF, et al. Role of nuclear factor-kappa B activation in metalloproteinase-1, -3, and -9 secretion by human macrophagesinvitroand rabbit foam cells producedinvivo[J]. Arteriosclerosis Thrombosis Vasc Biol, 2002, 22(5):765-771.
[24]Holmes DR, Petrinec D, Wester W, et al. Indomethacin prevents elastase-induced abdominal aortic aneurysms in the rat[J]. J Surg Res, 1996, 63(1):305-309.
(責任編輯: 陳妙玲, 余小慧)
Effects of amifostine on formation of abdominal aortic aneurysm in mice induced by benzo[a]pyrene
TAO Lu-yuan, WU Shao-ze, WANG Jiao-ni, WANG Guo-qiang, XUE Yang-jing, XU Zhi-qiang, WANG Jie, TANG Ji-fei, JI Kang-ting
(DepartmentofGardiology,TheSecondHospitalAffiliatedtoWenzhouMedicalUniversity,Wenzhou325027,China.E-mail:jikt@wzmc.edu.cn)
AIM: To study the role of amifostine on the formation of benzo[a]pyrene (BaP)-induced abdominal aortic aneurysm (AAA) in C57BL/6J mice and the underlying mechanism. METHODS: RAW246.7 mononuclear macrophageinvitrowere divided into control group, DMSO group, BaP group, low dose (1 μmol/L) amfostine treated group, middle dose (5 μmol/L) amfostine treated group and high dose (25μmol/L) amfostine treated group. The influence of BaP on the expression of matrix metalloproteinase (MMP)-9, MMP-12, TNF-α, NF-κB in the RAW246.7 mononuclear macrophagesinvitrowas determined by Western blot. Male C57BL/6J mice (8 months old) were divided into control group, model group (AngII+BaP group), low dose (50 mg/kg) amfostine treated group and high dose (100 mg/kg) amfostine treated group. After 6 weeks, the abdominal aorta were isolated. The aortic tissues were subjected to HE and Masson staining. The vascular wall structure, infiltration of macrophage, the expression of MMP-9, MMP-12, TNF-α, NF-κB were evaluated by Western blot and immunochemistry staining. RESULTS: Amifostine attenuated BaP-induced expression of TNF-α, MMP-9, MMP-12, NF-κB in the RAW246.7 mononuclear macrophages (P<0.05). The results of animal experiments showed that the incidence of AAA in high dose amifostine treated group were significantly lower than that in low dose amifostine treated group and model group (P<0.05). Immunohistochemistry staining observation showed that amifostine inhibited the aortic macrophage infiltration more obviously in high amifostine treated group compared with model group and low dose amifostine treated group (P<0.05). Compared with model group and low dose amifostine treated group, the MMP-9, MMP-12, TNF-α and NF-κB expression of abdominal aorta in high amifostine treated group was reduced significantly (P<0.05).CONCLUSION: Amifostine inhibits BaP-induced activation of macrophages, and also prevents the formation of abdominal aortic aneurysm in C57BL/6J mice induced by BaP by inhibition of the NF-κB pathway, macrophage infiltration and the expression of TNF-α and MMPs.
Amifostine; Abdominal aortic aneurysm; Benzo[a]pyrene; Macrophage; Matrix metalloproteinases
1000- 4718(2016)12- 2168- 09
2016- 06- 20
2016- 10- 21
國家自然科學基金資助項目(No. 81573185);浙江省科技廳項目(No. 2014C33163);溫州科技局項目(No. Y20140678)
R363; R543.1+6
A
10.3969/j.issn.1000- 4718.2016.12.008
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0577-88002214; E-mail: jikt@wzmc.edu.cn

