活性氧簇介導血管緊張素 II對延髓神經元胞內游離Ca2+水平的調節作用*
劉小妮, 曹冬青, 張娜娜, 陶 然, 丁瀅泂, 金惠銘, 盧 寧△
(1復旦大學基礎醫學院生理與病理生理系,上海 200032; 2復旦大學附屬華山醫院神經外科,上海 200040)
活性氧簇介導血管緊張素 II對延髓神經元胞內游離Ca2+水平的調節作用*
劉小妮1, 曹冬青2, 張娜娜1, 陶 然1, 丁瀅泂1, 金惠銘1, 盧 寧1△
(1復旦大學基礎醫學院生理與病理生理系,上海 200032;2復旦大學附屬華山醫院神經外科,上海 200040)
目的: 探討活性氧簇(reactive oxygen species, ROS)介導血管緊張素II(angiotensin II, Ang II)對延髓神經元胞內游離Ca2+的調節作用及其機制。方法:原代培養延髓神經元;免疫熒光雙標法鑒定培養神經元的特征;給予Ang II處理后,用二氫乙啶熒光探針法測定神經元ROS水平;同時或單獨給予Ang II和NADPH氧化酶抑制劑apocynin或自由基清除劑TEMPOL后,Fura-2/AM鈣瞬變法記錄神經元胞內游離Ca2+的水平;CCK-8法檢測神經元活性。結果:原代培養的延髓神經元多數為谷氨酸陽性的神經元;Ang II(5 μmol/L)可在10 min內顯著升高神經元ROS水平(P<0.01);給予Ang II處理后延髓神經元胞內Ca2+水平顯著升高(P<0.01);給予apocynin/TEMPOL預處理后,Ang II引起的延髓神經元胞內Ca2+的升高則被抑制(P<0.05)。實驗濃度的Ang II對神經元無毒性作用。結論:ROS介導Ang II誘導的延髓神經元胞內Ca2+的升高作用,可能是Ang II在中樞誘導氧化應激作用的潛在細胞內信號機制。
延髓神經元; 活性氧簇; 細胞內Ca2+; 血管緊張素II
已知血管緊張素II(angiotensin II, Ang II)可通過中樞調控對體液及心血管調節發揮重要調節作用。Ang II 可通過作用于心血管中樞所在部位的AT1受體,而產生升高血壓、促進飲水、促進抗利尿激素的釋放和引起交感神經興奮等[1-2]。中樞Ang II信號機制的紊亂與高血壓、心力衰竭等多種心血管疾病的病理過程相關[3]。但Ang II在心血管調控中樞介導的細胞內信號機制仍不明確。

細胞內鈣離子濃度(intracellular Ca2+concentration, [Ca2+]i)在神經細胞內和神經細胞之間的生理與病理過程中都起著非常關鍵的作用,神經元胞內[Ca2+]i的增加可產生促進神經遞質的釋放、加強神經元之間的聯系和調節突觸的可塑性、促進基因轉錄等效應[9-10]。神經元胞內Ca2+水平的變化可直接影響神經元的興奮性[11]。由Ang II介導產生ROS的潛在信號機制是Ca2+的相關機制[12-13]。研究表明,Ang II可引起Ca2+電流的增加和K+電流的降低,從而通過調節動作電位的產生而增強神經元放電頻率[14]。ROS介導的神經元胞內[Ca2+]i的增加可能與細胞毒性及神經系統退行性疾病相關。但是,由Ang II介導的ROS及Ca2+的相關信號機制在心血管的中樞調控過程中仍有待進一步闡明。
因此,本研究主要通過給予Ang II觀察其對延髓神經元的ROS及[Ca2+]i的調節,并進一步對可能的作用機制進行探討,為闡明Ang II介導的ROS在心血管的中樞調控過程中發揮作用的細胞內信號機制提供實驗依據。
材 料 和 方 法
1 主要試劑與儀器
Ang II、apocynin、TEMPOL和二氫乙啶(dihydroethidium, DHE)購自Sigma;Fura-2/AM和 CCK-8試劑盒購自Dojindo;小鼠來源MAP-2抗體購自Abcam;兔來源谷氨酸抗體購自Sigma-Aldrich;神經元培養液、B27、胎牛血清(fetal bovine serum, FBS)和2.5%胰酶購自Gibco;DAPI、FITC標記山羊抗兔IgG (H+L)和Cy3標記山羊抗小鼠IgG (H+L)購自碧云天。CO2恒溫細胞培養箱(上海力申科學儀器有限公司);無菌超凈臺(上海博迅實業有限公司醫療設備廠);激光共聚焦系統(ZEISS);酶標儀(TECAN);鈣瞬變系統(PTI)。
2 方法
2.1 原代延髓神經元培養[5]取孕14~17 d的SD大鼠(購自上海斯萊克實驗動物中心),取胎鼠斷頭;在解剖顯微鏡下分離延髓,剪碎(約1 mm3);0.125%胰蛋白酶溶液于37 ℃細胞培養箱中消化10 min左右;10% 的FBS終止消化;取上清至新的離心管;1 000 r/min離心8 min;棄上清,加入Neurobasal medium 與B27的混合培養基(比例為49∶1),重懸細胞。將細胞接種到35 mm的培養皿或96孔板(前1 d用多聚賴氨酸處理)中,使細胞在37 ℃、 5% CO2條件下貼壁生長;每2 d半量換液1次,培養7 d左右,待神經元發育成熟,進行實驗。
2.2 神經元的鑒定[5]細胞經培養7 d左右,用0.01 mol/L PBS洗3次,4%多聚甲醛室溫固定細胞20 min;棄固定液,0.01 mol/L PBS洗3次;5%~7%胎牛血清封閉30 min;棄封閉液,加入Ⅰ抗:小鼠抗MAP-2抗體(1∶200,1%FBS配制),37℃孵育1 h后轉入4 ℃過夜;棄Ⅰ抗,0.01 mol/L PBS洗3次;加入Ⅱ抗:Cy3結合的山羊抗小鼠IgG (H+L)(1∶100,Ⅱ抗稀釋液配制),避光,37 ℃孵育1 h; 0.01 mol/L PBS洗3次;加入DAPI染核5 min; 0.01 mol/L PBS洗3次;采用激光共聚焦系統拍照鑒定。
2.3 延髓谷氨酸陽性神經元的鑒定 方法同2.2。第一Ⅰ抗為小鼠抗MAP-2抗體(1∶200)和第二Ⅰ抗為兔抗谷氨酸抗體(1∶100)。Ⅱ抗為FITC標記山羊抗兔IgG (H+L); Cy3標記山羊抗小鼠IgG (H+L)。

2.5 神經元胞內游離Ca2+的測定 以鈣離子敏感的熒光探針Fura-2/AM來檢測細胞內[Ca2+]i。Fura-2能以1∶1的比例特異性地與Ca2+結合,并且結合Ca2+后,其最大激發波長由原來Fura-2的380 nm變為其與Ca2+結合后的復合物的340 nm,通過鈣瞬變系統檢測延髓神經元F340/380的比值(R),采用R/R0來評估給藥前后細胞內Ca2+的變化,其中R0代表藥物處理前的熒光信號,R代表藥物處理后的熒光信號。實驗時,將已孵育好Fura-2/AM的神經元培養皿固定在載物臺上,用HBSS溶液灌流細胞,待鈣瞬變系統基線穩定后,用不同藥物灌流細胞。以上操作由FelixGX-4.2.2軟件執行。
2.6 CCK-8實驗檢測神經元的活性 神經元種于96孔板;培養的延髓神經元給予不同藥物處理后,棄含藥物的培養基,D-Hank’s溶液洗3遍;每孔加入110 μL CCK-8與培養基的混合液(二者體積比為1∶10),置于37 ℃細胞培養箱中孵育2 h;用酶標儀測定450 nm處的吸光度。
3 統計學處理
采用SPSS 19.0統計軟件進行分析。實驗結果用均數±標準誤(mean±SEM)表示。兩組實驗數據采用獨立樣本t檢驗,多組數據采用單因素方差分析(one-way ANOVA)。以P<0.05為差異有統計學意義。
結 果
1 原代延髓神經元的培養及鑒定
采用激光共聚焦結合顯微鏡觀察的方法對培養的細胞進行鑒定,圖1為培養5~7 d的延髓細胞,免疫熒光染色可見紅色的特異性MAP-2標記細胞,且可見原代培養的延髓細胞90%以上為神經元。
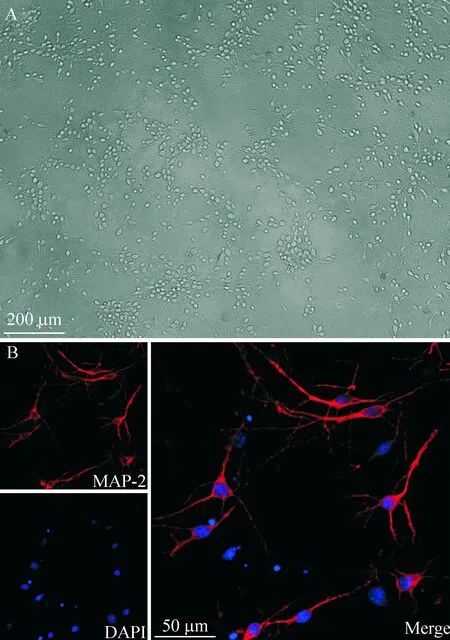
Figure 1.Identification of the primarily cultured medullary neurons. A: the white-light graph of the primarily cultured medullary neurons; B: fluorescence micrograph of the neurons stained with anti-MAP-2 antibody, fluorescence micrograph of neurons stained with DAPI, and merged graph of the former 2 photos.
圖1 原代延髓神經元的培養及鑒定
2 延髓谷氨酸陽性神經元的鑒定
由于中樞調節心血管活動的神經元大多為谷氨酸陽性的神經元,因此我們用谷氨酸去標記培養的延髓神經元。圖2可見紅色為MAP-2標記的神經元,綠色為谷氨酸陽性的細胞,藍色為DAPI標記的細胞核。結果顯示原代培養的延髓神經元80%以上為谷氨酸陽性的神經元。

Figure 2.Identification of glutamatergic neurons. The confocal images were the fluorescence micrographs of the neurons stained with anti-MAP-2 antibody (a neuronal maker), anti-glutamate (Glu) antibody and DAPI, and the merged graph of the former 3 photos.
圖2 延髓谷氨酸陽性神經元的鑒定
3 Ang II升高延髓神經元ROS的水平
前期研究顯示,Ang II(5 μmol/L)可顯著升高小鼠神經母細胞瘤細胞ROS水平[12]。在本研究中,給予Ang II(5 μmol/L),37 ℃分別孵育5、10 和30 min后,采用DHE熒光探針法檢測延髓神經元ROS水平。結果顯示Ang II可在10 min內顯著升高神經元的ROS水平,見圖3。
4 Ang II 引起神經元胞內游離Ca2+水平的升高
為研究Ang II對延髓神經元胞內[Ca2+]i的影響,我們首先研究單獨給予Ang II對神經元包內游離Ca2+水平的影響。結果顯示:Ang II可在10 min左右顯著升高神經元胞內[Ca2+]i,并在其升高達到穩定并持續約2 min后,再給予HBSS沖洗后,神經元胞內[Ca2+]i開始下降,見圖4。

Figure 3.The effects of Ang II on the ROS levels in the primarily cultured medullary neurons treated with or without Ang II (5 μmol/L) for 5, 10 and 30 min. ROS level was determined using the oxidant-sensitive fluorogenic probe dihydroethidium (DHE). Mean±SEM.n=12.*P<0.05,**P<0.01vs0 min group.
圖3 Ang II升高延髓神經元ROS水平
5 ROS 介導Ang II對延髓神經元[Ca2+]i的升高作用
延髓神經元給予NADPH氧化酶抑制劑apocynin或自由基清除劑TEMPOL預處理后,觀察Ang II 對神經元[Ca2+]i的效應,結果顯示apocynin和TEMPOL均可抑制Ang II對延髓神經元[Ca2+]i的升高作用,見圖5。
6 Ang II對延髓神經元無毒性作用
考慮到Ang II可能對神經元產生毒性作用,我們用CCK-8法檢測了實驗濃度的Ang II孵育神經元30 min后的細胞活力,結果顯示實驗中所用濃度的Ang II (5 μmol/L)不影響神經元的細胞活力,見圖6。
討 論
研究表明,NADPH氧化酶來源的ROS在Ang II依賴的心血管疾病的中樞調控過程中起著非常重要的調節作用[8, 15]。在高血壓的發病過程中,中樞及外周Ang II 可通過穹窿下區(suofornial organ,SFO)-室旁核(paraventricularis nucleus,PVN)-延髓頭端腹外側(the rostral ventrolateral medulla, RVLM)的通路,最后通過脊髓中間外側柱(intermediolateral column of spinal cord)的傳出將興奮傳遞至外周,引起交感神經興奮,而導致高血壓的發生[16]。在此過程中,RVLM區作為心血管交感活動的基本中樞,接受中樞心血管效應相關核團SFO、PVN等的纖維投射,在維持心血管中樞緊張性活動中起關鍵作用[16]。本課題組前期研究表明Ang II 可顯著升高延髓神經元的ROS水平,且主要是通過激活NADPH氧化酶產生[5-6];RVLM區微量注射NaHS可顯著降低SHR大鼠的血壓的心率,其機制可能是通過抑制NADPH氧化酶p47phox亞單位的磷酸化從而降低酶的活性,使ROS生成減少而所致[17]。因此研究中樞ROS的細胞內信號機制對闡明Ang II誘導的心血管疾病中樞調控機制具有重要的應用價值。

Figure 4.The effect of Ang II on [Ca2+]iin the primarily cultured medullary neurons. A: typical elevation of [Ca2+]iinduced by Ang II at 5 μmol/L; B: typical elevation of [Ca2+]iinduced by Ang II at 5 μmol/L and washout of Ang II led [Ca2+]ito decline; C: the quantitative analysis of the peak increase in [Ca2+]iin the neurons stimulated with Ang II (5 μmol/L). Mean±SEM.n=8.**P<0.01vscontrol.
圖4 Ang II引起延髓神經元胞內游離Ca2+水平的升高
在前期研究的基礎上,本工作主要采用離體實驗在細胞水平觀察ROS是否介導Ang II對細胞內行了鑒定,結果顯示培養的細胞中90%以上為神經元。由于中樞調節心血管活動的神經元大多為谷氨酸陽性的神經元,本研究重點觀察了培養的延髓神經元中谷氨酸的表達變化。結果顯示原代培養的延髓神經元80%以上為谷氨酸陽性神經元,為進一步研究奠定了細胞學基礎。

Figure 5.The effect of Ang II on [Ca2+]iin the primarily cultured medullary neurons pretreated with apocynin (an inhibitor of NADPH oxidase) or TEMPOL (a cell membrane-permeable superoxide dismutase mimetic). A, B: typical suppression of [Ca2+]ilevel induced by Ang II (5 μmol/L) with or without apocynin (100 μmol/L) or TEMPOL (100 μmol/L); C: the quantitative analysis showed the effects of Ang II were atte-nuated by apocynin or tempol. Mean±SEM.n=6.**P<0.01vscontrol group;#P<0.05vsAng II group.
圖5 ROS 介導Ang II對延髓神經元[Ca2+]i的升高作用
Ca2+水平的調節作用。并采用免疫熒光雙標結合激光共聚焦顯微鏡的方法對原代培養的延髓神經元進已證明,Ca2+作為重要的第二信使,參與神經遞質的釋放、突觸可塑性的調節、神經元的興奮性及基因轉錄的調節[9-10];神經元[Ca2+]i的變化可直接影響神經的興奮性[11];而[Ca2+]i在神經元之間的信號傳遞中起著非常重要的作用,并受細胞膜上的Ca2+通道和細胞內鈣庫的調控[18],提示研究神經元Ca2+的相關機制對其功能具有重要意義。為明確Ang II對延髓神經元[Ca2+]i的影響,我們采用Fura-2/AM法記錄神經元胞內[Ca2+]i的變化。結果顯示Ang II可在10 min左右顯著升高神經元[Ca2+]i,并在其升高達到穩定后,再給予HBSS沖洗后,神經元[Ca2+]i開始下降,提示Ang II可顯著升高延髓神經元[Ca2+]i。由于ROS參與了中樞Ang II所致的交感興奮與心血管效應,且主要與NADPH氧化酶途徑的激活有關[3-4, 7-8]。因此,為明確Ang II對神經元ROS的影響,我們首先給予Ang II處理后檢測延髓神經元ROS水平。結果顯示Ang II可在10 min內顯著升高神經元ROS水平,提示Ang II可顯著升高延髓神經元ROS水平。研究表明,apocynin可通過特異性地抑制NADPH氧化酶(ROS生成的關鍵酶)亞單位gp91ds-tat而選擇性地抑制NADPH氧化酶活性,從而使ROS生成減少[8];而TEMPOL則作為一種自由基清除劑可降低細胞ROS水平[19]。在本研究中,我們給予apocynin (NADPH氧化酶抑制劑)或TEMPOL(自由基清除劑)預處理后,再觀察Ang II 對神經元[Ca2+]i的效應,結果顯示apocynin和TEMPOL均可抑制Ang II對延髓神經元[Ca2+]i的升高作用,提示ROS 介導Ang II對延髓神經元[Ca2+]i的升高作用。此外,考慮到Ang II可能對神經元產生毒性作用,本工作采用CCK-8法檢測了實驗濃度的Ang II孵育神經元30 min后的細胞活力,結果顯示實驗中所用濃度的Ang II不影響神經元的細胞活力,提示實驗中所用濃度的Ang II對神經元無毒性作用。
本工作的實驗結果提示ROS介導Ang II誘導的延髓神經元胞內Ca2+的升高作用,可能是Ang II在中樞誘導氧化應激作用的潛在細胞內信號機制。

Figure 6.The cell viability analyzed by CCK-8 assay showed no significant difference of the cell activity between Ang II group and control group. Mean±SEM.n=6.
圖6 Ang II對神經元無毒性作用
[1] Giam B, Kaye DM, Rajapakse NW. Role of renal oxidative stress in the pathogenesis of the cardiorenal syndrome[J]. Heart Lung Circ, 2016, 25(8):874-880.
[2] Tamura K, Wakui H, Azushima K, et al. Angiotensin II type 1 receptor binding molecule ATRAP as a possible modulator of renal sodium handling and blood pressure in pathophysiology[J]. Curr Med Chem,2015,22(28):3210-3216.
[3] de Kloet AD, Liu M, Rodriguez V, et al. Role of neurons and glia in the CNS actions of the renin-angiotensin system in cardiovascular control[J]. Am J Physiol Regul Integr Comp Physiol, 2015, 309(5):R444-R458.
[4] Lu N, Helwig BG, Fels RJ, et al. Central Tempol alters basal sympathetic nerve discharge and attenuates sympathetic excitation to central ANG II[J]. Am J Physiol Heart Circ Physiol, 2004, 287(6):H2626-H2633.
[5] 曹冬青, 劉小妮, 徐海艷, 等. 內源性H2S抑制angiotensin Ⅱ引起的神經元活性氧水平的升高[J]. 中國病理生理雜志, 2014, 30(5):837-841.
[6] 馬 紅, 于海云, 于 燕, 等. H2S抑制Ang Ⅱ引起的神經元活性氧水平升高的機制研究[J]. 中國病理生理雜志, 2012, 28(5):865-869.
[7] Chan SH, Chan JY. Angiotensin-generated reactive oxygen species in brain and pathogenesis of cardiovascular diseases[J]. Antioxid Redox Signal, 2013, 19(10):1074-1084.
[8] Sun C, Sellers KW, Sumners C, et al. NAD(P)H oxidase inhibition attenuates neuronal chronotropic actions of angiotensin II[J]. Circ Res, 2005, 96(6):659-666.
[9] Berridge MJ. Neuronal calcium signaling[J]. Neuron,1998, 21(1):13-26.
[10]Lynch MA. Long-term potentiation and memory[J]. Phy-siol Rev,2004,84(1):87-136.
[11]Yong QC, Choo CH, Tan BH, et al. Effect of hydrogen sulfide on intracellular calcium homeostasis in neuronal cells[J]. Neurochem Int, 2010, 56(3):508-515.
[12]Zimmerman MC, Sharma RV, Davisson RL. Superoxide mediates angiotensin II-induced influx of extracellular calcium in neural cells[J]. Hypertension, 2005, 45(4):717-723.
[13]Chan SH, Chan JY. Brain stem NOS and ROS in neural mechanisms of hypertension[J]. Antioxid Redox Signal, 2014, 20(1):146-163.
[14]Sumners C, Zhu M, Gelband CH, et al. Angiotensin II type 1 receptor modulation of neuronal K+and Ca2+currents: intracellular mechanisms[J]. Am J Physiol, 1996, 271(1 Pt 1):C154-C163.
[15]Chan SH, Wu KL, Chang AY, et al. Oxidative impairment of mitochondrial electron transport chain complexes in rostral ventrolateral medulla contributes to neurogenic hypertension[J]. Hypertension, 2009, 53(2):217-227.
[16]Braga VA, Medeiros IA, Ribeiro TP, et al. Angiotensin-II-induced reactive oxygen species along the SFO-PVN-RVLM pathway: implications in neurogenic hypertension[J]. Braz J Med Biol Res, 2011, 44(9):871-876.
[17]Yu H, Xu H, Liu X, et al. Superoxide mediates depressive effects induced by hydrogen sulfide in rostral ventrolateral medulla of spontaneously hypertensive rats[J]. Oxid Med Cell Longev, 2015, 2015:927686.
[18]Clapham DE. Calcium signaling[J]. Cell, 2007, 131(6):1047-1058.
[19]Zimmerman MC, Dunlay RP, Lazartigues E, et al. Requirement for Rac1-dependent NADPH oxidase in the cardiovascular and dipsogenic actions of angiotensin II in the brain[J]. Circ Res, 2004, 95(5):532-539.
(責任編輯: 盧 萍, 羅 森)
ROS mediates regulation of intracellular Ca2+induced by angiotensin II in primarily cultured medullary neurons
LIU Xiao-ni1, CAO Dong-qing2, ZHANG Na-na1, TAO Ran1, DING Ying-jiong1, JIN Hui-ming1, LU Ning1
(1DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai200032,China;2DepartmentofNeurosurgery,HuashanHospital,FudanUniversity,Shanghai200040,China.E-mail:luning7@shmu.edu.cn)
AIM: To investigate the role of reactive oxygen species (ROS) in the regulation of intracellular Ca2 + induced by angiotensin II (Ang II) in the primarily cultured medullary neurons. METHODS: Primarily cultured medullary neurons were prepared from 14-day-old embryos of Sprague-Dawley rats in the study. The identification of medullary neurons was assessed by double-labeling immunofluorescence. To explore the role of ROS,mainly the superoxide ( O2 -· ) , the O2 -· generation was measured using the fluorogenic probe dihydroethidium (DHE) . To determine intracellular free calcium concentration ( [Ca2 +]i ) ,the neurons were loaded with the Ca2+-specific dye Fura-2 /AM. The cell viability(DHE).Todetermineintracellularfreecalciumconcentration([Ca2+]i),theneuronswereloadedwiththeCa2+-specificdyeFura-2/AM.ThecellviabilityafteraddingAngIIwasalsoexaminedusingCCK-8assay. RESULTS: Most of the cultured cells were medullary neurons, more than 80% of which were glutamate positive neurons. Ang II (5 μmol/L) increased the level of ROS within 10 min in the medullary neurons. Ang II at 5 μmol/L induced a significant [Ca2+]iincrease in the medullary neurons, and the effect of Ang II occurred rapidly and reached a peak within 20 min after administration. The level of [Ca2+]istarted to decline after washout. The Ca2+elevation induced by Ang II was significantly decreased by apocynin or TEMPOL. No significant difference in the cell viability between control group and 5 μmol/L Ang II treatment group was observed. CONCLUSION: ROS is involved in the regulation of [Ca2+]iinduced by Ang II in the primarily cultured medullary neurons, suggesting a potential intracellular signaling mechanism involved in the Ang II-mediated oxidant regulation of central neural control of blood pressure.
Medullary neurons; Reactive oxygen species; Intracellular Ca2+; Angiotensin II
1000- 4718(2016)12- 2133- 06
2016- 07- 12
2016- 09- 05
國家自然科學基金資助項目(No. 81170237);國家基礎科學人才培養基金資助項目(No. J1210041)
R363.2
A
10.3969/j.issn.1000- 4718.2016.12.003
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 021-54237452; E-mail: luning7@shmu.edu.cn

