抗氧化黑豆肽的分離純化與結構鑒定
劉恩岐 巫永華 高兆建 張建萍
(徐州工程學院 江蘇省食品資源開發與質量安全重點建設實驗室,徐州 221008)
抗氧化黑豆肽的分離純化與結構鑒定
劉恩岐 巫永華 高兆建 張建萍
(徐州工程學院 江蘇省食品資源開發與質量安全重點建設實驗室,徐州 221008)
以氧自由基清除能力(ORAC)為評價指標,通過超濾與大孔樹脂吸附、乙醇分級洗脫對黑豆蛋白酶解產物進行初步分離,采用Sephadex G-25凝膠過濾色譜、反相高效液相色譜(RP-HPLC)與排阻色譜(SEC)逐級純化,最終得到RP-HPLC P2組分SEC P2肽段和RP-HPLC P4組分SEC P3肽段2個純化多肽,質量濃度為1 mg/mL的2個純化多肽的ORAC 值(Trolox當量)分別為307.5和314.6 μmol/L,其氧自由基清除能力分別是超濾分離抗氧化最強黑豆肽組分(Mr<1 000)的2.68和2.74倍,經Edman降解、N-端測序進行結構鑒定,純化后的2個抗氧化肽段的氨基酸組成序列結構分別為Tyr-Asn-Ile和Trp-Asn-Pro,N-端分別為具有酚羥基結構的酪氨酸Tyr和疏水性很強的色氨酸Trp。
黑豆肽 氧自由基清除能力 分離純化 結構鑒定
按照自由基生物學理論,人體器官和細胞組織會不同程度地產生各種自由基,引起機體組織和細胞的氧化損傷和功能損害,適當補充具有自由基清除功能的抗氧化物質,能夠抵御自由基造成的細胞氧化和機體損傷危害,提高人體組織器官的抗氧化水平[1-3]。食物蛋白和氨基酸普遍具有一定的抗氧化活性,且多肽的抗氧化能力優于蛋白質和氨基酸[4-6]。研究發現,大豆蛋白酶解物中由3~7個氨基酸組成的一些相對分子質量<700的小分子肽,抗氧化較強的疏水性氨基酸側鏈基團暴露出來,可以更好地發揮抗氧化功能[7-11]。據報道,黑豆蛋白的氨基酸組成與普通大豆基本一致,且蛋白質和疏水性氨基酸含量均明顯高于普通大豆蛋白,具有生物活性肽類產品開發優勢[12-13]。
超濾和大孔吸附樹脂吸附分離具有設備簡單、操作方便等優點,已被廣泛應用于生物活性肽的初級分離[14]。色譜分離具有分離效率高、不會造成被分離物質的變性等特點,是目標功能肽分離純化的有效方法,既可以用于試驗分析研究,也可用于少量樣品的制備[15]。氧自由基清除能力(oxygen radical absorbance capacity,ORAC)是國際上應用范圍較廣的體外抗氧化活性檢測方法之一,具有生物相關性強、靈敏度高、穩定性與重現性好等特點,2004年在第一屆抗氧化方法國際會議上被推薦為抗氧化活性評價的標準方法之一[16-18]。本試驗采用堿性蛋白酶(Alcalase)、中性蛋白酶(Neutrase)和風味蛋白酶(Flavourzyme)對黑豆蛋白進行組合水解,以ORAC值為抗氧化評價指標,通過超濾和大孔樹脂分離獲得抗氧化活性較強的黑豆蛋白肽粗品,采用凝膠過濾 (GFC)、反相高效液相 (RP-HPLC)與排阻色譜(SEC)等進一步逐級純化,得到高純度的抗氧化肽段,通過Edman降解與蛋白肽N-端測序對抗氧化肽一級結構進行鑒定,以期探討肽鏈一級結構與抗氧化活性的構效關系。
1 材料與方法
1.1 材料與試劑
黑豆蛋白酶解物粗粉:將黑豆蛋白依次采用Alcalase酶水解30 min(60 ℃,pH 8.5),Neutrase酶水解60 min(50 ℃,pH 7.0),Flavourzyme酶水解30 min(50 ℃,pH 6.0),不同酶在底物上的作用位點不同,提高了酶解液的水解度和多肽含量[19]。于4 000r/min離心10min取上清液,冷凍干燥得到黑豆蛋白酶解物粗粉,相對分子質量≤5 000的多肽含量87.6%,具有較強的抗氧化活性。
Alcalase、Neutrase和Flavourzyme蛋白酶:丹麥諾維信(中國)生物技術有限公司;DA201-C大孔樹脂:江蘇蘇青水處理工程集團有限公司;熒光素鈉(FL)、自由基產生劑2,2’-偶氮二異丁基脒二鹽酸鹽(AAPH)、抗氧化標準物質Trolox:美國Sigma-Alorich公司;聚凝胺、PTH-氨基酸標品(PTH-AA)玻璃纖維膜、PTFE濾膜:日本島津公司。
1.2 儀器與設備
Labscale TFF小型切向流超濾系統:美國Millipore公司; Synergy H1全功能酶標儀:美國BioTek公司;KTA蛋白純化系統、Sephadex G-25凝膠過濾色譜柱。
1.3 氧自由基清除能力(ORAC)的測定
參考曹亞蘭等[20]和Blanca H L等[21]的方法并修改,配制pH 7.4、75 mmol/L的磷酸氫二鉀、磷酸二氫鉀磷酸鹽緩沖液,用磷酸鹽緩沖液配制1 mg/mL的黑豆肽溶液、10 μmol/L的FL溶液和100 mmol/L的AAPH溶液。在96孔酶標板中,依次加入25 μL黑豆肽樣品、25 μL FL溶液,空白以25 μL緩沖液磷酸代替樣品,然后用多道移液器迅速加入150 μL AAPH溶液誘發熒光淬滅反應。將酶標板置于酶標儀振蕩8 s,振蕩幅度4 mm,以激發波長485 nm,發射波長535 nm于37 ℃條件下進行連續測定,每1 min測定1次各微孔的熒光強度,測定時間設定在熒光衰減呈基線后為止。應用BioTek全功能酶標儀Gen5數據分析軟件得出熒光衰減曲線(熒光強度-時間)下面的面積(AUC),通過黑豆肽熒光衰減曲線的保護面積(netAUC)與標準抗氧化物質Trolox的netAUC值比較,以Trolox當量(μmol/L)表示黑豆肽的ORAC值。
netAUC=AUC抗氧化物質-AUC空白
1.4 抗氧化黑豆肽的分離純化
1.4.1 超濾及大孔樹脂分離
通過截留相對分子質量為1 000、3 000和5 000的超濾膜對黑豆蛋白酶解物粗粉水溶液進行分離,采用DA201-C樹脂對抗氧化活性較強的黑豆蛋白肽超濾組分進行充分吸附,依次用體積分數為25%、50%、75%和100%乙醇洗脫3 h,按疏水性大小分離獲得ORAC值相對最強的黑豆蛋白肽粗品[22]。
1.4.2 Sephadex G-25凝膠過濾分離純化
1.4.3 反相高效液相色譜分離純化
將Sephadex G-25分離所得ORAC值最強的組分用含0.06%TFA的超純水溶解,12 000 r/min離心10 min,取上清;采用RP-HPLC法進一步純化,收集各洗脫峰,冷凍干燥,測定篩選抗氧化活性高的黑豆肽組分。
色譜柱:Zorbax SB-C18;進樣體積:500 μL;平衡緩沖液:0.06%TFA;洗脫緩沖液:含0.05%TFA的乙腈;梯度:0%~100% Bover 6 Column volumes;流速:0.8 mL/min;檢測:214 nm。
1.4.4 排阻色譜分離純化
將RP-HPLC分離所得ORAC值最強的組分用pH 8.6 Tris-HCl 溶液溶解,12 000 r/min離心10 min,取上清;采用SEC法分離和純度檢驗。
色譜柱:Superdex Peptide 10/300 GL;進樣體積:500 μL;平衡緩沖液:pH 8.6,50 mmol Tris-HCl,300 mmol NaCl;梯度:等梯度1.5個柱體積;流速:0.5 mL/min;檢測:214 nm。
1.5 多肽氨基酸序列測定
參照劉晶等[23]的方法采用PPSQ-31A蛋白測序儀測定抗氧化黑豆肽的氨基酸序列結構。采用Edman降解法從多肽的N-端按順序將氨基酸逐個切下,將切下的氨基酸與異硫氰酸苯(PITC)反應,生成易于檢測的PTH氨基酸,采用柱前衍生的液相色譜分析,進行多肽的氨基酸序列分析。
樣品處理:將純樣品12 000 r/min離心10 min,取上清;將聚凝胺15 μL加到玻璃纖維膜上,氮氣吹干;將玻璃纖維膜上機預處理,即運行5個循環;將純樣品點加到預處理后的玻璃纖維膜上,N2吹干。
上機檢測:將加好樣品的玻璃纖維膜用PTFE濾膜封置于蛋白測序儀PPSQ-31A的反應器里,設定檢測氨基酸數及其他參數,當樣品序列色譜分析完成后,自動生成推斷的序列。
2 結果與分析
2.1 氧自由基清除能力(ORAC)標準曲線的建立
在熒光素鈉(FL)溶液中,加入過氧自由基啟動劑AAPH,FL受到過氧自由基的氧化攻擊,熒光強度衰減,當抗氧化劑Trolox存在時,以抑制自由基方式減緩FL熒光衰減速度,抑制程度反映了它對自由基的抗氧化能力。不同濃度的Trolox標準溶液的熒光淬滅動力學曲線見圖1,隨著Trolox濃度增加,到達熒光強度衰減基線的熒光淬滅時間逐漸延長,熒光動力學曲線下的面積逐漸增大,Trolox濃度與熒光動力學曲線下的保護面積netAUC 值之間的線性方程為y=55 385.8x+1 217 801.3 (R2=0.998 6)。將黑豆肽與Trolox的熒光衰減曲線保護面積netAUC相比較,從而得出黑豆肽的ORAC值,以Trolox當量(μmol/L)表示。

圖1 不同濃度的Trolox熒光淬滅動力學曲線
2.2 抗氧化黑豆蛋白肽的超濾與大孔樹脂吸附分離結果
2.2.1 超濾分離黑豆肽組分的抗氧化活性比較
由表1可知,通過超濾可以對黑豆蛋白酶解物進行有效地初步分離,黑豆蛋白肽的抗氧化活性與其相對分子質量分布范圍有很大關系,相對分子質量<1 000的黑豆肽超濾組分占58.2%,具有相對最高的氧自由基清除能力,試驗確定采用大孔樹脂吸附法對該組分進一步分離純化。
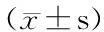
表1 黑豆肽超濾分離組分的氧自由基清除能力
2.2.2 大孔樹脂吸附乙醇洗脫分離黑豆肽組分的抗氧化活性比較
由表2可知, DA201-C大孔樹脂吸附,體積分數25%及50%乙醇洗脫分離的疏水性較低的黑豆肽組分約占69.1%,但氧自由基清除能力較低;體積分數75%乙醇洗脫分離的黑豆肽組分占25.2%,具有相對最高的ORAC值,該結果與苗欣等[24]的相關研究報道一致。而100%乙醇洗脫組分可能由于疏水性太高,在ORAC測定磷酸鹽緩沖液體系中的溶解度降低,反而ORAC值有所下降,因此確定以75%乙醇洗脫黑豆肽組分進行進一步的色譜分離純化。
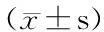
表2 黑豆肽大孔樹脂吸附分離組分的氧自由基清除能力
2.3 抗氧化黑豆肽的色譜分離純化結果
2.3.1 Sephadex G-25凝膠過濾分離純化結果
由圖2和表3可知,經Sephadex G-25純化后得到P1、P2、P3、P4、P5 5個峰組分,P1峰和P5峰的抗氧化活性很弱,P1組分可能是一些水解度較低的蛋白肽,P5組分可能是一些水解過度的游離氨基酸;P2、P3、P4組分的抗氧化活性較強,其中P4組分占37.2%,為主要組分,且ORAC值最強。但P4與P3組分的分離效果較差,試驗確定采用反相高效液相色譜(RP-HPLC) 對P4組分進一步分離純化。

圖2 抗氧化黑豆肽的Sephadex G-25分離圖譜

峰號P1P2P3P4P5組分比例/%4.818.229.737.210.1Trolox當量/μmol/L58.2±0.4116.5±0.3187.2±0.7245.4±0.329.4±0.5
2.3.2 RP-HPLC分離純化結果
由圖3可知,將G-25 P4 峰組分通過RP-HPLC純化后得到RP-HPLC P1、P2、P3、P4 4個黑豆肽組分,其中P2組分占41.4%、P4組分占36.4%,為主要組分。由表4可知,RP-HPLC P2、P4峰組分的ORAC值較為接近,且較G-25 P4 峰組分抗氧化活性進一步增強,試驗確定采用排阻色譜(SEC)對RP-HPLC P2和P4 2個組分進行分離和純度檢驗。

圖3 抗氧化黑豆肽的RP-HPLC分離圖譜

峰號P1P2P3P4組分比例/%16.341.45.936.4Trolox當量/μmol/L141.2±0.4278.5±0.6177.2±0.3285.4±0.2
2.3.3 SEC分離純化結果
由圖4可知,RP-HPLC純化后P2組分的SEC分離色譜圖顯示為1個大的主峰P2和1個小峰P1,SEC P2組分占86.95%,ORAC值(Trolox當量)為307. 5 μmol/L,比純化前RP-HPLC P2組分的抗氧化活性進一步增強,氧自由基清除能力是超濾分離抗氧化最強黑豆肽組分(Mr<1 000)的2.68倍。據此判斷SEC P2主峰組分為1個純度較高的肽段,試驗確定對其進行氨基酸序列結構鑒定分析。

圖4 抗氧化黑豆肽RP-HPLC-P2的SEC分離圖譜

圖5 抗氧化黑豆肽RP-HPLC-P4的SEC分離圖譜
由圖5可知,RP-HPLC純化后P4組分的SEC分離色譜圖顯示為單一主峰P3和一些微小的雜峰,SEC P3組分占87.95%,ORAC值(Trolox當量)為314.6 μmol/L,比純化前RP-HPLC P4組分的抗氧化活性進一步增強,氧自由基清除能力是超濾分離抗氧化最強黑豆肽組分(Mr<1 000)的2.74倍。據此判斷SEC P3主峰組分為1個純度較高的抗氧化肽段,試驗確定對其進行氨基酸序列結構鑒定分析。
2.4 抗氧化黑豆肽的氨基酸序列結構鑒定
Edman降解后通過蛋白測序儀測定,RP-HPLC純化后P2組分SEC P2黑豆肽的氨基酸組成如圖6所示,RP-HPLC P2組分SEC P2肽段共有3個氨基酸組成,其氨基酸組成序列結構為Tyr-Asn-Ile,相對分子質量為444。
RP-HPLC純化后P4組分SEC P3黑豆肽的氨基酸組成如圖7所示,RP-HPLC P4組分SEC P3肽段共有3個氨基酸組成,其氨基酸組成序列結構為Trp-Asn-Pro,相對分子質量為451。

圖6 抗氧化肽RP-HPLC-P2組分SEC-P2氨基酸序列圖

圖7 抗氧化肽RP-HPLC-P4組分SEC-P3氨基酸序列圖
據相關研究報道[25-26],抗氧化肽多數是一些由3~7個氨基酸所組成的小分子肽, N-端為捕捉自由基的能力較強的疏水性氨基酸如Ala、Ile、Pro、Trp等,具有較強的抗氧化活性,或N-末端是酪氨酸,它具有酚羥基結構,能提供質子從而猝滅自由基[9,27],可以提高肽的抗氧化能力。本試驗經多級色譜分離純化獲得的抗氧化黑豆肽是2個由3個氨基酸所組成的小肽,N-端為具有酚羥基結構的酪氨酸Tyr或疏水性很強的色氨酸Trp,與上述研究報道的抗氧化肽的氨基酸組成序列結構基本一致,為抗氧化目標功能肽的開發研究提供了理論參考。
3 結論
通過超濾和DA201-C大孔樹脂對黑豆蛋白酶法水解產物進行初步分離,相對分子質量<1 000,以體積分數75%乙醇洗脫的黑豆蛋白肽具有相對最強的抗氧化活性。采用色譜分離技術進一步逐級純化,經Sephadex G-25凝膠色譜分離,得到P1、P2、P3、P4和P5共5個峰組分,抗氧化活性相對最強的P4組分占37.2%。將Sephadex G-25 P4 峰組分通過RP-HPLC按疏水性差異分離純化后得到P1、P2、P3、P4共4個峰組分,其中P2組分占41.4%、P4組分占36.4%,RP-HPLC P2和P4峰組分的氧自由基清除能力較為接近,且較Sephadex G-25 P4峰組分的抗氧化活性進一步增強。
采用排阻色譜(SEC)法對RP-HPLC P2和P4峰組分進行分離和純度檢驗,最終獲得RP-HPLC P2組分SEC P2肽段和RP-HPLC P4組分SEC P3肽段2個純化的抗氧化黑豆肽。通過Edman 降解、蛋白測序儀測定,RP-HPLC P2組分SEC P2肽段的氨基酸組成序列結構為Tyr-Asn-Ile,N-端是具有酚羥基結構的酪氨酸Tyr;RP-HPLC P4組分SEC P3肽段的氨基酸組成序列結構為Trp-Asn-Pro,N-端是疏水性很強的色氨酸Trp。
[1]趙保路. 氧自由基和天然抗氧化劑[M]. 北京: 科學出版社, 1999
[2]Harman D. Aging: a theory based on free radical and radiation chemistry[J]. Journal of Gerontology, 1956(11): 298-300
[3]趙保路. 自由基、營養、天然抗氧化劑與衰老[J]. 生物物理學報, 2010, 26(1): 26-36
[4]陳園園. 大豆肽的酶解制備與抗疲勞、抗氧化功能研究[D]. 無錫: 江南大學, 2008
[5]王章存, 徐賢, 魏翠平. 大豆蛋白的酶解及其抗氧化活性研究[J]. 中國糧油學報, 2009, 24(5): 21-24
[6]張英, 董紹華. 氨基酸清除活性氧自由基作用的研究[J]. 科技通報, 1997,(5): 312-315
[7]張連慧, 賀寅, 劉新. 大豆肽的研究進展及其發展前景[J]. 食品工業科技, 2012,33(22): 406-408
[8]黎觀紅, 晏向華. 食物蛋白源生物活性肽: 基礎與應用[M]. 北京: 化學工業出版社, 2010
[9]Chen Hua-Ming, Muramoto K, Yamauchi F. Structural analysis of antioxidative peptides from soybean beta-Conglycinin[J]. Journal of Agriculture and Food Chemistry, 1995, 43(3): 574-578
[10]Chen H M, Muramoto K, Yamauchi F. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agriculture and Food Chemistry, 1998, 46(1):49-53
[11]Yamamoto N, Ejiri M, Mizuno S. Biogenic peptides and their potential use[J]. Current Pharmaceutical Design, 2003, 9(16): 1345-1355
[12]叢建民. 黑豆的營養成分分析研究[J]. 食品工業科技, 2008, 29(4): 262-264
[13]張瑞芬, 池建偉, 丘銀清, 等. 黑大豆的營養及保健功能研究進展[J]. 廣東農業科學, 2006(11): 13-16
[14]趙利, 錢芳, 許建軍, 等. 大孔吸附樹脂及其在蛋白質、多肽和氨基酸分離純化中的應用[J]. 四川食品與發酵, 2003(2): 39-41
[15]任嬌艷, 趙謀明, 崔春, 等. 草魚蛋白源抗氧化肽的分離及鑒定[J]. 食品科學, 2009, 30(13): 13-17
[16]宋立霞, 王向社, 吳紫云, 等. 氧自由基吸收能力測定方法的研究進展[J]. 食品研究與開發, 2008, 29(12): 166-170
[17]Prior R L, Wu X, Schaich K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J]. Journal of Agriculture and Food Chemistry, 2005, 53: 4290-4302
[18]Prior R L, Hoang H, Gu L, et al. Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity(ORAC) of plasma and other biological and food samples[J]. Journal of Agriculture and Food Chemistry, 2003, 51: 3273-3279
[19]李華, 劉恩岐, 唐仕榮, 等. 酶法制備黑豆抗氧化肽及其分離純化與氨基酸組成分析[J]. 食品科學, 2013, 34(9): 271-276
[20]曹亞蘭, 趙謀明, 鄭賽晶, 等. 以ORAC 法為評價指標優化制備大豆抗氧化肽[J]. 食品與發酵工業, 2011, 37(10): 73-77
[21]Blanca H L,Lourdes A, Isidra R, et al. ACE-inhibitory and radical-scavenging activity of peptides derived from β-lactoglobulin[J]. Journal of Agriculture and Food Chemistry, 2007, 55: 3392-3397
[22]鐘芳, 張曉梅, 麻建國. 大豆肽的大孔吸附樹脂以及凝膠過濾色譜分離[J]. 食品與機械, 2006, 22(4):25-28
[23]劉晶, 溫志英, 韓清波. 米渣肽抗疲勞作用及抗疲勞肽的分離鑒定[J]. 中國糧油學報, 2013, 28(1): 1-4
[24]苗欣, 張暉, 柳杰. 大孔樹脂對花生抗氧化肽的吸附研究[J]. 中國油脂, 2011, 36(5): 21-25
[25]Chen G T, Zhao L, Zhao L Y, et al. In vitro study on antioxidant activities of peanut protein hydrolysate[J]. Journal of the Science of Food and Agriculture, 2007, 87(2):357-362
[26]Pouliot Y, Wijers M C, Gauthier S F, et al. Fractionation of whey protein hydrolysates using charged UF/NF membranes[J]. Journal of Membrane Science, 1999, 158 (1):105-114
[27]Rajapakse N, Mendis E, Jung W, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38(2): 175-182.
Isolation and Identification of Antioxidant Peptides Derived from Black Soybean Protein
Liu Enqi Wu Yonghua Gao Zhaojian Zhang Jianping
(Jiangsu Key Laboratory of Food Resource Development and Quality Safety,Xuzhou Institute of Technology, Xuzhou 221008)
The oxygen radical absorbance capacity(ORAC) has been applied as an index to isolate the antioxidant peptides from black soybean protein hydrolysates by ultrafiltration (UF) and Macroporous Adsorption Resin (MAR); the fraction performed the highest antioxidant activity was further purified with consecutive methods on Sephadex G-25 column, reversed phase high-performance liquid chromatography (RH-HPLC) and Size Exclusion Chromatography (SEC); two highly purified antioxidant peptides named SEC P2 and SEC P3 produced from RP-HPLC P2 and RP-HPLC P4 have been obtained with ORAC values of 307.5 and 314.6 μmol/L, respectively. The antioxidant capacities were 2.68 and 2.74 times than that of the fraction purified by UF (Mr<1 000), respectively. Moreover, the amino acid sequences of the peptides with strong antioxidant activity were confirmed as Trp-Asn-Pro and Tyr-Asn-Ile by automated Edman degradation with protein sequencer. Additionally, Tyr with aromatic residue and Trp with high hydrophobicity could be located at N-terminus.
black soybean peptides, ORAC, isolation, structural analysis
TS201.2.1
A
1003-0174(2016)02-0033-06
2014-07-15
劉恩岐,男,1964年出生,博士,教授,糧油植物蛋白與食品生物技術

