RP-HPLC測定油用牡丹籽餅粕和籽殼中單萜苷的含量
劉 普 李小方 張 恒 劉一瓊 董俊青 鄧瑞雪
(河南省伏牛山野生藥材基源工程技術研究中心 河南科技大學化工與制藥學院,洛陽 471023)
RP-HPLC測定油用牡丹籽餅粕和籽殼中單萜苷的含量
劉 普 李小方 張 恒 劉一瓊 董俊青 鄧瑞雪
(河南省伏牛山野生藥材基源工程技術研究中心 河南科技大學化工與制藥學院,洛陽 471023)
建立RP-HPLC同時測定油用牡丹籽餅粕和籽殼中6種單萜苷類化合物含量的方法。采用乙腈(A)和磷酸二氫鉀緩沖鹽(B)(pH=3)為流動相梯度洗脫,梯度為0 min(A, 15%)→10 min(A, 15%)→22 min(A, 25%);檢測波長:4″-羥基白芍苷和氧化芍藥苷為260 nm,白芍苷、芍藥苷、6-O-β-D-吡喃葡萄糖-8-O-苯甲酰基-9α-甲氧基-牡丹酮和白芍苷R1為232 nm,柱溫30 ℃。結果表明,單萜苷類物質在油用牡丹籽餅粕中的含量遠遠大于在其籽殼中的含量,牡丹籽餅粕可以作為單萜苷類物質的一個重要來源。該方法準確,實用性好,可用于牡丹籽餅粕中單萜苷類成分的定性與定量分析。
油用牡丹 高效液相色譜法 單萜苷 含量測定
牡丹為芍藥科落葉灌木,是原產中國著名的觀賞花卉。牡丹籽可以用于榨油,牡丹籽油中含有豐富的不飽和脂肪酸,具有較好營養價值和保健功效[1-4]。在壓榨法制備牡丹籽油的過程中會產生大量的牡丹籽殼和牡丹籽餅粕等副產物,充分開發利用這些副產物對于提高油用牡丹的研究開發價值具有重要作用。
研究發現,牡丹籽中含有大量的單萜苷類化學成分[5-8]。單萜苷類成分為芍藥屬中一個特征性成分,具有廣泛的生物活性[9-10]。本課題組深入分析發現單萜苷類物質在油用牡丹籽殼和籽餅粕的含量有較大的差異。確定油用牡丹籽殼和籽餅粕中單萜苷類物質含量差異對于它們的深入開發利用具有重要意義。關于單萜苷類成分在油用牡丹籽殼和籽餅粕中的含量測定鮮見文獻報道。
本試驗采用波長切換法研究能同時分離4″-羥基白芍苷、氧化芍藥苷、白芍苷、芍藥苷、6-O-β-D-吡喃葡萄糖-8-O-苯甲酰基-9α-甲氧基-牡丹酮(paeonidanin,PD)和白芍苷R1等6種單萜苷類成分的分析色譜條件,對油用牡丹籽殼和籽餅粕中6種單萜苷類物質的含量進行了分析,為牡丹籽榨油副產物的進一步開發利用提供參考。
1 材料與方法
1.1 儀器、試劑及藥材
Agilent1100高效液相色譜儀:四元泵和二極管陣列檢測器(G1313A);在線脫氣,柱溫箱,自動進樣器,Agilent1100色譜工作站;FA2004型電子分析天平: 上海越平科學儀器有限公司。
4″-羥基白芍苷、氧化芍藥苷、白芍苷、芍藥苷、PD、白芍苷R1等對照品:自制,經NMR和 ESI-MS鑒定了化合物的結構,經HPLC測定純度大于98%。紫斑牡丹(P.rockii)籽和鳳丹牡丹(PaeoniaostiiT.Hong et J.X.Zhang)籽:河南省孟津縣土橋村花木公司基地。
乙腈為色譜純,水為高純水,磷酸二氫鉀為色譜純,其余試劑均為分析純。
1.2 試驗方法
1.2.1 色譜條件
Agilent1100高效液相色譜儀;色譜柱:Zorbax SB-Aq C18色譜柱(4.6 mm×250 mm,5 μm);流動相:乙腈-磷酸(0.05),或乙腈-磷酸二氫鉀緩沖鹽(pH=3.0);體積流量為1.0 mL/min;柱溫:30 ℃;進樣量:10 μL。
1.2.2 對照品溶液的制備
精密稱取對照品4″-羥基白芍苷10.3 mg,氧化芍藥苷10.4 mg,白芍苷10.8 mg,芍藥苷18.6 mg,PD14.9 mg,白芍苷R1 8.1 mg,用甲醇定容于50 mL容量瓶中,配成206、208、216、372、298、161 μg/mL的混合溶液,即為對照品儲備溶液。
1.2.3 供試品溶液的制備
取采自洛陽市孟津縣土橋村花木公司牡丹種植基地的紫斑牡丹和鳳丹牡丹種子,脫殼機脫殼,收集牡丹籽仁和牡丹籽殼,牡丹籽仁經壓榨法榨油后得牡丹籽餅粕,將油用牡丹籽殼和牡丹籽餅粕置于100 ℃的烘箱中烘3 h。將經過烘干的油用牡丹籽殼和牡丹籽餅粕粉碎,過60目篩,分別精密稱取10.00 g樣品,用濾紙包好,加入100 mL甲醇為提取溶劑,采用索氏提取器回流提取4 h。回收提取液,冷卻后,濾液用0.45 μm的微孔濾膜過濾,定容于100 mL容量瓶中,即為供試品溶液。
2 結果與討論
2.1 吸收波長的選擇
取1.2.2中配置的對照品樣品溶液,采用紫外可見分光光度計在波長200~400 nm間進行全波長掃描,以確定各單萜苷的最大吸收波長,從而確定合適的檢測波長。光譜掃描結果顯示4″-羥基白芍苷和氧化芍藥苷在260 nm處有明顯的吸收峰,白芍苷、芍藥苷、PD和白芍苷R1在232 nm處有最大吸收峰。因此,吸收波長采用變波長法測定,選擇260 nm作為4″-羥基白芍苷和氧化芍藥苷的檢測波長,232 nm作為白芍苷、芍藥苷、PD和白芍苷R1的檢測波長。
2.2 流動相的選擇
由于單萜苷類化合物含有較多的羥基,這些羥基與固定相作用較強,會導致拖尾。所以文獻報道分離芍藥苷等單萜苷類的流動相多為乙腈-磷酸水體系[11-13]。本研究優化了乙腈-磷酸水體系作為流動相的分離效果,發現采用乙腈-磷酸水體系時4″-羥基白芍苷和氧化芍藥苷2種單萜苷的分離效果較差。參考苷類分析方法的文獻報道[14],對乙腈-磷酸二氫鉀緩沖鹽體系分離單萜苷類的條件進行了優化,最終選擇乙腈-磷酸二氫鉀緩沖鹽(pH=3.0)為分離流動相。分離洗脫為梯度洗脫,條件為:0 min(A, 15%)→10 min(A, 15%)→22 min(A, 25%)。在此條件下,6個單萜苷都得到很好的分離,并且分析時間較短。
2.3 供試品的制備方法的建立
比較了甲醇、乙醇和乙腈等溶劑提取單萜苷的效率,同時對不同的提取方法(超聲、索氏回流、冷浸和回流)、提取時間、料液比及溶劑濃度進行了優化,以其中主要成分芍藥苷的含量作為衡量標準。結果發現采用10倍量的甲醇和乙腈用索氏提取器回流4 h時芍藥苷的得率比較接近,大于用其他提取方法的得率。由于乙腈毒性較大,綜合評價得率和安全性等因素,最后選擇甲醇作為提取溶劑。
2.4 線性關系的考察
精密吸取混合對照品儲備液1 mL加入到10 mL容量瓶中,用甲醇定容。然后吸取0.75、1.5、3、6、12 μL注入色譜儀,按照1.2中的色譜條件進行測定,記錄峰面積。以對照品的峰面積(y)為縱坐標,進樣量(x)為橫坐標進行線性回歸,得4″-羥基白芍苷、氧化芍藥苷、白芍苷、芍藥苷、PD和白芍苷R1的線性回歸方程見表1。

表1 6種對照品的線性關系
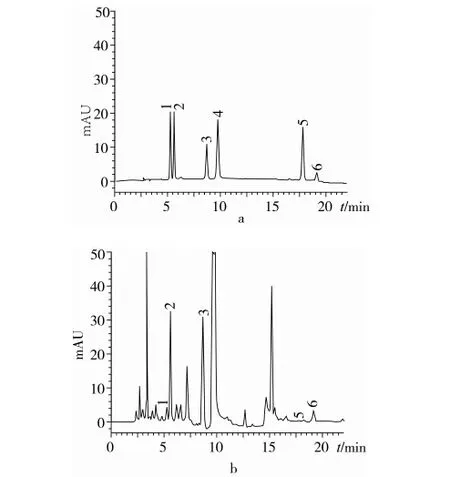
注:1對羥基白芍苷,2氧化芍藥苷,3 白芍苷,4 芍藥苷,5 PD,6 白芍苷R1。
圖1 對照品(a)和樣品的色譜圖(b)
2.5 精密度試驗
取對照品混合物溶液,按色譜條件,連續進樣6次,記錄峰面積,計算4″-羥基白芍苷、氧化芍藥苷、白芍苷、芍藥苷、PD、白芍苷R1峰面積的RSD分別為0.32%、0.87%、0.65%、0.57%、0.89%、0.68%,表明本方法的精密度良好。
2.6 穩定性試驗
取同一供試品溶液,分別于配制后的0、2、4、8、12、24、48 h進樣,記錄峰面積。結果顯示4″-羥基白芍苷、氧化芍藥苷、白芍苷、芍藥苷、PD、白芍苷R1的峰面積的RSD值分別為0.87%、1.14%、1.54%、1.08%、0.85%、0.97%。表明供試品溶液在48 h內穩定性良好。
2.7 重復性試驗
精密稱取紫斑牡丹籽餅粕粉末5份,每份10 g,按照1.2.3中的方法操作,制備所需供試品溶液,測定4″-羥基白芍苷、氧化芍藥苷、白芍苷、芍藥苷、PD和白芍苷R1的含量,計算各組分含量平均值分別為0.110、5.702、1.078 3、12.381 4、0.063 2、0.558 7 mg/g;RSD分別為0.89%、1.02%、1.31%、0.76%、0.87%,0.95%。
2.8 加樣回收率試驗
精密稱取已經測得含量的紫斑牡丹籽餅粕粉末9份,每份10.00 g,3份為一組,分別精密加入一定量的4″-羥基白芍苷、氧化芍藥苷、白芍苷、芍藥苷、PD、白芍苷R1對照品(約相當于樣品中各對照品含量的80%、100%、120%),加入10 mL乙醇,按照“1.2.3”中的方法操作,制備所需溶液,進樣10 mL,測定提取液中5種組分的含量并計算加樣回收率。4″-羥基白芍苷、氧化芍藥苷、白芍苷、芍藥苷、PD和白芍苷R1平均加樣回收率和RSD見表2。

表2 回收率測定結果(n=3)
2.9 樣品含量的測定
將經過烘干的油用牡丹籽殼和牡丹籽餅粕用高速粉碎機粉碎,過60目篩,按照1.2.3中的方法制備供試品溶液。精密吸取對照品混合物和供試品溶液各10 μL,注入高效液相色譜儀,照色譜條件分別測定,外標法計算不同部位中各個單萜苷的含量,結果見表3。

表3 樣品含量測定結果/mg/g (n=5, x±s)
3 結論
本試驗建立了波長切換同時測定2種油用牡丹籽殼和榨油后的籽餅粕中6種單萜苷類化合物含量的測定方法。結果表明,6種單萜苷在油用牡丹籽殼和籽餅粕中含量不同,在油用牡丹籽餅粕中的含量遠遠大于其在牡丹籽殼中的含量,最多可以相差400多倍。在油用牡丹籽餅粕中,這6種單萜苷類物質的含量也有非常大的差異,其中含量最多的單萜苷為芍藥苷,其在紫斑牡丹籽餅粕中的含量為12.339 5 mg/g;含量最低的單萜苷為PD,其在鳳丹牡丹籽餅粕中的含量僅為0.003 2 mg/g。油用牡丹籽餅粕作為壓榨法制備牡丹籽油的最主要的副產物,含有豐富的單萜苷類成分,可以通過從中提取單萜苷類物質進一步提高其應用價值。
[1]戚軍超,周海梅,馬錦琦,等. 牡丹籽油化學成分GC-MS分析[J]. 糧食與油脂, 2005, 19 (11):22-23
Qi J C, Zhou H M, Ma J Q, et al. Analysis of the chemical constituents in peony seed oil by GC-MS[J]. Cereals & Oils, 2005,19 (11):22-23
[2]鄧瑞雪,劉振,秦琳琳,等. 超臨界CO2流體提取洛陽牡丹籽油工藝研究[J],食品科學,2010,31(10):142-145
Deng R X, Liu Z, Qin L L, et al. Optimization of supercritical CO2extraction and analysis of chemical composition of peony seed oil[J].Food Science, 2010, 31(10): 142-145
[3]史國安,郭香鳳,金寶磊,等. 牡丹籽油超臨界CO2萃取工藝優化及抗氧化活性的研究[J],中國糧油學報,2013,28(4):47-50
Shi G A, Guo X F, Jin B L, et al. Optimization of supercritical CO2extraction and analysis of antioxidation activity of peony seed oil[J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(4): 47-50
[4]王昌濤,張萍,董銀卯. 超臨界CO2提取牡丹籽油的工藝以及成分分析[J]. 中國糧油學報,2009,24(8):96-99
Wang C T, Zhang P, Dong Y M. The technique of the extraction of oil from peony seed with supercritical CO2extraction method and the analysis of the composition[J]. Journal of the Chinese Cereals and Oils Association, 2009,24(8):96-99
[5]S. H. Wu, D. G. Wu, Y. W. Chen.Chemical constituents and bioactivities of plants from the genusPaeonia[J].Chemistry & Biodiversity, 2010, 7(7):90-104
[6]C. N. He, Y. Peng, Y. C. Zhang,et al. Xiao.Phytochemical and biological studies of paeoniaceae[J].Chemistry & Biodiversity,2010, 7(7):805-838
[7]何春年,肖偉,李敏,等. 牡丹種子化學成分研究[J]. 中國中藥雜志, 2010,35 (11):1428-1431
He C N, Xiao W, Li M, et al. Chemical constituents from seeds of Paeonia suffruticosa[J]. China Journal of Chinese Materia Medica, 2010, 35(11):1428-1431
[8]He C N, Zhang Y C, Xiao P G,etal. Monoterpene glycosides from the seeds of Paeonia suffruticosa protect HEK 293 cells from irradiation-induced DNA damage[J]. Phytochemistry Letters, 2012, 5(1): 128-133
[9]劉普,李亮,鄧瑞雪,等. 鳳丹籽餅粕單萜苷類成分的研究[J],中國藥學雜志,2013,48(17):1445-1448
Liu P, Li L, Deng R X, et al. Monoterpene glucosides from seed cake ofPaeoniaostii[J]. Chinese Pharmaceutical Journal, 2013,48(17):1445-1448
[10]劉普,盧宗元,鄧瑞雪,等. 鳳丹籽餅粕中一個新單萜苷[J],中國藥學雜志,2014,49(5):360-362
Liu P, Lu Z Y, Deng R X, et al. A new Monoterpene glycosides isolated from seed cake ofPaeoniaostii[J]. Chinese Pharmaceutical Journal, 2014,49(5):360-362
[11]李偉銘,趙月然,楊燕云,等. HPLC波長切換法同時測定白芍飲品中9種成分的含量[J],藥物分析雜志,2011,31(12):2208-2212
Li W M, Zhao Y R, Yang Y Y, et al. RP-HPLC with UV switch determination of 9 components in white peony roots species[J]. Chinese Journal of pharmaceutical Analysis, 2011,31(12):2208-2212
[12]葛志偉,賀慶,林云徑,等. RP-HPLC法測定杭白芍及其飲片中芍藥內酯苷、芍藥苷和苯甲酰芍藥苷[J],中草藥,2008,39(3):378-380
Ge Z W, He Q, Lin Y J, et al. RP-HPLC determination of the Albiflorin, Paeoniflorin and benzoylpaeoniflorin inPaeonialactifloraPall[J].Chinese Traditional and Herbal Drugs, 2008,39(3):378-380
[13]何秀菊,張振秋,王婧寧,等. HPLC波長切換法同時測定桂枝、白芍藥對提取物中8個成分的含量[J].藥物分析雜志,2013,33(11):1899-1903
He X J, Zhang Z Q, Wang J N, et al. HPLC with UV switch determination of 8 indicative components in combination extracts ofPersicaeRamulus andPaeoniaeRadix Alba[J]. Chinese Journal of pharmaceutical Analysis, 2013,33(11):1899-1903
[14]劉普,張創峰,鄧瑞雪,等. 高效液相色譜法同時測定小葉丁香不同部位中5種活性成分的含量[J].中國藥學雜志,2011,46(24):1935-1938
Liu P, Zhang C F, Deng R X, et al. Simultaneous determination of five Glycosides in Syringa pubenscens Turcz by HPLC[J].Chinese Pharmaceutical Journal, 2011,46(24):1935-1938.
Determination of Monoterpene Glycosides in Seed Cake and Seed Shell of Peony for Oil
Liu Pu Li Xiaofang Zhang Heng Liu Yiqiong Dong Junqing Deng Ruixue
(Henan Engineering Technology Research Center for Funiu Mountain Wild Medicinal Source Chemical Engineering & pharmaceutical College, Henan University of Science and Technology, Luoyang 471023)
To establish an HPLC method for simultaneous determination of 6 monoterpene glycosides in seed cake and seed shell of peony for oil, the separation was performed on an Agilent Zorbax SB C18column, using acetonitrile (A) and potassium dihydrogen phosphate solution (B) (pH=3) as the mobile phase by a gradient elution 0 min(A, 15%)→10 min(A, 15%)→22 min(A, 25%). Detection wavelength was set at 260 nm for the detection of 4″-hydroxyl-abiflofin, oxypaeoniflorin, and 232 nm for the detection of abiflofin, paeoniflorin, Paeonidanin, abiflofin R1. Column temperature was set at 30 ℃.The results indicated that the content of monoterpene glycosides in seed cake was higer than that in seed shell, and the seed cake would become the natural resource of monoterpene glycosides. The method was simple, accurate and could be used for quality control of the seed cake of peony for oil.
peony for oil, HPLC, monoterpene glycosides, assay
TS229
A
1003-0174(2016)10-0142-04
洛陽市科技攻關項目(1301052A,1401074A),河南科技大學大學生訓練計劃(HG201501),河南省重點科技攻關(162102310202)
2015-02-15
劉普,男,1978年出生,副教授,牡丹深加工
鄧瑞雪,女,1978年出生,副教授,功能活性天然產物及其全合成

