電紡聚己內酯引導骨再生膜的仿生礦化研究
鄧霞 白石
1.核工業四一六醫院口腔科,成都 610051;2.重慶醫科大學附屬口腔醫院種植科,重慶 400015
電紡聚己內酯引導骨再生膜的仿生礦化研究
鄧霞1白石2
1.核工業四一六醫院口腔科,成都 610051;2.重慶醫科大學附屬口腔醫院種植科,重慶 400015
目的 探討組織工程化電紡聚己內酯支架材料的生物礦化特性及其用作引導骨組織再生膜的可能性。方法 利用靜電紡絲法制備聚己內酯(PCL)超細纖維膜支架,采用體外過飽和礦化液(SCS)浸泡法,在電紡膜上仿生沉積磷灰石。該復合材料采用掃描電子顯微鏡(SEM)、X射線衍射儀(XRD)、傅里葉變換紅外光譜儀(FTIR)等方法進行結構表征;采用接觸角實驗評價其親水性;將成骨細胞與復合材料共培養,用SEM觀察并評價其細胞相容性。結果 PCL電紡薄膜由超細纖維交織形成三維多孔結構,隨著礦化時間增加,PCL電紡纖維上沉積的結晶物數量增多,形態增大并覆蓋整個薄膜表面,形成磷酸氫鈣及類骨磷灰石晶體。成骨細胞在復合材料表面黏附、鋪展,呈正常生長形貌。結論 PCL電紡膜經過SCS處理是一種簡便有效的制備復合材料的仿生礦化方法,該材料具有良好的細胞相容性,在仿細胞外基質組織工程化材料及引導骨組織再生膜研制方面具有一定的應用前景。
引導骨組織再生; 靜電紡絲; 聚己內酯; 仿生礦化; 磷酸鈣
Correspondence: Bai Shi, E-mail: 2296059@qq.com.
靜電紡絲技術是一種簡便易行的制備超細纖維的有效方法。紡織物具有較高的比表面積和高孔隙率,其微觀結構與天然細胞外基質(extracellular matrix,ECM)相近,可以為細胞的生存提供良好的微環境,是較理想的組織工程支架[1]。目前已有膠原、殼聚糖、聚乳酸、聚己內酯(polycaprolactone,PCL)等數十種天然或合成的高分子材料[2]被應用于靜電紡絲研究中。這些材料中,PCL是一種人工合成的聚酯類生物高分子材料[3],安全無毒,生物降解性、力學性能、生物相容性均良好且具有形狀記憶效應[4],因此在生物醫學領域具有誘人的應用前景。
引導骨組織再生(guided bone regeneration,GBR)是目前促進牙槽骨組織再生的有效手段,而GBR生物屏障膜是決定其臨床效果的主要因素之一。近年來,學者們致力于研制能促使牙槽骨、牙骨質及牙周膜全方位再生的復合結構屏障膜,并賦予其生物活性、載藥抗菌等復合功能來滿足臨床需要[5]。
仿生礦化是將生物礦化的方法引入材料合成的過程,以有機基質為模板,與無機礦物離子在界面處相互作用,對晶體的成核和生長進行分子調控,制造性能優良的有機-無機復合生物材料[6]。如何實現磷灰石微細晶體的快速沉積及均勻分布,一直是仿生礦化薄膜的研究熱點。本實驗結合靜電紡絲法和仿生礦化法,將PCL電紡膜作為有機模板,利用氫氧化鈣對其進行預處理,采用過飽和鈣磷混和液(supersaturated calcification solution,SCS)仿生礦化法在PCL電紡超細纖維膜上快速礦化沉積磷灰石微晶體,制備GBR復合生物屏障膜,考察其仿生礦化特征,并進行初步的材料體外細胞學研究,為進一步研制在結構和功能上更適合頜面骨組織缺損修復的電紡PCL/磷酸鈣(PCL/calcium phosphate,PCL/ CAP)復合生物屏障材料提供實驗依據。
1 材料和方法
1.1 主要原料及儀器設備
PCL(美國Sigma公司);氫氧化鈣、碳酸鈉、無水氯化鈣、碳酸氫鈉、二甲基甲酰胺(dimethylformamide,DMF),氯仿均為分析純(成都市科龍化工試劑廠)。
THZ-C型恒溫水浴搖床(江蘇常州市萬合儀器制造有限公司);10-1-S型電熱恒溫鼓風干燥箱(上海喆鈦機械制造有限公司);AH250型電子天平(奧豪斯公司,美國);高壓靜電紡絲機(四川大學紡織工程學院紡織研究所提供);X’Pert Pro MPD 型X射線衍射儀(X-ray diffraction,XRD,Philips公司,荷蘭);Nicolet 510P型傅里葉變換紅外光譜儀(Fourier transform infrared spectroscopy,FTIR,Nicolet公司,美國);JSM-5900LV型掃描電子顯微鏡(scanning electron microscope,SEM,JEOL公司,日本);IX50/IX70型倒置相差顯微鏡(Olympus公司,日本);OCA20視頻光學接觸角測量儀(北京東方德菲膠體化學儀器有限公司)。
1.2 PCL電紡膜的制備及表征
[7]配制PCL電紡溶液,將10 mL電紡溶液置于液體推注裝置中,裝置末端連接噴絲頭(內徑0.5 mm)。推注裝置恒定以0.05 mL·min-1的加載速度將液體推出噴絲頭。噴絲頭同時與高壓電源的正極相連,在噴絲頭正下方放置玻璃蓋玻片做收集板,并作為接地負極。在設定條件下制備電紡產物。樣品噴金,SEM下觀察電紡超細纖維的形態,采用SigmaScan Pro 2.0圖像分析軟件測量纖維直徑。
1.3 PCL電紡膜的仿生礦化及檢測
按文獻[8]配制SCS仿生礦化液。將載有PCL電紡膜的蓋玻片經新鮮配制的飽和氫氧化鈣溶液浸泡,預礦化1 h,去離子水漂洗后, 37 ℃恒溫浸泡于礦化溶液中。實驗分組分別為12、24、48 h,礦化結束后,標本用去離子水漂洗,去除未反應的離子,自然干燥后送檢。在SEM下觀察形貌,用XRD及FTIR檢測材料的物相分布。以滴躺法檢測0.2 μL去離子水在純PCL電紡膜及PCL電紡膜礦化12、48 h組待測材料表面的接觸角,闡釋其潤濕性質。
1.4 成骨細胞與材料的復合培養
成骨細胞的分離培養采用剛出生3~5 d的SD乳鼠顱蓋骨組織塊法。將分離的SD乳鼠顱蓋骨用PBS洗滌3次,用眼科剪剪成0.5~1.0 mm3的小塊,放入含DMEM培養基的培養瓶中,加入4 mL DMEM培養液(含體積分數15%小牛血清、100 U·mL-1青霉素、100 mg·L-1鏈霉素)。培養瓶置于37 ℃、體積分數5%CO2飽和濕度孵箱中培養,6 h后翻轉培養瓶。用倒置相差顯微鏡逐日觀察細胞從組織塊的游出及生長情況,平均每3 d更換1次培養液。當細胞增殖貼壁融合成單層后,0.25%胰蛋白酶消化收集細胞,經反復分瓶傳代及細胞增殖致所需細胞量后備用。將試樣放置于6孔板內,環氧乙烷冷消毒,PBS浸泡清洗 3次,每次 1 h,DMEM培養液孵育過夜。將第4代成骨細胞消化,制成密度為1×105·mL-1的懸浮液,分別接種于已備好的材料上,37 ℃條件下5%CO2孵箱內繼續靜置培養3 d。分別于第3 h、1 d、2 d將試樣取出,10%多聚甲醛固定,乙醇梯度脫水,醋酸異戊酯置換乙醇,臨界點干燥,表面噴金,SEM觀察。
2 結果
2.1 SEM形貌
在SEM下可見,電紡PCL膜由亞微米級超細纖維交織而成,具有高孔隙率及比表面積的特殊三維結構(圖1A)。在SCS液中浸泡12 h,電紡PCL膜即有沿纖維分布的細小結晶物沉積(圖1B);隨著礦化時間的延長,24 h組樣品上的晶體體積逐漸增大,數目增多,但仍然可見PCL基體膜的網狀結構(圖1C);48 h組樣品上礦化結晶密集堆積,連接成片,覆蓋整個基質表面,單個晶體呈葉片狀,以原來形成的鈣磷沉積為核心,增高增厚,相互交織成叢,形成花團狀外形(圖1D)。

圖1 電紡PCL膜及在SCS中不同礦化時間后的形貌 SEM × 1 000Fig 1 Micrographs of electrospun PCL and the coated PCL scaffolds after immersing in SCS at different times SEM × 1 000
2.2 XRD及FTIR分析
XRD結果(圖2)顯示,21.53°、23.85°為PCL的特征衍射峰,25.9°、31°、33°為磷灰石特征衍射峰。PCL+SCS培養12 h組僅出現PCL的特征峰,磷灰石特征峰基本未顯示;PCL+SCS培養24 h組,除了出現PCL的特征峰外,在25.9°和31°位置出現了磷灰石特征峰;PCL+SCS培養48 h組除PCL的特征峰外,在25.9°、31°和33°位置出現了磷灰石特征峰。將PCL+SCS培養48 h組樣品與PCL基體膜作FTIR對比分析,在1 629 cm-1出現羰基特征振動吸收峰,在1 726 cm-1出現酯基特征振動吸收峰,在560、600、1 037 cm-1區出現PO43-的特征振動吸收峰,在1 417和1 464 cm-1處出現CO32–的特征振動吸收峰。
2.3 材料的親水性接觸角檢測
經滴躺法測定,純PCL電紡膜接觸角為91°,液滴在材料表面呈球形;礦化12 h后接觸角為23.5°,液滴明顯鋪展,但尚未完全浸潤;礦化48 h后材料接觸角為0°,液滴在材料表面完全浸潤。
2.4 成骨細胞在復合材料上的生長
以48 h組樣品的細胞培養為例,細胞接種于材料表面3 h后,細胞呈球形,其后逐漸伸出偽足黏附于材料表面(圖3A);1 d后,細胞變成紡錘形及梭形定植,偽足細長,仍可見細胞核部分隆起(圖3B);2 d后,細胞更加鋪展,呈多角形,并相互交聯(圖3C)。成骨細胞在材料表面的黏附、鋪展和生長行為符合正常生長形貌,提示該材料有良好細胞相容性。
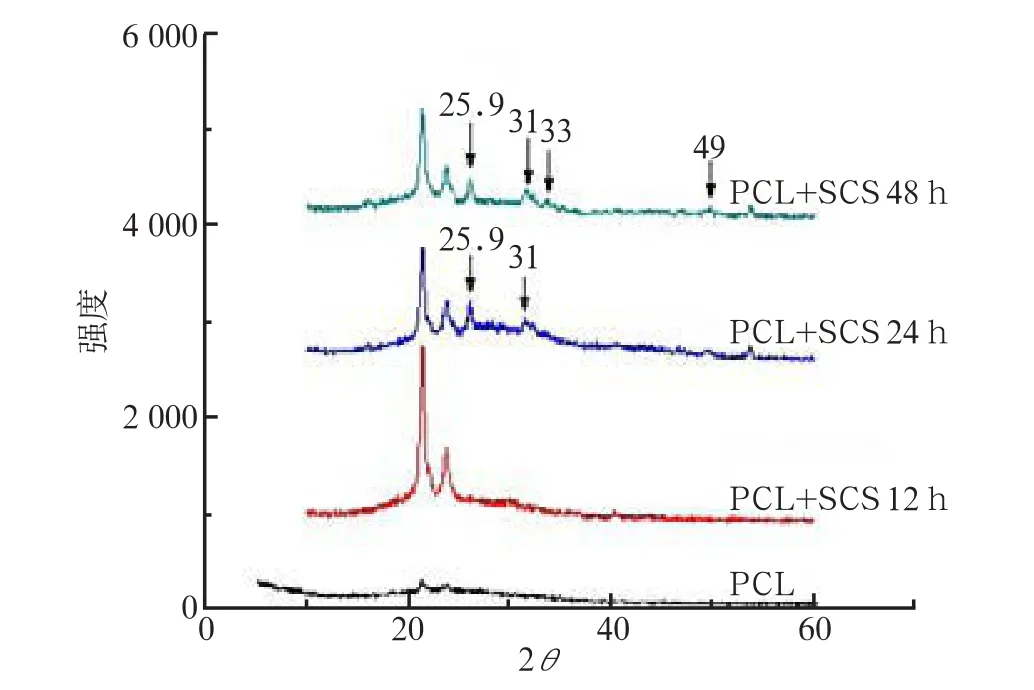
圖2 電紡PCL膜及在SCS中不同礦化時間后的XRD圖譜 Fig 2 XRD pattern of electrospun PCL and the coated PCL scaf- folds after immersing in SCS at different times

圖3 成骨細胞在PCL+SCS 48 h組復合材料上的生長情況 SEM × 1 000Fig 3 Osteoblasts cultured on PCL+SCS 48 h composite SEM × 1 000
3 討論
GBR技術是膜引導性組織再生技術(guided tissue regeneration,GTR)在骨缺損修復領域中的應用[9]。隨著該技術在牙槽外科、牙周科和口腔種植臨床的廣泛應用,對GBR生物屏障膜的要求也不斷提高,根據屏障膜兩側組織再生的不同特點,學者們致力于研制更適合臨床需要的不對稱結構復合屏障膜,并賦予其生物活性和載藥抗菌等多種功能[10]。
靜電紡絲技術的發展與應用為制備理想的復合結構GBR膜提供了契機[11]。電紡納米纖維膜的孔徑為4~6 μm,而真核細胞直徑范圍為10~100 μm,因此電紡纖維膜的結構特點使其具有細胞屏蔽功能,非常適合制備隔離屏蔽膜。同時,電紡超細纖維直徑與天然ECM(其中膠原纖維直徑為50~500 nm)相近,支架具有極大的比表面積、較高的孔隙率和較好的孔道連通,因而被用作仿生人體內ECM結構的組織工程支架材料[2]。進一步優化制備工藝,將電紡材料多層疊加,修飾改性,形成具有優良性能的復合材料則是該領域新的研究熱點。Bottino等[12]利用靜電紡絲技術設計并制備了一種功能梯度材料,該材料具有中間基層和兩側不同的功能表層,綜合了有機材料的良好機械性能、生物降解性和無機微粒的生物活性,兼顧了促進根端牙周膜組織再生和牙槽骨缺損側骨再生的要求。因此,在電紡GBR膜阻擋軟組織,發揮良好屏障功能的同時,在膜的骨缺損側引入無機成分,增加材料的生物活性和骨誘導性,對骨組織的再生修復具有積極意義。
制備電紡有機-無機復合材料層有兩種途徑:一是將無機微粒如CaCO3和羥磷灰石直接加入電紡原液中,混紡形成復合材料[13-14];二是將高分子電紡材料作為有機模板,在體外生物礦化[15-16]。前者的工藝過程中很難將無機微粒均質地分散于有機基質中,后者則更加體現了對天然骨組織中納米磷酸鈣在有機基質模板調控下的形態發生和有序組裝的仿生設計。國內外已開展了大量模板仿生的研究。本研究采用體外仿生礦化的方式在電紡PCL基膜上沉積磷灰石,著重考察其礦化特性,為后續研制電紡PCL多層復合GBR膜提供實驗基礎。
仿生礦化常采用體外溶液浸泡法,以研究類骨磷灰石的形成。目前認為,液相仿生礦化至少需兩個基本條件:其一是具有亞微米級的礦化成核生長點,即基質材料表面具有帶有一定量負電荷的功能基團,有利于順序吸附Ca2+和PO43-離子,為礦化物如磷灰石等的沉積提供成核位點,使礦化層與基質材料通過化學鍵相互結合;其二是具有過飽和鈣磷離子濃度的微環境。一般的體外模型有模擬體液,交替礦化液及SCS[8,17-18]等。相比而言,SCS法礦化更簡單、快捷、高效,本實驗即采用該方法對PCL電紡三維支架材料進行生物礦化研究。由于PCL類可降解高分子生物材料表面疏水性強,細胞親和性欠佳,表面缺乏誘導礦化的功能基團,如-PO4H2、-COOH、-OH、-CONH2、-NH2等,如何引入功能基團是對高分子材料仿生礦化的關鍵。在Kawashita等[19]的相關研究中,將羧甲基殼聚糖纖維預先處理,使材料表面暴露游離的羧基。在本實驗中,采用飽和Ca(OH)2溶液浸泡PCL電紡三維支架,進行預礦化處理,酯基在水解過程中易開環形成游離的羧基,Ca(OH)2電離生成的部分Ca2+與游離的羧基絡合;SCS中含有部分(PO4)3-,(PO4)3-取代羧基形成磷灰石晶核,并逐漸長大成磷灰石微細晶粒。飽和Ca(OH)2溶液預礦化處理,有助于PCL膜發生表面水解,提供更多的晶核形成位點促進了礦化結晶。本實驗中,游離羧基與Ca2+形成的絡合物是啟動礦化成核的決定性因素。
XRD實驗結果顯示,PCL+SCS培養12 h組僅出現PCL的特征峰,磷灰石特征峰基本未顯示,說明其結晶很差;PCL+SCS培養24 h組除PCL的特征峰外,在25.9°、31°位置出現了磷灰石特征峰,說明其結晶度優于PCL+SCS培養12 h組;PCL+SCS培養48 h組在25.9°、31°、33°位置出現了磷灰石特征峰,說明其結晶度優于PCL+SCS培養12 h及24 h組。隨著礦化時間延長,PCL峰值依次降低,而磷灰石特征峰依次增高,提示PCL膜表面覆蓋有更多的磷灰石晶體,磷灰石層的增厚增強了對PCL特征峰的吸收,強度下降。XRD分析結果與SEM觀察結果完全一致。FTIR結果提示:磷灰石中含有碳酸根,表明該磷灰石為與天然骨相似的類骨磷灰石。
PCL電紡膜的SEM觀察表明,隨著時間延長,礦化結晶逐漸長大,密集分布,最終覆蓋有機基體表面,其外形趨于穩定,成片狀規則結晶。LeGeros[20]在無蛋白溶液中合成磷酸鈣的研究表明,呈規則片狀晶體的水磷酸氫鈣是成骨和礦化過程的中間相,它在生理環境中能最終轉化為片狀類骨磷灰石。雖然SEM為磷灰石晶體形成提供了最直接的證據,但是根據晶體形貌判斷晶體結構是初步的,因此本實驗采用XRD、FTIR等其他方法進行進一步分析,證實其沉淀物為類骨磷灰石結構。
PCL電紡膜礦化前,其酯基為疏水基,呈現較強的疏水性,這對細胞的黏附與生長不利。經過礦化處理后形成的PCL/CAP復合膜,培養12 h組的樣品,由于磷灰石晶體的吸附沉積,材料表面接觸角明顯變小,說明其可濕性提高;培養48 h組的礦化樣品,液滴滴躺于其上很快直接鋪展浸潤,提示由于晶體增多,所以材料完全改性為親水表面,與其他研究[21]結果相符。改性后的親水表面不但利于蛋白質吸附,提高成骨細胞黏附性,還能改善材料的綜合降解性能。因此,采用礦化48 h組材料作體外細胞培養,結果顯示,成骨細胞在PCL/CAP材料表面展現黏附、鋪展的生長形貌,初步提示材料具有細胞相容性,可作為多層電紡GBR膜的骨缺損側內表層,為骨組織再生提供良好條件。
有研究[22]表明,在仿生礦化的材料表面,細胞相對增殖率明顯提高,表示其具有良好的生物相容性。在本實驗基礎上,本課題組將進一步在細胞增殖分化、生物學功能的有效表達及載藥抗菌等方面展開后續研究,設計研制更適合口腔頜面部骨組織缺損修復的電紡PCL/CAP多層復合GBR屏障材料。
[參考文獻]
[1] Bhardwaj N, Kundu SC. Electrospinning: a fascinating fiber fabrication technique[J]. Biotechnol Adv, 2010, 28(3):325-347.
[2] Liu W, Thomopoulos S, Xia Y. Electrospun nanofibers for regenerative medicine[J]. Adv Healthc Mater, 2012, 1(1): 10-25.
[3] 楊延慧, 嚴涵, 康曉梅. 聚己內酯的應用研究進展[J]. 化工新型材料, 2011, 39(12):13-15.
Yang YH, Yan H, Kang XM. Advances in application research of polycaprolactone[J]. New Chem Mater, 2011, 39 (12):13-15.
[4] 朱文超, 崔海坡, 郭丹一, 等. 形狀記憶聚合物特性及在生物醫學領域應用中的優勢[J]. 中國組織工程研究, 2014, 18(47):7677-7682.
Zhu WC, Cui HP, Guo DY, et al. Properties and biomedical applications of shape memory polymers[J]. Chin J Tissue Eng Res, 2014, 18(47):7677-7682.
[5] Costa PF, Vaquette C, Zhang Q, et al. Advanced tissue engineering scaffold design for regeneration of the complex hierarchical periodontal structure[J]. J Clin Periodontol, 2014, 41(3):283-294.
[6] Lin K, Wu C, Chang J. Advances in synthesis of calcium phosphate crystals with controlled size and shape[J]. Acta Biomater, 2014, 10(10):4071-4102.
[7] Binulal NS, Deepthy M, Selvamurugan N, et al. Role of nanofibrous poly(caprolactone) scaffolds in human mesenchymal stem cell attachment and spreading for in vitro bone tissue engineering—response to osteogenic regulators[J]. Tissue Eng Part A, 2010, 16(2):393-404.
[8] Li F, Feng QL, Cui FZ, et al. A simple biomimetic method for calcium phosphate coating[J]. Surf Coat Tech, 2002, 154(1):88-93.
[9] Llambés F, Silvestre FJ, Caffesse R. Vertical guided bone regeneration with bioabsorbable barriers[J]. J Periodontol, 2007, 78(10):2036-2042.
[10] 馬士卿, 張旭, 孫迎春, 等. 引導骨組織再生膜的研究進展[J]. 口腔醫學研究, 2016, 32(3):308-310.
Ma SQ, Zhang X, Sun YC, et al. Research progress of GBR membrane[J]. J Oral Sci Res, 2016, 32(3):308-310.
[11] Jaiswal A, Kadam S, Soni V. Fabrication of biocomposite membrane by electrospinning for guided bone regeneration [J]. Tissue Eng (Part A), 2011, 17(3/4):561-562.
[12] Bottino MC, Thomas V, Janowski GM. A novel spatially designed and functionally graded electrospun membrane for periodontal regeneration[J]. Acta Biomater, 2011, 7(1): 216-224.
[13] Sridhar R, Sundarrajan S, Venugopal JR, et al. Electrospun inorganic and polymer composite nanofibers for biomedical applications[J]. J Biomater Sci Polym Ed, 2013, 24(4):365-385.
[14] Zang JT, Qi X, Li SQ, et al. Fabrication of novel scaffolds containing collagen-Ⅰ/polylactic acid/nanohydroxyapatite via co-electrospinning methods[J]. Chem Res Chin Univ, 2010, 26(4):662-666.
[15] Patel PA, Eckart J, Advincula MC, et al. Rapid synthesis of polymer-silica hybrid nanofibers by biomimetic mineralization[J]. Polymer, 2009, 50:1214-1222.
[16] Chang W, Mu X, Zhu X, et al. Biomimetic composite scaffolds based mineralization of hydroxyapatite on electrospun calcium-containing poly(vinyl alcohol) nanofibers[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(7):4369-4376.
[17] Andric T, Wright LD, Freeman JW. Rapid mineralization of electrospun scaffolds for bone tissue engineering[J]. J Biomater Sci Polym Ed, 2011, 22(11):1535-1550.
[18] Yin YJ, Luo XY, Cui JF, et al. A study on biomineralization behavior of N-methylene phosphochitosan scaffolds [J]. Macromol Biosci, 2004, 4(10):971-977.
[19] Kawashita M, Nakao M, Minoda M, et al. Apatite-forming ability of carboxyl group-containing polymer gels in a simulated body fluid[J]. Biomaterials, 2003, 24(14):2477-2484.
[20] LeGeros RZ. Apatites in biological systems[J]. Prog Crystal Growth Charact, 1981, 4(1/2):1-45.
[21] Ito Y, Hasuda H, Kamitakahara M, et al. A composite of hydroxyapatite with electrospun biodegradable nanofibers as a tissue engineering material[J]. J Biosci Bioeng, 2005, 100(1):43-49.
[22] Ravichandran R, Venugopal JR, Sundarrajan S, et al. Precipitation of nanohydroxyapatite on PLLA/PBLG/Collagen nanofibrous structures for the differentiation of adipose derived stem cells to osteogenic lineage[J]. Biomaterials, 2012, 33(3):846-855.
(本文編輯 吳愛華)
Biomineralization of electrospun polycaprolactone-guided bone regeneration membrane
Deng Xia1, Bai Shi2. (1. Dept. of Stomatology, Nuclear of Industry 416 Hospital, Chengdu 610051, China; 2. Dept. of Implantology, College of Stomatology, Chongqing University of Medical Science, Chongqing 400015, China)
Objective To evaluate the biomineralization of the tissue-engineering electrospun polycaprolactone (PCL) scaffold and its potential use for guided bone regeneration (GBR) membranes. Methods PCL ultrafinefiber scaffolds were fabricated by electrospinning and then immersed in supersaturated calcification solution (SCS) for biomineralization investigation. The electrospun PCL scaffolds and the calcium phosphate coating were identified by scanning electron microscopy (SEM), X-ray diffraction (XRD), and Fourier transform infrared spectroscopy (FTIR). Water-contact angles were also measured to evaluate the hydrophilicity of the modified surface. The biocompatibility of the composite was investigated by culturing osteoblasts on the scaffolds. Cell behavior was observed by SEM. Results The electrospun PCL scaffold was composed of ultrafine fibers and well-interconnected pores. The deposits on the fibers grew in number and size as the biomineralization time increased. Then, the covering of the whole PCL film was identified as dicalcium phosphate dehydrate and apatite. Good cell attachment and proliferation behavior were observed on the membranes. Conclusion The quick apatite formation on the surface of the PCL electrospun scaffold indicated that SCS biomineralization may be an effective approach for obtaining PCL/calcium phosphate composites. The cellular biocompatibility of the composite scaffold was preliminarily confirmed by the in vitro culture of osteoblasts on the scaffold. As such, the composite scaffold is a promising biomimetic extracellular matrix biomaterial for bone tissue engineering and GBR membranes.
guided bone regeneration; electrospun; polycaprolactone; biomineralization; calcium phosphate
R 783.1
A
10.7518/hxkq.2016.06.004
2016-04-10;
2016-10-08
鄧霞,副主任醫師,博士, E-mail:xiad520@sina.com
白石,主治醫師,碩士,E-mail:2296059@qq.com

