水中高錳酸鹽指數測定的若干影響因素分析
顧曉明 陳 杰 朱廣杰 李 保
(1.長江委水文局長江口水環境監測中心,上海 200136; 2.太倉市江海水文勘測科技咨詢中心,江蘇 太倉 215440)
?
水中高錳酸鹽指數測定的若干影響因素分析
顧曉明1,2陳 杰2朱廣杰2李 保1
(1.長江委水文局長江口水環境監測中心,上海 200136; 2.太倉市江海水文勘測科技咨詢中心,江蘇 太倉 215440)
酸性高錳酸鉀法是水中高錳酸鹽指數測定的常用方法,由于在測定時影響因素多,致使結果的穩定性和準確性不易控制。通過對同一標準物質溶液在不同試驗條件下的對比試驗,分析各因素對實驗結果的影響。結果表明:反應酸度的高低、加熱時間的長短、水浴溫度的變化、高錳酸鉀標準溶液濃度的大小等都會對測定結果產生影響;其中,控制硫酸濃度為1∶3、加熱時間為30±1 min、水浴溫度98℃以上以及高錳酸鉀標準溶液濃度接近0.010 0 mol/L是取得準確結果的關鍵因素。
水質監測;指數測定;高錳酸鹽;測定方法;影響因素;相對誤差
1 研究背景
水中高錳酸鹽指數的測定是地表水、飲用水和生活污水水質監測分析中的一項常規項目,作為反映水體中有機及無機可氧化物質污染的重要指標,已經越來越受到關注和重視[1-3]。
在地表水的高錳酸鹽指數測定中,主要采用水和廢水監測分析方法(第四版)(GB11892-89)對高錳酸鹽指數進行測定[2],但現實往往樣品數量多,在批量測定時,受到反應酸度、加熱時間、水浴溫度等眾多因素的影響,測定結果的穩定性和準確性不易控制,需要反復試驗,因此消耗了大量時間和精力。結合實際工作和對比試驗,分析影響測定結果的因素,為準確測定高錳酸鹽指數,提高工作效率提供參考。
2 試驗部分
2.1 反應原理
水樣在酸性條件下,高錳酸鉀將其中的無機還原性物質氧化,剩余的高錳酸鉀用過量的草酸鈉還原,再以高錳酸鉀回滴剩余的草酸鈉,根據兩者的消耗量,計算相樣品中高錳酸鹽指數(以mg/L表示)[1-4]:
MnO4-+ 還原性物質+ H+Mn2++ CO2↑+H2O
(1)
2MnO4-+ 5C2O42-+ 16 H+2Mn2++ 10CO2↑+ 8 H2O
(2)
2.2 適用范圍
適用于未被污染或輕微污染、氯離子濃度低于300 mg/L的飲用水、水源水和地面水化學需氧量的測定,測定范圍為 0.05~5.0 mg/L[3]。
2.3 主要儀器
主要試驗儀器包括多孔恒溫水浴鍋、250 ml錐形瓶、25 ml棕色酸式滴定管、計時器、胖肚移液管、溫度計和洗耳球等。
2.4 主要試劑
硫酸(分析純),高錳酸鉀(優級純),草酸鈉(優級純);C(1/5KMnO4)=0.100 mol/L高錳酸鉀貯備液;C(1/2Na2C2O4)=0.100 mol/L草酸鈉貯備液;C(1/5KMnO4)=0.01 mol/L高錳酸鉀溶液;C(1/2Na2C2O4)=0.010 0 mol/L草酸鈉溶液;純化水(不含還原性物質)。
2.5 試驗方法與分析
2.5.1 反應酸度
根據高錳酸鹽指數的反應原理,反應體系中pH值的高低,能夠直接影響反應速率。現選取相同試驗條件,即GB11892-89高錳酸鹽指數的測定方法,取100 ml水樣、高錳酸鉀濃度為0.01 mol/L、100℃恒溫水浴、反應時間30 min,分別使用5 ml濃度為98%、1∶1、1∶2、1∶3、1∶4的硫酸溶液,影響結果見表1。
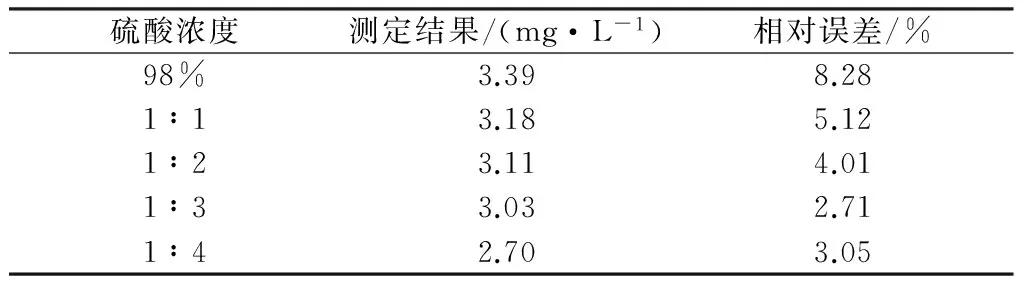
表1 不同硫酸濃度對測定結果的影響
從表1可以看出,在相同的反應條件下,降低反應溶液的pH值,會使測定結果偏大;提高反應溶液的pH值,使測定結果偏小。從化學平衡的角度來分析,當酸度增大時式(1)和式(2)會加速向右進行,反之則向左進行。相反,當酸度降低,氫離子濃度低,高錳酸鉀的氧化能力減弱,氧化不完全,導致測定結果偏小。
2.5.2 滴定時溶液溫度
在相同實驗條件下,即GB11892-89高錳酸鹽指數的測定方法,取100 ml水樣、高錳酸鉀濃度為0.01 mol/L、硫酸溶液(1+3)、100℃恒溫水浴、反應時間30 min;取出后對不同溫度的溶液滴定,影響結果見圖1。
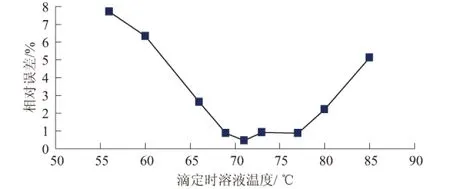
圖1 滴定時溶液溫度對測定結果的影響
從圖1可知,用高錳酸鉀滴定剩余草酸時,當溶液溫度控制在69℃~77℃左右進行滴定,此時測定結果的相對誤差可控制在1.0%以內。高錳酸鉀氧化草酸鈉的反應是個吸熱反應,在常溫下其反應速度非常慢,當溫度升高時反應速度明顯加快,但反應體系的溫度也不能太高。因為當溫度高于80℃時,草酸鈉會被分解:H2C2O4→CO2↑+CO↑+H2O 導致結果偏低;若溫度小于69℃,反應不完全導致結果偏大。
2.5.3 水浴溫度
選用標準使用液濃度為2.22±0.16 mg/L,在相同實驗條件下,即GB11892-89高錳酸鹽指數的測定方法,取100 ml水樣、高錳酸鉀濃度為0.01 mol/L、硫酸溶液(1+3)、反應時間30 min;水浴溫度分別為70℃,80℃,90℃,95℃,98℃和100℃,影響結果見圖2。
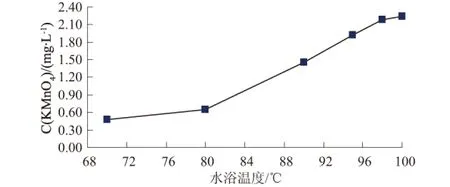
圖2 水浴溫度對測定結果的影響
從圖2可知,當水浴溫度控制在98℃以上時,測定結果最接近標準物質溶液的保證值濃度。根據阿倫尼烏斯公式(Arrhenius equation:dlnk/dT=Ea/RT2),其中,k為反應速度;T為絕對溫度;Ea為反應活化能;R為氣體常數。由此可看出,反應速率與溫度的關系,溫度越高反應速率越快,高錳酸鹽指數的測定是部分氧化反應,在固定的30min反應時間溫度越高,氧化率越高[5]。
2.5.4 起點溫度
在相同實驗條件下,即GB11892-89高錳酸鹽指數的測定方法,取100 ml水樣、高錳酸鉀濃度為0.01 mol/L、硫酸溶液(1+3)、反應時間30 min;放入水浴鍋時起點溫度分別為4℃,10℃,20℃,25℃,30℃和40℃,加溫至100℃;影響結果見表2。
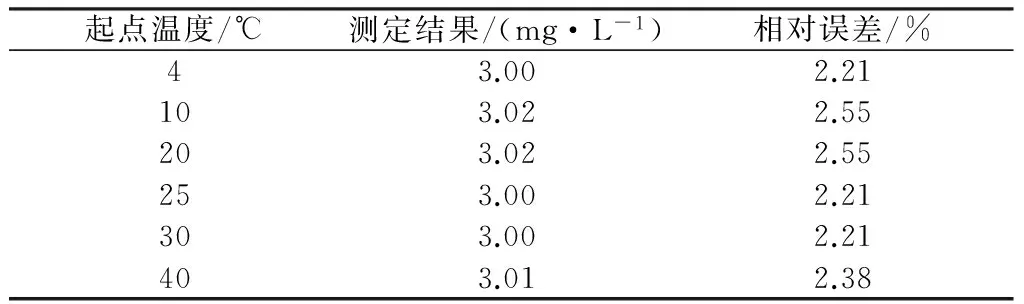
表2 不同起點溫度對測定結果的影響

2.5.5 水浴加熱時間
在相同實驗條件下,即GB11892-89高錳酸鹽指數的測定方法,取100ml水樣、高錳酸鉀濃度為0.01mol/L、硫酸溶液(1+3)、水浴溫度100℃;水浴加熱時間分別為27,28,29,30,31,32min和33min;影響結果見圖3。
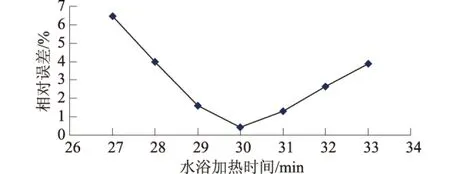
圖3 水浴加熱時間對測定結果的影響
從圖3可知,在實際水樣的測定過程中,高錳酸鹽指數測定準確性與加熱時間的長短有緊密聯系。當加熱時間在30±1 min時,相對誤差可控制在 2.0%以內,加熱30 min測定結果的準確性最高。反應時間越長,反應進行得越徹底,消耗的氧化劑也就越多[7],誤差偏大;反之加熱時間不足,亦使誤差偏大。因此,應嚴格控制加熱時間,才能有效保證測定結果的準確性。
2.5.6 高錳酸鉀標準溶液濃度
在相同試驗條件下,即GB11892-89高錳酸鹽指數的測定方法,取100ml水樣、硫酸溶液(1+3)、水浴溫度100℃、反應時間30 min;高錳酸鉀標準溶液濃度分別為: 0.012 1,0.011 3,0.010 2,0.010 0 mol/L和0.009 8 mol/L。影響結果見表3。
從表3可以看出,在相同的反應條件下,高錳酸鉀標準溶液濃度接近0.010 0 mol/L,此時相對誤差最小。根據化學平衡原理,當提高反應體系中反應物的濃度時,會使化學反應的平衡向生成物方向移動,因此當提高高錳酸鉀溶液的濃度時會增強的氧化性,使實際的測量結果出現正偏差[7]。
2.6 試驗操作技巧建議
2.6.1 與以上分析因素相關的操作技巧建議
(1) 高錳酸鉀溶液在C(1/5KMnO4)=0.01 mol/L 現配現用,以當天配制時校正的濃度為準。草酸鈉溶液C (1/2Na2C2O4)=0.010 0 mol/L 在常溫一周內使用,貯備液在4℃保存。
(2) 試劑加入測定的水樣后,應盡快置于沸水浴中,否則可能會影響測定結果。
(3) 測定中,沸水浴液面要高于錐形瓶內反應液的液面,保證其反應溫度,沸水浴加熱時間應從水浴重新沸騰起開始計時。
(4) 當批量測定水樣時,彼此之間要相隔一定的時間放入水浴鍋內,不能同時放入,以免在滴定時發生時間上的沖突而致使反應條件的改變,對測定結果產生影響。
2.6.2 其他操作技巧建議
(1) 移取10 ml高錳酸鉀溶液和10 ml草酸鈉溶液時用胖肚移液管準確移取。
(2) 在進行滴定時,錐形瓶下須用白色背景才能更好地辨認微紅色,反之滴定終點顏色的判斷易造成偏差。
(3) 滴定過程中,按規定要求滴定,速度應遵循“成滴不成線”的原則,即滴定過程中溶液應呈珠串狀往下滴,而不宜呈直線狀,直到溶液出現穩定的微紅色為止(30 s內不褪色)。
(4) 在進行滴定時,溶液溫度在80℃左右反應速度最快,70℃以下時反應速度慢,滴定時間長。
(5) 水中氯離子的存在對酸性高錳酸鹽測定值的影響十分明顯,氯離子對CODMn測定值的干擾很大[8],所以當水中氯離子濃度超出所規定范圍時,不適用酸性高錳酸鉀測定法。
3 結 語
由此可見,高錳酸鹽指數是一個相對的條件性指標,在分析過程中受反應體系酸度、高錳酸鉀標準溶液濃度、加熱時間、反應體系溫度等多個因素的影響。上文僅分析了常見的和影響較大的幾個因素。事實上只有充分理解測定標準中的每項規定,嚴格按標準測定,才能有效提高結果的穩定性和準確性。
[1] 王秀英.淺析影響高錳酸鹽指數測定的若干因素[J].福建分析測試,2009,18(2):92-94.
[2] 國家環境保護總局.水和廢水監測分析方法(第四版)[M].北京:中國環境科學出版社,2002.
[3] 中國標準出版社第二編輯室.水質分析方法國家標準匯編[M].北京:中國標準出版杜,1996.
[4] 田東紅.高錳酸鹽指數(酸性法)的條件性[J].北方環境,2010,1(2):94-95.
[5] 張少軍,陳冬毅.探討水中高錳酸鹽指數的測定因素[J]. 城鎮供水,2007(4):54-56.
[6] 周遺品,趙永金,張延金.Arrhenius公式與活化能[J].石河子大學學報,1995(4):76-80.
[7] 霍麗麗,孫志國. 高錳酸鹽指數測定的主要影響因素分析[J]. 遼寧師專學報, 2010,12(2):100-101.
[8] 陳紅英,張林廠.氯離子質量濃度與高錳酸鹽指數的相關關系[J].浙江工業大學學報,2011,39(4):411-414.
(編輯:李 慧)
2016-09-15
顧曉明,男,長江委水文局長江口水環境監測中心,助理工程師.
1006-0081(2016)11-0068-03
X832
A

