直接貼壁法體外分離培養大鼠骨髓內皮祖細胞
方 曉,王康康,高維陸,張 輝,尹宗生
?
直接貼壁法體外分離培養大鼠骨髓內皮祖細胞
方 曉,王康康,高維陸,張 輝,尹宗生
取90 g SPF級SD大鼠的雙后肢骨髓,分別使用直接貼壁法和密度梯度離心法獲得大鼠骨髓單個核細胞,用內皮培養體系EGM-2培養基進行定向誘導分化7~14 d獲得大鼠內皮祖細胞。免疫熒光染色和細胞功能學鑒定內皮祖細胞,觀察內皮祖細胞出現的時間和數量,CCK-8法鑒定細胞的增殖能力。與密度梯度離心法相比,直接貼壁法在內皮祖細胞出現的時間、數量和增殖能力差異有統計學意義(P<0.01)。因此,相對于密度梯度離心法,直接貼壁法培養出的內皮祖細胞分化時間更短、數量更多且增殖能力更強。
內皮祖細胞;骨髓;直接貼壁法;密度梯度離心法
Asahara et al[1]于1997年首次成功從人外周血中分離出內皮祖細胞,并指出這種細胞是血管生成的前體細胞,參與出生后血管生成,此后對內皮祖細胞的研究不斷深入。內皮祖細胞作為內皮細胞的前體細胞,有向缺血區定向歸巢并分化為成熟內皮細胞、遲發的高增殖潛能等特性,在維持血管內皮完整性、修復受損血管內皮細胞、促進新生血管形成及組織修復等方面起重要作用[2]。內皮祖細胞對心腦血管疾病[3]、外周血管疾病[4]及中樞神經系統損傷[5]等的治療有重要意義,并為缺血性疾病的治療提供了新思路。因此,內皮祖細胞的生物學特性在臨床疾病上的應用成為了醫學界研究的熱點。內皮祖細胞主要存在于骨髓中,由骨髓中單個核細胞分化而來,傳統的培養方法是使用密度梯度離心法,該研究主要使用直接貼壁法分離培養獲得目的細胞,并與密度梯度離心法進行多方面的比較。
1 材料與方法
1.1 材料 90 g健康SD大鼠,雄性,SPF級,由安徽醫科大學實驗動物中心提供;EGM-2完全培養基購自瑞士LONZA公司;大鼠淋巴細胞分離液購自天津灝洋科技有限公司;鼠纖維聯接蛋白(rat fibronectin,FN )購自瑞士Gene Operation公司;CD133抗體購自美國 Biorbyt公司;DiI標記的乙酰化低密度脂蛋白(Dil-ac-LDL)購自美國 Invitrogen公司;異硫氰酸熒光素荊豆凝集素-1(FITC-UEA-1)購自美國Sigma公司;TRITC-羊抗兔IgG和FITC-羊抗小鼠IgG均購自北京中杉金橋生物技術有限公司。
1.2 方法
1.2.1 大鼠骨髓源性內皮祖細胞的分離、培養 SD大鼠用10%水合氯醛腹腔麻醉后采用頸椎脫臼法處死,75%酒精浸泡消毒5~10 min,將處死后的大鼠置入無菌彎盤中,超凈臺內嚴格行無菌操作原則,組織剪剪開大鼠雙后肢皮膚,分離肌肉組織,暴露并離斷股骨、脛骨,去除骨四周附著的軟組織,注意盡可能多保留骨髓含量最豐富的兩側干骺端。用注射器抽吸10 ml PBS緩沖液反復沖洗骨髓腔,骨髓沖洗液不銹鋼濾網過濾,移液管吹打,得到均勻的骨髓懸液。將所得骨髓懸液分成兩份,一份加入紅細胞裂解液后離心重懸制成1×106/ml的細胞懸液,接種到提前鋪有FN的6孔板中;另一部分按照淋巴細胞分離液說明書使用密度梯度離心法獲得單核細胞并制成1×106/ml的細胞懸液,接種到鋪有FN的6孔板中。每孔加入含EGM-2培養基,置于37 ℃、5% CO2的恒溫培養箱中進行培養。接種48 h后首次換液,棄未貼壁細胞,加入新鮮培養基后繼續培養,每隔2~3 d換液,加入新鮮培養基,在倒置顯微鏡下動態觀察培養過程中細胞形態的變化;接種10~20 d,待原代細胞逐漸融合至80%,按1 ∶2或1 ∶3比例進行細胞傳代。
1.2.2 大鼠骨髓源性內皮祖細胞的鑒定
1.2.2.1 形態學鑒定 首次換液后,每日在倒置顯微鏡下觀察細胞形態并拍照記錄。待每孔細胞形態變為梭形、分化成內皮祖細胞時,用細胞計數板統計每孔細胞數量。
1.2.2.2 免疫熒光鑒定 取第三代分離培養的細胞進行免疫熒光法鑒定Flk-1和CD133的表達。將第三代分離培養的細胞制成細胞懸液,以1×106/ml的細胞濃度接種于已行FN包被的24孔培養板中,37 ℃、5% CO2細胞培養箱中約24 h,使內皮祖細胞貼壁良好,完成爬片。用4%多聚甲醛固定30 min,PBS沖洗3次,0.2% Triton X-100作用10 min后,PBS洗3次,加入羊血清室溫封閉30 min,傾去羊血清,PBS沖洗3次,加入兔抗大鼠Flk-1抗體(1 ∶50)和小鼠抗大鼠CD133抗體(1 ∶50),4 ℃孵育過夜,PBS沖洗3次,空白對照用PBS代替一抗。加入TITC標記的山羊抗兔抗體和FITC標記的山羊抗小鼠抗體,避光室溫放置2 h,PBS洗3次。每孔加入DAPI 100 μl,避光室溫放置5 min,PBS洗3次,在載玻片上滴加抗熒光淬滅液封片后熒光顯微鏡下觀察。
1.2.2.3 細胞功能學鑒定 同以上方法獲得貼壁的內皮祖細胞,每孔加入DiI-ac-LDL濃度為10 μg/ml的EGM-2完全培養基500 μl,37 ℃避光孵育4 h后棄培養液,PBS洗3次,用4%多聚甲醛固定30 min,PBS洗3次,每孔中加入FITC-UEA-1,37 ℃避光孵育1 h后棄去多余染料,PBS洗3次。每孔加入DAPI 100 μl,避光室溫放置5 min,PBS洗3次,在載玻片上滴加抗熒光淬滅液封片后熒光顯微鏡下觀察。
1.2.3 內皮祖細胞增殖能力的鑒定 自首次換液后,每日倒置顯微鏡下觀察細胞生長情況。記錄出現梭形細胞的時間和細胞鋪滿瓶底的時間。分別取生長狀態良好的第3代細胞胰酶消化后制作成單細胞懸液,以1×105/ml的密度接種在5個96孔培養板中,每孔100 μl。從第2天開始,每24 h隨機取一塊板,每孔加入CCK-8試劑10 μl,于37 ℃、5% CO2細胞培養箱中孵育2 h后置酶標儀上空白孔調零,選擇490 nm波長下測各孔光密度(opticaldensity,OD)值,連續測5 d,以時間為橫軸,OD值為縱軸繪制細胞生長曲線。
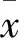
2 結果
2.1 細胞形態學觀察 剛分離獲得的細胞為圓形(圖1A),體積較小,懸浮于培養液中。培養48 h后,棄去未貼壁細胞,直接貼壁組鏡下可見貼壁細胞呈梭形或多角形(圖1B,箭頭所指為梭形細胞),核呈橢圓形, 部分細胞形成集落,也有部分長梭形細胞首尾相連排列成直線狀。梯度密度離心組鏡下見大量小而圓的貼壁細胞,未見明顯梭形或多角形細胞,直至培養96 h后見貼壁的梭形或多邊形細胞。直接貼壁法首次出現梭型形態細胞的時間為(49±1.55)h,而密度梯度離心法首次出現梭型形態細胞的時間為(95.5±2.26) h,兩者相比差異有統計學意義(t=41.59,P<0.01)。培養1周后,直接貼壁組細胞匯合度約80%(圖1D),密度梯度離心組細胞匯合度小于50%(圖1C)。待貼壁細胞完全分化成內皮祖細胞時,直接貼壁組細胞數量為(82.17±1.48)×104個每孔,密度梯度離心組細胞數量為(62.08±0.92)×104個每孔,兩者相比差異有統計學意義(t=28.25,P<0.01)。

圖1 內皮祖細胞生長情況 ×200
A:剛分離獲得的單核細胞;B:48 h已開始分化的內皮祖細胞;C:7 d密度離心組內皮祖細胞;D:7 d直接貼壁組內皮祖細胞
2.2 內皮祖細胞的細胞表型鑒定 將獲得細胞誘導培養后行免疫熒光染色,直接貼壁法和密度梯度離心法獲得的細胞染色皆為Flk-1和CD133雙陽性,紅色為Flk-1陽性,綠色為CD133陽性,藍色為DAPI對核的染色(圖2),符合內皮祖細胞的免疫熒光鑒定。
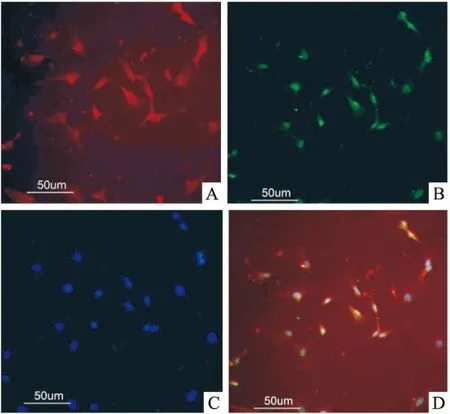
圖2 內皮祖細胞免疫熒光鑒定結果 ×200
2.3 細胞功能學鑒定 將獲得細胞誘導培養后行Dil-ac-LDL及FITC-UEA-1熒光檢測,倒置熒光顯微鏡下觀察經過兩種不同方法獲得的細胞攝取Dil-ac-LDL在565 nm波長激發光激發時呈現紅色熒光,而其結合FITC-UEA-1在525 nm波長激發光激發時呈現綠色熒光,藍色為DAPI對細胞核的染色(圖3),雙熒光標記的細胞被認為是可以分化為內皮細胞的前體細胞。
2.4 細胞增殖能力鑒定 在原代培養中,直接貼壁組在首次48 h換液即可見梭形或多角形形態的細胞,密度梯度離心組在96 h才開始出現梭形形態細胞。根據CCK-8法所繪制的生長曲線顯示,直接貼壁組OD值為0.251±0.067,密度梯度離心組OD值為0.225±0.049,細胞原代培養后兩組細胞增殖能力比較差異有統計學意義(t=3.37,P<0.05),見圖4。
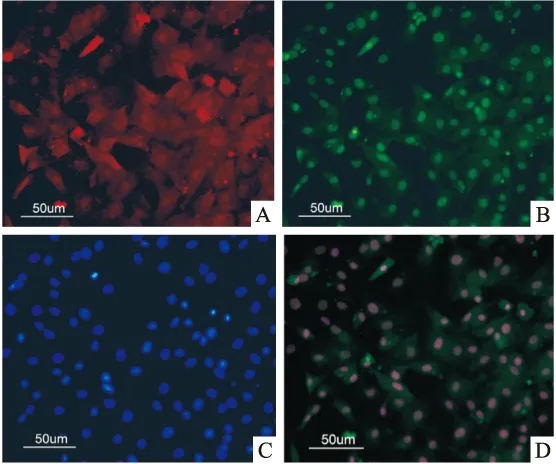
圖3 細胞功能學鑒定 ×200
A:攝取Dil-ac-LDL的細胞;B:結合FITC-UEA-1;C:DAPI標記的細胞核;D:合成圖像
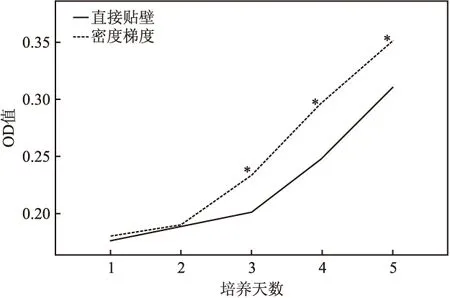
圖4 CCK8法檢測內皮祖細胞增殖能力
3 討論
分離獲得內皮祖細胞可以有很多來源部位,成人外周血、臍血、脾臟及骨髓等組織中均存在內皮祖細胞,其中,骨髓中內皮祖細胞數量最多[6],大約是外周血中的內皮祖細胞數量的500倍。由于目前內皮祖細胞表面缺乏特異性表面標志物,學術界對內皮祖細胞的鑒定有較大爭議,但是大多數人認為Flk-1和CD133雙陽性和吞噬Dil-ac-LDL及結合FITC-UEA-1實驗雙陽性的細胞可以被認為是內皮祖細胞[7],本實驗采用該方法來鑒定內皮祖細胞。
目前,在體外分離內皮祖細胞的方法有很多種,主要有密度梯度離心法和免疫磁珠分選法[8]。免疫磁珠分選法主要采用CD34或CD133抗體,此方法最大的優點是可以收集到純度較高的內皮祖細胞[9]。但是目前內皮祖細胞缺乏特異性的表面標志物,同時免疫磁珠分選法要求實驗條件較高、操作復雜、價格昂貴、獲得細胞量少,因此難以推廣。然而密度梯度離心法相對于免疫磁珠分選法操作簡單,使用方便[10],但可能獲得的細胞純度低,只能將骨髓中整個單核細胞(包括內皮祖細胞)分離出來,并包括部分血小板、成纖維細胞等。雖然密度梯度離心法操作相對簡單,但是在操作過程中需要對細胞進行反復離心,對細胞損傷較大。相對于其他原代細胞,內皮祖細胞非常脆弱,在后期誘導培養過程中貼壁分化需要較長時間、增殖緩慢,這些可能和在提取過程中反復離心有很大關系。因此先使用紅細胞裂解液去除骨髓中的大量紅細胞,然后將獲得的標本直接接種在6孔板里進行誘導培養,通過多次的傳代純化得到純度較高的內皮祖細胞。通過免疫熒光鑒定和細胞功能學檢測,由此兩種方法獲得的細胞皆是內皮祖細胞。并且直接貼壁法實驗操作更加簡單,獲得的細胞增殖能力更強,可以為后期實驗方便快捷的提供更多優質的內皮祖細胞。
[1] Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science,1997,275(5302):964-7.
[2] Friedrich E B,Walenta K,Scharlau J,et al.CD34-/CD133+/VEGFR-2+endothelial progenitor cell subpopulation with potent vasoregenerative capacities[J].Circ Res,2006,98(3):e20-5.
[3] Aragona C O,Imbalzano E,Mamone F,et al.Endothelial progenitor cells for diagnosis and prognosis in cardiovascular disease[J]. Stem Cells Int,2016,2016:8043792.
[4] Wang S, Chen Z, Tang X, et al. Transplantation of vascular endothelial growth factor 165-transfected endothelial progenitor cells for the treatment of limb ischemia[J]. Mol Med Rep,2015,12(4):4967-74.
[5] Bai Y Y, Peng X G, Wang L S, et al. Bone marrow endothelial progenitorcell transplantation after ischemic stroke:an investigation into its possible mechanism[J]. CNS Neurosci Ther, 2015,21(11):877-86.
[6] 張 碩, 杜怡斌, 杜公文, 等. 骨髓源性EPCs對脊髓源性NSCs增殖分化的影響[J].安徽醫科大學學報,2015,50(1):20-4.
[7] Peichev M, Naiyer A J, Pereira D, et al. Expression of VEGFR-2 and AC133 by circulating human CD34(+) cells identifies a population of functional endothelial precursors[J]. Blood, 2000,95(3):952-8.
[8] Tepper O M, Capla J M, Galiano R D, et al. Adult vasculogenesis occurs through in situ recruitment, proliferation, and tubulization of circulating bone marrow-derived cells[J]. Blood, 2005,105(3):1068-77.
[9] Wang S,Chen Z,Tang X,et al.Transplantation of vascular endothelial growth factor 165-transfected endothelial progenitor cells for the treatment of limb ischemia[J]. Mol Med Rep,2015,12(4):4967-74.
[10]王 麗, 張會峰, 袁慧娟, 等.大鼠骨髓內皮祖細胞的分離培養與鑒定[J].中國組織工程研究,2012,16(10):1733-6.
Isolation and culture of endothelial progenitor cell by direct adherent methodinvitro
Fang Xiao, Wang Kangkang, Gao Weilu,et al
(DeptofOrthopaedics,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022)
The bone marrow taken from both hindlimbs of SD rats was divided into two parts, mononuclear cell was obtained by direct adherent method and density gradient centrifugation, respectively. Endothelial progenitor cell(EPC) was induced to differentiate from mononuclear cell when cultured 7 to 14 days in EGM-2. EPC was identified by immunofluorescence staining and experimental study of cell function; number of EPC and the time of EPC appeared were recorded; proliferation ability was examined by CCK-8 method. The time when EPC first emerged, number of EPC, and proliferation ability in direct adherent group were significantly than those in density gradient centrifugation group. Therefore, compared with density gradient centrifugation, the cell isolated by direct adherent method could get more cells, need less time to differentiate into EPC and have bigger proliferation potential.
endothelial progenitor cell;bone marrow;direct adherent method;density gradient centrifugation
國家自然科學基金(編號:81171173)
安徽醫科大學第一附屬醫院骨關節與骨腫瘤科,合肥 230022
方 曉,男,碩士研究生; 尹宗生,男,教授,主任醫師,博士生導師,責任作者,E-mail:yinzongsheng1961@sina.com
時間:2016-10-12 13:23:00
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.034.html
R 394.26
A
1000-1492(2016)11-1696-04
10.19405/j.cnki.issn1000-1492.2016.11.034
2016-06-27接收

