氯化鋰抑制丙泊酚誘導原代培養神經元凋亡
李建立,朱喜春,崔紅賞,劉 銳
?
氯化鋰抑制丙泊酚誘導原代培養神經元凋亡
李建立1,朱喜春1,崔紅賞2,劉 銳3
目的 探討氯化鋰對丙泊酚誘導原代培養皮層神經元凋亡的影響及機制。方法 體外原代培養7 d的大鼠皮層神經元,用MTT法檢測不同濃度氯化鋰(0.1、1、5、10 μmol/L)單獨作用皮層神經元12 h后神經元存活率的變化。神經元隨機分為6組:溶劑對照組(給予等容積的20%脂肪乳),丙泊酚組(終濃度為500 μmol/L),氯化鋰+丙泊酚組(氯化鋰終濃度分別為0.1、1、5、10 μmol/L,丙泊酚終濃度為500 μmol/L),藥物處理12 h后,MTT法檢測神經元存活率的變化,Hoechst33258核染色法和流式細胞儀檢測神經元調亡,Western blot法測定神經元磷酸化糖原合成酶激酶-3β(pGSK-3β)和裂解半胱天冬酶-3(cleaved-Caspase-3)蛋白水平。結果 與溶劑對照組比較,不同濃度氯化鋰單獨作用神經元12 h后,神經元存活率未見顯著變化。與溶劑對照組比較,丙泊酚組神經元存活率顯著下降(P<0.01),神經元凋亡率顯著增加(P<0.01),pGSK-3β蛋白水平顯著下降(P<0.01), cleaved-Caspase-3蛋白水平顯著增加(P<0.01)。與丙泊酚組比較,氯化鋰可劑量依賴性增加神經元存活率(P<0.01),神經元凋亡率顯著下降(P<0.01),pGSK-3β蛋白水平顯著增加(P<0.01), cleaved-Caspase-3蛋白水平顯著下降(P<0.01)。結論 氯化鋰可抑制丙泊酚誘導的原代培養皮層神經元凋亡,其機制可能與提高神經元pGSK-3β蛋白水平和降低cleaved-Caspase-3蛋白水平有關。
丙泊酚;氯化鋰;神經凋亡;原代培養皮層神經元;pGSK-3β;cleaved-Caspase-3
研究[1-2]表明出生7 d SD大鼠連續大劑量應用丙泊酚可引起大腦多個腦區神經細胞的凋亡,并引起大鼠成年后的學習記憶功能損傷。體外原代培養細胞實驗也表明丙泊酚可誘導神經元凋亡[3-4]。氯化鋰作為精神科的常用藥物,在臨床上被廣泛用于治療雙向情感障礙[5]。近年來研究[6-7]表明鋰劑可用于治療中樞神經系統損傷和老年退行性疾病,如阿爾茨海默病等。以往有研究[8]表明氯化鋰可對抗麻醉藥氯胺酮和丙泊酚所引起的發育期大鼠大腦神經細胞損傷,但具體機制目前還不清楚,該研究利用原代培養皮層神經元,探討氯化鋰對丙泊酚誘導皮層神經元凋亡的影響及其可能機制。
1 材料與方法
1.1 材料 丙泊酚(propofol,意大利AstraZeneca公司,批號:KW814);20%脂肪乳(廣州百特公司);Neurobasal培養液、B27促生長劑、DMEM培養液、胎牛血清(美國Gibco公司); DMSO、MTT、17β雌二醇(美國Sigma公司); 胰蛋白酶和Hoechst33258染料(北京索來寶公司); Annexin V-FITC 試劑盒(浙江聯科生物技術有限公司);磷酸化糖原合成酶激酶-3β(phospho glycogen synthase kinase-3β,pGSK-3β)和裂解半胱天冬酶-3(cleaved-cysteine protease protein-3,cleaved-Caspase-3)(美國Cell signal Technology公司)。
1.2 皮層神經元原代培養 新生1 d 內的SD幼鼠取額葉皮質,用冷PBS液沖洗,去除腦膜和血管后放入DMEM培養基中剪碎,然后放入37 ℃水浴鍋內將皮層組織充分消化(0.125%胰蛋白酶)15 min,然后將皮層組織移入DMEM培養基中(含10%胎牛血清)終止胰蛋白酶的作用,然后把細胞轉移到含DMEM培養基中(含10%胎牛血清)輕輕吹打制成細胞懸液。用100目鋼絲篩將細胞懸液過濾,計數后接種于多聚賴氨酸包被的培養板中,放于5% CO2培養箱37 ℃恒溫培養24 h后,將培養液換成Neurobasal+B27培養基繼續培養,每隔2 d半量換液1次。神經元體外培養至7 d用于實驗。
1.3 實驗分組 觀察不同濃度氯化鋰對皮層神經元存活率的影響,分為4組:溶劑對照組,氯化鋰處理組(終濃度分別為0.1、1、5、10 μmol/L)。 觀察氯化鋰對丙泊酚引起皮層神經元損傷的影響時,分為6組:溶劑對照組(給予等容積的20%脂肪乳),丙泊酚組(終濃度為500 μmol/L),氯化鋰+丙泊酚不同濃度組(丙泊酚終濃度為500 μmol/L,氯化鋰終濃度分別為0.1、1、5、10 μmol/L)。
1.4 MTT法檢測神經元存活率 按不同分組將神經元給予藥物處理12 h,每組設6個復孔。然后每孔加入10 μl MTT液,放入37 ℃恒溫培養箱中繼續孵育4 h,加入DMSO 200 μl/孔,震蕩5 min溶解甲臜,酶標儀測定570 nm處的吸光度值。以對照組平均吸光度值為100%,以各處理組吸光度值與對照組的比值計算細胞存活率。
1.5 Hoechst33258核染色法測定神經元凋亡 體外培養7 d的神經元,按分組分別給予不同藥物處理12 h后,顯微鏡下觀察神經元成長情況。然后移去培養液,用冷PBS沖洗神經元去除雜質和死細胞, 每孔加入4%多聚甲醛200 μl將細胞固定30 min,去除多聚甲醛后,用冷PBS沖洗1次,然后每孔加入Hoechst33258染液1 ml處理神經元8 min后,冷PBS漂洗。在熒光顯微鏡(日本奧林巴斯,型號B×41)下隨機選取5個視野進行計數,計算神經元的凋亡率,凋亡率(%)=(凋亡細胞數/細胞總數)×100%。
1.6 流式細胞儀檢測神經元凋亡 體外培養至7 d給予不同干預措施處理神經元12 h后,移去培養液,冷PBS液沖洗神經元3次,加入0.125%胰酶,邊消化邊鏡下觀察,當細胞突起回縮,胞體變圓時立即加入培養基終止消化。然后輕輕吹打混勻用PBS重懸細胞并計數使每管細胞數目不少于1× 109/ml,然后轉移到離心管中,1 000 r/min離心5 min,去除上清液,收集細胞。PBS液沖洗細胞2次,1 000 r/min離心5 min,去除上清液, 暗室中加入195 μl Annexin V-FITC結合液輕輕重懸細胞,然后加入10 μl PI染色液,輕輕混勻,各組設3個復孔。用美國BD公司流式細胞儀上機檢測各處理組神經元的凋亡率。
1.7 Western blot法測定神經元pGSK-3β和cleaved-Caspase-3蛋白水平 體外培養至7 d給予不同干預措施處理神經元12 h后,用0.25%胰酶將細胞消化收集后裂解,BCA法測定總蛋白含量。將蛋白加上樣緩沖液煮沸變性,以10% SDS二聚丙烯酰胺凝膠電泳1.5 h分離, 經過2 h將蛋白轉至PVDF膜,室溫下封閉1 h分別加入一抗pGSK-3β和cleaved-Caspase-3抗體(1 ∶2 000稀釋), 4 ℃孵育過夜, 常規洗滌,加入二抗(1 ∶5 000)37 ℃孵育60 min,洗滌,電化學法發光顯色,X線片曝光。用凝膠圖像處理系統分析目標條帶與內參照條帶吸光度的比值。實驗重復3次, 設β-actin蛋白為內參。
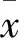
2 結果
2.1 不同濃度氯化鋰對皮層神經元存活率的影響 與溶劑對照組(99.8±6.3)%比較,不同濃度氯化鋰(0.1、1、5、10 μmol/L)單獨作用皮層神經元12 h后,神經元存活率分別為(98.8±4.9)%、(99.1±5.2)%、(98.6±6.7)%、(99.2±7.2)%,未見顯著性變化(F=2.125,P>0.05)。
2.2 氯化鋰對丙泊酚誘導皮層神經元損傷的影響 與溶劑對照組(99.9±7.9)%比較,丙泊酚組神經元存活率(57.3±4.5)%顯著下降(P<0.01)。不同濃度氯化鋰(0.1、1、5、10 μmol/L)處理后,神經元存活率分別為(60.2±4.6)%、(70.3±6.1)%、(79.3±6.2)%、(85.7±6.7)%,與丙泊酚組比較,1、5、10 μmol/L氯化鋰處理組均顯著增加(F=65.095,P<0.01),其中10 μmol/L氯化鋰保護作用最好。
2.3 氯化鋰對丙泊酚誘導皮層神經元凋亡的影響 Hoechst33258核染色法檢測神經元凋亡,結果顯示:與溶劑對照組比較,丙泊酚組神經元凋亡率顯著增加(P<0.01)。與丙泊酚組比較,氯化鋰+丙泊酚組神經元凋亡率顯著下降(F=34.636,P<0.01)。見圖1。流式細胞術檢測結果進一步證實了氯化鋰抑制丙泊酚誘導皮層神經元凋亡。見圖2。

圖1 Hoechst33258核染色法檢測氯化鋰對丙泊酚誘導皮層神經元凋亡的影響±s) ×400
A:溶劑對照組;B:丙泊酚組;C:氯化鋰+丙泊酚組;與溶劑對照組比較:**P<0.01;與丙泊酚組比較:##P<0.01
2.4 不同處理對皮層神經元pGSK-3β蛋白水平的影響 與溶劑對照組比較,丙泊酚組神經元pGSK-3β蛋白水平顯著降低(P<0.01)。與丙泊酚組比較,氯化鋰+丙泊酚組神經元pGSK-3β蛋白水平顯著增加(F=98.546,P<0.01)。見圖3。
2.5 不同處理對皮層神經元cleaved-Caspase-3蛋白水平的影響 與溶劑對照組比較,丙泊酚組神經元cleaved-Caspase-3蛋白水平顯著增加(P<0.01)。與丙泊酚組比較,氯化鋰+丙泊酚組神經元cleaved-Caspase-3蛋白水平顯著下降(F=76.329,P<0.01)。見圖4。


A:溶劑對照組;B:丙泊酚組;C:氯化鋰+丙泊酚組

圖3 不同處理對皮層神經元pGSK-3β蛋白水平的影響
與溶劑對照組比較:**P<0.01;與丙泊酚組比較:##P<0.01
3 討論
丙泊酚是否適用于新生兒和嬰幼兒的全身麻醉,目前觀點不一。研究[1-4]表明丙泊酚具有發育期神經毒性,大劑量長時間應用可對發育期動物大腦廣泛腦區神經細胞和原代培養神經元產生凋亡樣損傷,因此丙泊酚對嬰幼兒大腦產生損傷的機制以及尋找藥物防治其損傷引起了學者的廣泛關注。

圖4 不同處理對皮層神經元cleaved-Caspase-3蛋白水平的影響
與溶劑對照組比較:**P<0.01;與丙泊酚組比較:##P<0.01
動物試驗研究[8]表明氯化鋰可抑制丙泊酚引起的發育期大鼠大腦神經細胞凋亡,但作用機制還不十分清楚。為進一步研究氯化鋰抑制丙泊酚引起的發育期大腦損傷的機制,本實驗應用原代培養皮層神經元,顯示氯化鋰可通過提高神經元pGSK-3β蛋白水平和降低cleaved-Caspase-3蛋白水平進而抑制丙泊酚誘導原代培養皮層神經元凋亡。
研究[9-11]表明以GSK-3β為中心的信號通路在麻醉藥誘導發育期大腦神經損傷中發揮著重要作用。GSK-3β在大腦分布廣泛,主要定位于神經元樣細胞,是細胞內多種信號轉導通路的重要組成部分,其活化與神經元的凋亡直接相關。在中樞神經系統中,GSK-3β通過激活轉錄調節細胞的增殖、分化、存活與凋亡,參與神經系統的多種病理生理過程,GSK-3β活性異常會引起下游信號通路的異常,進而引起許多中樞神經系統疾病的發生[12]。以往研究[11]顯示丙泊酚可降低發育期大鼠大腦pGSK-3β蛋白的表達水平,進而引起大鼠大腦廣泛腦區神經細胞的凋亡。細胞凋亡是麻醉藥引起發育期大腦神經損傷的主要機制之一。凋亡受凋亡調節基因的控制,Bcl-2是調控凋亡的主要基因,可抑制凋亡過程中起重要作用的因子如Caspase-3和Caspase-9的活化。Caspase-3是凋亡發生的最終執行者,是凋亡蛋白級聯反應的必經之路,隨著Caspase-3蛋白的活化,細胞將發生不可逆性凋亡。GSK-3β誘導Caspase-3活化可能是引起凋亡的重要機制。本研究結果表明丙泊酚作用皮層神經元12 h,降低了神經元GSK-3β Ser9 位點的磷酸化水平,引起神經元pGSK-3β蛋白水平的顯著性下降,同時使cleaved-Caspase-3蛋白表達水平顯著性增加,提示丙泊酚誘導皮層神經元凋亡可能與pGSK-3β蛋白水平下降和cleaved-Caspase-3蛋白水平增加有關。
與促凋亡作用相反,抑制GSK-3β活性提高pGSK-3β蛋白表達水平產生抗凋亡作用,對細胞存活發揮著重要作用。氯化鋰作為一種GSK-3β活性抑制劑,具有廣泛的生物學效應,在精神障礙性疾病的治療中發揮著重要作用。近年來氯化鋰的神經保護作用受到廣泛重視。研究[13]表明氯化鋰通過抑制神經細胞凋亡發揮神經保護作用,可治療腦缺血和慢性神經退行性病變。另有研究[14]表明氯化鋰可抑制新生鼠缺血缺氧引起的大腦神經細胞凋亡。本研究進一步觀察氯化鋰對丙泊酚誘導皮層神經元損傷的影響,結果表明不同濃度氯化鋰單獨作用皮層神經元12 h未發現對皮層神經元存活率產生影響,但可抑制丙泊酚引起的皮層神經元損傷,表現為神經元存活率顯著增加和神經元凋亡率顯著下降。同時結果表明氯化鋰可通過抑制丙泊酚引起的神經元pGSK-3β蛋白水平下降,降低cleaved-Caspase-3蛋白水平,抑制丙泊酚誘導的皮層神經元凋亡,對神經元產生保護作用。
綜上所述,氯化鋰具有抑制丙泊酚誘導皮層神經元凋亡的作用,其機制可能是通過提高神經元pGSK-3β蛋白水平和降低cleaved-Caspase-3蛋白水平實現的。本研究為圍術期應用氯化鋰預防丙泊酚對嬰幼兒大腦產生神經損傷提供了初步的實驗依據。
[1] Huang J, Jing S, Chen X, et al. Propofol administration during early postnatal life suppresses hippocampal neurogenesis[J]. Mol Neurobiol, 2016, 53(2):1031-44.
[2] Karen T, Schlager G W, Bendix I, et al. Effect of propofol in the immature rat brain on short-and long-term neurodevelopmental outcome[J]. PLoS One, 2013,8(5):e64480.
[3] Zhong Y, Liang Y, Chen J, et al. Propofol inhibits proliferation and induces neuroapoptosis of hippocampal neuronsinvitroviadownregulation of NF-κB p65 and Bcl-2 and upregulation of caspase-3[J].Cell Biochem Funct, 2014, 32(8):720-9.
[4] Berns M, Seeberg L, Schmidt M, et al. High-dose propofol triggers short-term neuroprotection and long-term neurodegeneration in primary neuronal cultures from rat embryos[J].J Int Med Res, 2009,37(3):680-8.
[5] Benedetti F, Bollettini I, Barberi I,et al. Lithium and gsk3-beta promoter gene variants influence white matter microstructure in bipolar disorder[J].Neuropsychopharmacology, 2013, 38(2):313-7.
[6] Qu Z S, Li L, Sun X, et al. Glycogen synthase kinase-3 regulates production of amyloid-beta peptides and tau phosphorylation in diabetic rat brain[J]. Sci World J,2014, 2014:878123.
[7] Sofola O, Kerr F, Rogers I, et al. Inhibition of gsk-3 ameliorates abeta pathology in an adult onset drosophila model of Alzheimer′s disease[J]. PLoS Genet,2010,6(9):e1001087.
[8] Straiko M M, Young C, Cattano D, et al. Lithium protects against anesthesia-induced developmental neuroapoptosis[J]. Anesthesiology, 2009, 110(4):862-8.
[9] Li Y, Wang F, Liu C, et al. JNK pathway may be involved in isoflurane-induced apoptosis in the hippocampi of neonatal rats[J]. Neurosci Lett, 2013, 545:17-22.
[10]Liu J R, Baek C, Han X H, et al. Role of glycogen synthase kinase-3beta in ketamine-induced developmental neuroapoptosis in rats[J]. Br J Anaesth, 2013, 110 Suppl 1:i3-9.
[11]Soriano S G, Liu Q, Li J,et al. Ketamine activates cell cycle signaling and apoptosis in the neonatal rat brain[J]. Anesthesiology, 2010,112(5):1155-63.
[12]唐倩倩,郭小云,劉 迪,等. GSK-3β參與神經精神疾病的研究進展[J].中國藥理學通報,2014,30(9):1193-6.
[13]Marmol F. Lithium:bipolar disorder and neurodegenerative diseases possible cellular mechanisms of the therapeutic effects of lithium[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2008, 32(8):1761-71.
[14]鄒艷平,栗艷芳.鋰劑抑制新生鼠缺氧缺血后的細胞凋亡及炎癥反應研究[J].中國實用神經疾病雜志,2013,16(6):1-5.
Lithium chloride ptotects against propofol-induced apoptosis on primary cultured neurons
Li Jianli1, Zhu Xichun1, Cui Hongshang2, et al
(1DeptofAnesthesiology,2DeptofThoracicSurgery,HebeiGeneralHospital,Shijiazhuang050051)
ObjectiveToinvestigatetheprotectiveeffectsandthemechanismsoflithiumchlorideonthepropofol-inducedneuroapoptosisonprimaryculturedcorticalneurons.MethodsCorticalneuronswereprimarilyculturedforsevendays,andtreatedwithdifferentconcerntrationsoflithiumchloride(0.1,1,5,10μmol/L),andtheneuronviabilitywasmeasuredbyMTTassayafter12htreatments.Corticalneuronsweredividedintothreegroups:vehicle-controlgroup(treatedwithequalvolumeofintralipid),propofol-treatedgroup(treatedwith500μmol/Lpropofol),propofol+lithiumchloridetreatedgroup(treatedwith500μmol/Lpropofoland10μmol/Llithiumchloride).Theneuronsweretreatedfor12h;theneuronviabilitywasmeasuredbyMTTassay;neuroapoptosiswasdetectedbyHoechst33258stainingandFCMassay,andpGSK-3βandcleaved-Caspase-3proteinsweredetectedbyWesternblot.ResultsTheneuronviabilitywasnotaffectedbyvariousconcentrationsoflithiumchloride.Comparedwiththevehicle-controlgroup,theneuronviabilitydecreasedgreatly(P<0.01),theneuroapoptosisincreasedgreatly(P<0.01),thepGSK-3βproteinleveldecreased(P<0.01),andcleaved-Caspase-3proteinlevelincreased(P<0.01)inpropofol-treatedgroup.Comparedwiththepropofol-treatedgroup,lithiumchlorideincreasedneuronviabilityindose-dependentmanner(P<0.01),theneuroapoptosisdecreasedgreatly(P<0.01),thepGSK-3βproteinlevelincreased(P<0.01),andcleaved-Caspase-3proteinleveldecreased(P<0.01)inpropofol+lithiumchloridetreatedgroup.ConclusionLithiumchloridecanprotectagainstpropofol-inducedneuroapoptosisonprimaryculturedneuronsbyincreasingthelevelofpGSK-3βanddecreasingthelevelofcleaved-Caspase-3.
propofol;lithiumchloride;neuroapoptosis;primaryculturedcorticalneuron;pGSK-3β;cleaved-Caspase-3
河北省醫學科學研究重點課題計劃(編號:ZL20140095);2015年政府資助臨床醫學優秀人才培養和基礎課題研究項目(編號:361003-6)
河北省人民醫院1麻醉科、2胸外科,石家莊 0500513河北省胸科醫院呼吸內科,石家莊 050000
李建立,男,副教授,博士,責任作者,E-mail:hblijianli@163.com
時間:2016-10-12 13:23:00
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.012.html
R 971.2;R 965
A
1000-1492(2016)11-1608-05
10.19405/j.cnki.issn1000-1492.2016.11.012
2016-06-27接收

