溶血磷脂酸對(duì)不同轉(zhuǎn)移性肝癌細(xì)胞遷移行為的影響
李鐸 李佳文 袁群琛 林川川 宋關(guān)斌
(重慶大學(xué)生物工程學(xué)院,重慶 400044)
溶血磷脂酸對(duì)不同轉(zhuǎn)移性肝癌細(xì)胞遷移行為的影響
李鐸 李佳文 袁群琛 林川川 宋關(guān)斌
(重慶大學(xué)生物工程學(xué)院,重慶 400044)
旨在研究溶血磷脂酸(Lysophosphatidic acid,LPA)對(duì)兩種轉(zhuǎn)移性不同的肝癌細(xì)胞MHCC97H和HepG2遷移行為的影響。采用Transwell法檢測(cè)肝癌細(xì)胞的遷移能力,RT-PCR檢測(cè)肝癌細(xì)胞中LPA受體(LPA receptor,LPAR)mRNA水平的表達(dá)。結(jié)果顯示,LPA對(duì)低轉(zhuǎn)移性肝癌細(xì)胞HepG2的遷移沒(méi)有明顯影響,但顯著促進(jìn)高轉(zhuǎn)移性肝癌細(xì)胞MHCC97H的遷移能力。LPA對(duì)兩種細(xì)胞的增殖都沒(méi)有明顯影響。RT-PCR實(shí)驗(yàn)發(fā)現(xiàn)兩種肝癌細(xì)胞中LPAR的表達(dá)呈現(xiàn)差異,LPAR1在MHCC97H細(xì)胞中表達(dá),但HepG2細(xì)胞不表達(dá)。用LPAR1/3抑制劑Ki16425阻斷MHCC97H中LPAR1的作用后發(fā)現(xiàn),LPA對(duì)MHCC97H細(xì)胞的促遷移作用消失,表明LPA通過(guò)與LPAR1作用促進(jìn)了MHCC97H細(xì)胞的遷移。LPA對(duì)不同轉(zhuǎn)移性肝癌細(xì)胞遷移能力的影響存在差異,該差異可能來(lái)自于細(xì)胞表達(dá)LPAR的不同。
溶血磷脂酸;肝癌細(xì)胞;溶血磷脂酸受體;細(xì)胞遷移
肝癌是威脅人類健康的重大疾病,其患病率和致死率在我國(guó)逐年增加,如何有效地預(yù)防和治療肝癌目前仍是臨床上亟待解決的難題[1]。腫瘤細(xì)胞轉(zhuǎn)移是指細(xì)胞穿破組織屏障侵入周邊組織,并通過(guò)淋巴液和血液循環(huán)到達(dá)靶位點(diǎn)后形成新的腫瘤。腫瘤細(xì)胞的惡性程度與轉(zhuǎn)移能力成正比[2,3]。阻斷腫瘤
細(xì)胞的轉(zhuǎn)移是治療腫瘤的主要方向之一。腫瘤細(xì)胞的遷移行為受到多種因素調(diào)控,多種細(xì)胞旁分泌或腫瘤細(xì)胞自分泌的趨化/細(xì)胞因子對(duì)腫瘤細(xì)胞的遷移行為都會(huì)產(chǎn)生關(guān)鍵的調(diào)控作用[4]。深入了解各種化學(xué)因子對(duì)肝癌細(xì)胞遷移行為的影響及其機(jī)理將對(duì)肝癌的臨床治療提供幫助。
溶血磷脂酸(Lysophosphatidic acid,LPA)作為一種多功能生物活性磷脂,能夠參與調(diào)控包括細(xì)胞遷移、增殖、分化以及存活能力等在內(nèi)的多種生物學(xué)行為,廣泛存在于大多數(shù)組織中。目前已發(fā)現(xiàn)6種不同的LPA受體(LPA receptor,LPAR),分別命名為L(zhǎng)PAR1-6,在細(xì)胞中發(fā)揮著各自不同的作用,且廣泛參與LPA影響癌細(xì)胞生物學(xué)行為的過(guò)程[5-7]。近來(lái)的研究發(fā)現(xiàn),LPA高表達(dá)于卵巢癌和腹膜癌等癌癥患者的血清和腹水中,推測(cè)LPA同癌癥的發(fā)生發(fā)展密切聯(lián)系[8,9]。但LPA是否調(diào)控肝癌細(xì)胞遷移行為,是否導(dǎo)致肝癌惡化加速尚不明晰。據(jù)此,本文主要研究LPA對(duì)兩種轉(zhuǎn)移程度不同的肝癌細(xì)胞遷移能力的影響,并試圖闡明在LPA影響肝癌細(xì)胞遷移過(guò)程中起調(diào)控作用的LPAR種類,旨為臨床上肝癌的治療和靶向抗腫瘤藥物的研發(fā)提供參考。
1 材料與方法
1.1 材料
1.1.1 肝癌細(xì)胞 高轉(zhuǎn)移性人肝癌細(xì)胞株MHCC97H,購(gòu)于上海東方肝膽研究所;低轉(zhuǎn)移性人肝癌細(xì)胞株HepG2,由中國(guó)人民解放軍第三軍醫(yī)大學(xué)基礎(chǔ)部提供。
1.1.2 主要試劑、耗材 高糖DMEM培養(yǎng)基和小牛血清購(gòu)于Gbico公司;LPA購(gòu)于Aladdin生化科技股份有限公司;Ki16425購(gòu)于Selleck公司;LPAR1-6及GAPDH引物合成于Invitrogen公司;RNA提取試劑盒購(gòu)于Bio Teke公司;反轉(zhuǎn)錄試劑盒和PCR試劑盒購(gòu)于TaKaRa公司;結(jié)晶紫粉末購(gòu)于Sigma Aldrich公司;Transwell小室購(gòu)于Millipore公司;細(xì)胞培養(yǎng)板購(gòu)于Beaver公司;細(xì)胞計(jì)數(shù)板購(gòu)于上海精工公司。
1.2 方法
1.2.1 細(xì)胞培養(yǎng) MHCC97H和HepG2細(xì)胞復(fù)蘇后,采用完全高糖DMEM培養(yǎng)基(含10%小牛血清,100 U/mL青霉素及100 U/mL鏈霉素)于37℃,5% CO2+ 95%空氣的飽和濕度培養(yǎng)箱中進(jìn)行常規(guī)培養(yǎng)。待細(xì)胞生長(zhǎng)到鋪滿細(xì)胞瓶底面80%左右,用0.25%胰酶消化進(jìn)行傳代。
1.2.2 細(xì)胞遷移分析 采用Transwell法分析細(xì)胞的遷移能力。取對(duì)數(shù)生長(zhǎng)期的MHCC97H和HepG2細(xì)胞,饑餓處理12 h后用胰酶消化制成2×105個(gè)/mL濃度的細(xì)胞懸液。在無(wú)菌24孔細(xì)胞培養(yǎng)板中分別加入含LPA終濃度依次為0、0.1、1、10和50 μmol/L的無(wú)血清培養(yǎng)基600 μL,并將小孔孔徑為8 μm的Transwell小心置入孔板內(nèi),于Transwell上室加入100 μL 濃度為2×105個(gè)/mL的細(xì)胞懸液。在采用Ki16425處理的抑制實(shí)驗(yàn)中,需提前對(duì)細(xì)胞采用含10 μmol/L Ki16425的無(wú)血清培養(yǎng)基處理30 min,再將處理后的細(xì)胞加入Transwell上室,添加含10 μmol/L LPA的無(wú)血清培養(yǎng)基600 μL;其對(duì)照組和LPA組細(xì)胞分別加入同體積的含LPA終濃度為0 μmol/L和10 μmol/L的無(wú)血清培養(yǎng)基。將細(xì)胞培養(yǎng)板放置于孵箱中靜置培養(yǎng)12 h后取出,小心拭去Transwell上室未遷移的細(xì)胞,采用結(jié)晶紫染色液進(jìn)行染色,倒置風(fēng)干后于倒置相差顯微鏡下隨機(jī)選取4個(gè)視野進(jìn)行拍照,統(tǒng)計(jì)分析視野中遷移的細(xì)胞數(shù)目,計(jì)算細(xì)胞的相對(duì)遷移倍數(shù)。
1.2.3 細(xì)胞增殖分析 采用細(xì)胞計(jì)數(shù)法檢測(cè)細(xì)胞增殖情況。取對(duì)數(shù)生長(zhǎng)期的細(xì)胞制成懸液,以1×106個(gè)/孔接種到六孔板中培養(yǎng)24 h后,換無(wú)血清培養(yǎng)基饑餓12 h,然后每孔依次加入含LPA終濃度為0、0.1、1、10和50 μmol/L的無(wú)血清培養(yǎng)基2 mL培養(yǎng)12 h。消化制成細(xì)胞懸液,對(duì)每孔細(xì)胞進(jìn)行細(xì)胞計(jì)數(shù)。
1.2.4 LPAR的mRNA表達(dá)分析 采用RT-PCR檢測(cè)細(xì)胞中LPAR在mRNA水平的表達(dá)。取對(duì)數(shù)生長(zhǎng)期的細(xì)胞制成懸液,以2×106個(gè)/孔接種到六孔板中,培養(yǎng)24 h后棄去培養(yǎng)基,分別按照BioTeke說(shuō)明書(shū)提取兩種細(xì)胞的總RNA,按照TaKaRa說(shuō)明書(shū)進(jìn)行cDNA第一鏈合成,并將所得產(chǎn)物進(jìn)行PCR擴(kuò)增。所用引物序列如下表1所示。反應(yīng)條件:95℃預(yù)變性5 min,95℃ 30 s,60℃ 30 s,72℃ 1 min,35個(gè)循環(huán);72℃延伸10 min。對(duì)所得PCR產(chǎn)物進(jìn)行2%瓊脂糖凝膠電泳,分析兩種細(xì)胞中LPAR1-6的表達(dá)。

表1 RT-PCR引物
2 結(jié)果
2.1 LPA對(duì)肝癌細(xì)胞遷移行為的影響
采用Transwell法檢測(cè)了0-50 μmol/L LPA作用下,兩種細(xì)胞遷移能力的變化情況。
如圖1所示,不同濃度的LPA作用12 h后均能明顯促進(jìn)MHCC97H細(xì)胞的遷移能力,并且在0-10 μmol/L濃度作用下促遷移效果呈現(xiàn)劑量依賴關(guān)系,在LPA的濃度達(dá)到10 μmol/L時(shí)促遷移現(xiàn)象最為明顯,實(shí)驗(yàn)組細(xì)胞的遷移能力達(dá)到對(duì)照組的3倍。雖然50 μmol/L LPA作用組較之10 μmol/L作用組對(duì)細(xì)胞遷移能力的促進(jìn)作用有所下降,但也能明顯促進(jìn)MHCC97H細(xì)胞的遷移能力,為對(duì)照組的2倍。值得注意的是,在相同的實(shí)驗(yàn)條件下,LPA對(duì)低轉(zhuǎn)移性肝癌細(xì)胞HepG2的遷移能力沒(méi)有明顯影響(圖2)。
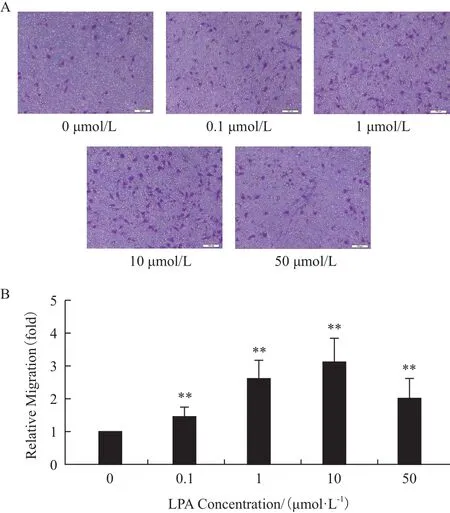
圖1 不同濃度的LPA對(duì)高轉(zhuǎn)移性肝癌細(xì)胞MHCC97H遷移能力的影響
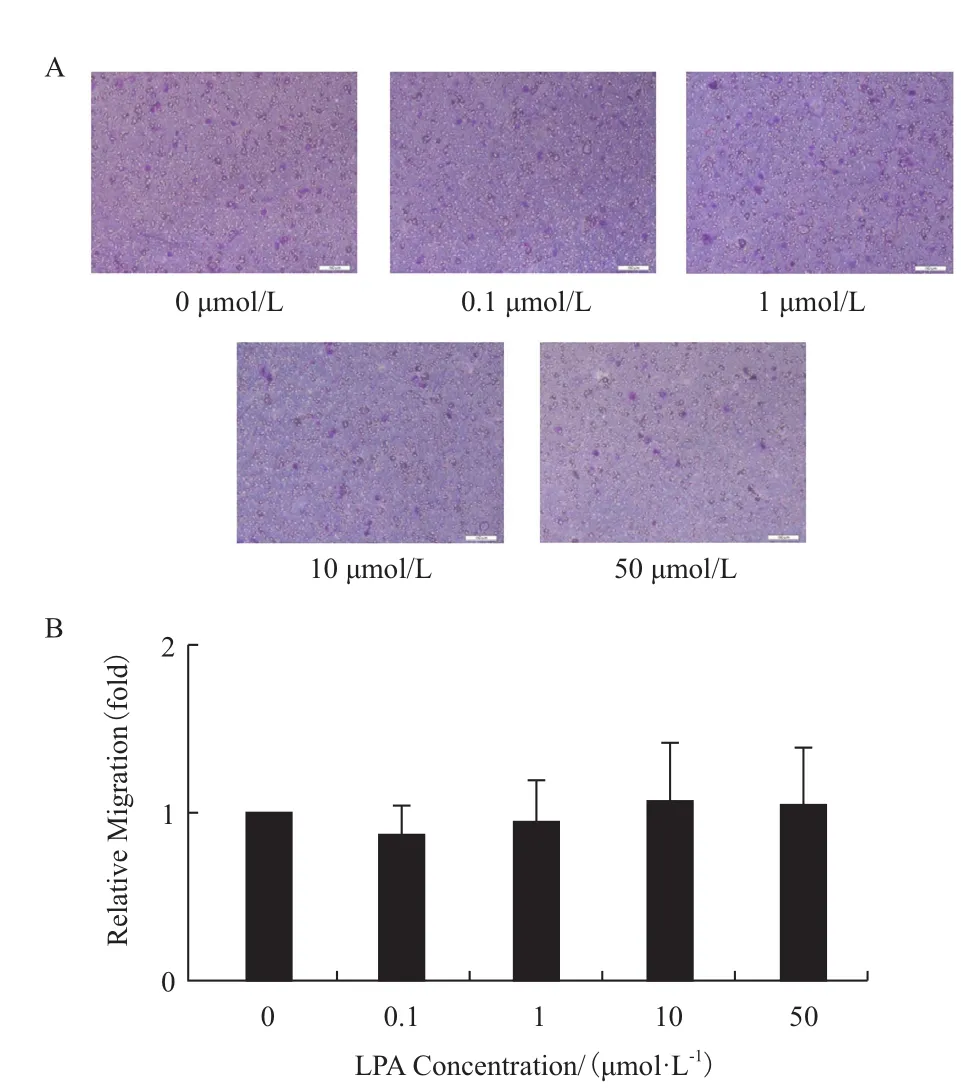
圖2 LPA濃度對(duì)低轉(zhuǎn)移性肝癌細(xì)胞HepG2遷移能力的影響
2.2 LPA對(duì)肝癌細(xì)胞增殖能力的影響
為了排除在LPA促肝癌細(xì)胞遷移的過(guò)程中細(xì)胞增殖對(duì)結(jié)果產(chǎn)生的影響,采用細(xì)胞計(jì)數(shù)法檢測(cè)了在不同濃度的LPA作用12 h后細(xì)胞增殖能力的變化情況。結(jié)果(圖3)顯示,不同濃度的LPA作用12 h后對(duì)MHCC97H和HepG2細(xì)胞的增殖均沒(méi)有產(chǎn)生明顯影響。
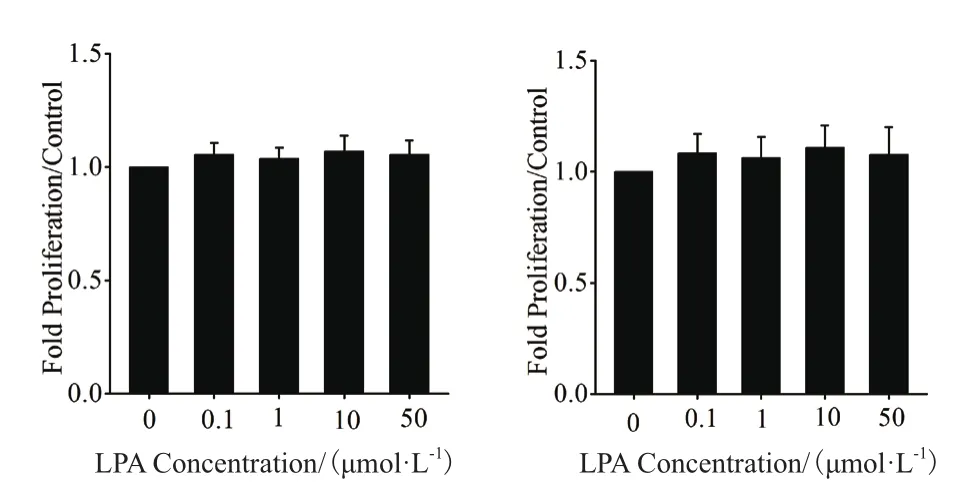
圖3 LPA濃度的對(duì)兩種肝癌細(xì)胞增殖的影響(n=4)
2.3 肝癌細(xì)胞中LPAR的表達(dá)
為了研究?jī)煞N不同轉(zhuǎn)移能力肝癌細(xì)胞響應(yīng)LPA促遷移作用的差異是否源于兩種細(xì)胞上LPAR表達(dá)的不同,分別檢測(cè)了兩種細(xì)胞中LPAR1-6在mRNA水平的表達(dá)情況。實(shí)驗(yàn)結(jié)果(圖4)顯示,在高轉(zhuǎn)移肝癌細(xì)胞MHCC97H中表達(dá)LPAR1、LPAR2、LPAR5和LPAR64種LPA受體,缺失了LPAR3和LPAR4的表達(dá);在低轉(zhuǎn)移肝癌細(xì)胞HepG2中表達(dá)LPAR2、LPAR3、LPAR4、LPAR5和LPAR6五種受體,缺失了LPAR1的表達(dá)。
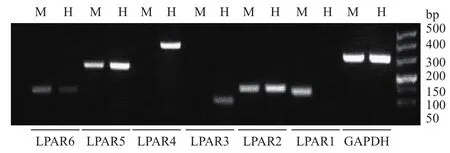
圖4 兩種不同轉(zhuǎn)移能力肝癌細(xì)胞中LPA受體的表達(dá)
2.4 LPAR1參與了LPA誘導(dǎo)的MHCC97H細(xì)胞遷移
進(jìn)一步采用LPAR1的特異抑制劑Ki16425處理MHCC97H細(xì)胞,阻斷LPA與LPAR1的結(jié)合后發(fā)現(xiàn),在Transwell實(shí)驗(yàn)中,Ki16425能夠明顯抑制LPA誘導(dǎo)的MHCC97H細(xì)胞的遷移(圖5)。
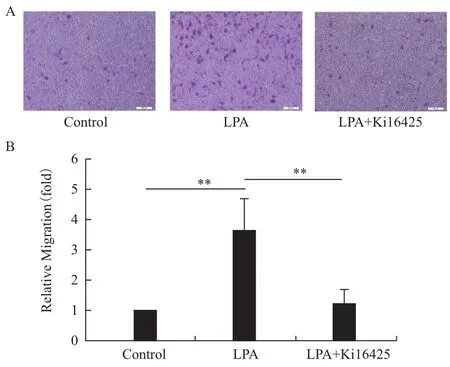
圖5 Ki16425抑制LPA誘導(dǎo)的MHCC97H細(xì)胞遷移
3 討論
本文研究了LPA對(duì)兩種轉(zhuǎn)移程度不同的人肝癌細(xì)胞遷移能力的影響,實(shí)驗(yàn)結(jié)果表明,LPA僅能誘導(dǎo)高轉(zhuǎn)移性的肝癌細(xì)胞MHCC97H的遷移,這與大多數(shù)文獻(xiàn)關(guān)于LPA對(duì)腫瘤細(xì)胞遷移能力的影響結(jié)果相符。例如,Shida等[10]的研究報(bào)道,LPA能夠顯著誘導(dǎo)結(jié)腸癌細(xì)胞DLD1的遷移能力;同樣,Du等[11]在對(duì)乳腺癌細(xì)胞MDA-MB-231的研究中也發(fā)現(xiàn)了相似的結(jié)果。盡管人們對(duì)LPA影響相關(guān)腫瘤細(xì)胞遷移能力有了一定的認(rèn)識(shí),但目前LPA影響不同轉(zhuǎn)移能力腫瘤細(xì)胞的遷移行為還鮮有報(bào)道[12,13]。我們的研究發(fā)現(xiàn),LPA對(duì)高轉(zhuǎn)移性的肝癌細(xì)胞MHCC97H的遷移能力有明顯促進(jìn)作用,但對(duì)低轉(zhuǎn)移性肝癌細(xì)胞HepG2的遷移并沒(méi)有產(chǎn)生明顯的影響,該實(shí)驗(yàn)結(jié)果提示轉(zhuǎn)移能力不同的腫瘤細(xì)胞的遷移行為對(duì)LPA的響應(yīng)可能存在差異。
LPA與其受體結(jié)合是細(xì)胞生物學(xué)行為響應(yīng)LPA的前提。由于兩種不同轉(zhuǎn)移能力肝癌細(xì)胞對(duì)LPA的促遷移作用表現(xiàn)出不同的響應(yīng)方式,因此,為了探明造成這種差異的具體原因,我們采用RTPCR技術(shù)檢測(cè)了兩種細(xì)胞中LPAR1-6的表達(dá)情況。實(shí)驗(yàn)結(jié)果表明,兩種細(xì)胞中LPAR的表達(dá)模式不同,MHCC97H表達(dá)LPAR1、LPAR2、LPAR5和LPAR6,不表達(dá)LPAR3和LPAR4。而HepG2表達(dá)LPAR2-6,不表達(dá)LPAR1,提示這種響應(yīng)差異很可能來(lái)自于細(xì)胞間表達(dá)LPAR的不同。在這6種相關(guān)的LPAR中,LPAR1能夠通過(guò)耦聯(lián)的G蛋白激活下游多條信號(hào)通路來(lái)刺激細(xì)胞內(nèi)黏著斑和偽足的形成、細(xì)胞骨架的重排[14],同時(shí),抑制細(xì)胞內(nèi)環(huán)磷酸
腺苷(cyclic adenosine monophosphate,cAMP)的堆積[15],從而促進(jìn)細(xì)胞的遷移。因此,大量的研究認(rèn)為L(zhǎng)PAR1對(duì)細(xì)胞的遷移起主要介導(dǎo)作用,在對(duì)人肝癌細(xì)胞SK-Hep1[16]、結(jié)腸癌細(xì)胞DLD1[10]、前列腺癌細(xì)胞PC3[17]等癌細(xì)胞的研究中均證實(shí)了這一觀點(diǎn)。有趣的是,LPAR1 在腫瘤組織中的表達(dá)普遍高于健康組織,表達(dá)豐度同組織的惡性程度呈正比[18],且某些不響應(yīng)LPA促遷移作用的癌細(xì)胞中普遍缺失了LPAR1的表達(dá),這可能解釋了低轉(zhuǎn)移性的肝癌細(xì)胞HepG2中不表達(dá)LPAR1的原因[19]。當(dāng)然,目前也有研究報(bào)道在某些腫瘤細(xì)胞中,LPA的促遷移作用不是通過(guò)LPAR1進(jìn)行傳導(dǎo)的,例如,Kato等[20]對(duì)倉(cāng)鼠胰腺癌細(xì)胞的研究工作就表明LPA的促遷移行為是通過(guò)LPAR3進(jìn)行傳導(dǎo)的,并且在敲除LPAR1后有利于細(xì)胞響應(yīng)LPA的作用;Yamada等[21]在對(duì)人惡性胸膜間皮瘤細(xì)胞的研究中也發(fā)現(xiàn),LPAR2調(diào)控了LPA的促遷移信號(hào),LPAR1并不參與其中。為了明確兩種肝癌細(xì)胞遷移響應(yīng)LPA的差異是否與LPAR1相關(guān),我們進(jìn)一步利用LPAR1的特異性抑制劑Ki16425 阻斷MHCC97H細(xì)胞中LPA R1與 LPA的結(jié)合,結(jié)果發(fā)現(xiàn)LPA對(duì)MHCC97H細(xì)胞遷移促進(jìn)作用消失。因此,我們可以初步判定,在MHCC97H中LPAR1介導(dǎo)了LPA對(duì)細(xì)胞遷移的誘導(dǎo)作用,而HepG2不響應(yīng)LPA的促遷移作用很可能源于該細(xì)胞中缺失了LPAR1的表達(dá)。
我們的研究表明,不同轉(zhuǎn)移能力的細(xì)胞對(duì)LPA的響應(yīng)可能存在差異。就肝癌細(xì)胞而言,高轉(zhuǎn)移性的肝癌細(xì)胞細(xì)胞響應(yīng)LPA的促遷移作用,而低轉(zhuǎn)移性的肝癌細(xì)胞不響應(yīng)LPA的作用,這與Sokolov等[22]的研究結(jié)果相似。我們的研究結(jié)果為L(zhǎng)PA影響不同轉(zhuǎn)移能力癌細(xì)胞的遷移行為以及該過(guò)程中涉及到的可能分子機(jī)理提供了實(shí)驗(yàn)參考。由于目前我們只針對(duì)兩種高低轉(zhuǎn)移能力不同的肝癌細(xì)胞系進(jìn)行了研究,并未涉及到更多轉(zhuǎn)移能力不同的細(xì)胞間比較,加之癌細(xì)胞種類繁雜,這種響應(yīng)差異與細(xì)胞轉(zhuǎn)移程度的關(guān)聯(lián)是否存在規(guī)律性,還需進(jìn)一步的研究驗(yàn)證。
4 結(jié)論
LPA可顯著促進(jìn)高轉(zhuǎn)移性肝癌細(xì)胞MHCC97H的遷移,但對(duì)低轉(zhuǎn)移性肝癌細(xì)胞HepG2的遷移行為沒(méi)有明顯影響,這種影響差異與兩種細(xì)胞表達(dá)LPAR譜系不同有關(guān)。HepG2細(xì)胞缺失LPAR1的表達(dá)可能是其不響應(yīng)LPA促遷移作用的重要原因。
[1] Ahmedin J, Freddie B, Center MM, et al. Global cancer statistics[J]. Ca Cancer J Clin, 2011, 61(2):69-90.
[2] Sun J, Luo Q, Liu L, et al. Biomechanical profile of cancer stem-like cells derived from MHCC97H cell lines[J]. J Biomech, 2016, 49(1):45-52.
[3] Bhattacharya S, Darjatmoko SR, Polans AS, et al. Resveratrol modulates the malignant properties of cutaneous melanoma through changes in the activation and attenuation of the antiapoptotic protooncogenic protein Akt/PKB[J]. Melanoma Res, 2011, 21(3):180-187.
[4] Luo Z, Wang Q, Lau WB, et al. Tumor microenvironment:the culprit for ovarian cancer metastasis[J]. Cancer Lett, 2016, 377(2):174-182.
[5] Liona-Minguez S, Ghasssemian A, Helleday T. Lysophosphatidic acid receptor(LPAR)modulators:the current pharmacological toolbox[J]. Prog Lipid Res, 2015, 58:51-75.
[6] Liu Y, An S, Ward R, et al. G protein-coupled receptors as promising cancer targets[J]. Cancer Lett, 2016, 376(2):226-239.
[7] Leblanc R, Peyruchaud O. New insights into the autotoxin/LPA axis in cancer development and metastasis[J]. Exp Cell Res, 2015, 333(2):183-189.
[8] Celine P, Simon O, Saulnier-Blache B. Lysophosphatidic acid synthesis and release[J]. Prostaglandins, 2001, 64(1-4):1-10.
[9] Mills GB, Moolenaar WH. The emerging role of lysophosphatidic acid in cancer[J]. Nat Rev Cancer, 2003, 3(8):582-591.
[10] Shida D, Kitayama J, Yamaguchi H, et al. Lysophosphatidic acid enhances the metastatic potential of human colon carcinoma DLD1 cells through LPA1[J]. Cancer Res, 2003, 63(7):1706-1711.
[11] Du J, Sun C, Hu Z, et al. Lysophosphatidic acid induces MDAMB-231 breast cancer cells migration through activation of PI3K/ PAK1/ERK signaling[J]. PLoS One, 2010, 5(12):e15940.
[12] Willier S, Butt E, Grunewald TG. Lysophosphatidic acid(LPA)signalling in cell migration and cancer invasion:a focussed review and analysis of LPA receptor gene expression on the basis of more than 1700 cancer microarrays[J]. Biol Cell, 2013, 105(8):
317-33.
[13] Herrema H, Czajkowska D, Theard D, et al. Rho kinase, myosin-II, and p42/44 MAPK control extracellular matrix-mediated apical bile canalicular lumen morphogenesis in HepG2 cells[J]. Mol Biol Cell, 2006, 17(7):3291-3303.
[14] Ji WC, Herr DR, Noguchi K, et al. LPA receptors:subtypes and biological actions[J]. Annu Rev Pharmacol Toxicol, 2010, 50(1):157-86.
[15]Guo R, Kasbohm EA, Arora P, et al. Expression and function of lysophosphatidic acid LPA1 receptor in prostate cancer cells[J]. Endocrinology, 2006, 147(10):4883-4892.
[16] Park SY, Jeong KJ, Panupinthu N, et al. Lysophosphatidic acid augments human hepatocellular carcinoma cell invasion through LPA1 receptor and MMP-9 expression[J]. Oncogene, 2011, 30(11):1351-1359.
[17]Hao F, Tan M, Xu X, et al. Lysophosphatidic acid induces prostate cancer PC3 cell migration via activation of LPA1, p42 and p38α[J]. Biochim Biophys Acta, 2007, 1771(7):883-892.
[18]Yamada T, Sato K, Komachi M, et al. Lysophosphatidic acid in malignant ascites stimulates motility of human pancreatic cancer cells through LPA1[J]. J Biol Chem, 2004, 279(8):6595-6605.
[19]Komachi M, Tomura H, Malchinkhuu E, et al. LPA1 receptors mediate stimulation, whereas LPA2 receptors mediate inhibition, of migration of pancreatic cancer cells in response to lysophosphatidic acid and malignant ascites[J]. Carcinogenesis, 2009, 30(3):457-465.
[20]Kato K, Yoshikawa K, Tanabe E, et al. Opposite roles of LPA1 and LPA3 on cell motile and invasive activities of pancreatic cancer cells[J]. Tumour Biol, 2013, 33(5):1739-1744.
[21] Yamada T, Yano S, Oqino H, et al. Lysophosphatidic acid stimulates the proliferation and motility of malignant pleural mesothelioma cells through lysophosphatidic acid receptors, LPA1 and LPA2[J]. Cancer Sci, 2008, 99(8):1603-1610.
[22] Sokolov E, Eheim AL, Ahrens WA, et al. Lysophosphatidic acid receptor expression and function in human hepatocellular carcinoma[J]. J Surg Res, 2013, 180(1):104-113.
(責(zé)任編輯 馬鑫)
Effects of Lysophosphatidic Acid on the Migrations of Hepatoma Cells with Different Metastasis
LI Duo LI Jia-wen YUAN Qun-chen LIN Chuan-chuan SONG Guan-bin
(College of Bioengineering,Chongqing University,Chongqing 400044)
The aim of this study is to investigate the effect of lysophosphatidic acid(LPA)on cell migration of two kinds of hepatocellular carcinoma cells(MHCC97H and HepG2)with different metastasis,and to evaluate the underlying mechanism. Transwell assay was employed to investigate the impact of LPA on the migration of the hepatocellular carcinoma cells,and RT-PCR to detect the mRNA expression of LPA receptor(LPAR)in the hepatocellular carcinoma cells. Results showed that the LPA presented no obvious effect on the migration of HepG2 cells in low metastasis,but significantly promoted the migration of MHCC97H cells in high metastasis. LPA caused insignificant impact to the proliferation of both cells. RT-PCR demonstrated that expressions of LPAR at mRNA level in MHCC97H and HepG2 cells were different,LPAR1 expressed in MHCC97H cells,however,not in HepG2 cells. Importantly,the promotion effect of LPA on the migration of MHCC97H cells disappeared after Ki16425(a specific inhibitor of LPAR1/3)was used to block the role of LPAR1 in MHCC97H cells. This indicated that LPA promoted MHCC97H cell migration via interaction with LPAR1. The effects of LPA on the migration of hepatoma cells in different metastasis varied,which resulted from the different expressions of LPAR in these two cell types.
lysophosphatidic acid;hepatoma cell;lysophosphatidic acid receptor;cell migration
10.13560/j.cnki.biotech.bull.1985.2016.12.029
2016-04-20
國(guó)家自然科學(xué)基金項(xiàng)目(11272365),國(guó)家級(jí)大學(xué)生創(chuàng)新訓(xùn)練項(xiàng)目(201510611045)
李鐸,女,研究方向:細(xì)胞生物學(xué);E-mail:liduo1995@live.com
宋關(guān)斌,男,教授,研究方向:細(xì)胞生物學(xué);E-mail:song9973@163.com

