基于核酸外切酶I的適配體熒光傳感器檢測人尿液中的Hg2+
趙秋伶+張尤華+于曉艷


摘 要 基于富含胸腺嘧啶(T)DNA適配體對Hg2+的特異性識別和核酸外切酶I(Exo Ⅰ)輔助的信號轉換策略,建立了快速檢測人尿液中Hg2+的熒光分析方法。固定在微孔板上的DNA適配體特異識別Hg2+后,折疊成穩定的發卡型雙鏈結構,不能被單鏈特異性的Exo Ⅰ水解,核酸染料SYBR Green I(SG)插入發卡部位產生熒光信號,基于此可實現Hg2+的定量檢測。優化后的最佳實驗條件為:微孔板包被親和素濃度為50 mg/L;檢測DNA包被濃度為75 nmol/L;使用5 SG以及1.2 μL的Exo Ⅰ。在最佳實驗條件下,體系熒光強度與Hg2+濃度的對數呈良好線性關系,線性范圍為2~500 nmol/L,檢出限為1.5 nmol/L(3σ)。利用本方法檢測尿樣中的Hg2+,加標回收率為91.2%~95.0%,相對標準偏差(n=5)為2.1%~4.6%。本方法選擇性良好,操作簡單,用HNO3KMnO4溶液將尿液中其它形式的汞氧化為Hg2+后,成功實現了尿液中總汞含量的檢測。
關鍵詞 DNA識別;核酸外切酶I;汞離子;信號放大;熒光分析
20160112收稿;20160424接受
本文系國家自然科學基金(No.21506087)資助
Email: flyzhql@iccas.ac.cn
1 引 言
汞是一種高毒性重金屬元素,可在水、空氣和土壤中進行遷移,并通過食物鏈進入人體,在肝、腎、腦等器官組織富集,影響生殖和發育,有致畸、致癌、致突變的作用[1,2]。目前,生物樣品中總汞的檢測方法主要有原子吸收光譜[3,4]、原子熒光光譜[5,6]和電感耦合等離子體質譜[7,8]等,這些方法靈敏度和分辨率高,但依賴于大型儀器和專業的操作人員,樣品預處理繁瑣,無法滿足大批量樣本快速篩查的需求[9,10]。因此,開發準確、靈敏、簡便、快速、經濟的汞檢測新技術具有非常重要的實用價值。
Hg2+能進入DNA鏈的胸腺嘧啶(Thymine,T)堿基之間,形成穩定的 “THg2+T”結構,基于此人們構建了各種高靈敏、高特異性的Hg2+熒光傳感器[11~13]。與傳統的儀器分析方法比較,核酸作為識別分子的熒光傳感方法簡便、快速、成本低,尤其適于現場實時檢測。但仍然存在檢測通量低、假信號率高、難以直接應用于復雜生物試樣[14]等不足。
核酸外切酶I(Exo Ⅰ)是按3′→5′方向,特異性切割單鏈的核酸外切酶,對雙鏈DNA及RNA不起作用。許多研究將Exo Ⅰ應用于核酸探針的信號轉變策略,以實現核酸、蛋白質等生物分子的超靈敏檢測[15]。本研究在微孔板上固定DNA以識別目標分子,采用Exo Ⅰ輔助的信號轉換策略,建立了快速檢測尿液中Hg2+的高通量熒光分析新方法。Exo Ⅰ的使用降低了假信號率,提高了檢測的靈敏度。將DNA進行固定后,識別和檢測步驟分開進行,有效排除了樣品基質中背景熒光物質的干擾,實現了復雜尿樣中Hg2+的熒光分析檢測。
2 實驗部分
2.1 儀器與試劑
SpectraMaxParadigm多功能酶標儀(美國Molecular Devices 公司);Fluoro log 321型熒光分光光度計(美國Jobin Yvon 公司);UV2550 紫外分光光度計(日本島津公司);臺式冷凍恒溫搖床(太倉市實驗設備廠); PHS3C型pH 計(上海雷磁儀器廠);迷你離心機(德國Eppendorf公司)。
黑色96孔微孔板(康寧公司);親和素和牛血清白蛋白(BSA,美國 Sigma 公司);核酸外切酶I(E. coli Exo Ⅰ,2650A,大連寶生物工程有限公司);檢測DNA 序列(5′BiotinGGAGTTGGTTGATTGATTTTTTCTTTCTTCCTTCT 3′)由上海生工生物工程公司合成,用超純水配成100 μmol/L儲備液。實驗所用的緩沖溶液(碳酸鹽緩沖液:0.5 mol/L Na2CO3NaHCO3,pH=9.0;PBS緩沖液:0.1 mol/L Na2HPO4KH2PO4,100 mmol/L NaCl,pH=7.4;PBST緩沖液:0.1 mol/L PBS,pH=7.4, 2 mmol/L MgCl2,0.12% Tween20;結合緩沖液:25 mmol/L TrisHCl,pH=7.4,100 mmol/L NaCl,2 mmol/L MgCl2,5 mmol/L KCl);SYBR Green I(10000×,DMSO)購自美國Invitrogen 公司,使用前用結合緩沖液稀釋100倍(100×工作液);0.5 mmol/L汞標準溶液的配制參見文獻[16],用結合緩沖液稀釋成不同濃度。用經酸處理的具塞聚乙烯塑料瓶收集一次尿樣,盡快測定比重,置于4℃保存;其它試劑為分析純。實驗用水為MilliQ超純水(18.2 MΩ·cm,美國Millipore公司)。
2.2 實驗方法
2.2.1 包被親和素 親和素用碳酸鹽緩沖液稀釋成適當濃度,包被微孔板(100 μL/孔),4℃放置12 h后, 用PBST緩沖溶液清洗。最后用1% BSA 封閉1 h,PBST洗滌3次。
2.2.2 DNA在微孔板上的固定 親和素包被的微孔板中,每孔加入100 μL 檢測DNA的PBS溶液, 37℃搖床搖振反應2 h,通過DNA 5′端的生物素和親和素的特異相互作用,DNA固定到親和素包被的微孔板上。PBST洗滌3次,200 μL/孔。然后加1% BSA封閉1 h,PBST洗滌3次。包被的DNA微孔板立即用于下步測試。
2.2.3 Hg2+的定量檢測 (1)DNA識別反應 Hg2+標準溶液用結合緩沖液稀釋成系列濃度,分別加入到包被檢測DNA的微孔板中, 每孔100 μL,室溫孵育40 min使DNA和Hg2+充分反應。接著在每孔中加入1.2 μL Exo Ⅰ(5 U/μL)和11 μL 10×Exo Ⅰ緩沖液, 37℃孵育30 min;傾去反應液,用PBST緩沖液洗滌3次,200 μL/孔。 (2)熒光測定 在識別反應后的微孔板各孔中加入100 μL 的5×SG的溶液,室溫孵育10 min。用熒光酶標儀測定熒光光譜。激發波長480 nm,發射波長520 nm。加入Hg2+前, 測得熒光強度I0;加入Hg2+之后, 測得熒光強度IF,以IF定量分析Hg2+濃度,繪制工作曲線。
2.2.4 實際樣品測定 (1) 添加回收實驗 4℃保存的尿樣,離心取上層清夜,向樣品中分別添加2.0, 10.0和50.0 nmol/L的Hg2+標準液,4℃放置過夜后,再次離心,取上層清夜。用建立的方法測定熒光強度。(2)病人尿樣總汞檢測 先將尿樣中其它形式的汞轉變成Hg2+:在10 mL尿液中,加入濃HNO3 2 mL及 6% KMnO4溶液1 mL,加熱回流2 h;待KMnO4溶液的顏色消失,將溫度降低到60℃以下,然后加入0.1 mL KMnO4溶液,再加熱溶液;最后用堿將溶液調至pH 8.0,并濃縮至原體積[17]。然后按照建立的方法檢測。
3 實驗部分
3.1 實驗原理及可行性分析
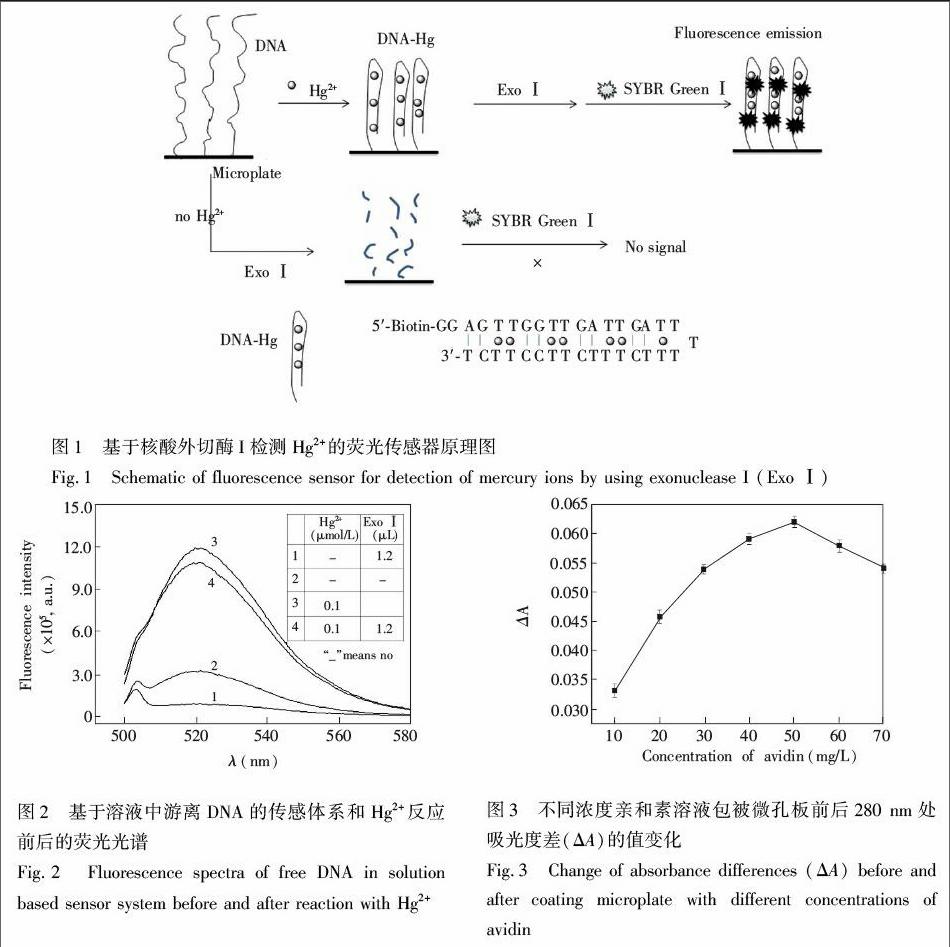
實驗原理如圖1 所示,黑色微孔板固定的5′生物素標記的檢測DNA序列含有較多的胸腺嘧啶(T)堿基,基于Hg2+能插入TT堿基之間形成穩定的(THg2+T)配位結構,檢測DNA能對Hg2+進行特異識別。當Hg2+存在時,DNA結合Hg2+后發生構象轉換,形成穩定的“發卡型”雙鏈結構(圖1中DNAHg)。Exo Ⅰ是單鏈特異性3′→5′ 核酸外切酶,不分解雙鏈DNA。本研究中DNA轉變成穩定的“發卡型”雙鏈結構,Exo Ⅰ不能水解此雙鏈結構[17]。核酸染料SG插入“發卡型”雙鏈結構,產生熒光信號。相反,無Hg2+存在時,微孔板上固定的DNA被Exo Ⅰ剪切,因此無熒光信號發射。本研究采用微孔板固定DNA,Hg2+和DNA作用后也被固定在板上,識別反應結束后,液相與固相分離后,再加入SG測定熒光強度,尿樣中復雜的基底及熒光成分[18]對檢測信號基本不產生影響。
為驗證方法的可行性,采用DNA溶液進行上述的識別反應,傳感體系與Hg2+反應前后的熒光光譜圖如圖2所示。與Hg2+作用前,體系熒光信號較弱(圖2,曲線1和2);加入Hg2+后,體系的熒光信號強度大幅增加(圖2,曲線3和4)。溶液中自由狀態的DNA呈現松散的“莖環”結構,SG可以插入其中,顯示一定熒光信號(圖2,曲線2);自由狀態的DNA可被Exo Ⅰ水解,因此溶液基本上沒有熒光信號(圖2,曲線1),這說明使用Exo Ⅰ可以消除背景信號。曲線4的熒光信號弱于曲線3,說明Exo Ⅰ的加入使部分未反應的DNA被剪切,部分消除空白背景信號。上述實驗結果說明,Exo Ⅰ的引入,特異性地消除了背景熒光信號,提高了分析的靈敏度。
3.2 實驗條件的優化
3.2.1 親和素包被濃度的優化 對親和素的包被濃度進行了優化,測定了不同親和素包被濃度下, 包被前后溶液在280 nm處吸光度值減少值ΔA(圖3)。結果表明, 在親和素包被濃度為50 mg/L時, 吸光度值減少量最大, 表明此時微孔板上包被親和素的量達到飽和。所以本實驗中采用50 mg/L親和素進行包被。
3.2.2 DNA 的包被濃度的優化
固定親和素包被濃度為50 mg/L,使用不同濃度的DNA包被微孔板后(無封閉步驟),然后與過量的Hg2+發生識別反應,形成“發卡型”雙鏈結構后,加入過量的SG核酸染料孵育10 min,測定520 nm處的熒光強度 IF。結果如圖4所示,在DNA包被濃度為75 nmol/L時,IF最大,表明此時包被的DNA最多。因此在本實驗中,DNA包被濃度采用75 nmol/L。
3.2.3 SG用量的優化 固定親和素包被濃度為50 mg/L,DNA包被濃度為75 nmol/L,與過量的Hg2+發生識別反應,形成“發卡型”雙鏈結構后,分別與1×,5×,10×,20×的SG核酸染料孵育10 min,測定熒光強度。結果如圖5所示,使用5×SG時,體系在520 nm波長處熒光強度達到最大值,說明此時反應已飽和,因此本實驗中采用5×SG。
3.2.4 Exo Ⅰ用量的優化 當DNA包被濃度為75 nmol/L,封閉液為 1% BSA 時,DNA未做識別反應,直接被Exo Ⅰ水解,考察5 U/μL Exo Ⅰ 用量(0.5, 0.8, 1.0, 1.2, 1.5和1.8 μL)的影響(圖6)。SG用量為5×時,檢測體系在520 nm處的熒光強度。結果表明,隨Exo Ⅰ用量增加,更多的DNA被Exo Ⅰ水解,體系熒光強度降低,當Exo Ⅰ用量為1.2 μL,體系熒光強度最低,繼續增加濃度熒光強度變化不大,因此本實驗中Exo Ⅰ用量為1.2 μL。
3.3 方法的線性范圍和檢出限
在最佳實驗條件下,測定不同濃度的Hg2+與DNA傳感器作用后的熒光光譜(λex = 480 nm, λem = 520 nm),結果如圖7a 所示,隨著Hg2+濃度不斷增加,520 nm處的熒光強度IF逐漸增大。在Hg2+濃度在2~500 nmol/L范圍內,IF與Hg2+濃度的對數呈良好的線性關系(圖7b),回歸方程為IF =563805lgC + 56994,相關系數(R)為0.9906,檢出限1.5 nmol /L (3σ) (0.3 μg/L)。尿汞水平在一定程度上反映了人接觸汞的程度,人體尿汞正常的參考范圍為 ≤25 nmol/L[19]。本方法的檢出限以及線性范圍下限遠小于人體尿汞正常含量最大值,可以滿足臨床檢測需要。
3.4 特異性考察
考察了本方法檢測Hg2+的選擇性。將Pb2+, Ni2+, Cu2+, Co2+, Fe2+, Ca2+及Zn2+添加到尿樣中,在最佳實驗條件下進行測定。當干擾離子濃度高于Hg2+濃度100倍時,不同陽離子的熒光響應情況如圖8所示,只有Hg2+能使體系信號明顯增加,說明該熒光傳感器對Hg2+有良好的特異性。
3.5 實際尿液樣品中Hg2+的檢測
選擇原子熒光光譜法未檢出Hg的尿液樣品進行標準加入實驗,計算回收率和相對標準偏差,結果如表1所示。3個水平的加樣回收率為91.2%~95.0%,相對標準偏差為2.1%~4.6%。表明本方法準確度和靈敏度良好,能夠滿足生物試樣中Hg2+污染檢測的要求。此外,實驗表明,尿樣中的復雜成分(無機類的鈉、鉀、氯、硫酸鹽、磷酸鹽、銨鹽、Ca2+等;有機物質包括尿素、尿激酶、表皮生長因子、生長激素、促紅細胞生長素、促性腺激素、血管舒緩素和抗腫瘤肽類物質等)對Hg2+檢測無影響,表明本方法具有良好特異性。
取兩例病人尿樣樣本(原子熒光光譜法檢測總汞含量分別是17.3和12.2 nmol/L,),按照2.2.4的方法將尿樣中其它形式的汞轉變成Hg2+,然后在最佳實驗條件下檢測總汞含量,檢出量分別為17.1和12.5 nmol/L,相對標準偏差為3.6%~5.5%(n=5)。檢測結果與原子熒光光譜法一致,表明本方法準確度和靈敏度良好,有望用于臨床實際樣本的檢測。
4 結 論
用微孔板上固定DNA作為識別分子,發展了一種基于核酸外切酶I的熒光傳感平臺,實現了尿樣中Hg2+ 的熒光分析檢測。本方法操作簡便、靈敏度高、特異性好,滿足高通量樣品檢測的需求,適合現場即時分析,對于臨床樣品中尿液汞的檢測具有重要意義。同時,本研究為血液、頭發等生物樣品中總汞的檢測提供了新思路。
References
1 CHEN Ying, SHAO YuFang. Environmental Chemistry, 2012, 31(12): 1934-1941
陳 影, 邵玉芳. 環境化學, 2012, 31(12): 1934-1941
2 ZHAO Jing, SUN HaiJuan, FENG XuQiao. Science and Technology of Food Industry, 2014, 35(7): 357-363
趙 靜, 孫海娟, 馮敘橋. 食品工業科技, 2014, 35(7): 357-363
3 Shah A Q, Kazi T G, Baig J A, Afridi H I, Arain M B. Food Chem., 2012, 134(4): 2345-2349
4 de Jesus A, Zmozinski A V, Vieira M A, Ribeiro A S, da Silva M M. Microchem. J., 2013, 110(9): 227-232
5 Yun Z J, He B, Wang Z H, Wang T, Jiang G B. Talanta, 2013, 106(6): 60-65
6 da Silva D G, Portugal L A, Serra A M, Ferreira S L C, Cerdà V. Food Chem., 2013, 137(14): 159-163
7 de Souzaa S S, Campiglia A D, Barbosa F. Anal. Chim. Acta, 2013, 761(2): 11- 17
8 WANG Meng, FENG WeiYue, ZHANG Fang, WANG Bing, SHI JunWen, Li Bai, CHAI ZhiFang, ZHAO YuLiang. Chinese J. Anal. Chem., 2005, 33(12): 1671-1675
王 萌, 豐偉悅, 張 芳, 汪 冰, 史俊穩, 李 柏, 柴之芳, 趙宇亮. 分析化學, 2005, 33(12): 1671-1675
9 ZHANG QinLong, GAO Ge, LIU YaPan. Chinese Journal of Health Laboratory Technology, 2015, 25(20): 3416-3418
張欽龍, 高 舸, 劉亞攀. 中國衛生檢驗雜志, 2015, 25(20): 3416-3418
10 YANG XueJi, HUNG CanDong. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2015, 51(7): 955-958
楊雪姬, 黃燦東. 理化檢驗化學分冊, 2015, 51(7): 955-958
11 LEI ZhaoJing, ZHANG CunZheng, HU QiuHui, LIU Yuan, ZHANG Qiang, LIU XianJin. Chinese J. Anal. Chem., 2012, 40(12): 1827-1831
雷兆靜,張存政,胡秋輝,劉 媛,張 強,劉賢金. 分析化學, 2012, 40(12): 1827-1831
12 ZHAI Kun, XIANG DongShan, ZHU Jun, HU HongQing. Chinese J. Anal. Chem., 2015, 43(8): 1125-1129
翟 琨, 向東山, 朱 俊, 胡紅青. 分析化學, 2015, 43(8): 1125-1129
13 Lu C, Huang P J, Ying Y, Liu J. Biosens. Bioelectron., 2015, 79:244-250
14 ZHAO QiuLing, LIU LingLing, YANG LiNa, ZHANG ZhenYu. Chinese J. Anal. Chem., 2014, 42(5): 683-688
趙秋伶, 劉玲玲, 楊麗娜, 張振宇. 分析化學, 2014, 42(5): 683-688
15 WEN Li, XU FengZhou, HE XiaoXiao, WANG KeMin, HE DingGeng, QING TaiPing, ZOU Zhen. Chinese J. Anal. Chem., 2015, 43(11): 1620-1628
文 立, 徐鳳州, 何曉曉, 王柯敏, 何定庚, 卿太平, 鄒 振. 分析化學, 2015, 43(11): 1620-1628
16 GB60288, Chemical Reagent Preparation of Stock Standard Solutions. National Standards of the People′s Republic of China
化學試劑雜質測定用標準溶液的制備, 中華人民共和國國家標準. GB60288
17 YU Li, CHEN Chun, LI Bei, LU XinYan, LIU Dan, GAO Yong. Environmental Monitoring in China, 2014, 30(1): 128-137
于 莉, 陳 純, 李 貝, 路新燕, 劉 丹, 高 勇. 中國環境監測, 2014, 30(1): 128-137
18 Yuan M, Zhu Y, Lou X, Chen C, Wei G, Lan M, Zhao J. Biosens. Bioelectron., 2012, 31(1): 330-336
19 LU Jun, GAO ShuMei, XIONG Jie, YANG YouYi, CHEN GuoQing. Lsaer Technology, 2010, 34(1): 45-47
陸 俊, 高淑梅, 熊 婕, 楊幼益, 陳國慶. 激光技術, 2010, 34(1): 45-47
20 YANG ShuiLian, NI WeiMin, LI XiaoJun, QIU ChuanYi, SUN DaoYuan, ZHAO LiQiang, SHAN HaoLin, HUANG ZhenNong, XIE LanLan, YOU QuanCheng, FENG KeYu. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2006, 24(7): 418-419
Abstract A novel fluorescence analysis method for fast detection of mercury ions in human urine was established based on DNA recognition and exonuclease I (Exo Ⅰ) assisted signal conversion strategy. The DNA immobilized on the surfaces of the microplates bound specifically with Hg2+ to fold into a stable “hairpin” doublestranded structure, thus avoided the hydrolysis by singlestranded DNA specific Exo Ⅰ. Nucleic acid dye SYBR Green I (SG) could insert into the doublestranded "hairpin" part to produce fluorescence signal emission. Based on the above facts, quantitative detection of mercury ions was achieved. The experimental results showed that, when the concentration of avidin coating solution was 50 mg/L and the concentration of the detection DNA immobilized on the microplate was 75 nmol/L, with 5SG and 1.2 μL of Exo Ⅰ, the optimal analytical performance could be achieved. A good linear relationship between the fluorescence intensity of the system at 520 nm versus the logarithm of mercury ions concentration in the range of 2-500 nmol/L was obtained under the optimal conditions, and the detection limit was 1.5 nmol/L (3σ). The recoveries of mercury in spiked human urine samples were 96.3%-100.5% with the relative standard derivations (RSDs) of 2.1%-4.6%. The method had good selectivity with simple operation, and could be used for the detection of total mercury content after oxidizing other forms of mercury in urine into mercury ions using HNO3KMnO4 oxidation method.
Keywords DNA recognition; Exonuclease I; Mercury ion ; Signal amplification strategy; Fluorescence analysis

