痕量環鈀配合物高效催化合成二茂鐵衍生物
索全伶, 張丹昭, 柯春龍, 竺 寧, 高媛媛, 解瑞俊, 韓利民
(內蒙古工業大學化工學院, 呼和浩特 010051)
?
痕量環鈀配合物高效催化合成二茂鐵衍生物
索全伶, 張丹昭, 柯春龍, 竺 寧, 高媛媛, 解瑞俊, 韓利民
(內蒙古工業大學化工學院, 呼和浩特 010051)

環鈀配合物; 高效鈀催化劑; 交叉偶聯; 二茂鐵衍生物; 反應機理
自從1965年由Cope課題組[1,2]合成出第一個環鈀配合物以來, 有關環鈀配合物的合成與催化方面的研究就從未間斷[3~7]. 在環鈀配合物中, 以亞胺為配體的環鈀配合物格外引人關注, 廣泛用作Heck, Suzuki-Miyaura, Sonogashira和Buchwald-Hartwig等交叉偶聯反應的催化劑[8,9].
在Suzuki-Miyaura交叉偶聯反應中, 單二茂鐵亞胺環鈀配合物催化劑表現出了優異的催化反應活性和選擇性, 使該類配合物催化劑的制備與催化反應性能研究成為備受關注的研究領域[10~12].
二茂鐵衍生物的應用十分廣泛, 涉及分子導線[13,14]、 聚合材料、 燃料添加劑、 抗癌試劑[15]和液晶材料[16]等許多方面. 吳養潔課題組[17,18]利用單二茂鐵亞胺環鈀配合物作為催化劑, 對芳香烴的碳-碳偶合反應進行了系統研究, 但是, 利用雙二茂鐵亞胺環鈀配合物作為催化劑, 設計合成二茂鐵衍生物的研究尚未見報道. 近年來, 利用碳-碳偶合方法設計合成特定功能目標化合物的報道[19~24]較多. 如, Purecha等[25]利用β-二酮配位的鈀配合物作為催化劑, 通過雙二茂鐵基汞與氯代芳烴進行交叉偶聯反應, 以較高產率制備出了系列二茂鐵衍生物; Long等[26]使用傳統鈀催化劑研究了二茂鐵硼酸與對甲苯基三氟甲磺酸的交叉偶聯反應, 也以較高產率得到了二茂鐵衍生物. 以二茂鐵基鹵化物作為反應底物進行的Suzuki-Miyaura交叉偶聯反應的報道較少, 僅有Imrie研究小組[19,27]利用傳統的鈀催化劑對這類反應進行了較詳細研究.

1 實驗部分
1.1 試劑與儀器
所用試劑和溶劑均為市售分析純試劑, 使用前經脫水和重蒸處理; 柱層析采用200~300目中性氧化鋁; Fc-I, R-B(OH)2和K3PO4·7H2O等反應原料和助劑均為Alfa-Aesar公司產品.
德國Bruker公司500 MHz核磁共振儀(TMS作內標); 美國Nicolet公司紅外光譜儀(KBr壓片); 日本島津公司SHIMADZU LCMS 2020型液相色譜-質譜聯用儀; 德國Bruker公司Elementar var Ⅲ型元素分析儀; 德國Bruker公司Sartorius PR011型分析天平(精度10-6); 河南省予華儀器有限公司SGCX-4顯微熔點儀.
1.2 實驗過程


1.3 交叉偶聯產物的表征
化合物1~9的1H NMR和13C NMR譜見本文支持信息.


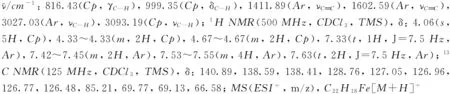
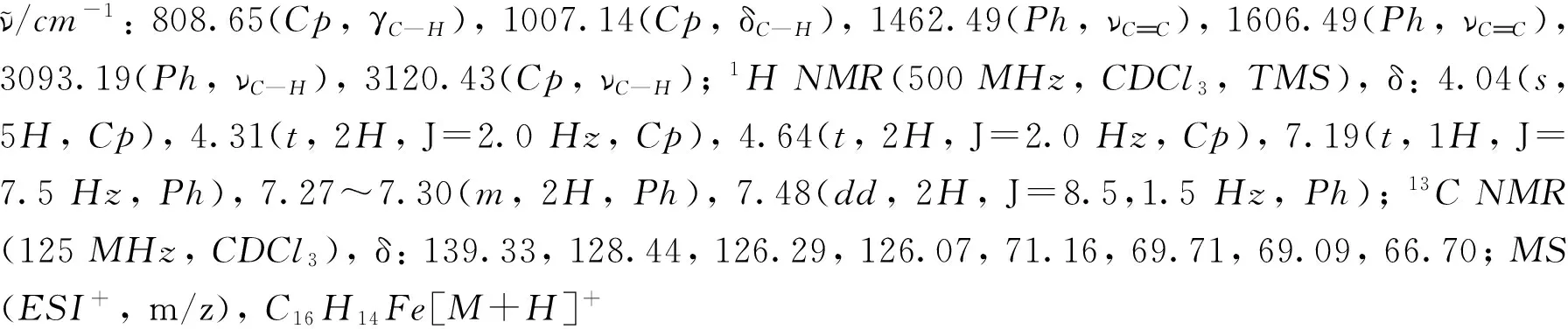
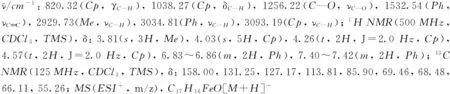
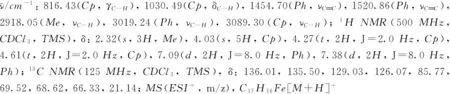
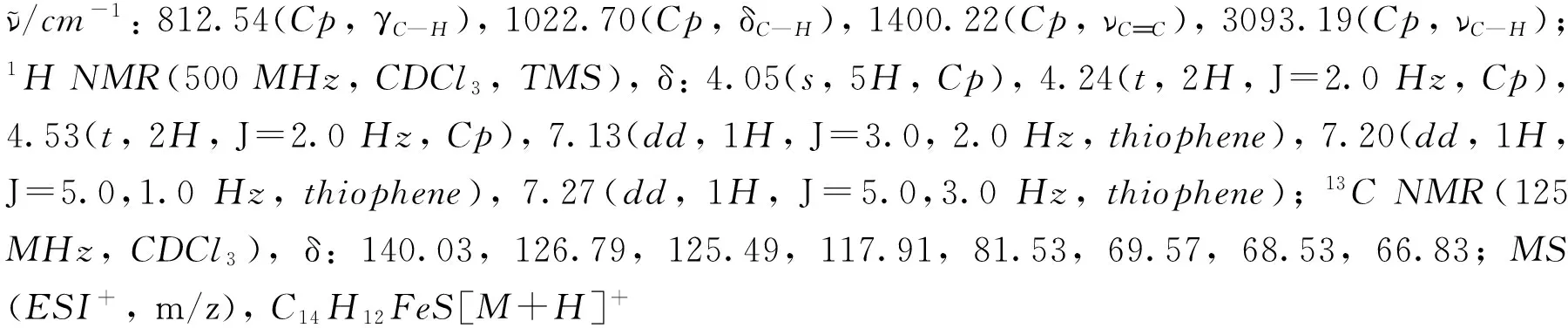
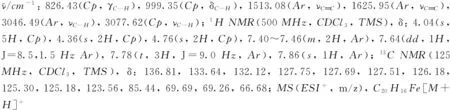

2 結果與討論
2.1 反應條件的優化
選擇DMF為反應溶劑, K3PO4·7H2O為堿助劑, 苯硼酸與碘代二茂鐵為底物的模型反應, 對5種鈀催化劑的催化活性進行了評價; 同時, 對雙二茂鐵亞胺環鈀化配合物的催化用量進行了考察, 結果見表1.

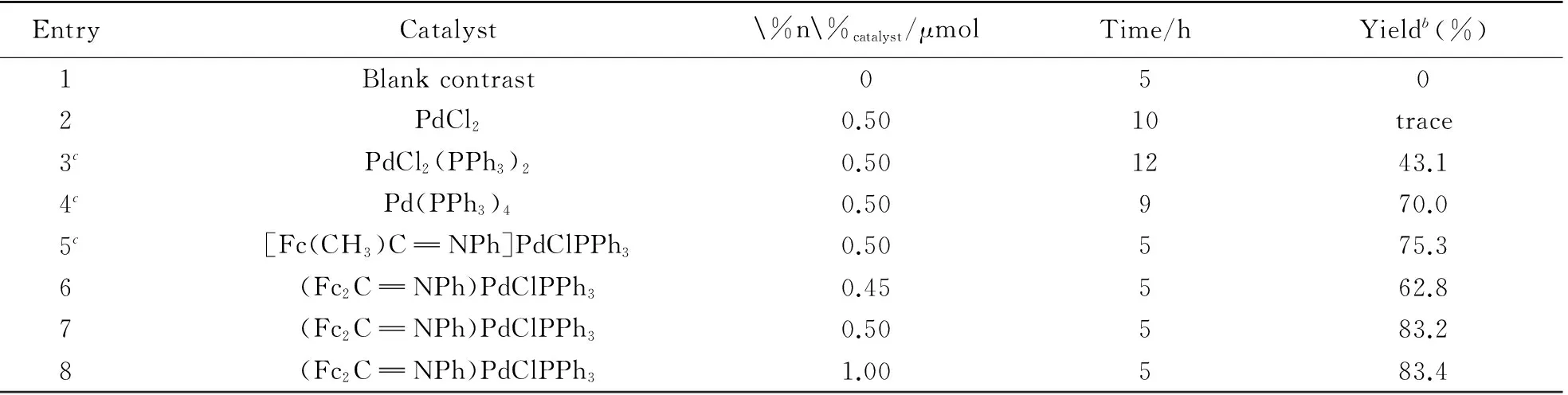
Table 1 Palladium-catalyzed Suzuki-Miyaura cross-coupling reactiona
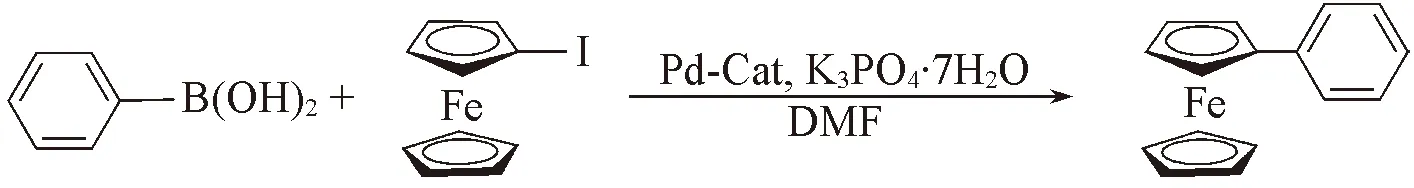
2.2 底物適應性考察
采用雙二茂鐵亞胺環鈀配合物作為催化劑, 對Suzuki-Miyaura交叉偶聯反應的底物適應范圍進行了考察, 實驗數據列于表2. 由表2數據可知, 硼酸底物的取代基R對反應產率有較大影響. 當R基的苯環對位為吸電子取代基時, 其反應產率要大于對位為推電子取代基時的反應產率(Entries 1, 2, 5, 6). 當底物的R基為苯甲醛時, 反應產率最高(90%, Entry 1). R基的共軛程度對反應產率影響不大(Entries 3, 4). 當硼酸底物的R基為芳香雜環(Entry 7)、 稠環芳烴(Entry 8)和二茂鐵基(Entry 9)時, 反應產率減少. 當R基為脂肪族烴(Entry 10)時, 催化反應活性很低.
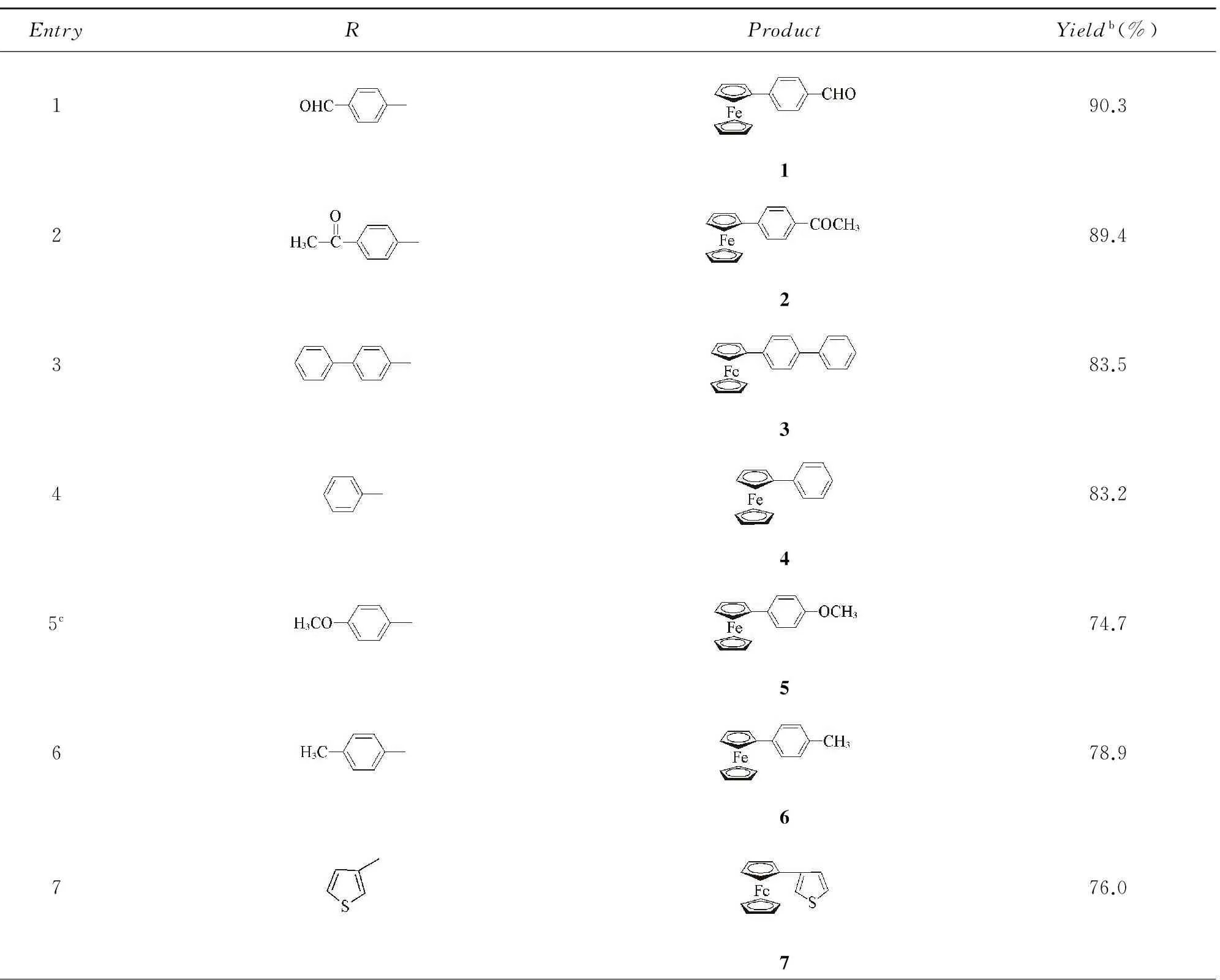
Table 2 Evaluation results for the substrate rangea
Continued
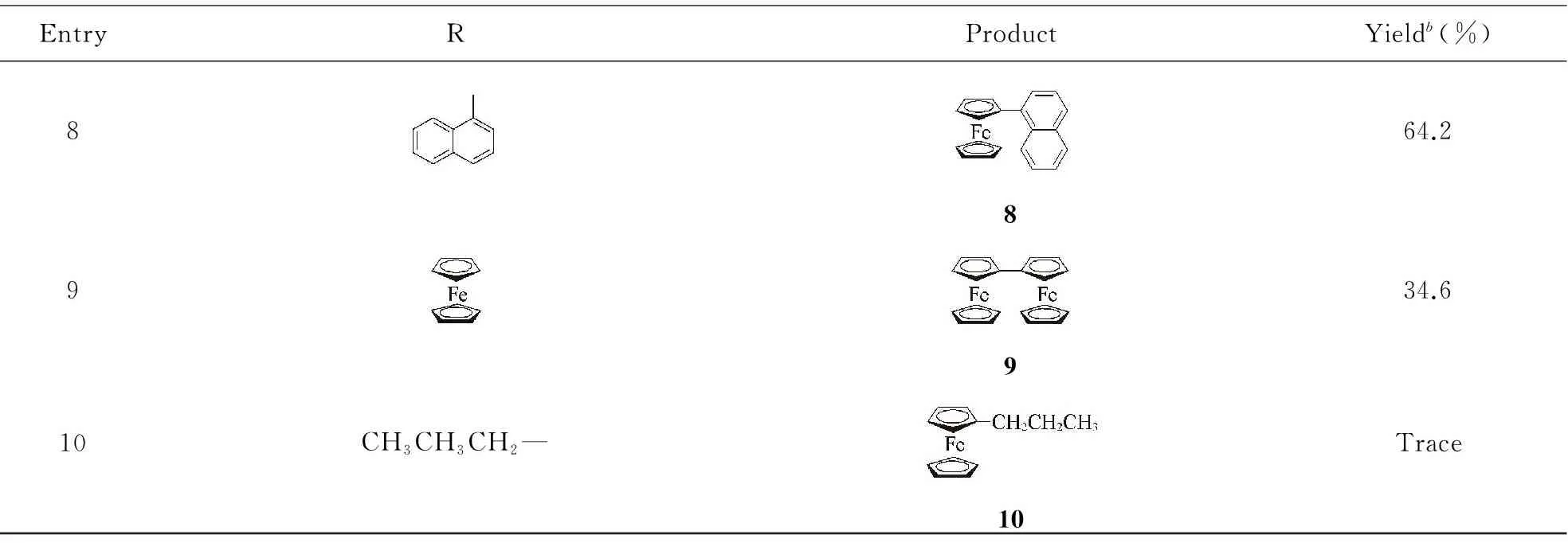
EntryRProductYieldb(%)864.28934.6910CH3CH3CH2—Trace10

本文建立的催化反應體系中, 雙二茂鐵亞胺環鈀配合物催化劑的用量較低(10-6級), 并可高效率地催化合成系列取代苯基二茂鐵、 噻吩基二茂鐵、 萘基二茂鐵和聯二茂鐵等二茂鐵衍生物.
3 反應機理推測

Fig.1 Molecule Structure of diferrocenylimine cyclopalladated complex catalyst(PdL4)
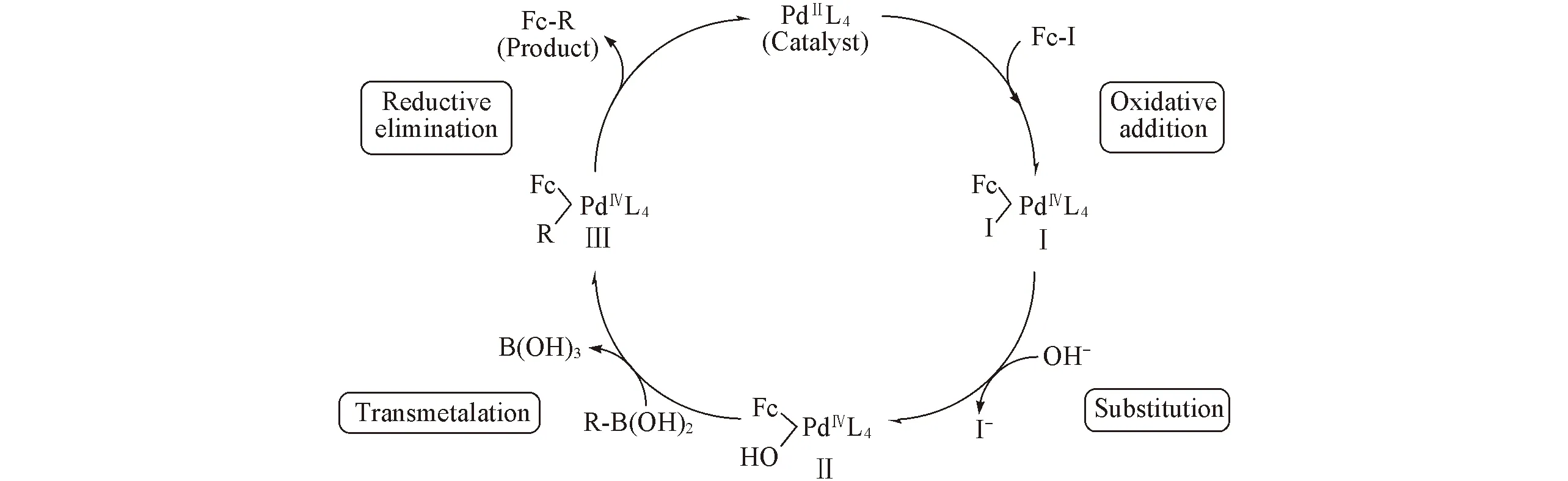
Fig.2 Catalytic cycle for C—C cross-coupling reaction
雙二茂鐵亞胺環鈀配合物催化劑(PdL4)的分子結構[28]見圖1. 由圖1可知, 配位中心的鈀離子(PdⅡ)為正二價, 4個配位原子與鈀離子形成了五元環鈀配合物. 在前人推測的碳-碳偶聯催化反應機理研究基礎[32~35]上, 本文給出了碘代二茂鐵與有機硼酸的交叉偶聯催化反應機理(圖2). 圖2表明, 催化劑(PdL4)與反應底物Fc-I首先進行氧化加成反應, 生成反應中間體Ⅰ, 同時正二價鈀離子(PdⅡ)被氧化為正四價鈀離子(PdⅣ), 并由四配位變為六配位配合物. 然后堿助劑K3PO4·7H2O水解產生的羥基OH-取代碘離子I-形成中間體Ⅱ. 再通過金屬轉移反應, 底物有機硼酸R—B(OH)2的R-基取代羥基OH-形成中間體Ⅲ, 同時釋放出硼酸B(OH)3. 最后通過還原消除反應, 生成產物Fc-R, 同時催化劑回到初始狀態PdL4, 完成催化循環.
從雙二茂鐵亞胺環鈀配合物催化劑(PdL4)的分子結構(圖1)可以推測, 亞胺基碳原子上鍵合的2個二茂鐵基, 在催化循環過程中可能對中心金屬離子PdⅡ/Ⅳ的電子得失具有促進作用, 這可能是導致該類催化劑活性較高的重要因素之一.
4 結 論
新型雙二茂鐵亞胺環鈀配合物(Fc2C=NPh)PdClPPh3催化劑對Suzuki-Miyaura交叉偶聯反應具有較高的催化活性. 利用碘代二茂鐵與各類有機硼酸進行Suzuki-Miyaura交叉偶聯反應, 使用痕量配合物催化劑, 以良好產率獲得了一系列二茂鐵衍生物(1~9). 本文實驗結果可用于設計合成帶有特殊官能團的功能二茂鐵衍生物.
支持信息見http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20150624.
[1] Cope A. C., Siekman R. W., J. Am. Chem. Soc., 1965, 87, 3272—3273
[2] Cope A. C., Friedrich E. C., J. Am. Chem. Soc., 1968, 90, 909—913
[3] Lopez C., Sales J., Solans X., Zquiak R., J. Chem. Soc., Dalton Trans., 1992, 2321—2328
[4] Huo S. Q., Wu Y. J., Du C. X., Zhu Y., Yuan H. Z., Mao X. A., J. Organomet. Chem., 1994, 483, 139—146
[5] Wu Y. J., Huo S. Q., Gong J. F., Cui X. L., Ding L., Ding K. L., Du C. X., Liu Y. H., Song M. P., J. Organomet. Chem., 2001, 637—639, 27—46
[6] Albrecht M., Chem. Rev., 2010, 110, 576—623
[7] Talancón D., López C., Font-Bardía M., Calvet T., Roubeau O., Eur. J. Inorg. Chem., 2014, 213—220
[8] Wu Y. J., Yang F., Zhang J. L., Cui X. L., Gong J. F., Song M. P., Li T. S., Chinese Sci. Bull., 2010, 55, 2784—2793
[9] Yu A. J., Li X. D., Peng D. P., Wu Y. J., Chang J. B., Appl. Organomet. Chem., 2012, 26, 301—304
[10] Gong J. F., Liu G. Y., Du C. X., Zhu Y., Wu Y. J., J. Organomet. Chem., 2005, 690, 3963—3969
[11] Zhang J. L., Wu Y. J., Li J. Y., Du C. X., Zheng J. M., Mai S. W., Song M. P., Chem. J. Chinese Universities, 2007, 28(12), 2311—2315(張金莉, 吳養潔, 李敬亞, 杜晨霞, 鄭菊梅, 麥松威, 宋毛平. 高等學校化學學報, 2007, 28(12), 2311—2315)
[12] Li Y., Fu Z. H., Rao L., Wang L., Li R., Li T. S., Wu Y. J., J. Chinese Chem. Soc., 2014, 61, 397—403
[13] Hildebrandt A., Lang H., Organometallics., 2013, 32, 5640—5653
[14] Pfaff U., Hildebrandt A., Schaarschmidt D., Rüffer T., Low P. J., Lang H., Organometallics., 2013, 32, 6106—6117
[15] Heinze K., Lang H., Organometallics., 2013, 32, 5623—5625
[16] Cheng Z. Y., Ren B. Y., Chang X. Y., Liu R., Tong Z., Chinese Chem. Lett., 2012, 23, 619—622
[17] Zhang M., Cui X. L., Chen X. P., Wang L. H., Li J. Y., Wu Y. S., Hou L. F., Wu Y. J., Tetrahedron., 2012, 68, 900—902
[18] Ma G. Z., Leng Y. T., Qiao H. J., Yang F., Wang S. W., Wu Y. J., Appl. Organomet. Chem., 2014, 28, 44—47
[19] Imrie C., Loubser C., Engelbrecht P., McCleland C. W., J. Chem. Soc., Perkin Trans., 1999, 1, 2513—2523
[20] Beletskaya I. P., Tsvetkov A. V., Latyshev G. V., Tafeenko V. A., Lukashev N. V., J. Organomet. Chem., 2001, 637-639, 653—663
[21] Luo M. H., Han L. M., Zhu N., Hong H. L., Xie R. J., Suo Q. L., Weng L. H., J. Coord. Chem., 2010, 63, 3805—3815
[22] Xu C., Li H. M., Wang Z. Q., Lou X. H., Fu W. J., Monatsh Chem., 2014, 145, 767—773
[23] Wang Y. C., Li X. Y., Li Y. J., Pan Y. M., Cheng K. G., Wang H. S., Chem. Res. Chinese Universities, 2014, 30(4), 614—618
[24] Yang F. Z., Zhang M., Xie J., Xie D. S., Fu L., Chem. J. Chinese Universities, 2015, 36(5), 914—918(楊鳳志, 張曼, 謝謹, 謝東升, 傅磊. 高等學校化學學報, 2015, 36(5), 914—918)
[25] Purecha V. H., Nandurkar N. S., Bhanage B. M., Nagarkar J. M., Tetrahedron Lett.. 2008, 49, 5252—5254
[26] Long B. H., Yang Y. B., Wang L. X., He W. M., Xiang J. N., Synth.Commun., 2010, 40, 1202—1208
[27] Imrie C., Engelbrecht P., Loubser C., McCleland C. W., Nyamori V. O., Bogardi R., Levendis D. C., Tolom N., Rooyen J. V., Williams N., J. Organomet. Chem., 2002, 645, 65—81
[28] Han L. M., Ke C. L., Zhang D. Z., Gao Y. Y., Zhu N., Xie R. J., Wang Y. Q., Suo Q. L., Polyhedron., 2015, 85, 621—626
[29] Oskooie H. A., Heravi M. M., Behbahani F. K., Molecules., 2007, 12, 1438—1446
[30] Ranger M., Rondeau D., Leclerc M., Macromolecules., 1997, 30, 7686—7691
[31] Mihigo S. O., Mammo W., Bezabih M.,. Marobel K. A, Abegaz B. M., Bioorgan.& Medic. Chem., 2010, 18, 2464—2473
[32] Deprez N. R., Sanford M. S., J. Am. Chem. Soc., 2009, 131, 11234—11241
[33] Garcia-Melchor M., Braga A. A. C., Lledos A., Ujaque G., Maseras F., Accounts Chem. Res., 2013, 46, 2626—2634
[34] Sun H. Y., Kubota K., Hall D. G., Chem. Eur. J., 2015, 21, 1—10
[35] Zhang G. D., Sun S. Y., Yang F., Zhang Q., Kang J. X., Wu Y. S., Wu Y. J., Adv. Synth. Catal., 2015, 357, 443—450
(Ed.: V, Z)
? Supported by the National Natural Science Foundation of China(Nos.21266019, 21062011, 21362019), the Program for New Century Excellent Talents in University, China(No.NCET-08-858) and the Inner Mongolia Autonomous Region Higher Scientific Research Program, China(No.NJZY14060).
High Efficency Synthesis of Ferrocenyl Derivatives Catalyzed by Trace Amount Cyclopalladated Complex?
SUO Quanling, ZHANG Danzhao, KE Chunlong, ZHU Ning, GAO Yuanyuan, XIE Ruijun, HAN Limin*
(Chemical Engineering College, Inner Mongolia University of Technology, Hohhot 010051, China)
A series of ferrocenyl derivatives with special substituent(1—9) in middle to excellent yields was synthesized by Suzuki-Miyaura cross-coupling reaction using new diferrocenylimine cyclopalladated complex(Fc2C=NPh)PdClPPh3(Fc=Ferrocenyl, Ph=Phenyl) as catalyst and Fc-I as reactant. The cross-coupling reaction conditions were optimized and the substrate scope was investigated, and a synthetic route was given for preparing ferrocenyl derivatives and the catalytic reaction mechanism was deduced. The results show that the complex catalyst highlights the features of high catalytic activity, trace catalyst loading, wide substrate scope, excellent reaction efficiency and insensitive to air and moisture for synthesizing ferrocenyl derivatives.
Cyclopalladated complex; High active palladium catalyst; Cross-coupling; Ferrocenyl derivative; Reaction mechanism
10.7503/cjcu20150624
2015-08-06.
日期: 2016-01-13.
國家自然科學基金(批準號: 21266019, 21062011, 21362019)、 教育部新世紀人才支持計劃(批準號: NCET-08-858)和內蒙古自治區高等學校科學研究項目(批準號: NJZY14060)資助.
O643; O621.3
A
聯系人簡介: 韓利民, 男, 博士, 教授, 主要從事合成化學和電化學方面的研究. E-mail: hanlimin_442@hotmail.com

