超高效液相色譜串聯質譜法同時測定馬尾藻中4種內源性植物激素
易 勇 唐 旭 林錫煌 劉源森 林 凌 徐長安*
1(國家海洋局第三海洋研究所, 廈門 361005) 2(福建農林大學食品學院, 福州 350002)
?
超高效液相色譜串聯質譜法同時測定馬尾藻中4種內源性植物激素
易 勇1,2唐 旭1林錫煌1劉源森1林 凌1徐長安*1
1(國家海洋局第三海洋研究所, 廈門 361005)2(福建農林大學食品學院, 福州 350002)
建立了利用超高效液相串聯質譜法(UPLC-MS/MS)同時測定馬尾藻中4種植物激素(吲哚乙酸、吲哚丁酸、脫落酸、玉米素)的方法。馬尾藻樣品經過70%甲醇提取后,經PCX+PAX固相小柱凈化,使用反相C18色譜柱分離。以5 mmol/L乙酸銨(含0.01%甲酸)和甲醇作為流動相進行梯度洗脫,采用多反應離子監測模式(MRM)分析測定。在0.01~1.0 μg/mL內,各種植物激素的相關系數均大于0.9990。4種植物激素的回收率為84.3%~102.1%,相對標準偏差為1.1%~6.4%。本方法的檢出限為0.025~0.2 μg/kg。
馬尾藻; 雙柱聯用; 超高效液相色譜串聯質譜; 內源性植物激素
1 引 言
海藻是海洋資源的重要組成部分,是一種低等隱花植物,有綠藻、褐藻、紅藻、藍藻等10門。研究發現,海藻中含有許多活性物質,可以開發成海洋醫藥、保健、化妝用品等[1]。馬尾藻是一類褐藻(Phaeophyta),作為海藻中的大型經濟海藻,其種類超過250種,廣泛分布于暖水和溫暖的海域。我國的廣東和廣西沿海盛產馬尾藻,約有60種[2]。大量研究發現,海藻中的促生長物質對陸生植物具有顯著的促生長作用[3],已有一些基于海藻植物生長調節劑的商業產品出現[4]。我國作為農業大國,隨著海藻生長調節劑的商業化進程,對于馬尾藻植物激素的檢測方法的開發顯得十分的必要。
海藻植物激素是一類十分重要的內源植物激素,含有吲哚乙酸(IAA)、吲哚丁酸(IBA)、脫落酸(ABA)及玉米素(ZT)等植物激素[5,6]。目前,對于海藻中植物激素的研究報道很少,并且國內未建立相關標準,多組分植物生長調節劑檢測方法的國家標準也尚未建立。因此選擇合適的檢測方法對于海藻植物激素的檢測顯得更加重要。目前,關于植物激素的檢測方法主要有三大類,分別是生物測試、免疫檢測和儀器分析方法。其中,儀器分析方法具有高靈敏度和高選擇性的優勢,特別是液相色譜-串聯質譜法,是近年來生物化學中常用的檢測技術[7~9]。
目前,還未見雙柱聯用凈化方法用于馬尾藻植物激素檢測的報道,關于固相萃取文獻中的方法大多數只能檢測同一類性質的植物激素[10]。鐘冬蓮等[11]采用HPLC-MS/MS法成功測定了毛竹筍4種典型的內源性植物激素。本研究采用固相萃取雙柱聯用凈化的方法,可以同時檢測多組分不同性質的植物激素,大大縮短了檢測時間。此外本研究采用超高效液相色譜串聯質譜法對海藻中的4種植物激素同時進行分析檢測,并探究了檢測條件、前處理技術和方法學。
2 實驗部分
2.1 儀器與試劑
Acquity超高效液相色譜儀(二極管列陣檢測器,美國Waters公司); Extrapid柱-盤手動固相萃取儀(北京萊伯泰科儀器股份有限公司); QTrap5500線性離子阱串聯質譜儀(美國AB Sciex公司); Milli-Q超純水儀(美國Millipore公司); 循環水式多用真空泵(鄭州長城科工貿有限公司); Neofuge 15R高速冷凍離心機(上海力申科學儀器有限公司); KQ-300E超聲清洗器(昆山市超聲儀器有限公司); BAS124S電子天平(賽多利斯科學儀器有限公司); R-215旋轉蒸發器(德國BUCHI公司); 津騰溶劑過濾器(天津市津騰實驗設備有限公司); IKA-Tisbasi組織勻漿機(德國IKA公司); 固相小柱PAX和PCX(月旭材料科技(上海)有限公司)。
標準品:吲哚乙酸、吲哚丁酸、玉米素、脫落酸 (美國Sigma公司); 甲醇(色譜純,美國Spectrum公司); 甲酸(色譜純,天津光復精細化工研究所); 乙酸銨(分析純,國藥集團化學試劑股份有限公司); 2,6-二叔丁基-4-甲基苯酚(BHT 生工生物工程(上海)股份有限公司); 氨水(分析純,西隴化工股份有限公司); 水為Milli-Q超純水; 緩沖溶液(含0.1%甲酸、0.5 mmol/L乙酸銨,pH 3.1)。
2.2 標準溶液的制備
標準溶液配制:分別準確稱取10 mg(精確到0.01 mg)的IAA, IBA, ABA和ZT標準品,用100% 甲醇定容到100 mL,配制100 μg/mL的標準貯備液,密封, 于-20℃儲存。分別吸取上述標準貯備液1 mL 于10 mL容量瓶中,用液相體系(60%緩沖溶液和40%甲醇,V/V)定容,配制成10 μg/mL的混合標準溶液,并進一步稀釋成一系列的標準溶液,待測。
2.3 樣品制備
2.3.1 樣品前處理 馬尾藻四月下旬采集于東山島,潔凈海水漂洗多次,用吸水紙將表面吸干,-20℃保存。參考QuEChERS(Quick Easy Cheap Effective Rugged Safe)快速前處理方法的稱樣量[12],準確稱取10 g鮮海藻樣品(精確至0.01 g),剪切破碎后,用勻漿機勻漿,加入30 mL 70% 甲醇溶液和5 mg抗氧化劑BHT,置于超聲波中提取15 min。再將提取液于8000 r/min條件下離心5 min,上清液轉移至100 mL燒杯中。將上清液于0.04 MPa、100 r/min、35℃條件下減壓濃縮至1 mL。
2.3.2 樣品凈化
分別用2 mL 100% 甲醇活化和2 mL 0.05% 甲酸溶液平衡固相萃取小柱PCX,然后將前處理好的1 mL濃縮液上樣,收集流出液; 再用2 mL 10% 甲醇溶液淋洗,收集淋洗液,最后用2 mL氨水-甲醇溶液(5∶95,V/V)洗脫,收集洗脫液。將淋洗液和流出液合并,上樣于2 mL 100% 甲醇活化和2 mL 0.1% 甲酸平衡好的固相萃取小柱PAX,再用2 mL 10%甲醇溶液淋洗,最后用2 mL 甲酸-甲醇溶液(5∶95,V/V)洗脫,收集洗脫液。合并兩次洗脫液,于0.03 MPa、100 r/min、35℃條件下減壓濃縮至干。再準確加入1.0 mL配制好的緩沖水溶液渦旋振蕩溶解殘留物,經0.22 μm濾膜過濾后,使用UPLC-MS/MS分析檢測。
2.4 超高效液相色譜串聯質譜檢測條件
2.4.1 超高效液相色譜條件 ACQUITY UPLC CSH C18色譜柱(100 mm×2.1 mm,1.7 μm; Waters公司); 柱溫:35℃; 樣品溫度:25℃; 進樣體積: 5 μL; 流速:0.3 mL/min; 流動相: 60% 緩沖溶液為流動相A、40%甲醇為流動相B; 洗脫程序:0~7 min,60%~20% A; 7~9 min,20%~60% A; 9~12 min,60% A。
2.4.2 質譜條件 離子源:電噴霧離子源(ESI); 掃描方式:多反應監測(MRM); 采用正離子掃描模式; 電噴霧電壓(IS):5500 V; 霧化氣電壓(GS1):50 V; 碰撞氣壓力(CAD):Mediun; 氣簾氣電壓(CUR):30 V; 輔助氣電壓(GS2):50 V; 離子源溫度(TEM):500℃。
3 結果與討論
3.1 前處理提取溶劑的優化
由于植物激素大多數是結構復雜的有機物[13],所以使用有機溶劑提取。本研究考察了不同濃度(100%, 90%, 70%和 50%)甲醇溶液的提取效果,為維持植物激素的穩定性,溶液中添加抗氧化劑BHT。每組設3個平行,通過UPLC-MS/MS法分別測定4種內源植物激素含量。
由表1可知,采用70%甲醇提取,得到的植物激素含量最高。由于植物激素吲哚乙酸在高溫甚至常溫下,時間過長易于分解; 如果水系過多,濃縮時需要更多的時間,不利于植物激素的提取,因此70%甲醇提取植物激素吲哚乙酸提取量較低。如果有機溶劑含量過多,有機溶劑除了溶解植物激素外,還溶解了植物體中含有的許多其它的有機物,它們之間可能發生物理化學反應,不利于吲哚乙酸的穩定,造成吲哚乙酸含量的減少,100%和90%甲醇提取吲哚乙酸含量較少可能與此有關。綜合考慮,本研究選擇70%甲醇進行馬尾藻內源性植物激素的提取。
表1 不同提取方式所得馬尾藻中4種植物激素的含量
Table 1 Plant hormone content with different extraction methods
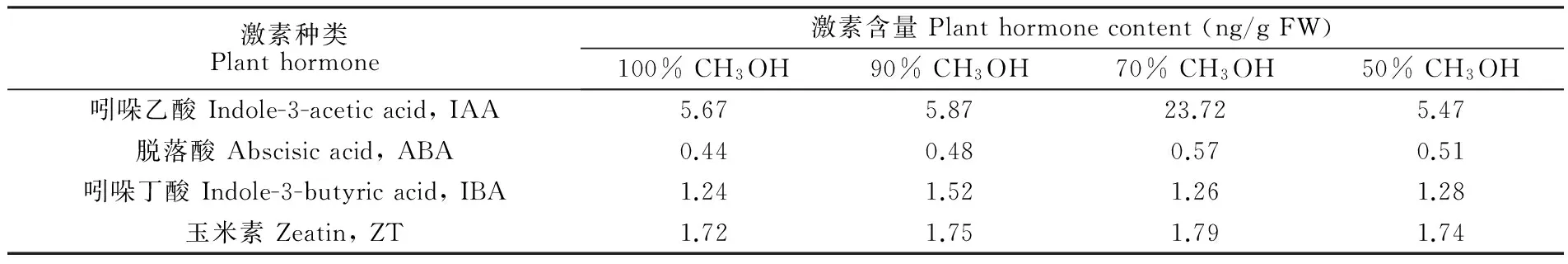
激素種類Planthormone激素含量Planthormonecontent(ng/gFW)100%CH3OH90%CH3OH70%CH3OH50%CH3OH吲哚乙酸Indole-3-aceticacid,IAA5.675.8723.725.47脫落酸Abscisicacid,ABA0.440.480.570.51吲哚丁酸Indole-3-butyricacid,IBA1.241.521.261.28玉米素Zeatin,ZT1.721.751.791.74
3.2 凈化方法的優化
提取海藻植物激素常采用甲醇作為溶劑,然而在經多次萃取的離心后,會有大量色素、醌類和酚類等雜質溶入提取液中,如果這些物質不經過凈化去除,就會對儀器的靈敏度和準確度產生很大影響,同時也會縮短色譜柱使用壽命。為了最大程度降低雜質的干擾,通常采用固相萃取小柱進行凈化處理[14]。在植物激素中,同時含有酸性和堿性植物激素,所以采用單純的陽離子或者陰離子固相小柱凈化,都會使部分植物激素損失。在實驗過程中,發現如果單獨采用PAX固相小柱進行處理,采用10 μg/mL 混合標準品的測試,會發生部分損失,這樣不利于植物激素的準確檢測,其結果見圖1a。由于PAX固相小柱為陰離子固相小柱,對陽離子(如H+)有吸附作用,對堿性的植物激素玉米素的吸附作用較差,其大部分作為流出液流出,檢測結果見圖1g,因此采用PCX+PAX雙柱聯用的方法。在優化相關條件基礎上,雙柱聯用吸附效果較好(圖1c)。
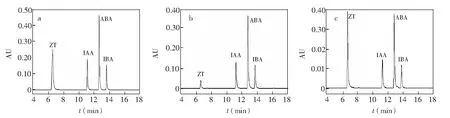
圖1 4種植物激素混合標準品(a)及其經PAX固相小柱凈化(b), 經PCX+PAX固相小柱凈化(c) 的液相色譜圖Fig.1 Chromatograms of the standard mixture (a), after purified by PAX solid-phase (b) and after purified by PCX and PAX solid-phase (c)色譜條件: ACQUITY UPLC CSH C18柱色譜柱(100 mm×2.1 mm,1.7 μm,Waters公司); 柱溫: 35℃; 樣品溫度: 25℃; 進樣體積: 10 μL; 流速: 0.15 mL/min; 波長268 nm; 流動相: 90%緩沖水溶液為流動相A、 10%甲醇為流動相B; 洗脫程序: 0~15 min,90%~10% A,15~18 min,10%~90% A,18~20 min,90% A。Conditions of (C): ACQUITY UPLC CSH C18 column (100 mm×2.1 mm,1.7 μm,Waters Co.); column temperature: 35℃; sample temperature 25℃; injection volume: 10 μL; flow rate: 0.15 mL/min; wavelenth: 268 nm; mobile phase: 90% buffer solution as mobile phase A; 10% methanol as mobile phase B; Elution program: 0~15 min,90%~10% A; 15~18 min,10%~90% A; 18~20 min,90% A.
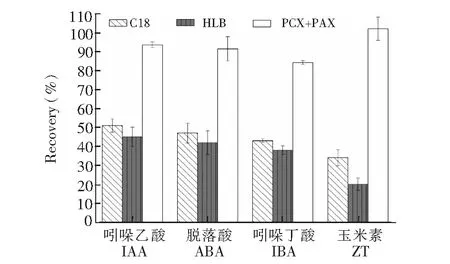
圖2 3種固相萃取方式的凈化回收率Fig.2 Recovery efficiencies for the three kinds of solid-phase extraction
固相萃取是植物激素研究常用的凈化方式,為了考察凈化效果和液相色譜柱上的保留行為,本研究考察了3種固相萃取方式,并以凈化回收率作為考察依據,如圖2所示,PCX+PAX的方式具有較好的回收率,回收率平均達到90%以上,而C18和HLB的回收率較差,平均不足50%,為了保證方法的凈化效果和準確度,最終選擇PCX+PAX雙柱聯用的方式。
3.3 色譜條件的優化
相對于BEH C18色譜柱,本研究選用的CSH C18色譜柱可以提供更好的峰形和峰之間的分辨率,并且雜質干擾較少[15]。
分別采用甲醇和乙腈作為流動相,發現流動相為乙腈時,樣品出峰時間較早,當4種植物激素組分同時進樣時,采用乙腈流動相標準品色譜峰之間的分辨率低于甲醇流動相的色譜標準品峰,因此采用甲醇作為洗脫流動相。同時考察了不同初始流動相比例,在初始流動相中甲醇體積占85%和10%,色譜峰的結果分別如圖3所示,其它色譜條件見2.4.1節。
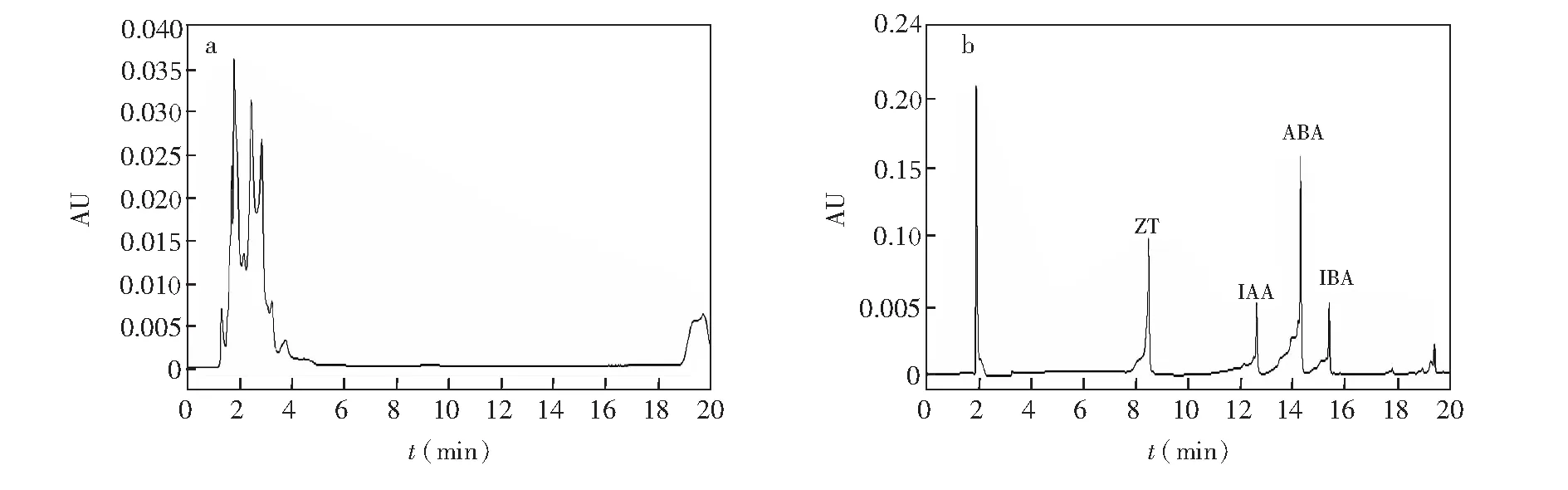
圖3 采用85%甲醇初始流動相(a) 和10%甲醇初始流動相(b)的混合標準溶液色譜圖Fig.3 Chromatograms of the mixed standard solution with 85% methanol of mobile phase (a) and with 10% methanol of mobile phase (b)
較高比例(85%)的甲醇不利于4種植物激素色譜峰的分開。可能是由于極性不夠,不足以分開4種植物激素色譜峰。同時,當甲醇比例降低時,出現峰形較差和溶劑效應,在2 min左右出現溶劑峰。在本研究過程中發現, 在流動相的水系中添加少量乙酸銨可以增加離子化效率,進而表現出較好的峰形和靈敏度。此外,為了保證本實驗的重復性和穩定性,同時維持水系酸度的穩定,在流動相的水系中再添加少量甲酸。圖4為添加乙酸銨和甲酸的4種植物激素混合標準溶液的色譜峰圖,檢測器為Qtrap5500質譜檢測器,檢測條件見2.4.2節。
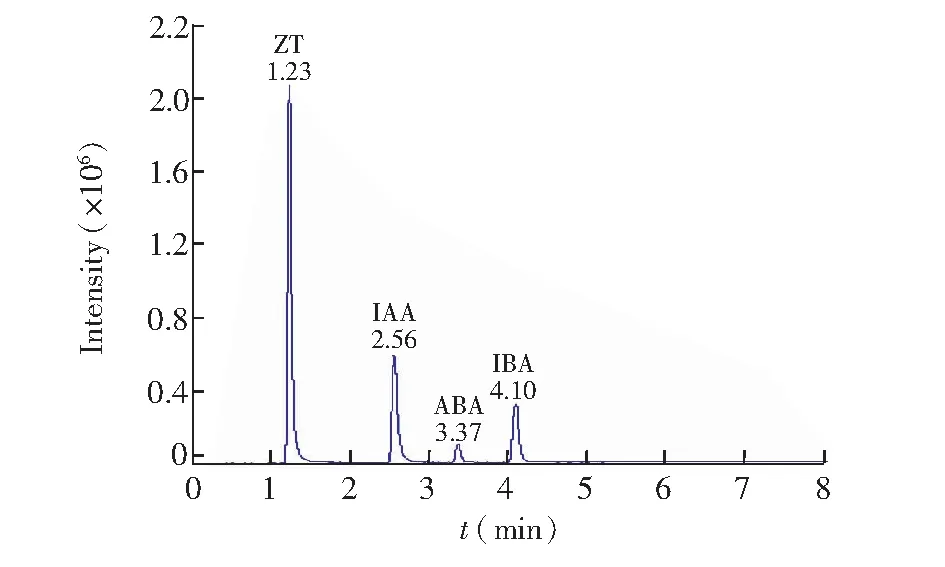
圖4 添加乙酸銨和甲酸后四種植物激素混合標準溶液的色譜峰圖Fig.4 Liquid chromatogram for the mixed standard solution of the four plant hormones with the addition of ammonium acetate and formate
3.4 質譜條件的優化
在電噴霧離子源(ESI)、正離子模式下,使用注射針泵,以20 μL/min的流速注入IAA、ABA、IBA和ZT標準品,在m/z100~300的掃描范圍內分別對各物質進行MS onLy質譜掃描,確定IAA、ABA、IBA和ZT的分子離子,然后進行Product MS2掃描,調節碰撞能量CE(Collsion energy)確定合適的子離子(子離子質譜圖如圖5)。最后進行MRM模式掃描,分別對上述4種生長素優化CE 、去簇電壓DP(Declustering potential)等,使信號強度達到最佳響應值(表2)。
3.5 方法評價
3.5.1 方法的標準曲線、線性范圍和檢出限 取10 μg/mL混合標準溶液, 配制成質量濃度分別為0.01, 0.1, 0.25, 0.5和1 μg/mL的混合標準溶液,繪制標準曲線(以質量濃度為X軸,對應的峰面積為Y軸)。結果表明,在0.01~1.0 μg/mL的質量濃度范圍內具有良好的線性關系,相關系數均大于0.9990,見表3。
結果表明,本方法對4種化合物檢出限較低,適于檢測馬尾藻內源性植物激素含量。另外,馬尾藻通過凈化后,4種植物激素的基質效應系數均為負值,具有明顯的基質減弱效應,表明本方法中的前處理凈化方式的凈化效果明顯,適用于馬尾藻的基質。
表2 4種植物激素的質譜條件
Table 2 Mass spectrometry conditions for the four plant hormones

目標分析物Analyte母離子Parention(m/z)子離子Daughterion(m/z)碰撞能量Collsionenergy(eV)去簇電壓Declusteringpotential(V)IAA176.0130.0*102.93543100IBA204.0130.1*144.1422195ABA265.1187.2*201.11917105ZT220.1136.0*118.9264890*定量離子(Quantitativeion)。
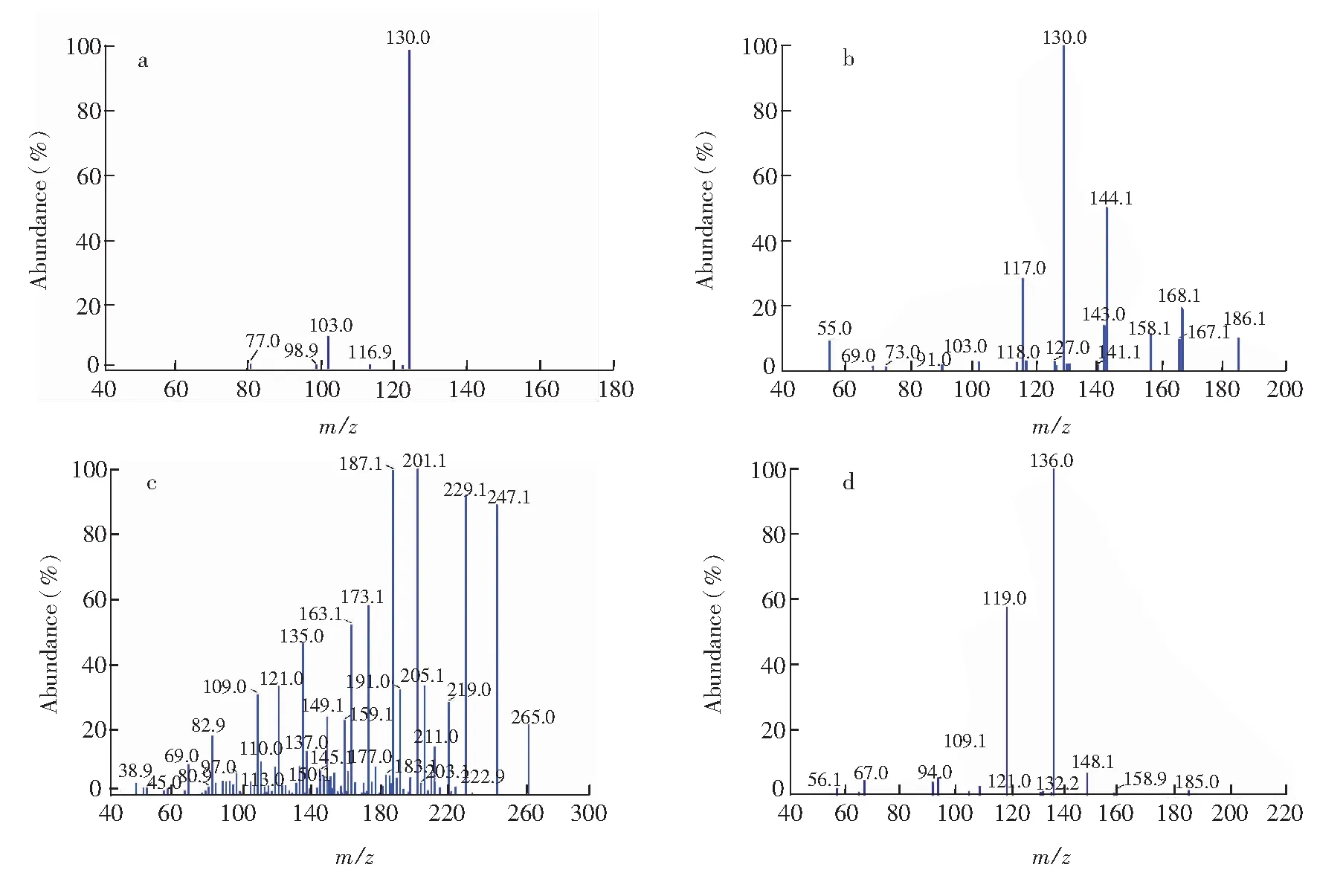
圖5 IAA(a), IBA(b), ABA(c)和 ZT(d)的子離子質譜圖Fig.5 Mass chromatograms of IAA ion (a), IBA ion (b), ABA ion (c) and ZT ion (d)
表3 4種植物激素的線性方程及檢出限
Table 3 Linearity and detection limits of the four plant hormones
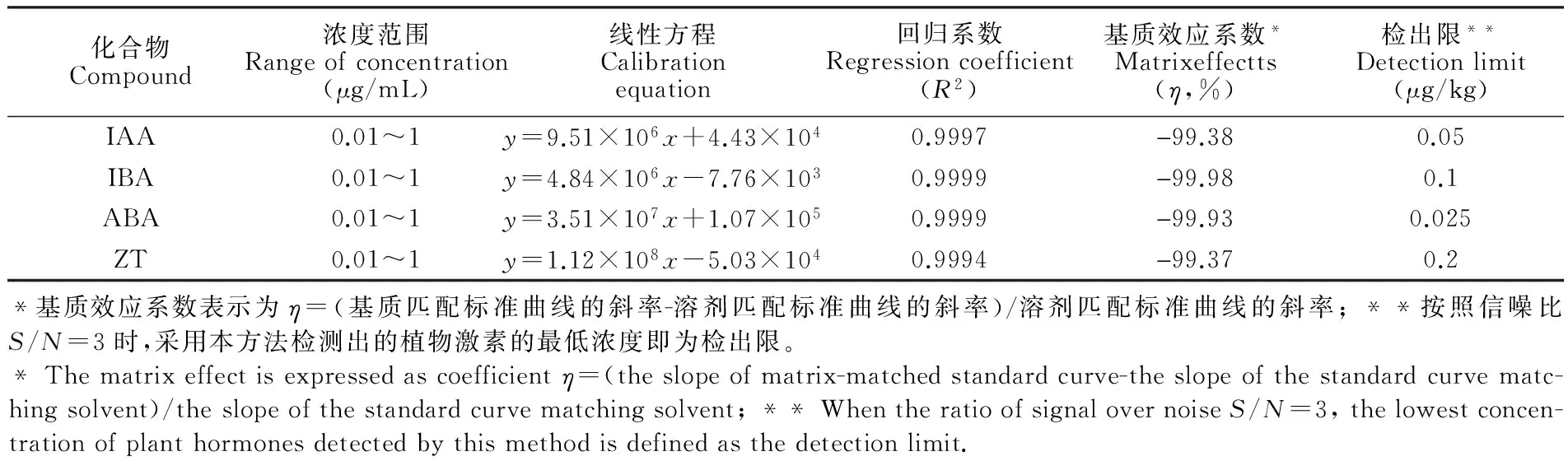
化合物Compound濃度范圍Rangeofconcentration(μg/mL)線性方程Calibrationequation回歸系數Regressioncoefficient(R2)基質效應系數*Matrixeffectts(η,%)檢出限**Detectionlimit(μg/kg)IAA0.01~1y=9.51×106x+4.43×1040.9997-99.380.05IBA0.01~1y=4.84×106x-7.76×1030.9999-99.980.1ABA0.01~1y=3.51×107x+1.07×1050.9999-99.930.025ZT0.01~1y=1.12×108x-5.03×1040.9994-99.370.2*基質效應系數表示為η=(基質匹配標準曲線的斜率-溶劑匹配標準曲線的斜率)/溶劑匹配標準曲線的斜率;**按照信噪比S/N=3時,采用本方法檢測出的植物激素的最低濃度即為檢出限。*Thematrixeffectisexpressedascoefficientη=(theslopeofmatrix-matchedstandardcurve-theslopeofthestandardcurvematc-hingsolvent)/theslopeofthestandardcurvematchingsolvent;**WhentheratioofsignalovernoiseS/N=3,thelowestconcen-trationofplanthormonesdetectedbythismethodisdefinedasthedetectionlimit.
表4 不同樣品激素的檢測含量、回收率及相對標準偏差(n=3)
Table 4 Detected contents, recovery efficiencies and relative standard deviations for different hormone samples
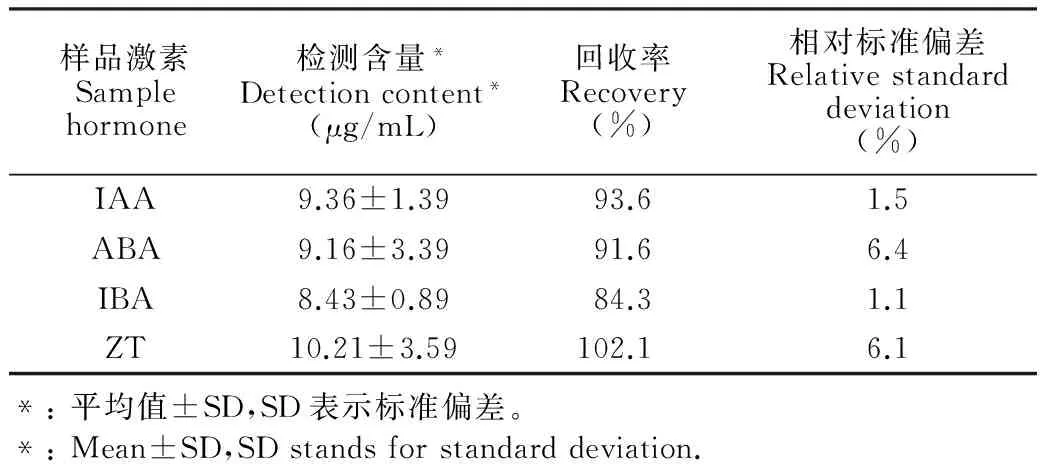
樣品激素Samplehormone檢測含量*Detectioncontent*(μg/mL)回收率Recovery(%)相對標準偏差Relativestandarddeviation(%)IAA9.36±1.3993.61.5ABA9.16±3.3991.66.4IBA8.43±0.8984.31.1ZT10.21±3.59102.16.1*:平均值±SD,SD表示標準偏差。*:Mean±SD,SDstandsforstandarddeviation.
3.5.2 方法的準確度和精密度 分別向馬尾藻的空白基質樣品中添加10 μg/mL的混合標準溶液,按照2.3.2節的方法進行處理,通過對比峰面積計算回收率,見表4。
結果表明,本方法回收率較高,相對標準偏差小于10%。方法具有足夠的靈敏性,準確可靠。
3.6 方法應用
為驗證本方法的適用性和實用性,應用本方法對采自東山島及市售的不同種類海藻(馬尾藻、海帶、龍須菜、海苔、紅藻)進行檢測,結果表明,樣品中IAA植物激素含量均較高,1.59~15.93 μg/kg,遠高于本方法的檢出限; 其它植物激素(如IBA, ABA, ZT)含量較低,分別為0.57~3.11 μg/kg, 0.08~0.29 μg/kg和0~0.30 μg/kg。同時, 凈化方法在基質效應方面可以進一步優化,為海藻中的植物激素檢測分析提供一種可靠的方法。
4 結 論
本方法在樣品前處理凈化過程中,采用雙柱聯用凈化的方法,同時凈化并保留了酸性生長素和堿性生長素。使得可以同時檢測馬尾藻中的4種不同性質的植物激素含量。本方法是一種簡單有效快捷的方法,滿足對于馬尾藻植物激素的檢測需求,為海藻生長調節劑的商業化進程提供技術支持。
1 Lü Hui-Min, ZHANG Kan.FoodScienceandTechnology, 1998, 6: 29-30
呂惠敏, 張 侃. 食品科技, 1998, 6: 29-30
2 ZHOU Qi-Cun, XIAO Feng-Bo.Marinescience, 2003, 27(3): 66-69
周歧存, 肖風波. 海洋科學, 2003, 27(3): 66-69
3 Gauraw K, Dinabandhu S.JournalofAppliedPhycology, 2011, 23(2): 251-255
4 QIN Qing, ZHANG Wen-Ju, ZHANG Tao.ChineseAgriculturalScienceBulletin, 2001, 17(1): 46-49
秦 青, 張文舉, 張 濤. 中國農學通報, 2001, 17(1): 46-49
5 WANG Ze-Wen, SUN Wei-Hong, LIU Tao, ZHAI Yu-Xiu, XING Li-Hong, MIAO Jun-Kui, LENG Kai-Liang.ProgressinFisherySciences, 2011, 32(1): 94-98
王澤文, 孫偉紅, 劉 濤, 瞿毓秀, 邢麗紅, 苗鈞魁, 冷凱良. 漁業科學進展, 2011, 32(1): 94-98
6 HAN Li-Jun, FAN Xiao, YUAN Zhao-Hui.OceanologiaEtLimnologiaSinica, 2003, 36(2): 167-170
韓麗君, 范 曉, 袁兆惠. 海洋與湖沼, 2003, 36(2): 167-170
7 TANG Li-Juan, WAN Yi-Qun.FoodScience, 2009, 30(21): 393-398
唐莉娟, 萬益群. 食品科學, 2009, 30(21): 393-398
8 Xue J Y, Wang S L, You X W, Dong J, Han L, Liu F.RapidCommun.MassSpectrom., 2011, 25(21): 3289-3297
9 BAI Yu, DU Fu-You, BAI Yu, LIU Hu-Wei.ChineseBulletinofLifeSciences, 2010, 22(1): 36-44
白 玉, 杜甫佑, 白 玉, 劉虎威. 生命科學, 2010, 1(22): 36-44
10 Dobrev P I, Havlicek L, Vagner M, Malbeck J, Kaminek M.J.Chromatogr.A, 2005, 1075: 159-166
11 ZHONG Dong-Lian, DING Ming, TANG Fu-Bin, MO Run-Hong, TENG Ying.ChineseJ.Anal.Chem., 2013, 41(11): 1739-1743
鐘冬蓮, 丁 明, 湯富彬, 莫潤宏, 滕 瑩. 分析化學, 2013, 41(11): 1739-1743
12 Shi X M, Jin F, Huang Y T, Du X, Li C, Wang M, Shao H, Jin M, Wang J.J.Agric.FoodChem., 2012, 60(1): 60-65
13 Zhong Q S, Qiu X X, Lin C Y, Shen L, Huo Y, Zhan S, Yao J, Huang J, Kawano S, Hashi Y, Xiao L, Zhou T.J.Chromatogr.A, 2014, 1359: 131-139
14 HUANG Bing-Xin, FAN Xiao, HAN Li-Jun.OceanologiaEtLimnologiaSinica, 2002, 33(5): 509-514
黃冰心, 范 曉, 韓麗君. 海洋與湖沼, 2002, 33(5): 509-514
15 Flokova K, Tarkowska D, Miersch O, Strnad M, Wasternack C, Novak O.Phytochemistry, 2014, 105: 147-157
(Received 22 July 2015; accepted 18 September 2015)
Simultaneous Determination of 4 Kind of Plant Hormones in Sargassum by Ultra Performance Liquid Chromatography Tandem Mass Spectrometry
YI Yong1,2, TANG Xu1, LIN Xi-Huang1, LIU Yuan-Sen1, LIN Ling1, XU Chang-An*1
1(ThirdInstituteofOceanography,StateOceanicAdministration,Xiamen361005,China)2(CollegeofFoodScience,FujianAgricultureandForestryUniversity,Fuzhou350002,China)
A method of simultaneous determination of four kind of auxins (Indole-3-acetic acid, Indole-3-butyric acid, Abscisic acid, Zeatin) in sargassum by ultra performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS) was established. After extracted by 70% methanol, the samples were enriched by the PCX and PAX solid-phase column. Then the samples were purified by reversed phase C18column using 5 mmol/L ammonium acetate (containing 0.01% formic acid) and methanol as a mobile phase in gradient elution. On the base of multiple reaction monitoring (MRM) analysis, the results showed that the correlation coefficient for all auxins examined exceeded 0.9990 in the range of 0.01-1.0 μg/mL. The recovery was from 84.3% to 102.1%, respectively. The relative standard deviation was less than 10%. Besides, the detection limit of this method was from 0.025 μg/kg to 0.2 μg/kg.
Sargassum; Double columns combination; Ultra performance liquid chromatography tandem mass spectrometry; Endogenous plant hormones
10.11895/j.issn.0253-3820.150585
本文系海洋公益性行業專項(No.201405038)、廈門南方海洋中心專項(No.14GZP004NF04)、國家海洋局第三海洋研究所基本科研業務費(海三科2013005)資助
2015-07-22收稿; 2015-09-18接受
* E-mail: xuchangan@tio.org.cn

