原花青素對MSG誘導的肥胖小鼠及脂肪變性L-02肝細胞的降脂作用
曹麗娟,張旭,陳朝銀,趙聲蘭*
(1.云南中醫學院中藥學院,云南昆明650500;2.昆明理工大學生命科學與技術學院,云南昆明650500)
原花青素對MSG誘導的肥胖小鼠及脂肪變性L-02肝細胞的降脂作用
曹麗娟1,張旭1,陳朝銀2,趙聲蘭1*
(1.云南中醫學院中藥學院,云南昆明650500;2.昆明理工大學生命科學與技術學院,云南昆明650500)
研究原花青素對谷氨酸鈉(MSG)誘導的肥胖小鼠和脂肪乳誘導的脂肪變性L-02肝細胞的降脂作用。谷氨酸鈉誘導的雄性肥胖小鼠模型建立后,分為正常對照組、模型組、陽性藥非諾貝特組和原花青素100 mg/kg、250 mg/kg劑量組,連續灌胃10周,測量小鼠體質量、體長、腹圍,并計算李氏指數,測定血清中總膽固醇(TC)和甘油三酯(TG)水平。建立脂肪變性L-02肝細胞模型,以非諾貝特為陽性對照,給予原花青素刺激液培養24 h后,測定細胞內TG含量。結果表明,與模型組相比,原花青素100 mg/kg、250 mg/kg劑量組均能顯著降低肥胖小鼠血清TC和TG水平(P<0.05),原花青素25 μg/mL、50 μg/mL和100 μg/mL劑量組均能極顯著降低脂肪變性L-02肝細胞內TG水平(P<0.01)。
原花青素;谷氨酸鈉;肥胖小鼠;脂肪變性L-02肝細胞;降脂
隨著工業的快速發展和人們生活水平的不斷提高,高脂血癥及肥胖患病率日益增加[1-2],同時伴隨心腦血管疾病[3]、癌癥[4]、糖尿病[5]等相關并發癥的發生。脂代謝是人體重要的代謝過程,脂代謝紊亂既影響生活質量,又威脅身體健康。以天然植物有效成分為原料的降脂藥物具有作用溫和、副作用小和適合長期服用等優點,受到廣大研究工作者的重視[6-7]。
原花青素(proanthocyanidin,PC)是植物中普遍存在的多酚類物質,主要由兒茶素和表兒茶素縮合而成。葡萄籽中原花青素含量達4.34%~16.86%[8-9]。原花青素具有抗氧化[10]、抗腫瘤[11]、抗紫外線[12]、抑菌[13]、降脂減肥[14]等作用,對癌癥、心血管、眼科等疾病有一定治療作用[15]。大量研究表明,中樞神經系統,尤其是下丘腦,在機體能量穩態調節中發揮重要作用,下丘腦能量調節通路結構改變或功能異常便形成下丘腦性肥胖[16]。醫用脂肪乳誘導正常L-02肝細胞48 h,能夠使正常L-02肝細胞發生脂肪變性成為脂肪變性L-02肝細胞,使細胞內甘油三酯蓄積和脂滴融合,引起肝細胞的脂代謝紊亂。目前,脂肪變性L-02肝細胞模型已應用于藥材不同炮制品、有效部位群及單體成分的降脂活性研究[17-19]。本研究利用谷氨酸鈉(monosodium glutamate,MSG)誘導的肥胖動物模型和脂肪乳誘導的脂肪變性L-02肝細胞模型,從動物水平和細胞水平研究原花青素的降脂作用,為原花青素在降脂領域的應用提供依據。
1 材料與方法
1.1材料與試劑
小鼠:未有生育行為的昆明種小鼠30只(雌雄各半),體質量22 g左右(動物許可證號:SCXK(川)2013-24);人正常L-02肝細胞株:中國科學院昆明動物研究所;谷氨酸鈉:BBI生命科學有限公司;葡萄籽原花青素(純度98%):曲阜市圣嘉德生物科技有限公司;非諾貝特膠囊:法國利博福尼制藥公司;20%醫用脂肪乳:四川科倫藥業股份有限公司;四季青胎牛血清(100 mL/瓶):浙江天航生物科技有限公司;RPMI 1640培養液、甘油三酯(triglycerides,TG)測定試劑盒、總膽固醇(total cholesterol,TC)測定試劑盒:中生北控生物科技股份有限公司。
1.2儀器與設備
INFINITE M200 PRO酶標儀:瑞士TECAN公司;先行者TM(OHAUS)分析天平(CP 214):奧豪斯(上海)有限公司;MCO-20AIC CO2培養箱:日本三洋有限公司;Nikon eclipse TS 100倒置顯微鏡:尼康儀器(上海)有限公司。
1.3方法
1.3.1動物實驗
MSG誘導的肥胖小鼠模型的建立:將12周齡未有生育行為的雌雄健康昆明種小鼠配對繁殖,確定雌鼠懷孕后,分出雌鼠單獨喂養,每只母鼠喂養新生乳鼠10只。新生乳鼠分為MSG干預組和正常對照組。MSG干預組:乳鼠出生后第2~8天,每天皮下注射3 mg/(g·d)MSG,正常對照組給予等劑量生理鹽水。正常哺乳喂養3周后,小鼠斷乳喂以普通飼料,4周后雌雄小鼠分籠喂養[20]。
雄性乳鼠喂養6周齡后,將上述MSG干預組分為模型組(給予0.1 mL/10 g的生理鹽水)、非諾貝特40 mg/kg劑量組、原花青素100mg/kg劑量組、原花青素250mg/kg劑量組,每組10只。正常對照組給予等劑量的生理鹽水0.1 mL/10 g。試驗期間,飼養環境溫度為室溫,各組小鼠自由進食和飲水,每天灌胃給藥一次,連續10周,末次給藥后禁食不禁水12 h,測量體質量和體長(鼻尖至肛門的長度),計算李氏指數,李氏指數=[體質量(g)×1 000/體長(cm)]1/3;摘眼球取血,分離血清,測定血清中甘油三酯(TG)和總膽固醇(TC)含量。
1.3.2細胞實驗
原花青素供試品:精密稱取原花青素,用稀釋100倍的二甲基亞砜(dimethyl sulfoxide,DMSO)將其配制成4×10-2mg/mL的儲備液,隨后用G0液(僅含有0.2%血清的RPMI-1640培養液)稀釋成25 μg/mL、50 μg/mL、100 μg/mL供試品。
非諾貝特陽性藥:精密稱取非諾貝特,用DMSO和G0液配制成質量濃度為25 μg/mL供試品。
醫用脂肪乳誘導液:吸取5 mL醫用脂肪乳,用10%胎牛血清稀釋至100 mL。
脂肪變性L-02肝細胞模型的建立:用0.25%胰酶消化對數生長期的L-02肝細胞,計數后以每孔5×105個細胞密度接種于6孔板,放入CO2培養箱,在37℃、5%CO2及適宜濕度條件下培養,待細胞長至80%左右,用G0液進行饑餓處理24 h,使細胞周期同步化,模型組給予醫用脂肪乳誘導液繼續培養48 h,正常對照組給予正常培養液培養相同時間,即可得到脂肪變性L-02肝細胞。
分組及給藥:實驗分為正常對照組、模型組、非諾貝特組、原花青素給藥組。正常對照組和模型組每孔繼續給予2 mL G0液;非諾貝特組每孔給予2 mL非諾貝特供試品;原花青素給藥組每孔分別給予2 mL不同質量濃度的原花青素供試品。每個濃度設3個復孔,給藥后繼續培養24 h。
細胞內TG含量的檢測:給藥培養24 h后,用磷酸緩沖鹽溶液(phosphate buffer saline,PBS)洗滌細胞2~3次,用細胞刮刀刮取細胞并收集于1.5 mL離心管,2 000 r/min離心5 min,棄上清,加入0.01%Triton X-100溶液50 μL,反復凍融3次,細胞充分裂解后,4℃,5000 r/min離心10 min,取上清,測定TG含量。
1.3.3統計學分析
實驗數據用(xˉ±s)表示,采用GraphPad Prism 5.0統計軟件分析處理數據,所有數據進行單因素方差分析,以P<0.05、P<0.01為差異具有顯著統計學意義。
2 結果與分析
2.1原花青素對MSG誘導的肥胖小鼠體質量、李氏指數、腹圍和體長的影響
原花青素對MSG誘導的肥胖小鼠體質量、李氏指數、腹圍和體長的影響結果見表1。
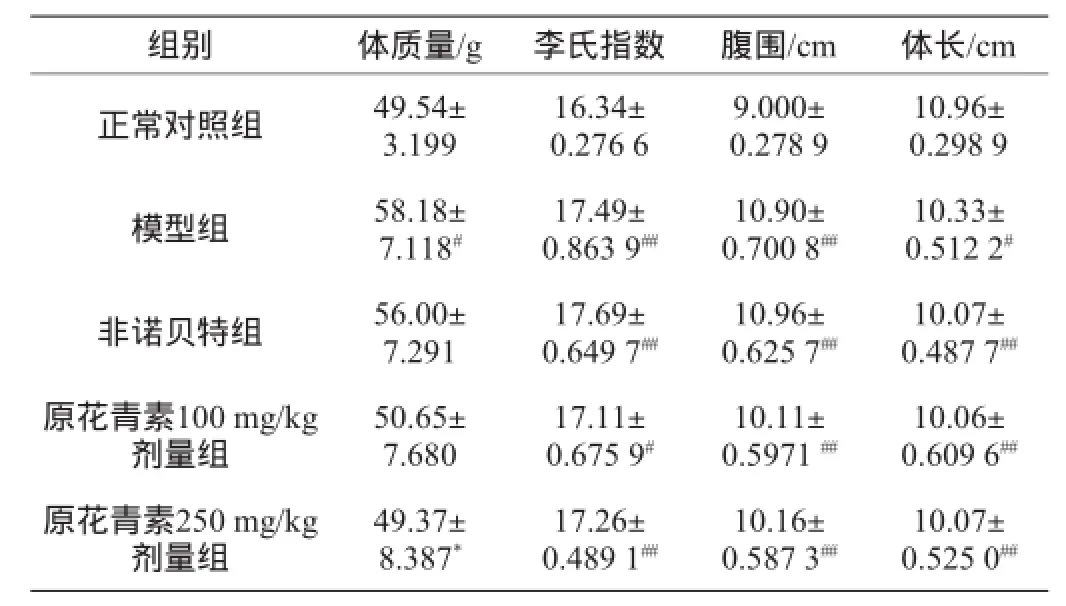
表1 原花青素對下丘腦性肥胖小鼠體質量、李氏指數、腹圍、體長的影響Table 1 Effects of proanthocyanidins on weight,Lee’s index, abdominal circumference and body length of hypothalamic obese mice
由表1可知,與正常對照組相比,模型組體質量顯著增加(P<0.05),模型組、陽性藥組、原花青素100 mg/kg劑量組和250 mg/kg劑量組小鼠的體長顯著降低,腹圍顯著升高,李氏指數顯著升高(P<0.05),說明MSG誘導的肥胖動物模型成功建立;與模型組相比,原花青素250 mg/kg劑量組的體質量顯著降低(P<0.05),預示原花青素有一定的減肥作用。
2.2原花青素對MSG誘導的肥胖小鼠血清TG、TC的影響
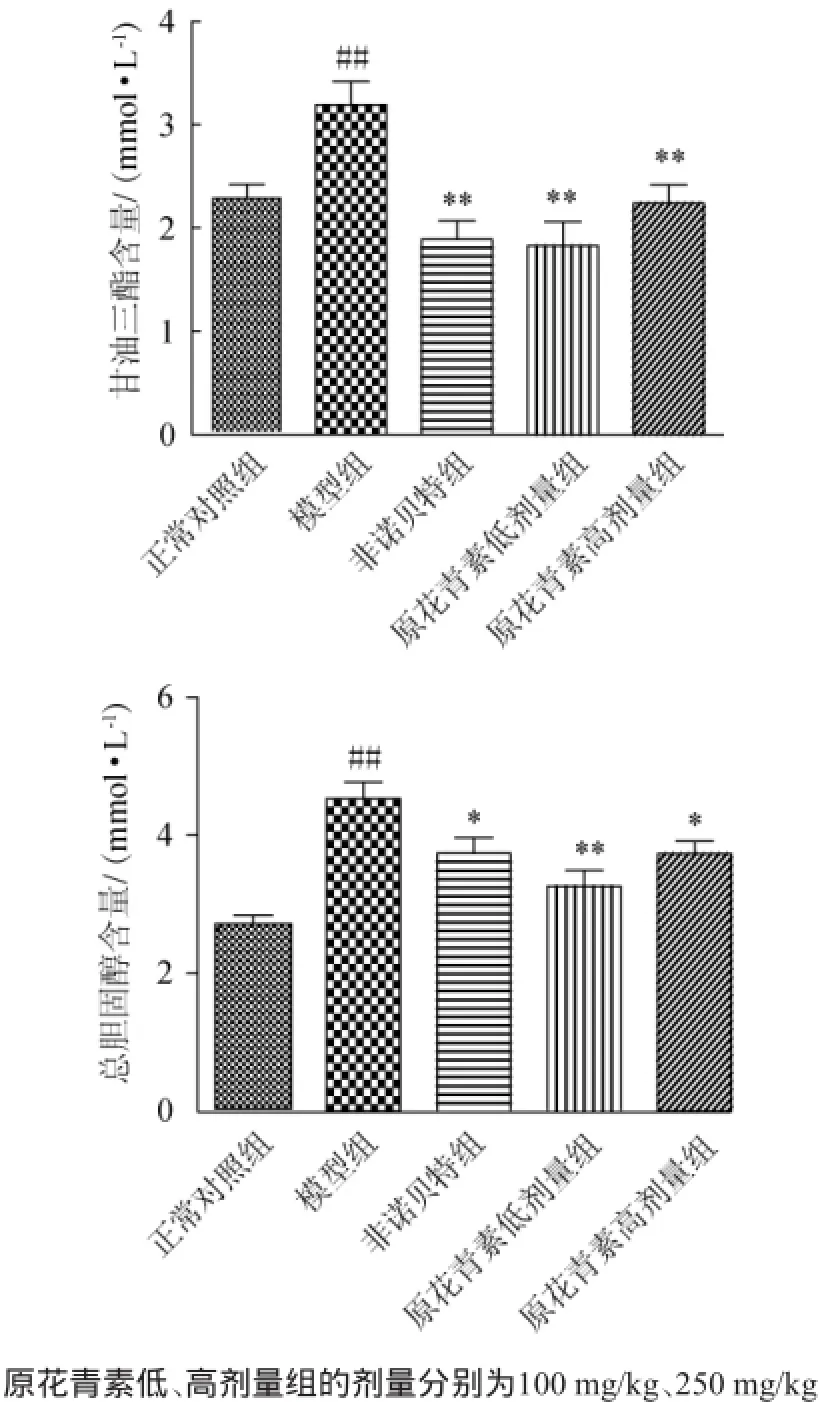
圖1 原花青素對下丘腦性肥胖小鼠血清中TG、TC的影響Fig.1 Effects of proanthocyanidins on the serum TG and TC in hypothalamic obese mice
原花青素對MSG誘導的肥胖小鼠血清TG、TC的影響結果見圖1。由圖1可知,與正常對照組相比,模型組TG和TC含量極顯著性升高(P<0.01);與模型組相比,非諾貝特組、原花青素100 mg/kg和250 mg/kg劑量組TG和TC均顯著性降低(P<0.05),說明原花青素可降低MSG誘導的肥胖小鼠血清TG、TC水平,這與原花青素屬于多酚類物質,具有較好的抗氧化活性,可能與抑制脂肪酶活性和氧化的血脂沉積在血管壁上有關[21]。在實驗范圍內,原花青素100 mg/kg劑量組降低肥胖小鼠血清TG、TC效果優于250 mg/kg劑量組,這與低劑量原花青素能夠較好地改善肥胖模型大鼠腸道菌群結構,從而發揮較好降脂減肥作用的報道相一致[22]。50 mg/kg劑量組的降脂效果是不是更好有待進一步進行試驗研究。有研究報道,蘋果[23]、可可[24]、花生種皮[25]等食材中的原花青素均有降脂活性,因此食源性原花青素可作為非藥物治療高脂血癥研究的一個方向。
2.3原花青素對脂肪變性L-02肝細胞中甘油三酯水平的影響
原花青素對脂肪變性肝L-02細胞中甘油三酯水平的影響結果見圖2。由圖2可知,與正常對照組相比,模型組TG顯著性升高(P<0.01),說明成功復制脂肪變性L-02肝細胞模型;與模型組相比,非諾貝特組和原花青素25 μg/mL、50 μg/mL、100 μg/mL劑量組均能極顯著降低脂肪變性L-02肝細胞中TG水平(P<0.01),說明原花青素對脂肪變性L-02肝細胞有降脂作用。原花青素降低脂肪變性L-02肝細胞TG的作用,在25~100 μg/mL實驗范圍內呈現劑量效應關系,半數有效濃度(median effective concentration,EC50)為66.26μg/mL、25μg/mL原花青素對脂肪變性L-02肝細胞的降脂作用是相同劑量非諾貝特的1.66倍,提示原花青素具有較好的降低肝臟脂肪作用。肝臟是機體代謝最旺盛的器官,是脂肪代謝的重要場所,參與脂質代謝過程的多個環節,如果脂代謝出現紊亂,則過多脂肪積累在肝臟,肝細胞內甘油三酯蓄積,發生脂肪變性,誘發脂肪肝[26-28]。
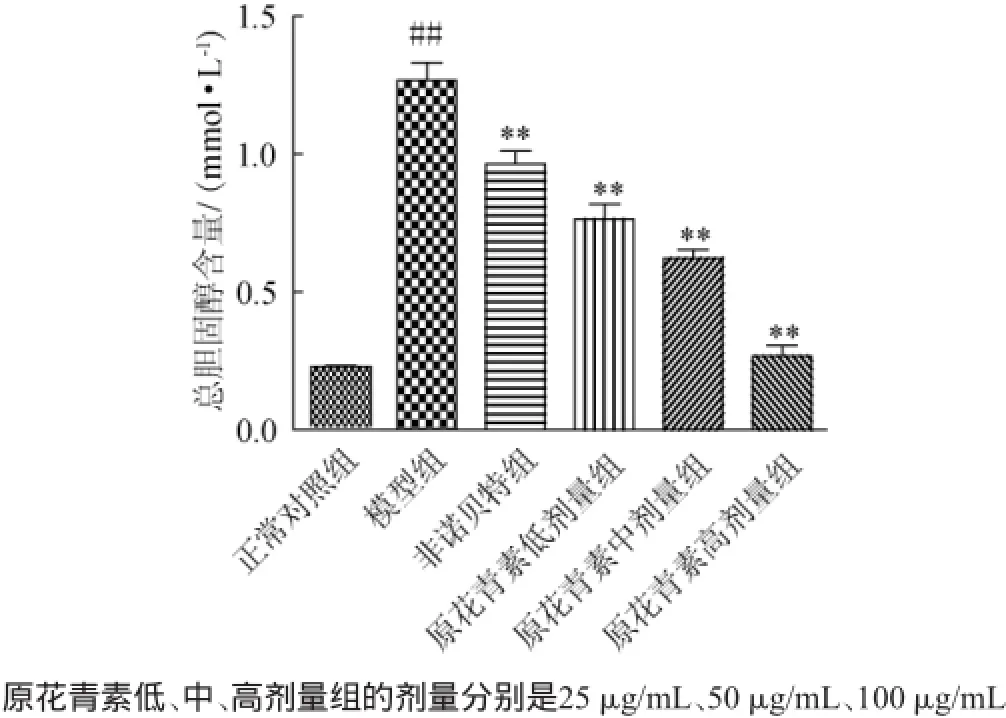
圖2 原花青素對脂肪變性L-02肝細胞中甘油三酯水平的影響Fig.2 Effects of proanthocyanidins on TG content in steatosis L-02 hepatocytes
3 結論
復制MSG誘導的肥胖小鼠模型,給予肥胖小鼠原花青素10周后,原花青素給藥組動物血清中TG和TC水平均顯著性降低,說明原花青素對MSG誘導的肥胖小鼠具有降脂作用。復制脂肪變性L-02肝細胞模型,給予原花青素,結果表明,25~100 μg/mL原花青素能夠顯著降低脂肪變性L-02肝細胞內TG水平。動物實驗和細胞實驗結果均表明,原花青素具有良好的降脂作用。
[1]VISSCHER T L,SEIDELL J C.The public health impact of obesity[J]. Annu Rev Public Health,2001,22(1):355-375.
[2]FLIER J S.Obesity wars:molecular progress confronts an expanding epidemic[J].Cell,2004,116(2):337-350.
[3]BORATO D C,PARABOCZ G C,RIBAS J T,et al.Biomarkers in obesity:serum myeloperoxidase and traditional cardiac risk parameters[J]. Exp Clin Endocrinol Diabetes,2016,124(1):49-54.
[4]AMOLD M,LEITZMANN M,FREISLING H,et al.Obesity and cancer:An update of the global impact[J].Cancer Epidemiol,2016,41(3-4):8-15.
[5]HOU D Q,ZHAO X Y,LIU J T,et al.Association of childhood and adolescents obesity with adult diabetes[J].Chinese J Prev Med,2016,50 (1):23-27.
[6]張帆,王英.降脂減肥植物的研究進展[J].包頭醫學院學報,2006,22(3):333-335.
[7]劉蕊,徐寶國.食品及其化學成分降脂減肥研究進展[J].天然產物研究與開發,2014,26(2):337-345.
[8]李春陽,許時嬰,王璋.香草醛-鹽酸法測定葡萄籽、梗中原花青素含量的研究[J].食品科學,2004,25(2):157-161.
[9]董瑞霞,李立祥,王茜,等.植物中原花青素含量測定[J].茶業通報,2008,30(2):67-69.
[10]任桐輝,黃曉輝,茹晶晶.葡萄籽中原花青素的抗氧化性能的研究[J].寧德師范學院學報:自然科學版,2015,27(2):136-139.
[11]李華,王華,劉霞.葡萄籽原花青素抗癌活性及其機制研究進展[J].安徽大學學報:自然科學版,2012,36(4):101-108.
[12]楊健,袁春龍,任亞梅,等.葡萄籽原花青素的提取及其抗紫外線活性測定[J].食品科學,2014,35(18):69-73.
[13]于軍,單靜敏,曹雁平.葡萄籽和蘋果原花青素對變形鏈球菌和金黃色葡萄球菌的抑制作用[J].食品科學,2011,32(17):123-127.
[14]彭峰林,許思毛,上官若男.運動和葡萄籽原花青素對高脂飲食大鼠血脂代謝及自由基水平的影響[J].中國康復醫學雜志,2013,28(4):325-329.
[15]趙丕文,段國平,劉曉利.葡萄籽原花青素的藥理學研究進展[J].環球中醫藥,2014,7(4):313-316.
[16]吳蔚,楊葉虹,李益明.下丘腦性肥胖臨床研究進展[J].國際內分泌代謝雜志,2014,34(1):32-35.
[17]王敏江,林佩,李云飛,等.何首烏不同炮制品對肝細胞脂代謝的干預作用研究[J].現代藥物與臨床,2013,28(4):494-499.
[18]肖力爭.研究黃茶君山銀針調節糖脂代謝功效及機制[D].長沙:湖南農業大學,2014.
[19]俞捷,林佩,陸建美,等.何首烏活性成分二苯乙烯苷對肝細胞脂質合成、分解及轉運的調節作用研究[J].中國藥學雜志,2014,49(23):2077-2082.
[20]沈紀中.五甲基槲皮素抗代謝綜合征的作用及作用機制研究[D].武漢:華中科技大學,2012.
[21]李春陽,許時嬰,程建青.葡萄籽原花青素降低小鼠血清中膽固醇作用的研究[J].食品研究與開發,2005,26(6):40-45.
[22]宋雪琳,李雅梅,肖俊松,等.葡萄籽原花青素對營養肥胖模型大鼠腸道菌群的影響[J].食品科學技術學報,2015,33(5):39-46.
[23]SERRA A T,ROCHA J,SEPODES B,et al.Evaluation of cardiovascular protective effect of different apple varieties-correlation of response with composition[J].Food Chem,2012,135(4):2378-2386.
[24]VERSTRAETEN S V,JAGGERS G K,FRAGA C G,et al.Procyanidins can interact with Caco-2 cell membrane lipid rafts:involvement of cholesterol[J].Biochim Biophys Acta,2013,1828(11):2646-2653.
[25]TAMURA T,INOUE N,OZAWA M,et al.Peanut-skin polyphenols, procyanidin A1 and epicatechin-(4 β→6)-epicatechin-(2 β→O→7,4 β→8)-catechin,exert cholesterol micelle-degrading activityin vitro[J]. Biosci Biotechnol Biochem,2013,77(6):1306-1309.
[26]魯麗,劉赫.脂肪肝、脂代謝紊亂與糖尿病及其臨床對策[J].實用糖尿病雜志,2015,11(1):6-7.
[27]洪天配,路然.脂質代謝紊亂導致非酒精性脂肪性肝病的發病機制[J].臨床肝膽病雜志,2015,31(7):1050-1054.
[28]郭鵬,吳崇明,欒紅,等.露兜簕來源咖啡酰奎寧酸抑制HepG2肝細胞脂質積聚并調節脂代謝相關基因的表達[J].藥學學報,2015,50(3):278-283.
Lipid-lowering effect of procyanidins on the MSG-induced obese mice and steatotic L-02 hepatocytes
CAO Lijuan1,ZHANG Xu1,CHEN Chaoyin2,ZHAO Shenglan1*
(1.Faculty of Chinese Traditional Medicine,Yunnan University of Traditional Chinese Medicine,Kunming 650500,China; 2.Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China)
The lipid-lowering effect of proanthocyanidins on obese mice induced by monosodium glutamate(MSG)and steatotic L-02 hepatocytes induced by fat emulsion was sudied.The MSG-induced obese mice model was established and the animals were divided into normal control group, model group,positive drug fenofibrate group,proanthocyanidins 100 mg/kg,250 mg/kg dose groups.After the obese mice were gavaged for 10 weeks,the weight,body length,.abdominal girth,Lee's indexes were measured.The contents of triglyceride,total cholesterol in serum were determined.The steatosis model of hepatocytes was established,fenofibrate was used as positive control,and the hepatocytes in the treatment groups were treated with proanthocyanidins stimulus.The intracellular triacylglycerol content was determined after 24 h.The results showed that compared with the model group,proanthocyanidins 100 mg/kg,250 mg/kg dose groups significantly reduced total cholesterol and triglyceride levels in serum of hypothalamic obese mice(P<0.05).The proanthocyanidins 25 μg/ml,50 μg/ml,100 μg/ml dose groups significantly reduced triglyceride levels of the steatotic L-02 hepatocytes(P<0.01).
procyanidins;MSG;obese mice;steatotic L-02 hepatocytes;lipid-lowering
TS262.9
0254-5071(2016)08-0155-04
10.11882/j.issn.0254-5071.2016.08.035
2016-04-01
云南省教育廳自然科學研究重大專項(ZD2014009);國家自然科學基金項目(21466037)
曹麗娟(1991-),女,碩士研究生,研究方向為中藥資源開發與利用。
趙聲蘭(1962-),女,教授,碩士,研究方向為藥食資源研究與開發利用。

