根際微生物調控植物根系構型研究進展
陳偉立,李 娟,朱紅惠,陳杰忠,姚 青,,*
1 華南農業大學園藝學院,廣州 510642 2 仲愷農業工程學院,廣州 510225 3 廣東省微生物研究所,廣州 510070
?
根際微生物調控植物根系構型研究進展
陳偉立1,李 娟2,朱紅惠3,陳杰忠1,姚 青1,3,*
1 華南農業大學園藝學院,廣州 510642 2 仲愷農業工程學院,廣州 510225 3 廣東省微生物研究所,廣州 510070
根系構型是最重要的植物形態特征之一,具有可塑性,既由遺傳因素控制,又受到許多環境因子的調控。近年的大量研究表明,根際微生物能夠調控植物的根系構型,進而影響植物的一系列生理與生態過程。綜述叢枝菌根真菌(AMF)、根瘤菌、植物根際促生菌(PGPR)等重要根際微生物類群對植物根系構型的調控模式以及相應的調控機理,并對進一步的研究進行了展望,旨在為今后的相關研究和實際應用提供參考。
根系構型;根際微生物;調控
根系在植物生長發育中起著重要的作用,既是植株吸收水分和營養的主要器官,又是支撐植株地上部的重要力量[1]。因此,根系作為植株的地下部分,其活力與植物吸收能力的強弱有直接關系,這些都直接影響著地上部分的生長與發育。由于土壤的物質和能量被植物獲取和利用均是通過根系得以實現的,因此,根系的分布特征反映了土壤的物質和能量被植物利用的可能性以及生產力,而根系在土壤中的分布特征主要表現為根系構型(RSA)[2]。根系構型既受到遺傳控制,又受到許多環境因子(尤其是根際微生物)的調控。本文在此主要綜述了根際微生物對根系構型的調控作用及其相應機制,旨在為后來研究者提供一定的理論參考,進一步闡明根際微生物與根系構型之間的復雜關系,最終更好地被應用于生產實踐。
1 植物根系構型
1.1 根系構型研究的意義
根系構型是一個重要的農學和生態學指標,指同一根系中不同級別的根在生長介質中的相互連接情況和空間分布[2],具體包括根系形態、根系拓撲結構、總根長、根系分布、根長密度和根系的延長速率、各級根的發生及在空間的三維分布、根系的生長角度和根系的扭轉程度等。根系構型特點直接反映了根系的生長狀況。良好的根系構型不僅可以提高根系對土壤養分和水分利用的效率,而且也是構建穩定生態群落的基礎,此外,根系構型在土壤維持[3- 4]和抗病性[5- 6]方面也起著不可或缺的作用,所以,植物根系構型的研究對植物的生長發育及其生態穩定性具有重要意義。近年來,根系構型的研究已經成為諸多學科研究的熱點問題,主要包括植物根系生長及對養分吸收利用等營養功能的研究[7- 8],不同根系構型對各種土壤環境的適應性變化的定量研究[9- 10],植物根系生長的三維可視化模擬研究[11- 13],以及根際微生物對植物根系構型的影響[14- 15]。
1.2 根系構型調控的必要性
在全世界大部分地區,水分和礦質養分的有效性是作物生產力的主要限制因素,而且肥沃并具有良好生態環境的耕地極其有限[11],這對主要經濟作物如水稻[16- 17]、小麥[18]、玉米[19- 20]及其它植物如橡膠[21]、大豆[22]、荔枝[23]、苜蓿[24]等的生長狀況及產量影響巨大,而植物生長狀況的良好與否很大程度上依賴于根系對土壤水分及養分吸收能力的強弱。在同樣的環境條件下,良好的根系構型可以提高植株對有限資源的利用,進而提高產量和品質[25]。而根系構型具有極強可塑性的報道屢見不鮮[26],說明作物生產中對根系構型的調控是絕對可行的。
在育種界,根系構型特點已經慢慢成為育種者考慮的重要因素之一[27- 28],而且很多研究也表明植株根系構型的改善會促進植株生長和發育。因此,根系構型的調控對植株的生長發育及最終產量都具有重大的現實意義,是滿足當代社會對作物產量需求的一個有效解決途徑。
1.3 根系構型調控的途徑
根系主要的功能就是從土壤或基質中吸收水分和養分,因此通過控制水分[17,20]和養分[29]的多少將會直接影響根系的生長發育狀況及生理特性。例如,低磷可以誘導水稻[30]和擬南芥[31]側根的發生,不過在玉米中則發現相反的結果[32],這說明磷對根系的改善作用因物種不同而不同。另外,土壤或基質的溫度或外界環境的溫度,以及土壤的質地和機械阻力也會對根系的生長產生影響,在一定的溫度范圍內,植物根系的長度隨溫度的升高而增長,當溫度過高或過低時都會抑制根系的生長[33]。在緊實土壤中生長的根系,其伸長速度減慢,根長縮短且變粗等。另外一些微量元素如硼、鉬等對根系的生長也是不可缺少的。雖然有毒元素如銅過多則會抑制主根生長,但會促進比較短的側根的密度[34]。
近年來,土壤生物因子對根系構型的調控作用日益引起關注,其中根際微生物對根系構型的調控得到廣泛報道。根際微生物是土壤生態系統中最為活躍的構成因子,參與了土壤中各種生物學過程(如共生)和生物化學過程(如土壤酶),對植物的生長發育和環境適應性產生重要影響。植物根際是植物、微生物和土壤相互影響最強烈的區域,根系構型與根際微生物間相互影響,相互作用,根系構型的改變勢必會影響微生物群落的構成與分布,而根際微生物的存在對植株根系的發育及生長也有重要的影響。目前關于此領域的研究主要集中于叢枝菌根真菌(AMF)、根瘤菌及植物根際促生菌(PGPR)等根際微生物如何有效地調控植物根系構型[35- 39]。
2 根際微生物對根系構型的調控
2.1 AMF
AMF是與植物內共生的土壤真菌,其宿主范圍十分廣泛,可與陸地上80%以上的維管束植物形成共生關系[40]。建立共生體后,AMF可以提高植物根系對土壤水分及養分的吸收,植物的抗旱性、耐澇性、耐鹽性和抗病性,加強植物抵抗高溫和重金屬毒害的能力,此外AMF還可以分解有毒有機物,修復污染與退化土壤等[41- 42]。雖然對AMF的認識已經非常深刻,但是其依然是植物微生物群落中一個關鍵卻神秘的組分。
AMF侵染植物根系而形成叢枝結構,因此認為AMF對植物生理生態過程的影響與根系構型的變化密不可分,國內外有關AMF影響植物根系構型的研究已經有20多年的歷史,發現AMF對植物根系構型的調控是全方位的,包括根系生物量、長度、根直徑、根總表面積、根總體積、分枝數、根生長角度以及側根發育和不定根形成等各根系指標。
在根系生物量、長度及面積等方面,柱花草(Stylosanthesgracilis)接種Glomusversiforme顯著增加了根系長度,而且還觀察到其基根角度有增大的趨勢[43]。接種AMF時,角豆樹白根、黃根生物量及玉米根系總長度、根條數(根分枝數)和根系吸收面積都顯著增加[44- 45],而在柑橘根系長度增加的同時,根系的平均直徑卻降低了[46],這與Yuan等人[47]所觀察到根平均直徑增加的結果不同,而且還發現不同AMF種類對植株生長效應不同,促進或抑制地上部和地下部生物量的情況時有報道[48- 49]。不管是接種Glomusmosseae還是Acaulosporadelicata都增加了翅果油樹的根系體積、表面積和根系吸收能力,提高了根系酶體系,有利于植物抵抗各種脅迫,對擴大翅果油樹植物的分布區具有重要意義[50]。除此之外,Yao等人[35]第一次報道了叢枝菌根對不同直徑級別根系的分布情況的影響,發現接種G.versiforme顯著增加柑橘直徑<0.4 mm根系比例,減少直徑0.4—1.2 mm的根系比例。之后Wu等人[51]也發現接種AMF后在顯著增加Citrustangerine根系總長度、總投影面積、總表面積和總體積的同時,0—1 cm根總長及其在中的比例也得到增加,但根平均直徑和1—2 cm分級根總長在總根長中所占比例顯著減少。
在側根及分枝方面,AMF起著巨大作用[47,52- 53]。Schellenbaum等人[54]發現,接種Glomusfasciculatum使得葡萄(Vitisvinifera)根系的一級、二級和三級根的分枝分別增加了140%、200%和266%。在其它植物種類中也發現了類似現象,接種AMF使成年番荔枝根系總數目、一級側根數目和二級側根數目分別增加了3、2倍和4倍,而且總根、不定根、一級側根和二級側根的長度都有不同程度的增加[55];接種Glomusintraradices雖然沒有增加水稻冠根的數量,但是由冠根發育出來的大側根和細側根數量都比對照高出三分之一,而且還發現細側根數量的增加是由于大側根數量增加引起的,不受接菌影響[36]。而且在干旱和水澇條件下,接種AMF分別促進水稻分枝指數增加2.4—4.1倍和1.7—2.6倍[56]。AMF同樣促進荔枝[57]、柑橘[58]和歐洲榿木[59]等木本植物的根系分枝,但顯著減少后者根毛數量。
此外,在低溫[60]、水分脅迫[39,61- 63]、鹽脅迫[41,64]、原油污染[65]的土壤中,AMF對根系構型的改善愈發明顯,這促進了植物在逆境條件下的正常生長發育。而且研究發現感染立枯病的番茄在接種G.mosseae后,根系總長度和根尖數量增加,這在一定程度上使植株更加抗病[66]。另外在組培、扦插和嫁接試驗中,AMF對植物根系的生長發育起著促進作用,在Williams香蕉(MusaAAA)上,G.versiforme雖然顯著地增加組培苗的須根數量,但是須根的平均長度降低,導致整個根系中須根的總長沒有變化[67]。AMF可以改善一品紅扦插時的生根表現,顯著促進了不定根的生成[68],也會增加西瓜嫁接苗的根系生物量[69]。
另外還發現,復合菌種處理的番茄根系總根長和根鮮重均顯著高于單一菌株處理[70]。干旱下接種內生菌根真菌、外生菌根真菌、混合接種對滇柏和楸樹根系影響不一致,滇柏以外生菌和混合菌接種對根系生物量的效果更顯著,而楸樹以內生菌的效果最為顯著,而且滇柏根系平均直徑、總長度及表面積呈增加趨勢[71]。
雖然上述研究中報道的都是AMF對根系構型特點改善作用更大,但是其不影響或減少根系長度或側根數量的報道也有許多,例如接種時濕地植物Bidensfrondosa根系長度和表面積要低于不接種處理,而接種對Ecliptaprostrata根系構型影響不大[72]。而在多年生黑麥草中,AMF雖然沒改變根系生物量,但顯著減少根長度,根直徑和根數量[73]。另外有研究指出當植株所接AMF種類不是其優勢菌株時,不會增加根系長度和促進側根的發生,甚至會比不接菌時的根系長度和側根數量都要低[74- 75],其中很大的原因可能是其與植株根系競爭碳素。由此可見,AMF對根系構型的影響錯綜復雜,而這可能是由于不同植物種類、不同菌劑種類、不同試驗條件等造成的,反過來,不同種類植株根系構型不同也會影響它們對AMF的依賴性。
2.2 根瘤菌
根瘤菌是一類廣泛分布于土壤中的革蘭氏陰性細菌,是與豆科植物共生的重要微生物,它能侵染豆科植物根部或莖部而形成根瘤或莖瘤,然后在根瘤或莖瘤中分化成類菌體,將空氣中的氮素固定為植物可吸收利用的氨。Hafeez等[76]發現根瘤菌Rhizobiumleguminosarum使得棉花根干重、根生物量和根表面積分別增加了248%、332%和283%,而且會促進蒺藜狀苜蓿的根毛卷曲及增加分枝的程度,進而側根數量增多[77- 78],還發現百脈根根瘤菌會促進擬南芥側根發生和伸長[79],但是也有研究者發現接種根瘤菌對大豆根系長度沒有影響,但會增加根表面積和體積[80]。不過,目前關于根瘤與根系構型的直接研究并不多見,諸如根瘤在根系上如何分布的以及根瘤的形成對根系構型又會有怎樣的促進或抑制作用等問題尚未得到深入探討。
2.3 PGPR
PGPR是棲居于植物根圍中的一類土壤細菌,通過諸多方式來促進植株生長,如產生植物激素(生長素和赤霉素等)、氮固定、溶磷、抵抗重金屬污染和改善根系構型等,而且可以減少肥料的施用[81- 82],常見的如假單孢菌屬和芽孢桿菌屬等。通常情況下,PGPR作為生物肥料、植物促進和生物防除方面的接種劑,在農業生產起著重要的作用[83]。但是關于PGPR對植物根系構型影響的研究并不是很多,但是,在已報道的研究中發現其在改變根系構型方面所起作用也很重要。
大部分的PGPR都增加植株根毛密度和根長度及根生物量,促進根毛從近根尖部位開始形成[84- 86]。Serratiaproteamaculans會增加鷹嘴豆(Cicerarietinum)根長、側根數量和長度以及根生物量[87],接種Azospirillumlipoferum會增加玉米幼苗根表面積、根生物量、根長和根尖數量,促進根系分枝,但沒有改變根平均直徑[88],而之前的研究發現,接種Azospirillumbrasilense在增加菜豆根長和根鮮重的同時會減少根直徑,而且在菜豆苗生長的初始階段,細根在長根中所占比例大[89],但是Nosheen等人[81]發現接種PGPR(特別是A.brasilense和Pseudomonasstutzeri)同時顯著地增加紅花(Carthamustinctorius)根長、根面積和根直徑。Guti E Rrez-Luna等人[90]在檸檬根際土壤中成功分離出3種促進主根生長和側根發育的菌株,經鑒定分別為蠟樣芽胞桿菌(Bacilluscereus),簡單芽孢桿菌(Bacillussimplex)和芽孢桿菌(Bacillussp),均屬于PGPR,它們是通過釋放揮發性有機化合物來改變根系構型的。此外在有AMF或施用化肥時,接種PGPR的效果會更加顯著[91]。
與AMF類似,PGPR也有不影響甚至抑制根系生長的效應,例如,接種Pseudomonastrivialis會使得雜草雙雄雀麥(Bromusdiandrus)根系生物量、根表面積、根體積和根尖數量減少,從而保證硬質小麥(Triticumdurum)的正常生長[92]。兩種根際促生菌假單胞細菌(Pseudomonasputida)和腸桿菌(Enterobactercloacae)對黃瓜根系生長的影響不明顯,這可能與植物種類有關,或者是由于植物對根際促生菌的選擇差異性。
2.4 其他根際微生物
除了AMF、根瘤菌和PGPR外,其它根際微生物如外生菌根真菌等對植物根系構型也有一定的影響。
不同于AMF,外生菌根共生體只存在于5%以下陸生植物種類中,但是許多生長于溫帶森林的松科和山毛櫸科以及熱帶亞熱帶地區的桃金娘科和龍腦香科都以外生菌根為主[93],主要功能是擴大根系對水分和養分的吸收面積,分泌多種生物酶,提高植物根系對氮、磷和鉀等養分的吸收,產生生物素、生長素等促進植物生長,提高植物的抗逆性和抗病性,以及活化土壤[94- 95]。分別接種黃色須腹菌(Rhizopogenluteous)、彩色豆馬勃(Pisolithustinctorius)和美味牛肝菌(Boletusedulis)3種外生菌根真菌后,黑松(Pinusthunbergii)幼苗許多根系參數均比對照有不同程度的增加,側根與主根之間夾角從大到小依次為R.luteous、B.edulis、P.tinctorius、對照,R.luteous有效擴大了根系吸收的空間范圍[96]。另外,P.tinctorius和Burkholderiaglathei對滇柏[71]和松樹[97]的根系效應也與上述相似。此外對分別來自正常森林和火燒森林的假山毛櫸(Nothofagusalpina)幼苗根系比較發現,外生菌根真菌(Descoleaantarctica)促使其根系系統更加深入土壤,且側根及細根主要分布在下層土壤,以避免上層較低的相對濕度[98]。另外干旱脅迫下,外生菌根真菌雖然沒有增加幼年歐洲山毛櫸(Fagussylvatica)植株生物量,但顯著增加了根尖數量和細根形成,特別是0.2—0.8 mm級別根[99]。
除了外生菌根真菌外,弗蘭克氏菌是一類能與多種非豆科木本雙子葉植物共生固氮的放線菌,它也顯著促進歐洲榿木(Alnusglutinosa)幼苗根系分枝,但會顯著減少根毛數量[59]。而且有意思的是,Kawaguchi等人[100]用從綠色木霉菌(Trichodermaviride)分離出來的木聚糖酶處理煙草根系發現主根細胞分裂和細胞伸長受到抑制,但是根系維管束和根毛的形成并不受任何影響,而且若移除該木聚糖酶,根系構型會重新改變,說明根際微生物分泌的生物酶可能對根系構型起著一定的調控作用。
3 根際微生物調控根系構型的機制
植物根系構型的改變主要是有內源性因素和外在環境因素兩方面的影響,而根際微生物調控植物根系構型主要是從以下幾方面來實現(圖1):(1)改變影響植物根系構型的內在因子,如側根數量的增加等;(2)改變植株對礦質養分的吸收,主要為氮和磷等;(3)影響植物激素的水平與平衡;(4)影響植物碳素營養的分配。
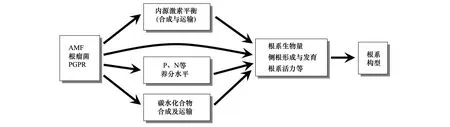
圖1 3種根際微生物調控植株根系構型的相關機制Fig.1 The mechanisms of three rhizospheric microorganisms′ regulation on plant Root system architectureAMF:叢枝菌根真菌 Arbuscular Mycorrhizal Fungi;PGPR:植物根際促生菌 Plant Growth Promoting Rhinoacteria
3.1 影響植物根系構型的內在因子
眾所周知,不同種植物,其根系構型的差異非常大。典型的雙子葉植物的根系是由主根、側根、不定根構成的直根系;典型的禾本科單子葉植物的根系是由主根、側根、初生根、冠根、不定根構成的須根系[101],另外,木本植物與草本植物的根系也明顯不同。
除去物種之間的差異性,側根是影響植物根系構型最主要的內在因子,其在根系響應土壤環境條件方面起著至關重要的作用,因此,環境因子往往是通過影響側根的發生來影響根系構型[15,102-103]。高等植物側根的形成主要包括4個關鍵階段[101]:(1)中柱鞘建成細胞受到刺激發生分化;(2)中柱鞘細胞的極性不對稱分裂產生側根原基;(3)側根原基細胞膨大突破主根最處層;(4)側根分生組織的活化與側根生長。早在20世紀90年代,Taylor和Scheuring[104]就發現番茄根系的RSI- 1基因在側根原基發生的早期就被啟動,一直持續到側根剛剛突出主根,認為RSI- 1可以作為側根發生過程中的分子標記;另外在擬南芥的根系還發現LRP1基因在側根和不定根的原基發生的早期啟動,而在側根突出主根之前關閉,也可作為側根發生的分子標記[105]。不過到目前為止還沒確定哪個標記基因可以用于研究側根發生的關鍵階段。
根系活力也是影響根系構型的另一重要因素。在Kawaguchi等人[100]用從T.viride分離出來的木聚糖酶處理煙草根系的研究中發現主根細胞分裂和細胞伸長受到抑制可能是根系中編碼細胞周期素依賴性激酶(CDK)的基因表達受阻導致根分生組織活力的降低。在辣椒中接種3種AMF菌劑(Glomusetunicatum,G.mosseae和G.versiforme)都顯著增加了根系活力以及根系抗氧化酶活性,一級側根數、根表面積、根體積和根質量都比對照高出許多,其中G.mosseae的效果最佳[106]。根生長角度對根系構型的影響同樣不可忽略,Uga等人[107]在水稻上發現DRO1是控制深根比率的一個主要數量性狀位點,而且干旱條件下DRO1會增大根生長角度,從而促進深根系統的形成,提高水稻產量。
3.2 激素調控
植物激素是調控根發育和構型的主要因素。研究發現生長素運輸途徑對根系結構的調控主要表現在以下方面:(1)參與主根的生長;(2)參與側根的形成與伸長,具體為參與側根原基組織的生長,使側根從母根上突出;(3)調控鹽脅迫條件下根系的發育過程,從而使根系的生長發育適應鹽脅迫。其中,最重要的,植物生長素是側根發生和發育的重要信號[15]。添加外源生長素能夠增加側根的數目,抑制生長素的運輸則減少側根的數目[108],而且還發現生長素的峰值出現在側根的發生位置以及側根突出和伸長階段[101]。AMF會促使根系合成生長素增加,并且生長素信號是早期叢枝菌根形成所必需的[109],因此接種AMF改變玉米根系構型可能是由于其增加了IBA所導致[110],且在番茄中也發現了類似的現象[111]。一些PGPR可以釋放IAA改變植株生長素含量,進而促進植株形成一個細長且高度分枝的根系系統[112]。同樣,在Jiang等人[113]的研究中發現,以細菌為生的線蟲類會促進土壤中產生IAA的細菌生長和增加土壤中氮營養和IAA,進而促使擬南芥形成高度分枝根系系統,而且根系更長更細。另一方面,P.trivialis會通過產生高濃度的IAA來抑制雜草根系的生長,從而真正意義上實現生物防控[92]。分子水平上,側根發生最重要的一種生長素蛋白是SLR1/IAA14,slr1突變體會鈍化IAA14而不能形成側根[114]。KRP1和KRP2是編碼細胞周期蛋白激酶(CDK)的基因,Himanen等人[115]研究發現,KRP1和KRP2的表達可以抑制細胞周期從G1期向S期轉變;KRP2的超表達明顯減少側根的數目;生長素NAA則抑制KRP1和KRP2的表達,由此可見,生長素通過調控細胞分裂周期來影響側根的發生。LAX(likeAUX1)是介導生長素從胞外向胞內轉移的載體蛋白,而載體突變體lax3的側根數目減少,表明生長素的胞內胞外轉移也決定著側根的發育[116]。
此外,細胞分裂素是另一個重要的影響側根發育的植物激素。由于在許多生理過程中拮抗生長素的作用,細胞分裂素能夠抑制許多植物的側根發育[7,117],報道指出,細胞分裂素含量降低的擬南芥突變體的側根數目增加[118],添加外源細胞分裂素則減少側根的數目[119]。其他對側根發育產生影響激素包括乙烯[120]、赤霉素[121]、油菜素內酯[122]、脫落酸[123-124]、水楊酸[125]、多胺[51]以及越來越引起大家關注的獨腳金內脂[126]等,而且細胞分裂素和脫落酸反向調節側根發生,而生長素和油菜素內酯對側根發生起著促進作用[127]。AMF侵染植物根系形成菌根共生體過程中能誘導植物合成多種信號物質,如水楊酸、茉莉酸、類黃酮、一氧化氮和過氧化氫等[128],從而一定程度上調控根系的發育;擁有ACC脫氨酶的根際細菌會通過減少乙烯的含量促進根系生長來調控根系構型[87],此外,PGPR也可通過產生生長素或細胞分裂素來調控根系構型和促進莖生長[129]。
3.3 礦質養分調控
研究表明,不論是AMF,還是根瘤菌或PGPR都可以改善植物對養分的吸收[130],從而改變植物根系構型,例如B.glathei促進松樹根系改善主要是通過加強礦物風化來改善植株營養狀況實現的[97];還有,與對照處理相比,滇柏的接種處理和楸樹的內生菌根真菌和混合菌根真菌處理對N和P的吸收都顯著增加,進而增加根系生物量[71]。
AMF與根系共生后,能顯著促進根系對土壤礦質營養元素特別是P的吸收,甚至在土壤溫度降低植物生長和P吸收受抑的情況下,AMF仍能增加植物體內P含量[131],但是如果土壤中含P豐富,叢枝菌根對植株的貢獻會大大折扣,而且也相應地發現AMF改變根系構型通常是在低磷條件下[132],因此低磷促進側根的形成,尤其是淺層根系的生長[133]。進一步研究發現,接種AMF玉米根中磷酸鹽轉運體基因ZEAma:Pht1;6(叢枝菌根誘導)表達水平為不接菌的26—135倍,提高了莖中磷含量,進而促進了植株生長;在增施少量磷肥時,會顯著增加該基因的表達,但是不影響ZEAma:Pht1;3(磷饑餓誘導)的表達[134]。
植株高氮水平抑制側根的形成和生長,PGPR菌株Phyllobacteriumsp會改善高外源硝酸根離子對擬南芥側根生長的抑制作用[135]。不過局部高氮會促進側根的形成和生長[136],在低營養條件下,AMF促進了角豆樹根系對無機氮的吸收,且使該根系具有高濃度的氮素[44]。Boukcim等[137]發現AMF在氮利用率高的田間挪威云杉中會顯著增加根系側根數量,減少所有側根的長度,而在氮利用率低時會顯著減少側根數量,只增加三級側根數量。中度干旱脅迫和光照下,外生菌根真菌會促進幼年F.sylvatica根系對氮素的吸收,從而促進根系生長[99]。不過有意思的是,在營養豐富的土壤中,溫帶森林菌根樹更傾向于通過增殖根系來汲取更多養分[138],說明AMF在該環境條件下對根系構型的影響可能遠小于在土壤營養貧瘠時。
3.4 碳素調控
根系的生長和發育依賴植物形成的光合碳水化合物,碳水化合物可直接作為代謝底物或生長調節物質影響細胞的分裂,導致根系構型發生變化[139]。植物地上部分與地下部在利用碳水化合物方面存在著競爭關系,而在共生微生物的存在下,地上部分的蔗糖經長距離運輸向根系的分配比率提高,例如“菌根碳庫”的存在會促使糖向菌根化細胞中轉移[104,140],因此,根際微生物可能通過調控植株碳素營養的運輸來改變根系構型。接種AMF會顯著增加枳殼幼苗葉片葡萄糖和蔗糖含量,但減少根葡萄糖和蔗糖含量[48],不過在白三葉草中,卻是增加了根系的蔗糖含量[141],可能是因為不同菌劑種類對木本植株和草本植株的作用模式不同所致,但兩個研究都表明接菌增加了植株根系總長度、根表面積以及總體積。另一方面,在春夏季,許多植物葉片增多且光合作用活躍,這使得大量的碳水化合物被運輸至地下部,促進細根的形成以維持AMF的生存[142]。另外,接種AMF時,一品紅插條的葉片糖含量增加,且碳水化合物動力學開始變化,從而根系生長得到促進[68]。本文之前所描述的AMF減少根系長度及側根數量的原因可能是其與宿主植株競爭碳水化合物所致。除了AMF,PGPR和根瘤菌通常都能增加根系生物量[143-145],說明它們也參與到碳水化合物的運輸過程中,最終導致根系構型發生改變,不過目前關于根際微生物調控碳水化合物組分及分配及其對根系構型影響的研究鮮見報道,特別是后兩種微生物。
4 展望
雖然土壤根際微生物影響不同植物根系構型的研究日益增多,相應地也提出了一些調控機制,但是,不同微生物改變根系構型的差異性及最主要的調控途徑還需要更深層次的理解。由于根系是生長于土壤中,不能直接觀察,因此選擇合適的試驗方案至關重要,需要不斷地優化,以便更直觀地了解根際微生物對植株根系構型的調控作用。對根系構型的研究,主要是為了仿真出根系在不同的生長條件下的分布情況,從而得出更加有利于生產和實驗的品種或者根系結構,可以更好的利用土壤的營養,提高產量和品質。就目前研究方向而言,以下幾方面可能值得重視和深入探討:(1)AMF與其它根際微生物相互作用(協同或競爭)對植株根系構型有哪些影響?這些影響的作用機制是什么?這些問題尚不明確,需要深入研究。(2)根際微生物的侵染或定殖需要消耗根系的碳素(光合產物),而碳素也是根系構建的物質基礎,那么,根際微生物對碳素的競爭是如何調控根系構型的?在這一調控途徑過程中,何種碳素(葡萄糖、果糖或蔗糖)起著關鍵作用?(3)根系構型與作物(如菜豆)的生產力密切相關,在農業生產中如何有效利用根際微生物來改善根系構型,使植株更加適應周圍環境變化,從而實現高產優質。總之,根際微生物對植物根系構型的調控意義深遠,值得進行更多的深入研究。
[1] Bailey P H J, Currey J D, Fitter A H. The role of root system architecture and root hairs in promoting anchorage against uprooting forces inAlliumcepaand root mutants ofArabidopsisthaliana. Journal of Experimental Botany, 2002, 53(367): 333- 340.
[2] Lynch J. Root architecture and plant productivity. Plant Physiology, 1995, 109(1): 7- 13.
[3] 屈志強, 劉連友, 呂艷麗. 沙生植物構型及其與抗風蝕能力關系研究綜述. 生態學雜志, 2011, 30(2): 357- 362.
[4] 楊小林, 張希明, 李義玲, 李紹才, 孫海龍. 塔克拉瑪干沙漠腹地3種植物根系構型及其生境適應策略. 植物生態學報, 2008, 32(6): 1268- 1276.
[5] Cichy K A, Snapp S S, Kirk W W. Fusarium root rot incidence and root system architecture in grafted common bean lines. Plant and Soil, 2007, 300(1/2): 233- 244.
[6] Norman J R, Atkinson D, Hooker J E. Arbuscular mycorrhizal fungal-induced alteration to root architecture in strawberry and induced resistance to the root pathogenPhytophthorafragariae. Plant and Soil, 1996, 185(2): 191- 198.
[7] Aloni R, Aloni E, Langhans M, Ullrich C I. Role of cytokinin and auxin in shaping root architecture: regulating vascular differentiation, lateral root initiation, root apical dominance and root gravitropism. Annals of Botany, 2006, 97(5): 883- 893.
[8] Beebe S E, Rojas-Pierce M, Yan X L, Blair M W, Pedraza F, Muoz F, Tohme J, Lynch J P. Quantitative trait loci for root architecture traits correlated with phosphorus acquisition in common bean. Crop Science, 2006, 46(1): 413- 423.
[9] Hishi T. Heterogeneity of individual roots within the fine root architecture: causal links between physiological and ecosystem functions. Journal of Forest Research, 2007, 12(2): 126- 133.
[10] 劉靈, 廖紅, 王秀榮, 嚴小龍. 磷有效性對大豆菌根侵染的調控及其與根構型、磷效率的關系. 應用生態學報, 2008, 19(3): 564- 568.
[11] Bingham I J, Wu L H. Simulation of wheat growth using the 3D root architecture model SPACSYS: validation and sensitivity analysis. European Journal of Agronomy, 2011, 34(3): 181- 189.
[12] Mooney S J, Pridmore T P, Helliwell J, Bennett M J. Developing X-ray computed tomography to non-invasively image 3-D root systems architecture in soil. Plant and Soil, 2012, 352(1/2): 1- 22.
[13] Fang S Q, Clark R, Liao H. 3D Quantification of plant root architecture in situ // Mancuso S, ed. Measuring Roots: A Updated Approach. New York: Springer, 2012: 135- 148.
[14] Chatzistathis T, Orfanoudakis M, Alifragis D, Therios I. Colonization of Greek olive cultivars′ root system by arbuscular mycorrhiza fungus: root morphology, growth, and mineral nutrition of olive plants. Scientia Agricola, 2013, 70(3): 185- 194.
[15] Krome K, Rosenberg K, Dickler C, Kreuzer K, Ludwig-Müller J, Ullrich-Eberius C, Scheu S, Bonkowski M. Soil bacteria and protozoa affect root branching via effects on the auxin and cytokinin balance in plants. Plant and Soil, 2010, 328(1/2): 191- 201.
[16] Uga Y, Sugimoto K, Ogawa S, Rane J, Ishitani M, Hara N, Kitomi Y, Inukai Y, Ono K, Kanno N, Inoue H, Takehisa Hi, Motoyama R, Nagamura Y, Wu J Z, Matsumoto T, Takai T, Okuno K, Yano M. Control of root system architecture byDEEPERROOTING1 increases rice yield under drought conditions. Nature Genetics, 2013, 45(9): 1097- 1102.
[17] 王秋菊, 李明賢, 趙宏亮, 遲力勇. 控水灌溉對水稻根系生長影響的試驗研究. 中國農學通報, 2008, 24(8): 206- 208.
[18] 楊永輝, 武繼承, 吳普特, 黃占斌, 趙西寧, 管秀娟, 何方. 保水劑用量對小麥不同生育期根系生理特性的影響. 應用生態學報, 2011, 22(1): 73- 78.
[19] Qi W Z, Liu H H, Liu P, Dong S T, Zhao B Q, So H B, Li G, Liu H D, Zhang J W, Zhao B. Morphological and physiological characteristics of corn (ZeamaysL.) roots from cultivars with different yield potentials. European Journal of Agronomy, 2012, 38: 54- 63.
[20] 姜春光, 盧樹昌, 陳清. 模擬不同降雨條件對日光溫室填閑作物糯玉米產量、根系生長及養分吸收的影響. 北方園藝, 2011, (17): 71- 75.
[21] 華元剛, 林清火, 羅微, 茶正早, 林釗沐. 氮素供應對橡膠樹根系生長的影響. 中國農學通報, 2006, 22(6): 421- 424.
[22] 喬云發, 韓曉增. 長期定量施肥對大豆根系形態和根瘤性狀的影響. 大豆科學, 2011, 30(1): 119- 122.
[23] 張承林, 付子軾. 水分脅迫對荔枝幼樹根系與梢生長的影響. 果樹學報, 2005, 22(4): 339- 342.
[24] 李錦華, 陳積山, 田福平, 常根柱. 苜蓿根系構型研究展望 // 2007年中國草學會青年工作委員會學術研討會論文集. 北京: 中國草學會青年工作委員會, 2007: 126- 129.
[25] 單立山, 李毅, 董秋蓮, 耿東梅. 紅砂根系構型對干旱的生態適應. 中國沙漠, 2012, 32(5): 1283- 1290.
[26] Armengaud P, Zambaux K, Hills A, Sulpice R, Pattison R J, Blatt M R, Amtmann A. EZ-Rhizo: integrated software for the fast and accurate measurement of root system architecture. The Plant Journal, 2009, 57(5): 945- 956.
[27] Fita A, Nuez F, Picó B. Diversity in root architecture and response to P deficiency in seedlings ofCucumismeloL. Euphytica, 2011, 181(3): 323- 339.
[28] Postma J A, Jaramillo R E, Lynch J P. Towards modeling the function of root traits for enhancing water acquisition by crops // Response of Crops to Limited Water: Understanding and Modeling Water Stress Effects on Plant Growth Processes. America: American Society of Agronomy, 2008: 251- 275.
[29] Lynch J P. Root architecture and nutrient acquisition // BassiriRad H, ed. Nutrient Acquisition by Plants: An Ecological Perspective. Berlin: Springer, 2005: 147- 183.
[30] Zhang Y L, Duan Y H, Shen Q R. Screening of physiological indices for response of rice to nitrate. Acta Pedologica Sinica, 2004, 41(4): 571- 576.
[31] Niu Y F, Chai R S, Jin G L, Wang H, Tang C X, Zhang Y S. Responses of root architecture development to low phosphorus availability: a review. Annals of Botany, 2013, 112(2): 391- 408.
[32] Li Z X, Xu C Z, Li K P, Yan S, Qu X, Zhang J R. Phosphate starvation of maize inhibits lateral root formation and alters gene expression in the lateral root primordium zone. BMC Plant Biology, 2012, 12(1): 89- 89.
[33] 張旭麗, 李洪. 玉米根系與環境條件的關系. 山西農業科學, 2010, 38(7): 120- 122.
[34] Lequeux H, Hermans C, Lutts S, Verbruggen N. Response to copper excess inArabidopsisthaliana: Impact on the root system architecture, hormone distribution, lignin accumulation and mineral profile. Plant Physiology and Biochemistry, 2010, 48(8): 673- 682.
[35] Yao Q, Wang L R, Zhu H H, Chen J Z. Effect of arbuscular mycorrhizal fungal inoculation on root system architecture of trifoliate orange (PoncirustrifoliataL. Raf.) seedlings. Scientia Horticulturae, 2009, 121(4): 458- 461.
[36] Gutjahr C, Casieri L, Paszkowski U.Glomusintraradicesinduces changes in root system architecture of rice independently of common symbiosis signaling. New Phytologist, 2009, 182(4): 829- 837.
[37] Lopez L D, Shantharaj D, Liu L, Bais H, Yu J Y. Robust image-based 3D modeling of root architecture. Computer Graphics International, 2011: 1- 10.
[38] Nichols S N, Crush J R, Woodfield D R. Effects of inbreeding on nodal root system morphology and architecture of white clover (TrifoliumrepensL.). Euphytica, 2007, 156(3): 365- 373.
[39] Wu Q S, Zou Y N, Huang Y M. The arbuscular mycorrhizal fungusDiversisporaspurcaameliorates effects of waterlogging on growth, root system architecture and antioxidant enzyme activities of citrus seedlings. Fungal Ecology, 2013, 6(1): 37- 43.
[40] Smith S E, Read D J. Mycorrhizal Symbiosis. 3rd ed. London: Academic Press, 2010.
[41] Campanelli A, Ruta C, De Mastro G, Morone-Fortunato I. The role of arbuscular mycorrhizal fungi in alleviating salt stress inMedicagosativaL. var. icon. Symbiosis, 2013, 59(2): 65- 76.
[42] Aranda E, Scervino J M, Godoy P, Reina R, Ocampo J A, Wittich R M, García-Romera I. Role of arbuscular mycorrhizal fungusRhizophaguscustosin the dissipation of PAHs under root-organ culture conditions. Environmental Pollution, 2013, 181: 182- 189.
[43] Yao Q, Zhu H H, Chen J Z, Christie P. Influence of an arbuscular mycorrhizal fungus on competition for phosphorus between sweet orange and a leguminous herb. Journal of Plant Nutrition, 2005, 28(12): 2179- 2192.
[44] Cruz C, Green J J, Watson C A, Wilson F, Martins-Lou??o M A. Functional aspects of root architecture and mycorrhizal inoculation with respect to nutrient uptake capacity. Mycorrhiza, 2004, 14(3): 177- 184.
[45] 黃京華, 劉青, 李曉輝, 曾任森, 駱世明. 叢枝菌根真菌誘導玉米根系形態變化及其機理. 玉米科學, 2013, 21(3): 131- 135.
[46] Yao Q, Lin F X, Chen J Z, Lei X T, Zhu H H. Responses of citrus seedlings and a leguminous herb,Stylosanthesgracilis, to arbuscular mycorrhizal fungal inoculation. Acta Horticulturae, 2008, 773: 63- 67.
[47] Yuan L H. Effects of arbuscular mycorrhizal fungi onElaeagnusmollisdiels seedlings′ growth and root. American-Eurasian Journal of Agricultural & Environmental Science, 2015, 15(2): 177- 183.
[48] Wu Q S, Zou Y N, He X H, Luo P. Arbuscular mycorrhizal fungi can alter some root characters and physiological status in trifoliate orange (PoncirustrifoliataL. Raf.) seedlings. Plant Growth Regulation, 2011, 65(2): 273- 278.
[49] Thilagar G, Bagyaraj D J. Influence of different arbuscular mycorrhizal fungi on growth and yield of chilly. Proceedings of the National Academy of Sciences, India Section B: Biological Sciences, 2015, 85(1): 71- 75.
[50] 袁麗環, 閆桂琴, 朱志敏. 叢枝菌根(AM)真菌對翅果油樹幼苗根系的影響. 西北植物學報, 2009, 29(3): 580- 585.
[51] Wu Q S, He X H, Zou Y N, Liu C Y, Xiao J, Li Y. Arbuscular mycorrhizas alter root system architecture ofCitrustangerinethrough regulating metabolism of endogenous polyamines. Plant Growth Regulation, 2012, 68(1): 27- 35.
[52] Gutjahr C, Paszkowski U. Multiple control levels of root system remodeling in arbuscular mycorrhizal symbiosis. Frontiers in Plant Science, 2013, 4: 204- 204.
[53] 江夏, 陳偉立, 徐春香, 朱紅惠, 姚青. 叢枝菌根真菌和磷水平對番茄幼苗側根形成的影響. 應用生態學報, 2015, 26(4): 1186- 1192.
[54] Schellenbaum L, Berta G, Ravolanirina F, Tisserant B, Gianinazzi S, Fitter A H. Influence of endomycorrhizal infection on root morphology in a micropropagated woody plant species (VitisviniferaL.). Annals of Botany, 1991, 68(2): 135- 141.
[55] Padilla I M G, Encina C L. Changes in root morphology accompanying mycorrhizal alleviation of phosphorus deficiency in micropropagatedAnnonacherimolaMill. plants. Scientia Horticulturae, 2005, 106(3): 360- 369.
[56] Vallino M, Fiorilli V, Bonfante P. Rice flooding negatively impacts root branching and arbuscular mycorrhizal colonization, but not fungal viability. Plant, Cell & Environment, 2014, 37(3): 557- 572.
[57] Yao Q, Zhu H H, Chen J Z. Growth responses and endogenous IAA and iPAs changes of litchi (LitchichinensisSonn.) seedlings induced by arbuscular mycorrhizal fungal inoculation. Scientia Horticulturae, 2005, 105(1): 145- 151.
[58] 張藝燦, 趙思, 鄒英寧, 吳強盛. 叢枝菌根真菌對限根栽培枳生長和根系構型的影響. 湖北農業科學, 2014, (11): 2588- 2590.
[59] Orfanoudakis M, Wheeler C T, Hooker J E. Both the arbuscular mycorrhizal fungusGigasporaroseaand Frankia increase root system branching and reduce root hair frequency inAlnusglutinosa. Mycorrhiza, 2010, 20(2): 117- 126.
[60] Wu Q S, Zou Y N. Beneficial roles of arbuscular mycorrhizas in citrus seedlings at temperature stress. Scientia Horticulturae, 2010, 125(3): 289- 293.
[61] 何躍軍, 鐘章成. 水分脅迫和接種叢枝菌根對香樟幼苗根系形態特征的影響. 西南大學學報: 自然科學版, 2012, 34(4): 33- 39.
[62] 王如巖, 于水強, 張金池, 叢日亮, 王群, 陳麗莎, 司登宇. 水分脅迫下菌根真菌對滇柏(CupressusduclouxianaHichel)幼苗生長和養分吸收的影響. 中國巖溶, 2011, 30(3): 313- 319.
[63] Zhao R X, Guo W, Bi N, Guo J Y, Wang L X, Zhao J, Zhang J. Arbuscular mycorrhizal fungi affect the growth, nutrient uptake and water status of maize (ZeamaysL.) grown in two types of coal mine spoils under drought stress. Applied Soil Ecology, 2015, 88: 41- 49.
[64] Wu Q S, Zou Y N, He X H. Contributions of arbuscular mycorrhizal fungi to growth, photosynthesis, root morphology and ionic balance of citrus seedlings under salt stress. Acta Physiologiae Plantarum, 2010, 32(2): 297- 304.
[65] Langer I, Syafruddin S, Steinkellner S, Puschenreiter M, Wenzel W W. Plant growth and root morphology ofPhaseolusvulgarisL. grown in a split-root system is affected by heterogeneity of crude oil pollution and mycorrhizal colonization. Plant and Soil, 2010, 332(1/2): 339- 355.
[66] Berta G, Sampo S, Gamalero E, Massa N, Lemanceau P. Suppression ofRhizoctoniaroot-rot of tomato byGlomusmossaeBEG12 andPseudomonasfluorescensA6RI is associated with their effect on the pathogen growth and on the root morphogenesis. European Journal of Plant Pathology, 2005, 111(3): 279- 288.
[67] 姚青, 朱紅惠, 羊宋貞. 叢枝菌根真菌對香蕉試管苗植株生長和礦質營養吸收的影響. 果樹學報, 2004, 21(5): 425- 428.
[68] Druege U, Xylaender M, Zerche S, Von Alten H. Rooting and vitality of poinsettia cuttings was increased by arbuscular mycorrhiza in the donor plants. Mycorrhiza, 2006, 17(1): 67- 72.
[69] 陳可, 孫吉慶, 劉潤進, 李敏. 叢枝菌根真菌對西瓜嫁接苗生長和根系防御性酶活性的影響. 應用生態學報, 2013, 24(1): 135- 141.
[70] 唐超, 李敏, 劉永舉, 劉潤進. 單一及復合AM真菌初侵染對番茄苗的生理影響. 中國農學通報, 2013, 29(13): 114- 119.
[71] 王如巖, 于水強, 張金池, 周垂帆, 陳莉莎. 干旱脅迫下接種菌根真菌對滇柏和楸樹幼苗根系的影響. 南京林業大學學報: 自然科學版, 2012, 36(6): 23- 27.
[72] Stevens K J, Wall C B, Janssen J A. Effects of arbuscular mycorrhizal fungi on seedling growth and development of two wetland plants,BidensfrondosaL., andEcliptaprostrataL., grown under three levels of water availability. Mycorrhiza, 2011, 21(4): 279- 288.
[73] Endlweber K, Scheu S. Interactions between mycorrhizal fungi and Collembola: effects on root structure of competing plant species. Biology and Fertility of Soils, 2007, 43(6): 741- 749.
[74] Lu N, Zhou X, Cui M, Yu M, Zhou J X, Qin Y S, Li Y. Colonization with arbuscular mycorrhizal fungi promotes the growth ofMorusalbaL. seedlings under greenhouse conditions. Forests, 2015, 6(3): 734- 747.
[75] Urcoviche R C, Gazim Z C, Dragunski D C, Barcellos F G, Alberton O. Plant growth and essential oil content ofMenthacrispainoculated with arbuscular mycorrhizal fungi under different levels of phosphorus. Industrial Crops and Products, 2015, 67: 103- 107.
[76] Hafeez F Y, Safdar M E, Chaudhry A U, Malik K A. Rhizobial inoculation improves seedling emergence, nutrient uptake and growth of cotton. Australian Journal of Experimental Agriculture, 2004, 44(6): 617- 622.
[77] Catoira R, Timmers A C, Maillet F, Galera C, Penmetsa R V, Cook D, Denarie J, Gough C. TheHCLgene ofMedicagotruncatulacontrols Rhizobium-induced root hair curling. Development, 2001, 128(9): 1507- 1518.
[78] Barea J M, Tobar R M, Azcón-Aguilar C. Effect of a genetically modifiedRhizobiummelilotiinoculant on the development of arbuscular mycorrhizas, root morphology, nutrient uptake and biomass accumulation inMedicagosativa. New Phytologist, 1996, 134(2): 361- 369.
[79] Desbrosses G, Queruel N, Poitout A, Touraine B. Fixing and non-fixing rhizobia affect Arabidopsis root architecture by interfering with the auxin signaling pathway. Molecular Microbial Ecology of the Rhizosphere, 2013, 1- 2: 327- 333.
[80] Wang X R, Pan Q, Chen F X, Yan X L, Liao H. Effects of co-inoculation with arbuscular mycorrhizal fungi and rhizobia on soybean growth as related to root architecture and availability of N and P. Mycorrhiza, 2011, 21(3): 173- 181.
[81] Nosheen A, Bano A, Ullah F, Farooq U, Yasmin H, Hussain I. Effect of plant growth promoting rhizobacteria on root morphology of Safflower (CarthamustinctoriusL.). African Journal of Biotechnology, 2011, 10(59): 12639- 12649.
[82] Babalola O O. Beneficial bacteria of agricultural importance. Biotechnology Letters, 2010, 32(11): 1559- 1570.
[83] Lugtenberg B J J, Chin-A-Woeng T F C, Bloemberg G V. Microbe-plant interactions: principles and mechanisms. Antonie Van Leeuwenhoek, 2002, 81(1/4): 373- 383.
[84] Remans T, Thijs S, Truyens S, Weyens N, Schellingen K, Keunen E, Gielen H, Cuypers A, Vangronsveld J. Understanding the development of roots exposed to contaminants and the potential of plant-associated bacteria for optimization of growth. Annals of Botany, 2012, 110(2): 239- 252.
[85] Contesto C, Desbrosses G, Lefoulon C, Béna G, Borel F, Galland M, Gamet L, Varoquaux F, Touraine B. Effects of rhizobacterial ACC deaminase activity onArabidopsisindicate that ethylene mediates local root responses to plant growth-promoting rhizobacteria. Plant Science, 2008, 175(1/2): 178- 189.
[86] Dobbelaere S, Croonenborghs A, Thys A, Broek A V, Vanderleyden J. Phytostimulatory effect ofAzospirillumbrasilensewild type and mutant strains altered in IAA production on wheat. Plant and Soil, 1999, 212(2): 153- 162.
[87] Shahzad S M, Khalid A, Arshad M, Tahir J, Mahmood T. Improving nodulation, growth and yield ofCicerarietinumL. through bacterial ACC-deaminase induced changes in root architecture. European Journal of Soil Biology, 2010, 46(5): 342- 347.
[88] Zemrany H E, Czarnes S, Hallett P D, Alamercery S, Bally R, Monrozier L J. Early changes in root characteristics of maize (Zeamays) following seed inoculation with the PGPRAzospirillumlipoferumCRT1. Plant and Soil, 2007, 291(1/2): 109- 118.
[89] German M A, Burdman S, Okon Y, Kigel J. Effects ofAzospirillumbrasilenseon root morphology of common bean (PhaseolusvulgarisL.) under different water regimes. Biology and Fertility of Soils, 2000, 32(3): 259- 264.
[90] Gutiérrez-Luna F M, López-Bucio J, Altamirano-Hernández J, Valencia-Cantero E, de la Cruz H R, Macías-Rodríguez L. Plant growth-promoting rhizobacteria modulate root-system architecture inArabidopsisthalianathrough volatile organic compound emission. Symbiosis, 2010, 51(1): 75- 83.
[91] Gamalero E, Trotta A, Massa N, Copetta A, Martinotti M G, Berta G. Impact of two fluorescent pseudomonads and an arbuscular mycorrhizal fungus on tomato plant growth, root architecture and P acquisition. Mycorrhiza, 2004, 14(3): 185- 192.
[92] Mejri D, Gamalero E, Tombolini R, Musso C, Massa N, Berta G, Souissi T. Biological control of great brome (Bromusdiandrus) in durum wheat (Triticumdurum): specificity, physiological traits and impact on plant growth and root architecture of the fluorescent pseudomonad strain X33d. Biocontrol, 2010, 55(4): 561- 572.
[93] Landeweert R, Hoffland E, Finlay R D, Kuyper T W, van Breemen N. Linking plants to rocks: ectomycorrhizal fungi mobilize nutrients from minerals. Trends in Ecology & Evolution, 2001, 16(5): 248- 254.
[94] Baldrian P. Ectomycorrhizal fungi and their enzymes in soils: is there enough evidence for their role as facultative soil saprotrophs?. Oecologia, 2009, 161(4): 657- 660.
[95] Courty P E, Buée M, Diedhiou A G, Frey-Klett P, Le Tacon F, Rineau F, Turpault M P, Uroz S, Garbaye J. The role of ectomycorrhizal communities in forest ecosystem processes: new perspectives and emerging concepts. Soil Biology and Biochemistry, 2010, 42(5): 679- 698.
[96] 吳小芹, 鄭玲, 葉建仁. 黑松三種菌根苗根系構型差異及其與生長的關系. 生態學報, 2009, 29(10): 5493- 5499.
[97] Calvaruso C, Turpault M P, Frey-Klett P. Root-associated bacteria contribute to mineral weathering and to mineral nutrition in trees: a budgeting analysis. Applied and Environmental Microbiology, 2006, 72(2): 1258- 1266.
[98] Palfner G, Canseco M I, Casanova-Katny A. Post-fire seedlings ofNothofagusalpinain Southern Chile show strong dominance of a single ectomycorrhizal fungus and a vertical shift in root architecture. Plant and Soil, 2008, 313(1/2): 237- 250.
[99] Pena R, Simon J, Rennenberg H, Polle A. Ectomycorrhiza affect architecture and nitrogen partitioning of beech (FagussylvaticaL.) seedlings under shade and drought. Environmental and Experimental Botany, 2013, 87: 207- 217.
[100] Kawaguchi Y, Nishiuchi T, Kodama H, Nakano T, Nishimura K, Shimamura K, Yamaguchi K, Kuchitsu K, Shinshi H, Suzuki K. Fungal elicitor-induced retardation and its restoration of root growth in tobacco seedlings. Plant Growth Regulation, 2012, 66(1): 59- 68.
[101] Nibau C, Gibbs D J, Coates J C. Branching out in new directions: the control of root architecture by lateral root formation. New Phytologist, 2008, 179(3): 595- 614.
[102] Gruber V, Zahaf O, Diet A, de Zélicourt A, de Lorenzo L, Crespi M. Impact of the environment on root architecture in dicotyledoneous plants // de Oliveira A C, Varshney R K, eds. Root Genomics. Berlin Heidelberg: Springer, 2011: 113- 132.
[103] Fusconi A. Regulation of root morphogenesis in arbuscular mycorrhizae: what role do fungal exudates, phosphate, sugars and hormones play in lateral root formation?. Annals of Botany, 2014, 113(1): 19- 33.
[104] Taylor B H, Scheuring C F. A molecular marker for lateral root initiation: theRSI- 1 gene of tomato (LycopersiconesculentumMill) is activated in early lateral root primordia. Molecular and General Genetics, 1994, 243(2): 148- 157.
[105] Smith D L, Fedoroff N V.LRP1, a gene expressed in lateral and adventitious root primordia of Arabidopsis. The Plant Cell, 1995, 7(6): 735- 745.
[106] 江盼盼, 宋述堯, 趙春波, 張傳偉. 三種叢枝菌根真菌對辣椒根系生長的影響及效應分析. 中國蔬菜, 2010, (6): 58- 62.
[107] Uga Y, Okuno K, Yano M.Dro1, a major QTL involved in deep rooting of rice under upland field conditions. Journal of Experimental Botany, 2011, 62(8): 2485- 2494.
[108] Marchant A, Bhalerao R, Casimiro I, Ekl?f J, Casero P J, Bennett M, Sandberg G.AUX1 promotes lateral root formation by facilitating indole- 3-acetic acid distribution between sink and source tissues in the Arabidopsis seedling. The Plant Cell, 2002, 14(3): 589- 597.
[109] Hanlon M T, Coenen C. Genetic evidence for auxin involvement in arbuscular mycorrhiza initiation. New Phytologist, 2011, 189(3): 701- 709.
[110] Kaldorf M, Ludwig-Müller J. AM fungi might affect the root morphology of maize by increasing indole- 3-butyric acid biosynthesis. Physiologia Plantarum, 2000, 109(1): 58- 67.
[111] Abeer H, Abd-Allah E F, Alqarawi A A, Alwhibi MS, Alenazi M M, Egamberdieva D, Ahmad P. Arbuscular mycorrhizal fungi mitigates NaCl induced adverse effects onSolanumlycopersicumL. Pakistan Journal of Botany, 2015, 47(1): 327- 340.
[112] Patten C L, Glick B R. Role ofPseudomonasputidaindoleacetic acid in development of the host plant root system. Applied and Environmental Microbiology, 2002, 68(8): 3795- 3801.
[113] Jiang Y, Wu Y, Xu W S, Cheng Y H, Chen J D, Xu L, Hu F, Li H X. IAA-producing bacteria and bacterial-feeding nematodes promoteArabidopsisthalianaroot growth in natural soil. European Journal of Soil Biology, 2012, 52: 20- 26.
[114] Fukaki H, Tameda S, Masuda H, Tasaka M. Lateral root formation is blocked by a gain-of-function mutation in theSOLITARY-ROOT/IAA14 gene of Arabidopsis. The Plant Journal, 2002, 29(2): 153- 168.
[115] Himanen K, Boucheron E, Vanneste S, de Almeida Engler J, Inzé D, Beeckman T. Auxin-mediated cell cycle activation during early lateral root initiation. The Plant Cell, 2002, 14(10): 2339- 2351.
[116] Swarup K, Benková E, Swarup R, Casimiro I, Péret B, Yang Y D, Parry G, Nielsen E, De Smet I, Vanneste S, Levesque M P, Carrier D, James N, Calvo V, Ljung K, Kramer E, Roberts R, Graham N, Marillonnet S, Patel K, Jones J D G, Taylor C G, Schachtman D P, May S, Sandberg G, Benfey P, Friml J, Kerr I, Beeckman T, Laplaze L, Bennett M J. The auxin influx carrier LAX3 promotes lateral root emergence. Nature Cell Biology, 2008, 10(8): 946- 954.
[117] Laplaze L, Benkova E, Casimiro I, Maes L, Vanneste S, Swarup R, Weijers D, Calvo V, Parizot B, Begon M, Rodriguez H, Offringa R, Graham N, Doumas P, Friml J, Bogusz D, Beeckman T, Bennett M. Cytokinins act directly on lateral root founder cells to inhibit root initiation. The Plant Cell, 2007, 19(12): 3889- 3900.
[118] Riefler M, Novak O, Strnad M, Schmülling T. Arabidopsis cytokinin receptor mutants reveal functions in shoot growth, leaf senescence, seed size, germination, root development, and cytokinin metabolism. The Plant Cell, 2006, 18(1): 40- 54.
[119] Li X, Mo X R, Shou H X, Wu P. Cytokinin-mediated cell cycling arrest of pericycle founder cells in lateral root initiation ofArabidopsis. Plant and Cell Physiology, 2006, 47(8): 1112- 1123.
[120] He X J, Mu R L, Cao W H, Zhang Z G, Zhang J S, Chen S Y.AtNAC2, a transcription factor downstream of ethylene and auxin signaling pathways, is involved in salt stress response and lateral root development. The Plant Journal, 2005, 44(6): 903- 916.
[121] Gou J Q, Strauss S H, Tsai C J, Fang K, Chen Y R, Jiang X N, Busov V B. Gibberellins regulate lateral root formation inPopulusthrough interactions with auxin and other hormones. The Plant Cell, 2010, 22(3): 623- 639.
[122] Bao F, Shen J J, Brady S R, Muday G K, Asami T, Yang Z B. Brassinosteroids interact with auxin to promote lateral root development in Arabidopsis. Plant Physiology, 2004, 134(4): 1624- 1631.
[123] Hong J H, Seah S W, Xu J. The root of ABA action in environmental stress response. Plant Cell Reports, 2013, 32(7): 971- 983.
[125] Echevarría-Machado I, Escobedo-GM R M, Larqué-Saavedra A. Responses of transformedCatharanthusroseusroots to femtomolar concentrations of salicylic acid. Plant Physiology and Biochemistry, 2007, 45(6/7): 501- 507.
[126] Koltai H, Prandi C. Strigolactones: biosynthesis, synthesis and functions in plant growth and stress responses // Tran L S P, Pal S, eds. Phytohormones: A Window to Metabolism, Signaling and Biotechnological Applications. New York: Springer, 2014: 265- 288.
[127] Fukaki H, Tasaka M. Hormone interactions during lateral root formation. Plant Molecular Biology, 2009, 69(4): 437- 449.
[128] 王彬, 張金政, 劉新, 李敏, 劉潤進. 叢枝菌根真菌誘導植物信號物質研究進展. 微生物學通報, 2010, 37(2): 263- 268.
[129] Ortíz-Castro R, Contreras-Cornejo H A, Macías-Rodríguez L, López-Bucio J. The role of microbial signals in plant growth and development. Plant Signaling & Behavior, 2009, 4(8): 701- 712.
[130] Herder G D, Van Isterdael G, Beeckman T, De Smet I. The roots of a new green revolution. Trends in Plant Science, 2010, 15(11): 600- 607.
[131] Karasawa T, Hodge A, Fitter A H. Growth, respiration and nutrient acquisition by the arbuscular mycorrhizal fungusGlomusmosseaeand its host plantPlantagolanceolatain cooled soil. Plant, Cell & Environment, 2012, 35(4): 819- 828.
[132] Schroeder M S, Janos D P. Plant growth, phosphorus nutrition, and root morphological responses to arbuscular mycorrhizas, phosphorus fertilization, and intraspecific density. Mycorrhiza, 2005, 15(3): 203- 216.
[133] López-Bucio J, Hernández-Abreu E, Sánchez-Calderón L, Nieto-Jacobo M F, Simpson J, Herrera-Estrella L. Phosphate availability alters architecture and causes changes in hormone sensitivity in the Arabidopsis root system. Plant Physiology, 2002, 129(1): 244- 256.
[134] Tian H, Drijber R A, Li X L, Miller D N, Wienhold B J. Arbuscular mycorrhizal fungi differ in their ability to regulate the expression of phosphate transporters in maize (ZeamaysL.). Mycorrhiza, 2013, 23(6): 507- 514.
[135] Mantelin S, Desbrosses G, Larcher M, Tranbarger T J, Cleyet-Marel J C, Touraine B. Nitrate-dependent control of root architecture and N nutrition are altered by a plant growth-promotingPhyllobacteriumsp. Planta, 2006, 223(3): 591- 603.
[136] Zhang H M, Forde B G. An ArabidopsisMADSboxgene that controls nutrient-induced changes in root architecture. Science, 1998, 279(5349): 407- 409.
[137] Boukcim H, Plassard C. Juvenile nitrogen uptake capacities and root architecture of two open-pollinated families ofPiceaabies. Effects of nitrogen source and ectomycorrhizal symbiosis. Journal of Plant Physiology, 2003, 160(10): 1211- 1218.
[138] Eissenstat D M, Kucharski J M, Zadworny M, Adams T S, Koide R T. Linking root traits to nutrient foraging in arbuscular mycorrhizal trees in a temperate forest. New Phytologist, 2015, 208(1):114-124.
[139] Willaume M, Pagès L. Correlated responses of root growth and sugar concentrations to various defoliation treatments and rhythmic shoot growth in oak tree seedlings (Quercuspubescens). Annals of Botany, 2011, 107(4): 653- 662.
[140] Bago B, Pfeffer P E, Shachar-Hill Y. Carbon metabolism and transport in arbuscular mycorrhizas. Plant Physiology, 2000, 124(3): 949- 958.
[141] 吳強盛, 袁芳英, 費永俊, 李莉, 黃詠明, 劉春艷. 叢枝菌根真菌對白三葉根系構型和糖含量的影響. 草業學報, 2014, 23(1): 199- 204.
[142] Birhane E, Kuyper T W, Sterck F J, Bongers F. Arbuscular mycorrhizal associations inBoswelliapapyrifera(frankincense-tree) dominated dry deciduous woodlands of Northern Ethiopia. Forest Ecology and Management, 2010, 260(12): 2160- 2169.
[143] Bhushan G, Sharma S K, Kumar S, Bisht A, Das R, Singh A P. Effect of plant growth promoting rhizobacteria and fungi on growth of urd bean (Vignamungo). Ethiopian International Journal of Multidisciplinary Research, 2015, 2(3): 13- 18.
[144] Badar R, Nisa Z, Ibrahim S. Supplementation of P with rhizobial inoculants to improve growth of peanut plants. International Journal of Applied Research, 2015, 1(4): 19- 23.
[145] Belimov A A, Dodd I C, Safronova V I, Shaposhnikov A I, Azarova T S, Makarova N M, Davies W J, Tikhonovich I A. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane- 1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanumtuberosum). Annals of Applied Biology, 2015, 167(1): 11- 25.
A review of the regulation of plant root system architecture by rhizosphere microorganisms
CHEN Weili1, LI Juan2, ZHU Honghui3, CHEN Jiezhong1, YAO Qing1,3,*
1 College of Horticulture, South China Agricultural University, Guangzhou 510642, China 2ZhongkaiUniversityofAgricultureandEngineering,Guangzhou510225,China3GuangdongInstituteofMicrobiology,Guangzhou510070,China
Plant root system architecture (RSA) is one of the most important characteristics of plant morphology. RSA exhibits a plasticity that is not only controlled by genetic factors but is also regulated by diverse environmental factors. Recently, a large number studies have indicated that rhizosphere microorganisms can regulate the plant RSA, and further influence an array of plant physiological and ecological processes. This paper mainly reviews the regulation patterns and corresponding mechanisms of plant RSA mediated by the important rhizosphere microorganisms, such as arbuscular mycorrhizal fungi, rhizobia, and plant growth-promoting rhizobacteria. Future research is proposed to provide reference for related research and practical applications.
root system architecture; rhizosphere microorganism; regulation
國家自然科學基金項目(31270448);廣東省高等學校人才引進專項(粵財教[2013]246號)
2015- 02- 26;
日期:2015- 12- 14
10.5846/stxb201502260390
*通訊作者Corresponding author.E-mail: yaoqscau@scau.edu.cn
陳偉立,李娟,朱紅惠,陳杰忠,姚青.根際微生物調控植物根系構型研究進展.生態學報,2016,36(17):5285- 5297.
Chen W L, Li J, Zhu H H, Chen J Z, Yao Q.A review of the regulation of plant root system architecture by rhizosphere microorganisms.Acta Ecologica Sinica,2016,36(17):5285- 5297.

