甲羥戊酸激酶基因真核及shRNA表達載體構(gòu)建及其對BxPC-3細胞周期蛋白表達的影響
金 銳,王 芳,欒 康,羅 欣,張勝權(quán)
?
甲羥戊酸激酶基因真核及shRNA表達載體構(gòu)建及其對BxPC-3細胞周期蛋白表達的影響
金 銳,王 芳,欒 康,羅 欣,張勝權(quán)
目的 構(gòu)建甲羥戊酸激酶(MVK)基因真核及shRNA表達載體并轉(zhuǎn)染至BxPC-3細胞中,觀察其對細胞周期蛋白的影響。 方法 從BxPC-3細胞中提取總RNA, 逆轉(zhuǎn)錄PCR(RT-PCR)法獲得目的基因MVK以及通過化學(xué)合成MVK(751~779)和MVK(1 089~1 117)位點寡核苷酸片段,構(gòu)建真核表達及shRNA表達載體并轉(zhuǎn)染至BxPC-3細胞,篩選穩(wěn)定表達細胞系。 Western blot法分析轉(zhuǎn)染后對BxPC-3細胞周期蛋白的影響。 結(jié)果 成功獲得MVK基因真核表達(pcDNA3.1-mvk)及兩個針對MVKshRNA表達載體(piLenti-RNAi-shRNA1/2)。通過抗生素篩選及Western blot分析獲得了穩(wěn)定的MVK過表達及低表達細胞株。Western blot分析顯示:過表達MVK的細胞株及MVKknockdown的細胞株中細胞周期蛋白Cyclin B1、Cyclin E表達量與正常及對照細胞相比均顯著降低。 結(jié)論MVK過表達及低表達均抑制BxPC-3細胞周期蛋白Cyclin B1、Cyclin E的表達。
甲羥戊酸激酶;基因重組;寡核苷酸;細胞周期蛋白;BxPC-3;shRNA
甲羥戊酸途徑是體內(nèi)膽固醇生物合成的重要代謝途徑[1],其主要是由乙酰輔酶A為原料合成甲羥戊酸,然后在甲羥戊酸激酶(mevalonate kinase,MVK)的催化作用下最終生成法尼基焦磷酸(FPP)、牛耳基牛兒焦磷酸(GGPP)、膽固醇(CH)等。中間代謝產(chǎn)物FPP、GGPP是細胞蛋白質(zhì)酯化的戊二烯供體,參與調(diào)節(jié)細胞增殖、凋亡、分化等過程[2]。研究[3]證實:幾乎存在一半以上腫瘤細胞中的p53能夠顯著上調(diào)細胞中甲羥戊酸途徑代謝及蛋白質(zhì)的酯化過程,提示甲羥戊酸途徑可能成為腫瘤治療的一個新靶點。胰腺癌是常見的消化系統(tǒng)惡性腫瘤,患者死亡率高。Harrison et al[4]研究發(fā)現(xiàn)苯乙酸鹽能夠抑制甲羥戊酸途徑中類異戊二烯的生物合成進而對胰腺癌細胞有生長抑制作用。真核細胞進行增殖主要依靠有絲分裂方式。分裂周期分為:間期和分裂期。細胞周期的順利進行需要細胞周期蛋白(Cyclins)及周期蛋白依賴性激酶(CDK)進行調(diào)節(jié)。當(dāng)甲羥戊酸代謝途徑紊亂,可能對胰腺癌細胞周期蛋白合成產(chǎn)生影響最終產(chǎn)生生長抑制。該研究通過體外構(gòu)建不同基因表達載體研究其對胰腺癌BxPC-3細胞周期蛋白的作用及機制,旨在為胰腺癌治療提供一個新的思路。
1 材料與方法
1.1 材料
1.1.1 基因重組試劑 TRIzol試劑、逆轉(zhuǎn)錄試劑盒、DNA上樣緩沖液(6×Loading Buffer、DNA Marker(DL2 000等)、PCR反應(yīng)試劑、Hind Ⅲ和XhoⅠ均購自日本TaKaRa公司;T4 DNA連接酶、限制性核酸內(nèi)切酶BbsI購自美國NEB公司;質(zhì)粒提取試劑盒購自美國OMEGA公司;膠回收試劑盒購自美國AxyGen公司。
1.1.2 細胞培養(yǎng)及轉(zhuǎn)染試劑 DMEM、1640、胎牛血清購自美國Gibco公司;G418和嘌呤霉素(Puromycin)購自美國Sigma公司;MegaTran1.0 Transfection Reagent購自美國Origene公司。
1.1.3 細胞、質(zhì)粒、菌株 胰腺癌細胞BxPC-3購自中國科學(xué)院細胞中心; pcDNA.3.1/myc-His A, B, and C、piLenti-RNAi-GFP、E.coliJM109均購自美國Invitrogen公司。
1.2 方法
1.2.1 引物設(shè)計 根據(jù)NCBI GenBank 提供的MVK序列,設(shè)計MVK真核表達引物。 上游引物(帶有Hind Ⅲ酶切位點):5′-CCCAAGCTTATGTTGTCAGAAGTCCTACTGG-3′; 下游引物(帶有Xho Ⅰ酶切位點):5′-CCGCTCGAGTCAGAGGCCATCCAGGGCTTGC-3′。利用shRNA在線軟件設(shè)計兩條針對MVK基因 mRNA的shRNA序列。針對MVK(751-779)的序列:5′-AGAAACAGGCTGCTCAAGTTCCCAGAGAT-3′和MVK(1 089~1 117)的序列:5′-TGGCTTTGACTGCTTGGAAACCAGCATCG-3′。寡核苷酸序列由上海生物工程有限公司合成。1.2.2 HaCaT細胞培養(yǎng)收集及總RNA提取 復(fù)蘇HaCaT細胞,用含10%胎牛血清的DMEM于37 ℃、5% CO2的培養(yǎng)箱中培養(yǎng)24 h,待其狀態(tài)良好,棄去培養(yǎng)液,PBS洗3次,0.25%胰酶消化,收集細胞懸液,TRIzol試劑提取細胞總RNA。
1.2.3 RT-PCR擴增野生型MVK基因
1.2.3.1 逆轉(zhuǎn)錄反應(yīng) 采用逆轉(zhuǎn)錄試劑盒進行逆轉(zhuǎn)錄反應(yīng),依次加入總RNA 5 μl,10×RT Buffer 1 μl,Oligo dT 0.5 μl,10 mmol/L dNTP 1 μl,25 mmol/L MgCl22 μl,AMV Reverse Transcriptase 0.25 μl。輕彈管底使其混勻,點動離心,42 ℃ 60 min, 95 ℃ 5 min條件下逆轉(zhuǎn)錄,加入40 μl ddH2O即為cDNA備用溶液。
1.2.3.2 PCR反應(yīng) 取上述cDNA 5 μl,依次加入TaqDNA Polymerase 1 μl、上下游引物各0.5 μl、10 mmol/L dNTP 0.5 μl、10×Buffer 2.5 μl、25 mmol/L MgCl21.5 μl,補ddH2O 8.5μl。94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,72 ℃ 10 min,循環(huán)30次。瓊脂糖凝膠電泳分析結(jié)果。
1.2.4 重組體的構(gòu)建及篩選
1.2.4.1MVK基因真核表達載體的構(gòu)建、篩選 將質(zhì)粒pcDNA.3.1和MVK在37 ℃的恒溫體系中分別用核酸內(nèi)切酶Hind Ⅲ和XhoⅠ雙酶切4 h。瓊脂糖凝膠電泳分析酶切結(jié)果,用膠回收試劑盒回收所需酶切產(chǎn)物。pcDNA.3.1和目的片段按5︰1摩爾比加入T4 DNA連接酶體系中,16 ℃連接過夜。-80 ℃取出感受態(tài)JM109細胞, 將上述重組體轉(zhuǎn)化至JM109中,37 ℃培養(yǎng)12 h,菌落擴增后經(jīng)PCR、酶切進行重組體鑒定,測序。-20 ℃保存,備用。重組體命名為pcDNA 3.1-mvk。
1.2.4.2MVK不同位點shRNA表達載體的構(gòu)建、篩選 合成的oligoDNA序列在緩沖體系中依次經(jīng)過變性、退火反應(yīng)。質(zhì)粒piLenti-RNAi-GFP及oligoDNA經(jīng)Bbs I酶切、電泳、回收,以5 ∶1的摩爾比16 ℃連接過夜。將連接產(chǎn)物轉(zhuǎn)化入JM109,經(jīng)抗生素及PCR篩選出陽性克隆,擴增,測序,提取質(zhì)粒。-20 ℃保存,備用。重組體命名為piLenti-RNAi-mvk1/2。
1.2.4.3 重組體轉(zhuǎn)染至BxPC-3細胞 復(fù)蘇凍存的人胰腺癌BxPC-3細胞,于含10%胎牛血清的1640培養(yǎng)基、37 ℃、5% CO2中培養(yǎng),待其狀態(tài)良好,按2×105/ml密度接種于12孔板中培養(yǎng),待其達到90%~95%匯合時,用MegaTran1.0 Transfection Reagent將重組質(zhì)粒轉(zhuǎn)染至BxPC-3細胞中,設(shè)置復(fù)孔培養(yǎng)24 h后,分別用G418和Puromycin抗性培養(yǎng)基篩選。同時設(shè)置空白未處理及轉(zhuǎn)染空載pcDNA3.1、piLenti-RNAi-GFP細胞組作為對照。
1.2.4.4 Western blot 檢測MVK基因表達產(chǎn)物 6組細胞(空白未處理細胞、pcDNA3.1、pcDNA3.1-mvk、piLenti-RNAi-GFP、piLenti-RNAi-mvk1/2穩(wěn)定轉(zhuǎn)染的細胞)培養(yǎng)后,提取細胞總蛋白進行SDS-PAGE凝膠電泳,按10 μl /孔上樣量加入12%凝膠孔中,依次進行:電泳(濃縮膠60 V,分離膠120 V約2 h)、轉(zhuǎn)移(150 mA恒流3 h左右)、封閉(5%脫脂牛奶常溫封閉2 h)、孵育一抗(4 ℃孵育過夜)、孵育二抗(常溫搖床孵育2 h)、Thermo Scientific SuperSignal West Pico Trial Kit化學(xué)發(fā)光底物顯影,分析MVK基因表達產(chǎn)物。
1.2.4.5 Western blot 檢測細胞周期蛋白表達 通過1.2.4.4步驟鑒定出MVK基因高表達及knockdown的細胞,接種24孔培養(yǎng)板,Western blot步驟同1.2.2.4,化學(xué)發(fā)光分析各組細胞中細胞周期蛋白(Cyclin B1及Cyclin E)的表達。
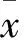
2 結(jié)果
2.1 PCR擴增MVK基因編碼區(qū)(CDS)及化學(xué)合成shRNA 經(jīng)RT-PCR獲得大量MVK基因全長片段,1.5%瓊脂糖凝膠電泳可見1 190 bp左右特異性擴增條帶,見圖1A。
2.2MVK真核表達重組體的構(gòu)建與鑒定MVK基因經(jīng)酶切、回收、連接、轉(zhuǎn)化后。PCR及雙酶切篩選陽性克隆,結(jié)果可見1 190 bp的MVKPCR產(chǎn)物,酶切后可見5 500 bp的pcDNA3.1及1 190 bp的MVK片段,見圖1A、1B 。陽性克隆擴增后測序,結(jié)果經(jīng)Blast比對正確(圖1C,給出MVK的部分序列),保存?zhèn)溆谩?/p>
2.3 shRNA表達載體的構(gòu)建與鑒定 shRNA經(jīng)酶切、電泳、回收、轉(zhuǎn)化、連接、轉(zhuǎn)化后,經(jīng)酶切篩選陽性克隆(圖1D)。擴增后測序,結(jié)果經(jīng)Blast比對正確(圖1D,給出shRNA1的序列),保存?zhèn)溆谩?/p>
2.4 轉(zhuǎn)染BxPC-3觀測GFP熒光和篩選穩(wěn)定表達細胞系 piLenti-RNAi-GFP-mvk(751-779,shRNA1)及piLenti-RNAi-GFP-mvk(1 089~1 117, shRNA2)轉(zhuǎn)染BxPC-3經(jīng)Puromycin(0.5 μg/ml) 篩選,熒光鏡下結(jié)果見圖2, Western blot分析顯示shRNA1穩(wěn)定轉(zhuǎn)染的細胞中MVK蛋白表達顯著降低,見圖3。
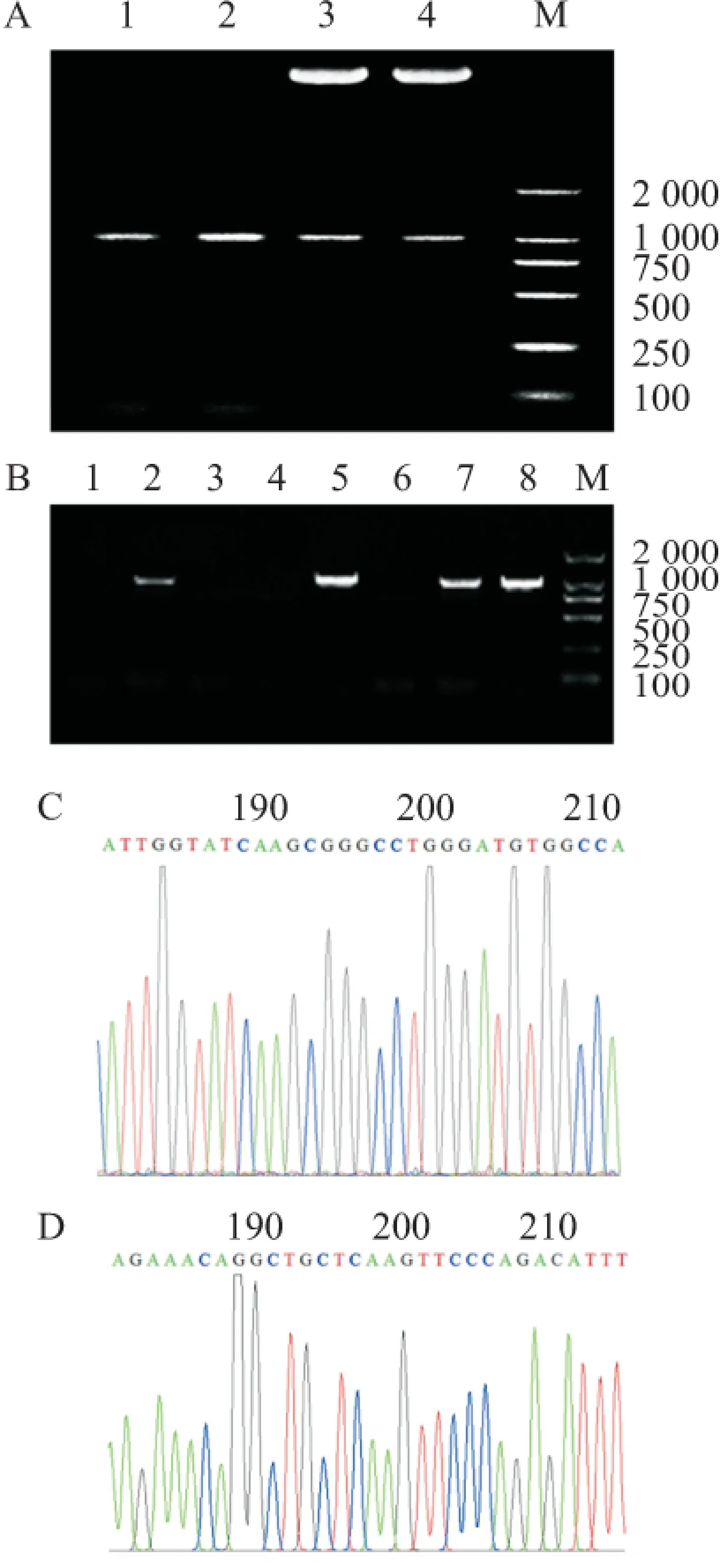
圖1 MVK真核表達載體及shRNA表達載體構(gòu)建
M: Marker;A:MVK全長片段獲取及重組體篩選;1、2:MVKPCR擴增產(chǎn)物;3、4:MVK重組體酶切結(jié)果;B: PCR篩選MVK重組體克隆; 1、3、4、6:陰性克隆;2、5、7、8:陽性克隆;C:MVK測序結(jié)果(部分序列);D: shRNA1 測序結(jié)果(部分序列)
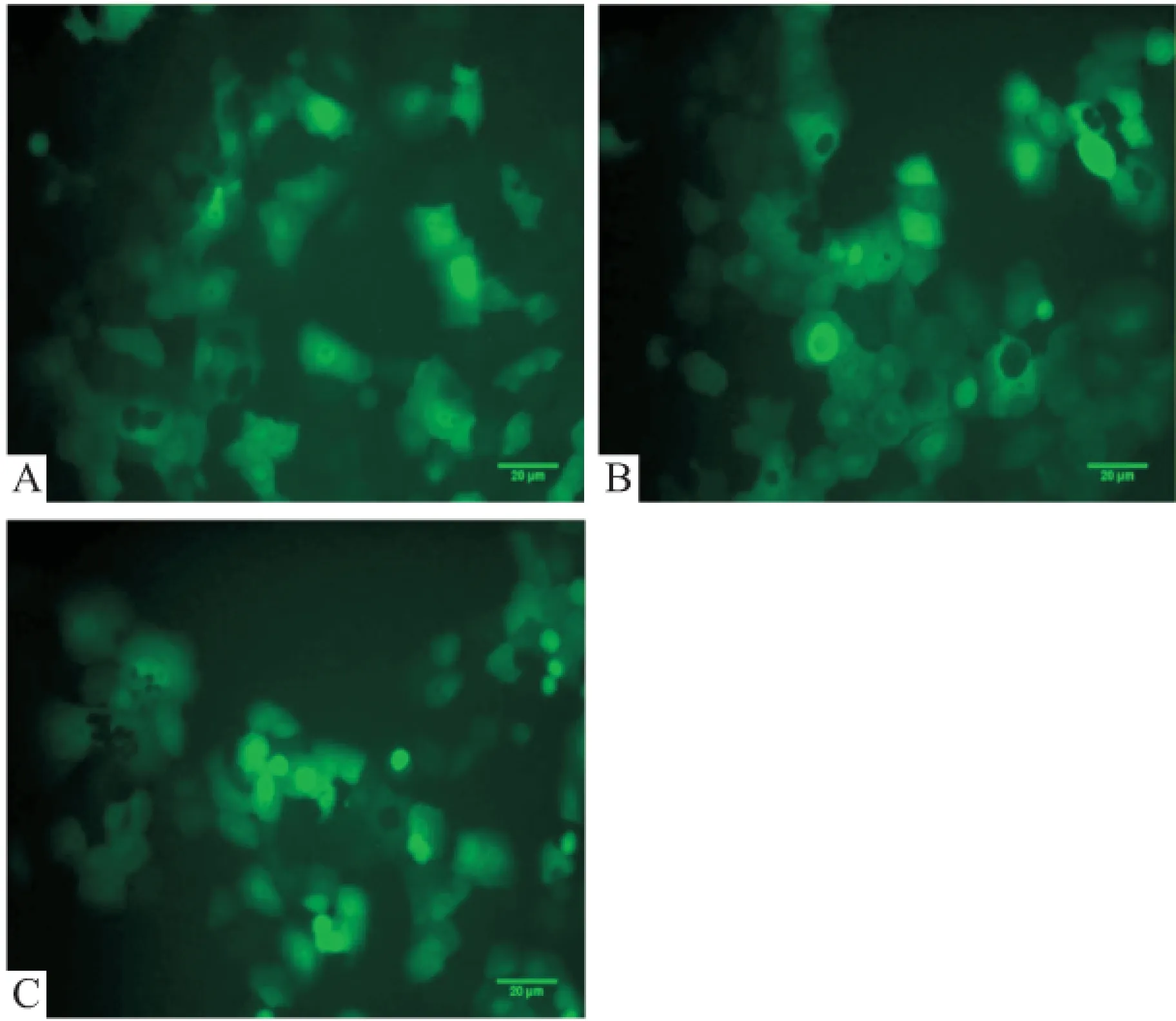
圖2 熒光篩選MVKshRNA轉(zhuǎn)染穩(wěn)定表達細胞系
A: 轉(zhuǎn)染piLenti-RNAi-GFP組; B: 轉(zhuǎn)染mvkshRNA1組; C: 轉(zhuǎn)染mvkshRNA2組
圖3 Western blot分析MVK及Cyclins結(jié)果
A:空白未處理組;b:轉(zhuǎn)染pcDNA3.1組;c:轉(zhuǎn)染pcDNA3.1-mvk組;d:轉(zhuǎn)染piLenti-RNAi-GFP組; e:轉(zhuǎn)染 piLenti-RNAi-GFP-mvk(751-779, shRNA1) 組;f:piLenti-RNAi-GFP-mvk(1 089~1 117,shRNA2) 組;與空白未處理組比較:*P<0.05;與轉(zhuǎn)染pcDNA3.1組比較:#P<0.05;與轉(zhuǎn)梁piLenti-RNAi-GFP組比較:△P<0.05
pcDNA3.1-mvk轉(zhuǎn)染BxPC-3后,用抗生素G418(500 μg/ml)篩選穩(wěn)定表達細胞株,Western blot結(jié)果顯示pcDNA3.1-mvk穩(wěn)定轉(zhuǎn)染的細胞中MVK蛋白表達顯著升高,見圖3。
2.5 Western blot分析轉(zhuǎn)染后MVK基因在BxPC-3中表達情況以及對BxPC-3細胞周期蛋白表達的影響 a到f組細胞各指標(biāo)分別進行方差分析,SPSS 17.0軟件分析得出FMVK=716.86,FCyclinB1=55.346,FCyclinE=93.321,各組均為P>0.05,即方差齊性,對各指標(biāo)分別進行t檢驗,結(jié)果顯示:轉(zhuǎn)染pcDNA3.1-mvk組、空白未處理組、轉(zhuǎn)染pcDNA3.1組相比,MVK相對表達量顯著升高,細胞周期蛋白(Cyclin B1、Cyclin E)相對表達量顯著降低,差異有統(tǒng)計學(xué)意義(P<0.05)。轉(zhuǎn)染MVKshRNA1/shRNA2組與空白未處理組、轉(zhuǎn)染piLenti-RNAi-GFP組相比,MVK相對表達量顯著降低,細胞周期蛋白(Cyclin B1、Cyclin E)相對表達量也顯著降低,差異有統(tǒng)計學(xué)意義(P<0.05)。見圖3。
3 討論
甲羥戊酸代謝途徑是體內(nèi)合成脂類物質(zhì)的一種重要代謝途徑,參與細胞的生理進程,幾乎存在于所有高等真核生物和病毒中[5]。其中MVK起到關(guān)鍵作用,是合成下游重要營養(yǎng)物質(zhì)的橋梁[6]。研究[7-8]表明甲羥戊酸基因突變將導(dǎo)致MVK缺失癥,是一種稀有的常染色體代謝性疾病。
本研究通過體外構(gòu)建MVK基因的真核表達載體轉(zhuǎn)染至人胰腺癌細胞BxPC-3,旨在研究MVK基因不同程度表達對其增殖相關(guān)蛋白的影響。通過體外研究發(fā)現(xiàn),轉(zhuǎn)染含有野生型MVK基因的重組體使BxPC-3細胞MVK基因高表達,并在很大程度上降低細胞周期蛋白Cyclin B1、Cyclin E的表達水平;轉(zhuǎn)染MVK基因的shRNA1/2均能下調(diào)BxPC-3細胞MVK基因的表達水平且不同程度地抑制其周期蛋白Cyclin B1、Cyclin E的表達。該研究采用基因工程及knockdown技術(shù)構(gòu)建不同基因表達載體來干預(yù)胰腺癌細胞MVK基因表達程度,從而為更詳細地研究甲羥戊酸途徑在胰腺癌中的作用機制打下了一個新的基礎(chǔ)。
縱觀甲羥戊酸整個代謝途徑,當(dāng)MVK缺失后將會導(dǎo)致下游的FPP、GGPP、CH等的缺失及上游甲羥戊酸的累積。其中FPP、GGPP是細胞蛋白質(zhì)酯化的戊二烯供體[9],細胞內(nèi)蛋白質(zhì)的異戊二烯化使定位于細胞膜上的GTP酶介導(dǎo)細胞信號的轉(zhuǎn)導(dǎo),從而調(diào)控細胞的生長及凋亡進程。其中,研究最多的就是小G蛋白參與的細胞調(diào)控機制。常見的小G蛋白如Ras、Rho、Rab、Ran家族等,它們是細胞內(nèi)多個信號轉(zhuǎn)導(dǎo)的中心環(huán)節(jié),因此參與對細胞生理功能的影響,并與抗腫瘤治療有關(guān)[10]。代謝中產(chǎn)生的CH是細胞膜系統(tǒng)的重要組成成分,在細胞的生理功能各個方面扮演著非常重要的角色。由此可以推斷,MVK基因突變后導(dǎo)致MVK功能缺失,造成下游產(chǎn)物FPP、GGPP等缺乏,導(dǎo)致細胞蛋白酯化過程不能進行,從而可能影響細胞周期蛋白及其蛋白因子表達,進而阻礙細胞的生長。而當(dāng)MVK活性過度增強時,將很大程度加快代謝反應(yīng)的進程,促使下游產(chǎn)物FPP、GGPP等合成持續(xù)增加,促進細胞蛋白質(zhì)酯化過程加快過度,從而可能不同程度地影響細胞的信號轉(zhuǎn)導(dǎo)造成生理功能紊亂,如降低周期蛋白的表達水平,表現(xiàn)為細胞生長抑制,其深入的分子機制有待進一步研究。因此,下一步將重點進行MVK正常表達、低表達和高表達情況下,BxPC-3細胞增殖相關(guān)情況及其相同條件下小G蛋白酯化情況及其介導(dǎo)的信號通路方面的研究。
[1] Rauthan M, Pilon M. The mevalonate pathway inC.elegans[J]. Lipids Health Dis, 2011, 10: 243.
[2] Joo J H, Jetten A M. Molecular mechanisms involved in farnesol-induced apoptosis[J]. Cancer Lett, 2010, 287(2):123-35.
[3] Thurnher M, Nussbaumer O, Gruenbacher G. Novel aspects of mevalonate pathway inhibitors as antitumor agents [J]. Clin Cancer Res, 2012, 18(13):3524-31.
[4] Harrison L E, Wojciechowicz D C, Brennan M F, et al. Phenylacetate inhibits isoprenoid biosynthesis and suppresses growth of human pancreatic carcinoma[J]. Surgery, 1998, 124(3):541-50.
[5] Gelb M H, Brunsveld L, Hrycyna C A, et al. Therapeutic intervention based on protein prenylation and associated modifications[J]. Nat Chem Biol, 2006,2(10):518-28.
[6] Haas D, Hoffmann G F. Mevalonate kinase deficiencies: from mevalonic aciduria to hyperimmunoglobulinemia D syndrome[J]. Orphanet J Rare Dis, 2006,1:13.
[7] Tricarico P M, Marcuzzi A, Piscianz E, et al. Mevalonate kinase deficiency and neuroinflammation: balance between apoptosis and pyroptosis[J]. Int J Mol Sci, 2013, 26; 14(12):23274-88.
[8] De Leo L, Marcuzzi A, Decorti G, et al. Targeting farnesyl-transferase as a novel therapeutic strategy for mevalonate kinase deficiency:invitroandinvivoapproaches[J]. Pharmacol Res, 2010, 61(6):506-10.
[9] Buhaescu I, Izzedine H. Mevalonate pathway: a review of clinical and therapeutical implications[J]. Clin Biochem, 2007, 40(9-10):575-84.
[10]Galle M, Crespo R, Kladniew B R, et al. Suppression by geraniol of the growth of A549 human lung adenocarcinoma cells and inhibition of the mevalonate pathway in culture andinvivo: potential use in cancer chemotherapy[J]. Nutr Cancer, 2014, 66(5):888-95.
The construction of eukaryotic and shRNA expression vector of mevalonate kinase gene and its effect on cyclins expression in BxPC-3
Jin Rui, Wang Fang, Luan Kang, et al
(Dept of Biochemistry and Molecular Biology, Anhui Medical University, Hefei 230032)
Objective To construct the eukaryotic expression and shRNA expression vectors of mevalonate kinase (MVK) gene and study the effect on cyclins expression in BxPC-3 cells. Methods Total RNA was extracted from BxPC-3 cells, and the desired geneMVKwas obtained by RT-PCR and acquiring chemical synthesisMVK(751-779) andMVK(1089-1117) locus oligo fragments. After construction of eukaryotic and shRNA expression vectors using genetic engineering, the recombinant was transfected into BxPC-3 and cell lines of stable expression were selected by antibiotic. Western blot was used to analyze the expression ofMVKand cyclins in BxPC-3. ResultsMVKeukaryotic (pcDNA3.1-mvk) and two shRNA (piLenti-RNAi-shRNA1/2) expression vectors forMVKwere successfully constructed. The cell lines with stableMVKover-expression and knockdown were obtained by antibiotic selection and Western blot. Western blot results showed that Cyclin B1 and Cyclin E expressed significantly lower both in BxPC-3 cell withMVKover-expression andMVKknockdown compared with the control. Conclusion BothMVKover expression and knockdown can inhibit the expression of Cyclin B1, Cyclin E in BxPC-3.
mevalonate kinase; genetic recombination; oligos; cyclins; BxPC-3 cell; shRNA
時間:2015-12-30 14:38
http://www.cnki.net/kcms/detail/34.1065.R.20151230.1438.012.html
國家自然科學(xué)基金(編號:81271748)
安徽醫(yī)科大學(xué)生物化學(xué)與分子生物學(xué)教研室,合肥 230032
金 銳,男,碩士研究生;
張勝權(quán),男,教授,碩士生導(dǎo)師,責(zé)任作者,E-mail:sqz36@yahoo.com
R 349.83
A
1000-1492(2016)01-0022-05
2015-10-12接收

