促紅細胞生成素對脊髓源性神經干細胞分化能力的影響
李小波,張 輝,王少濱,劉 杰,余 濤,杜怡斌,尹宗生
?
促紅細胞生成素對脊髓源性神經干細胞分化能力的影響
李小波1,張 輝1,王少濱2,劉 杰1,余 濤1,杜怡斌1,尹宗生1
目的 探討成體大鼠脊髓源性神經干細胞(NSCs)在促紅細胞生成素(EPO)的作用下體外分化的形態學表現,為成體脊髓源性NSCs移植治療脊髓損傷提供理論基礎。方法 利用無血清懸浮培養,體外分離培養SD大鼠脊髓源性NSCs,隨后以含血清培養基貼壁誘導分化培養7 d,行免疫細胞化學染色,以抗巢蛋白(Nestin)鑒定NSCs,以抗微管相關蛋白2(MAP2)和膠質纖維酸性蛋白(GFAP)免疫熒光染色檢測NSCs的分化情況。選取第3代NSCs,向培養基中添加EPO, 使EPO的終濃度為10 IU/ml,并設不添加EPO的對照組,免疫熒光共聚焦顯微鏡下分別觀察并計數各組神經元/細胞總數得出百分率。結果 SD大鼠脊髓組織體外懸浮培養可獲得大量神經球,所獲得的神經球均表達Nestin蛋白,以含血清培養基貼壁誘導分化培養,可檢測出MAP2和GFAP陽性細胞;EPO組誘導分化后,表達MAP2陽性細胞較對照組顯著提高(P<0.05)。結論 SD大鼠脊髓體外培養可獲得NSCs,EPO可促進成體脊髓源性NSCs向神經元方向分化。
神經干細胞;促紅細胞生成素;神經元;分化
脊髓損傷是骨科臨床工作中一種常見損傷,隨著醫學的發展和進步,其死亡率已經明顯降低,但致殘率仍很高,主要原因是損傷后神經功能的恢復目前醫學界仍沒有行之有效的治療措施。神經干細胞(neural stem cells,NSCs)是能夠自我更新、增殖和分化的一類細胞,有產生神經元和膠質細胞的多向分化潛能,在神經系統的損傷方面具有巨大的前景,應用NSCs移植治療脊髓損傷也一直是當前的主導研究方向,但研究[1]表明移植的NSCs生理狀態下神經生發的比例很低,大部分會分化成為膠質細胞形成瘢痕,阻礙損傷脊髓的恢復。促紅細胞生成素(erythropoietin,EPO)是一種水溶性的糖蛋白,可促進紅系祖細胞增殖、分化以及成熟。近來有研究[2]顯示EPO還可以降低神經元對低氧缺血的敏感性,增強神經元的存活能力等神經保護作用。該實驗擬通過對EPO調控大鼠脊髓源性NSCs分化方向的研究,為提高神經生發比例探索新的途徑,為NSCs移植治療脊髓損傷提供新的研究方向。
1 材料與方法
1.1 材料 SD大鼠,SPF級,7~9 d齡,由安徽醫科大學實驗動物中心提供。DMEM/F12(1 ∶1)培養基、B27、左旋多聚賴氨酸、左旋谷氨酸、胎牛血清均購自美國Gibco公司;表皮生長因子(epidermal growth factor,EGF)和堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)均購自美國Peprotech公司;大鼠抗巢蛋白(Nestin)抗體、小鼠抗微管相關蛋白2(microtubule associated protein,MAP2)抗體均購自美國Santa Cruz公司;兔膠質纖維酸性蛋白(glialfibrillary acidic protein,GFAP)抗體、山羊抗小鼠IgG/FITC、山羊抗兔IgG/TRITC均購自北京中杉金橋生物技術有限公司;24孔板購自美國 Corning公司。
1.2 方法
1.2.1 脊髓源性NSCs的體外培養和鑒定
1.2.1.1 NSCs的分離、培養 參考文獻[3]方法,7~9 d齡SD大鼠,以頸椎脫臼法處死,置于75%酒精中浸泡5 min消毒。消毒后在超凈臺內剪開背部皮膚,經椎管剪開,顯露脊髓組織;取出胸腰段脊髓,剝離組織表面的血管和脊膜,眼科剪剪碎至0.5 mm3大小;反復吹打后200目鋼網濾去組織雜質,收集懸液,以1 000 r/min離心5 min,棄上清液;沉淀用NSCs培養基重懸,以1×106/ml細胞密度接種于培養瓶;37 ℃、5% CO2培養箱培養,每2~3 d加入NSCs培養液,約7~9 d以機械吹打法傳代。
1.2.1.2 NSCs的Nestin免疫染色鑒定 參考文獻[4]方法,取生長狀態良好的第3代細胞,接種至24孔培養板中(預置有涂布100 μg /ml多聚賴氨酸的蓋玻片),40 g/L多聚甲醛固定20 min,PBS 1 ml/孔,漂洗3次,5 min/次,0.5% Triton X-100破膜10 min,PBS 1 ml/孔,漂洗3次,5 min/次,10%山羊血清封閉后置于37 ℃、5% CO2培養箱孵育1 h,吸棄山羊血清,滴加小鼠抗Nestin(1 ∶200)一抗,4 ℃冰箱過夜,PBS 1 ml/孔,漂洗3次,5 min/次,加入二抗山羊抗小鼠IgG /FITC (1 ∶100),37 ℃、5% CO2培養箱避光孵育1 h,PBS 1 ml/孔,漂洗3次,5 min/次,加入10 μg/ml Hoechst核染5 min,PBS 1 ml/孔,漂洗3次,5 min/次,封片,倒置熒光顯微鏡下觀察并拍照。
1.2.1.3 神經干細胞分化免疫化學染色 將NSCs接種于24孔培養板中(預置有涂布多聚賴氨酸的蓋玻片),每孔平均接種30個神經球,加入含有10%胎牛血清(FBS)的NSCs培養液500 μl, 37 ℃、5% CO2培養箱中靜置培養,每2~3 d換液1次,7 d后終止培養,收集貼有細胞的蓋玻片,分別做MAP-2、GFAP免疫熒光染色,免疫熒光顯微鏡下觀察并拍照。
1.2.2 EPO摻入實驗
1.2.2.1 實驗分組 取第3代NSCs懸液接種于添加EPO的無血清培養基中,使EPO的終濃度為10 IU/ml,另設不加EPO的對照組,37 ℃、5% CO2的恒溫培養箱中靜置培養,待形成神經球后,將EPO組和對照組分別接種于含10% FBS的分化培養基中,貼壁分化7 d。每組實驗重復3次。
1.2.2.2 MAP2免疫熒光染色 兩組NSCs貼壁分化7 d,分別行MAP2免疫熒光染色。然后在熒光顯微鏡下觀察并拍照,每組隨機取20個視野,計數MAP2陽性細胞數占細胞總數的百分率,然后進行統計學分析。每組實驗重復3次。
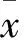
2 結果
2.1 NSCs鑒定
2.1.1 倒置相差顯微鏡下觀察結果 原代分離的NSCs呈單個懸浮狀,分散存在, 3~4 d后細胞逐漸聚集生長形成體積大小不一、形狀不規則的細胞團(圖1A),待培養至7~9 d,細胞團逐漸增大至典型的球形 (圖1B),部分體積較大細胞球的中心部位折光性差,顏色偏深,周邊邊境清晰,考慮可能為中心死亡細胞釋放毒性物質及周邊細胞阻礙營養吸收有關,此時細胞生長速度較慢,可用機械吹打法行細胞傳代。
2.1.2 免疫細胞化學染色 收集生長狀態良好的第3代神經球,Hoechst標記細胞核(圖2A),并行Nestin抗體免疫化學染色,結果顯示Nestin蛋白在NSCs胞質內呈陽性表達,神經球被染成綠色(圖2B),提示細胞球為神經干細胞球。
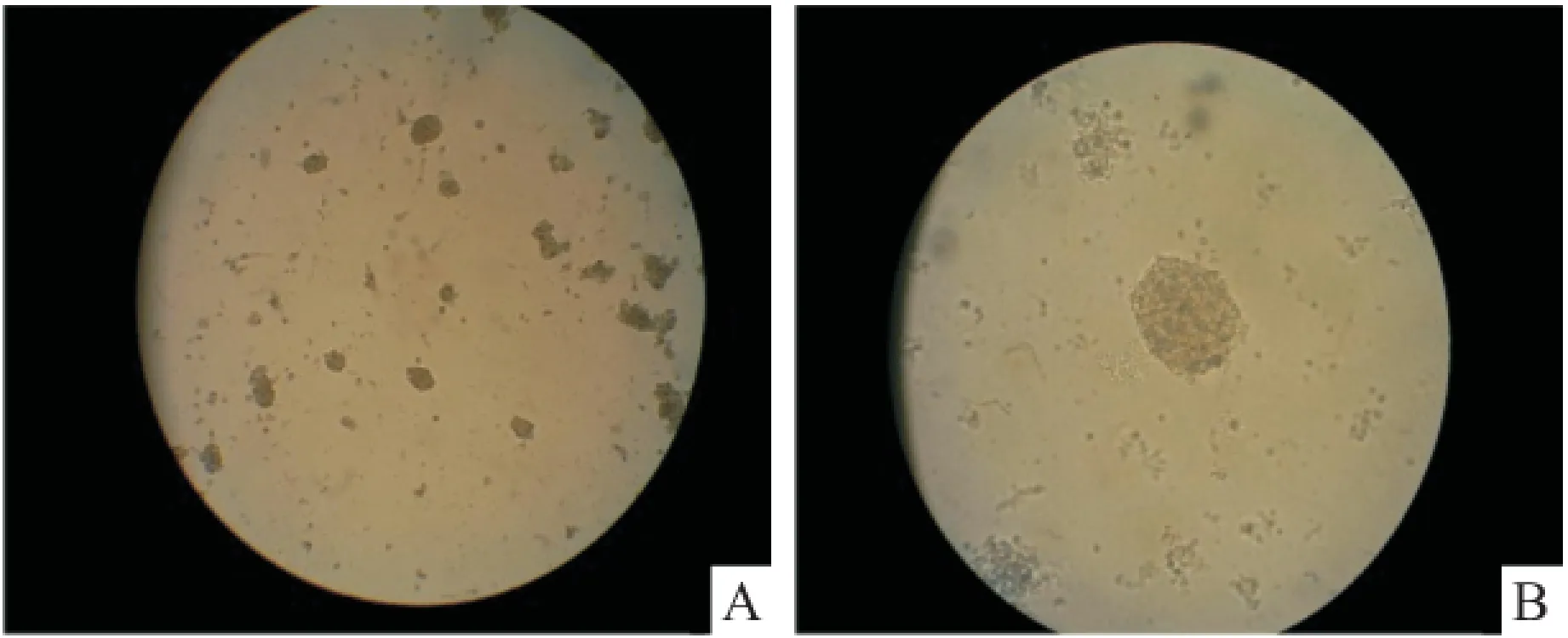
圖1 NSCs培養過程中的形態 ×200

圖2 NSCs的Nestin鑒定 ×200
貼壁分化培養7 d,普通光學顯微鏡下可見神經球周緣細胞向外遷移,突起呈放射狀延伸(圖3A),MAP2:免疫熒光顯微鏡下可見在部分細胞及突起中呈陽性表達,被染成綠色(圖3B),GFAP:免疫熒光顯微鏡下可見在部分細胞及突起中呈陽性表達,被染成紅色(圖3C)。
2.2 EPO作用下MAP2免疫化學染色 貼壁分化7 d后,兩組NSCs分別行MAP2免疫化學染色,在熒光顯微鏡下,每組隨機取20個視野,計算神經元分化比率,結果顯示對照組為(12.70±2.74)%,EPO組為(33.85±5.54)%,兩組比較差異有統計學意義(t=12.744,P<0.01)。見圖4。
3 討論
本實驗探討了EPO對成體脊髓源性NSCs分化的調控作用,通過分離培養成體脊髓組織,體外成功獲得大量懸浮生長的神經球。免疫化學染色顯示神經球呈Nestin陽性,而Nestin目前是公認的NSCs標志物[5],表明本實驗培養的細胞為NSCs。在添加10%FBS的培養基中NSCs貼壁分化7 d后,行免疫組化染色顯示分化細胞中可見MAP2陽性和GFAP陽性細胞,表明成體脊髓源性NSCs體外培養,有分化為神經元和星形膠質細胞的能力。以上結果初步證實了從成體脊髓組織分離培養的細胞具有自我更新和多向分化的潛能,具備了NSCs的基本屬性,為NSCs的定向分化和移植研究提供了良好應用價值的實驗材料。
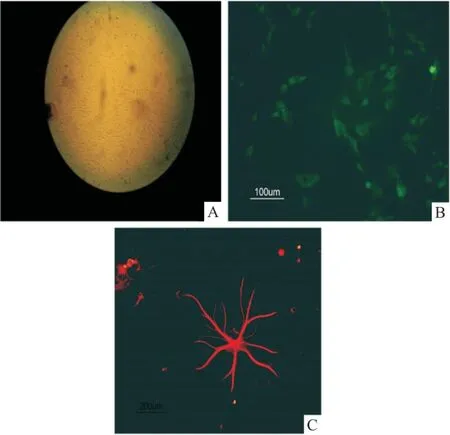
圖3 NSCs分化
A:神經球貼壁分化7 d(普通光鏡) ×200;B:神經球貼壁分化7 d,免疫細胞化學示MAP2陽性細胞(免疫熒光顯微鏡) ×200;C:神經球貼壁分化7 d,免疫細胞化學示GFAP陽性細胞(免疫熒光顯微鏡) ×100
圖4 對照組和EPO組MAP2免疫化學染色 ×200
A:神經元Hochest細胞核染色;B:神經元MAP2染色;1:對照組;2:EPO組
自1992年Reynolds et al[6]首先報道培養獲得NSCs以來,NSCs在神經損傷修復方面已經取得了明顯的進展,但相關研究主要集中在胚胎源性NSCs應用于腦組織方面,而對于成體脊髓源性NSCs在脊髓組織的研究則相對較少[7],從某種意義上來說成體脊髓源性NSCs的臨床意義可能更大,因為在中國神經損傷更多發于成年人,據不完全統計,現有截癱患者約40萬,每年新增約1萬患者,這些患者中大約有82%是16~32歲的青壯年男性。而且近來的研究[8]表明,神經生發區如前腦室下帶和海馬齒狀回的亞顆粒帶等區域存在較多的NSCs,而在非神經生發區如紋狀體、脊髓、小腦等雖然也存在NSCs,但數量很少,并且它們在體內主要生成膠質細胞,而脊髓損傷的功能恢復主要依靠分化的神經元重建神經通路,但大量分化為膠質細胞會阻礙通路的重建,因此應用成體脊髓源性NSCs修復神經損傷,促進NSCs向神經元方向定向分化,尤其是對NSCs發生與分化的調控因素及其調控機制的研究已逐漸成為當前的熱點。
EPO是一種調節細胞生成的體液因子,其主要的生理功能是促進紅系祖細胞增生和分化進而調節紅細胞生成,近年來不斷有研究[9-10]表明EPO還有非促紅細胞生成的作用,主要表現抗炎癥、抗凋亡以及神經保護等方面。其實EPO對體外培養的NSCs功能影響的實驗研究并不新鮮,已有相關文獻[11]報道EPO可抑制NSCs凋亡、促進其增殖及向神經元方向的定向分化,但目前的研究基本集中于胎鼠的腦組織,對成體脊髓源性NSCs研究甚少。本實驗以此作為研究背景,采用成體脊髓源性NSCs為實驗對象,以10 IU/ml EPO作用于體外培養的NSCs,觀察NSCs的分化方向。結果提示,與對照組相比,EPO組的NSCs向神經元方向分化的比例顯著提高。不過對于EPO如何調控NSCs向神經元方向分化卻鮮有文獻進行報道,目前的研究[12-14]表明NSCs分化的調控機制主要與以下3個方面有關:微環境、基因和信號通路。本研究表明體外培養條件下EPO可以促進成體脊髓源性NSCs向神經元方向分化,可能的原因為EPO與NSCs表面的EPO-R結合后誘導Jak2磷酸化,然后進一步激活下游的信號傳導通路來調控神經干細胞的分化方向。下一步將從信號通路方面深入探討EPO促進脊髓源性NSCs向神經元方向分化的機制。
綜上所述,成體大鼠脊髓組織體外分離培養可成功獲得能增殖、傳代并且有分化潛能的NSCs,EPO可促進體外培養的成體脊髓源性NSCs向神經元方向定向分化,為進一步研究EPO促進NSCs的分化機制及NSCs移植治療脊髓損傷等提供理論基礎和實驗依據。
[1] Pluchino S,Cusimano M,Bacigaluppi M,et al.Remodelling the injured CNS through the establishment of atypical ectopic perivascular neural stem cell niches[J].Arch Ital Biol,2010,148(2):173-83.
[2] Yu X,Shacka J J,Eells J B,et al.Erythropoietin receptor signaling is required for normal brain development[J].Development,2002,129(2):505-16.
[3] Yin Z S,Zhang H,Wang W,et al.Wnt-3a protein promote neuronal differentiation of neural stem cells derived from adult mouse spinal cord[J].Neurol Res, 2007 ,29(8):847-54.
[4] 張 碩,杜怡斌,杜公文,等. 骨髓源性EPCs對脊髓源性NSCs增殖分化的影響[J].安徽醫科大學學報,2015,50(1):20-4.
[5] Ke C L,Chen B L,Guo S L,et al.Differentiation of embryonic versus adult rat neural stem cells into dopaminergic neuronsinvitro[J].Neural Regen Res,2008,3(8):832-6.
[6] Reynolds B A,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mamrnalian central nervous system[J]. Science,1992,255(5052):1707-10.
[7] Bellenchi G C,Volpicelli F,Piscopo V,et al.Adult neural stem cells:an endogenous tool to repair brain injury[J].J Neurochem,2013,124(2):159-67.
[8] Song H,Stevens C F,Gage F H.Astroglia induce neurogenesis from adult neural stem cells[J].Nature,2002,417(6884):39-44.
[9] Sinor A D,Greenberg D A.Erythropoietin protects cultured cortical neurons,but not astroglia,from hypoxia and AMPA toxicity[J].Neuronsci Lett,2000,290(3):213-5.
[10] Siren A L,Fratelli M,Brines M,et al.Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress[J].Proc Natl Acad Sci USA,2001,98(7):4044-9.
[11] 趙舒武,高英茂,張曉麗,等.EPO對體外培養的神經干細胞增殖、分化和凋亡的影響[J].神經解剖學雜志,2007,23(5):549-53.
[12] Seki T.Microenvironment elements supporting adult hippocampal neurogenesis [J].Anat Sci Int,2003,78(2):69-78.
[13] Nieto M,Schuurmans C,Britz O,et al.Neural bHLH genes control the neuronal versus glial fate decision in cortical progenitors[J].Neuron,2001,29(2):401-13.
[14] Gaiano N, Nye J S,Fishell G.Radial glial identity is promoted by Notch1 signaling in the murine forebrain[J].Neuron,2000,26(2):395-404.
Li Xiaobo1, Zhang Hui1, Wang Shaobin2, et al
Effect of erythropoietin on the differentiation of adult spinal cord-derived neural stem cellsinvitro
(1Dept of Orthopaedics,The First Affiliated Hospital of Anhui Medical University,Hefei 230022;2DeptofOrthopaedics,TheFourthAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022)
Objective To investigate the promotion of the differentiation of erythropoietin(EPO) on the differentiation of the neural stem cells(NSCs)invitrofrom spinal cord of SD rats,and to provide experimental basis for the treatment of spinal cord injury by transplantating neural stem cells.Methods The spinal cord was isolated and cultured in serum-free suspension, then a differentiation suspension cultured in serum culture medium for 7 days was applied to the NSCs.Nestin was used to detect the NSCs,the differentiation ratio of NSCs into neurons and glia cells was detected by immunofluorescent histochemistry for microtubule-associated protein 2(MAP2) and glia fibrillary acid protein (GFAP).After obtained the third passage (P3) of NSCs, EPO was added to the medium on a final concentration of 10 IU/ml,control group without EPO, the differentiation proportion of MAP2-positive cells to total cells was identified by immunofluorescence staining.Results The results showed that the separated cells from spinal cord of SD rats formed neurospheres, in which nestin-positive cells were detected. GFAP and MAP2-positive cells were detected after differentiation culture.The proportion of MAP2-positive cells in the EPO group showed an significant increase compared with the control group(P<0.05).Conclusion The results indicate that NSCs can be obtained from the separated spinal cord of SD rats; EPO can increase the differentiation rate of NSCs into neurons.
neural stem cells;erythropoietin; neuron;differentiation
時間:2015-12-30 14:38
http://www.cnki.net/kcms/detail/34.1065.R.20151230.1438.008.html
國家自然科學基金 (編號:81171173)
1安徽醫科大學第一附屬醫院骨科,合肥 230022
2安徽醫科大學第四附屬醫院骨科,合肥 230022
李小波,男,碩士研究生;
尹宗生,男,教授,主任醫師,博士生導師,責任作者,E-mail:yinzongsheng1961@sina.com
R 651.21
A
1000-1492(2016)01-0014-04
2015-09-30接收

