鰱神經肽Y基因的克隆及其在禁食-恢復投喂條件下的表達特征分析
楊鎮宇王 丹,李 忠梁宏偉趙金坤羅相忠鄒桂偉
(1. 華中農業大學水產學院, 武漢 430070; 2. 中國水產科學研究院長江水產研究所, 武漢 430223; 3. 中國水產科學研究院淡水漁業研究中心, 無錫 214081)
鰱神經肽Y基因的克隆及其在禁食-恢復投喂條件下的表達特征分析
楊鎮宇1,2王 丹2,3李 忠2梁宏偉2趙金坤1,2羅相忠2鄒桂偉2
(1. 華中農業大學水產學院, 武漢 430070; 2. 中國水產科學研究院長江水產研究所, 武漢 430223; 3. 中國水產科學研究院淡水漁業研究中心, 無錫 214081)
為深入研究神經肽Y對鰱攝食活動的調節作用, 研究利用同源克隆方法獲得鰱NPY基因cDNA全長序列,并檢測在禁食-恢復投喂條件下, NPY在腦和肝臟中的表達情況. 結果表明: 鰱NPY基因cDNA全長782 bp, 包括5′端非翻譯區68 bp, 3′端非翻譯區423 bp, 開放閱讀框291 bp, 編碼96個氨基酸; 氨基酸相似性比較和系統進化分析結果顯示NPY較為保守; NPY在所檢測的13個組織中均有表達, 并且在腦垂體中表達量最大; 禁食導致NPY mRNA在腦中的表達量顯著上升, 恢復投喂6h后下降到基本水平, 表明NPY對鰱攝食有促進作用; 在肝臟中, 禁食前5天NPY mRNA表達量顯著上升, 禁食第7天急劇下降, 恢復投喂4h后下降到基本水平; NPY mRNA在腦和肝臟中的表達具有組織差異性, 其在肝臟中的具體作用機制有待進一步研究. 研究結果為探討NPY在鰱中的生物學功能和在遺傳育種中的作用提供了理論依據。
鰱; NPY基因; 禁食; 恢復投喂; 基因表達
攝食和能量平衡的調節對于動物的生長至關重要, 不適當的攝食和能量代謝會抑制動物生長、延緩青春期、降低動物對寄生蟲和疾病的抵抗力[1]。魚類與其他脊椎動物一樣, 通過中樞和外周的分泌因子來調節攝食和能量代謝[2]。神經肽Y,又稱神經肽酪氨酸(Neuropeptide Y, NPY), 是由瑞典科學家Tatemoto等[3]于1982年從豬腦中分離出來的一種含36個氨基酸的單鏈多肽, 是中樞和外周神經系統中最豐富的神經肽。NPY被認為是哺乳動物中最能有效促進食欲的肽之一[4—6]。與哺乳動物相似, 魚類NPY在腦中的結合區域也主要位于食欲調節區域[7], NPY對魚類的攝食和能量代謝也起著至關重要的作用[8,9]。Lopez-Patino等[10]發現在金魚(Carassiu sauratus)中, 側腦室內注射NPY可顯著提高其攝食量, 而加入NPY受體拮抗物可降低這種效應; 禁食能夠引起NPY表達量上升。Carpio等[11]通過腹腔注射將重組的NPY蛋白注射到羅非魚(Oreochromis niloticus)體中, 發現可以促進其攝食量和體重的增加。Peterson等[12]發現, 在斑點叉尾(Ietalurus punetaus)攝食前其腦組織NPY表達量增加, 并且腦組織中NPY表達量與饑餓時間呈正相關。
鰱(Hypophthalmichthys molitrix)是我國傳統養殖的“四大家魚”之一, 以浮游生物為食, 分布于我國各大水系[13]。鰱具有重要的經濟價值和生態價值, 近十年來年產量都居淡水魚類年產量第二[14],是我國普通百姓重要的動物性蛋白來源之一。NPY作為一種重要的攝食和能量代謝調控因子, 研究其對鰱攝食活動的調節作用, 有助為鰱新品種的選育提供輔助信息。本研究利用同源克隆方法獲得鰱NPY基因cDNA全長序列, 并檢測其在鰱各組織中的表達情況, 分析在饑餓-再投喂條件下在腦和肝中的表達特征, 從分子水平探討NPY對鰱攝食的調節作用, 以期為進一步研究NPY在鰱中的生物學功能打下基礎。
1 材料與方法
1.1 實驗材料
禁食-恢復投喂實驗 實驗魚由中國水產科學研究院長江水產研究所窯灣試驗場提供。選取健康無病、規格一致的鰱330尾[平均體重(13.93 ± 1.35) g], 在養殖車間養殖桶(500 L)內暫養2周, 每天投喂苗種一號粉料(武漢正大有限公司)2次(8:00和16:00), 溫度(29.5±1.2)℃。然后將實驗魚隨機分為3個實驗平行組, 分別在3個養殖桶(500 L)內養殖,每組110尾魚, 禁食15d, 隨后再恢復投喂15d (實驗條件同暫養期間), 實驗期間均使用曝氣自來水, 每天清理糞便和殘渣, 隔天換水1/3, 溶氧保持在7 mg/L以上, 自然光照。分別在禁食0(對照組)、1d、2d、3d、5d、7d、10d和15d; 在恢復投喂后1h、2h、4h、6h; 和恢復投喂后1d、3d、5d、7d、10d、15d取樣, 為保持取樣時間一致, 在每天中午12:00取樣。在實驗開始前, 15條魚取各個組織(全腦、腦垂體、心、肝、腎、脾、前腸、中腸、后腸、肌肉、鰓、皮、眼)用于NPY的組織表達分析;在禁食-恢復投喂實驗開始后, 每個采樣點每個平行組各取5條魚(3個實驗平行組)分別取全腦和肝臟用于檢測禁食-恢復投喂實驗對NPY mRNA表達量的影響。所取樣品均保存于-80℃備用。
實驗試劑與儀器 總RNA提取試劑Trizol Reagent購自Invitrogen 公司; 反轉錄試劑PrimeScriptTMRT Reagen Kit with gDNA Eraser和亞克隆載體pMD?18-T Vector system購自大連寶生物工程有限公司(TaKaRa); 瓊脂糖凝膠回收試劑Agarose Gel DNA Fragment Recovery Kit購自北京百泰克生物有限公司(Bioteke); 3′端和5′端的擴增試劑SMART RACE cDNAAmplication Kit購自美國Clontech公司; 熒光定量試劑QuantiFastTM SYBR?Green PCR Kit購自德國Qiagen公司; 大腸桿菌DH5α由本實驗室保種。其他試劑均為國產分析純。
熒光定量PCR儀為Qiagen公司生產的Rotor-Gene 6200 system, 紫外分光光度計為UNICO公司的UV-3802紫外分光光度計, 凝膠成像系統為Syngene公司的G: BOX。
引物 根據GenBank中其他已知物種的NPY基因cDNA序列的保守區設計引物NPY1用于擴增鰱NPY基因中間片段, 設計引物SMA NPY 3和SMA NPY 5用于分別擴增NPY基因的3′端和5′端。RT NPY 1為定量表達的特異性引物; β-actin 1(GenBank登錄號: AF301605)為定量表達的內參引物。以上引物均采用Primer 5.0設計, 由武漢擎科生物技術有限公司合成。引物序列見表1。
1.2 方法
總RNA的提取與cDNA合成 稱取上述所取鰱組織約100 mg (腦組織用于擴增基因全長), 使用Trizol Reagent (Invitrogen)試劑并根據其使用說明提取總RNA。使用紫外分光光度計測定RNA濃度,并根據A260/A280值判斷RNA的質量; 凝膠電泳檢測RNA的完整性; 以總RNA為模板, 使用PrimeScriptTM
RT Reagen Kit with gDNA Eraser (TaKaRa)試劑并按照說明書合成cDNA。

表 1 實驗所用引物Tab. 1 Primers used in the experiment
3′RACE和5′RACE 按照SMART RACE cDNAAmplication Kit (Clontech) 試劑盒操作要求,采用引物SMA NPY 3、SMA NPY 5進行擴增。PCR反應體系為25 μL, 其中10×Buffer 2.5 μL, 上、下游引物 (10 μmol/L) 各1 μL, dNTPs (10 mmol/L)0.5 μL, 高保真Taq酶0.3 μL, 模板1 μL, 以ddH2O補足體積。反應程序為: 94℃ 5min; 94℃ 30s, 58℃30s, 72℃ 45s, 35個循環; 72℃ 10min。PCR產物經電泳檢測、回收、連接、轉化后, 挑單克隆菌落送武漢生工生物技術有限公司測序。
序列分析 利用ContigExp軟件對獲得的鰱NPY cDNA序列進行片段拼接和序列分析, 用DNAStar software 5.0軟件對鰱NPY氨基酸序列進行排列比對分析, 用Clustal W 和 MEGA 5.0軟件對鰱氨基酸序列進行多序列比較和聚類分析。
鰱NPY mRNA表達的半定量PCR檢測 利用引物RT NPY 1和內參引物 β-actin 1檢測NPY基因在腦、腦垂體、心臟、肝臟、脾臟、腎臟、眼睛、皮膚、鰓、前腸、中腸、后腸和肌肉等各組織中的表達情況。PCR反應體系為15 μL, 包括10×Buffer 1.5 μL, 上、下游引物 (10 μmol/L) 各0.5 μL, dNTPs (10 mmol/L) 0.3 μL, Taq酶0.2μL, 模板0.8 μL, 以ddH2O補足體積。反應程序: 94℃5min; 94℃ 30s, 58℃ 30s, 72℃ 30s, 27( β-actin)和29(NPY)個循環; 72℃ 10min。對PCR產物進行1%瓊脂糖凝膠電泳, 并拍照保存。
實時熒光定量PCR分析 利用引物RT NPY 1和內參引物 β-actin 1檢測NPY基因在各組織、以及在饑餓處理條件下的腦和肝臟中的表達情況。反應體系為20 μL: 2×SYBR RealtimePCR Rremixture (Qiagen, Germany)10 μL, 上、下游引物(10 μmol/L)各1 μL, cDNA模板1 μL, 加ddH2O至20 μL。反應條件: 95℃ 10min; 95℃ 15s, 58℃ 15s, 72℃ 20s, 40個循環。使用Rotor-Gene 6200 system儀自帶軟件建立NPY和內參 β-actin的標準曲線, NPY和 β-actin的擴增效率分別為1.00和0.98, 研究表明在魚類禁食-恢復投喂條件下 β-actin的表達量是穩定的[15—17]。應用2-ΔΔCt分析方法對數據進行分析, 具體方法參考文獻[18], 計算公式如下:
Formula=2-ΔΔCtF=2-[(待測組目的基因平均Ct值)-(待測組內參基因平均Ct值)-(對照組目的基因平均Ct值)-(對照組內參基因平均Ct值)]

2 結果
2.1 鰱NPY基因序列分析
鰱NPY基因cDNA全長782 bp (GenBank 登錄號: KJ933391), 包括68 bp的5′端非翻譯區、291 bp的最大開放閱讀框和423 bp 的3′端非翻譯區。該cDNA序列編碼96個氨基酸, 在3′端非翻譯區有真核細胞加尾信號(AATAAA)和Poly(A)尾巴。
2.2 鰱NPY基因的同源性分析和系統進化樹構建
選取GenBank中已知的一些物種的NPY氨基酸序列: 人(Homo sapiens, NP_000896.1)、原雞(Gallus gallus, AAA48991.1)、牛(Bos Taurus,AAR37328.1)、非洲爪蟾(Xenopus laevis, AAA499-17.1)、小鼠(Musmus culus, EDK98613.1)、斑馬魚(Danio rerio, AAI62071.1)、草魚(Ctenopharyngodon idella, AGI44276.1)、中華倒刺鲃(Spinibarbus sinensis, ABE73783.1)、江黃顙魚(Pelteobagrus vachellii, AEM75018.1)、鰻鱺(Anguilla japonica, AFN84517.1)、黃鱔(Monopterus albus,AEX97162.1)、歐洲鱸(Dicentrarchus labrax,CAB64932.1)、齊口裂腹魚(Schizothorax prenanti,AGF80335.1)、大西洋鮭(Salmo salar, BAH241-01.1)。使用DNAMan softwar軟件將這些物種和鰱的NPY氨基酸序列進行比對。結果表明NPY氨基酸序列在分子進化過程中較保守, 與各物種NPY有較高的同源一致性, 其中, 與草魚、中華倒刺鲃、齊口裂腹魚相似度最高, 分別為100%、97.9%和97.9%, 與鳥類和哺乳動物的相似度也高達60%以上。
通過鄰接法(NJ法)構建的基于鰱NPY氨基酸序列的系統發育樹(圖 1)進一步可以看出, 鰱NPY與草魚NPY的親緣關系最近, 然后與鯉形目和鯰形目魚的NPY聚在一起; 鰻鱺、大西洋鮭、黃鱔和歐洲鱸的NPY聚為一支; 人、牛、家鼠、原雞和非洲爪蟾聚為一支。脊椎動物的NPY氨基酸序列相似性比較結果與系統進化分析的結果基本一致。
2.3 鰱NPY基因組織表達譜
分別用半定量和實時熒光定量PCR兩種方法檢測NPY基因在鰱腦、腦垂體、心臟、肝臟、脾臟、腎臟、眼睛、皮膚、鰓、前腸、中腸、后腸和肌肉等組織中的表達情況(圖 2、圖 3)。兩種方法檢測的結果基本一致, NPY在腦垂體、心臟、脾臟、腎臟、鰓和肝臟中大量表達, 在腸道中表達量較低, 在腦、眼睛和皮膚中僅有輕微表達, 在肌肉中幾乎不表達。兩種方法檢測的結果存在一定的差異性, 推測是由于二者檢測的靈敏度不一樣造成。
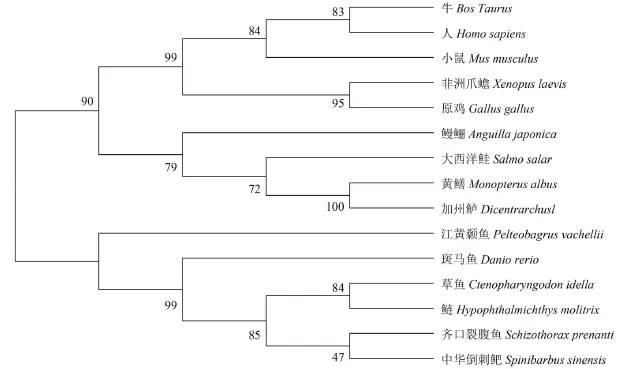
圖 1 NPY的系統進化樹Fig. 1 The phylogenetic tree of vertebrate NPYs
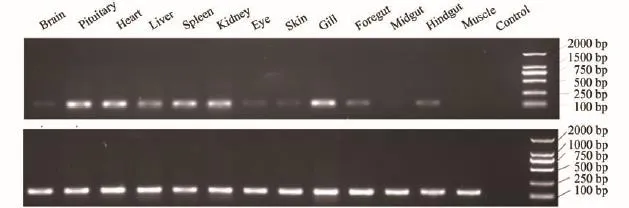
圖 2 NPY在不同組織中的表達(RT-PCR檢測)Fig. 2 The expression of NPY mRNA in different tissues of the silver carp (with RT-PCR)
2.4 禁食-恢復投喂對鰱腦和肝臟中NPY表達的影響
由圖 4可以看出, 禁食1—5d對腦中NPY mRNA的表達沒有影響; 禁食第7天, NPY表達量顯著上升(P<0.05), 直到禁食第15天上升到最大(P<0.05); 恢復投喂2h后開始, NPY急劇地下降(P<0.05), 直到6h后下降到基本水平。在肝臟中(圖 5), 禁食前5d,NPY mRNA表達量顯著上升(P<0.05); 禁食第7天,NPY表達量急劇下降(P<0.05), 隨后下降趨勢變緩(P<0.05); 在恢復投喂后, NPY表達量繼續下降(P<0.05), 直到恢復投喂4h后恢復到基本水平。
3 討論
3.1 鰱NPY基因cDNA序列分析
NPY被證明是脊椎動物進化過程中最保守的神經肽之一[11,19,20]。在本研究中, 氨基酸序列相似性比較顯示鰱NPY基因與各物種NPY基因的同源一致性高達60%以上, 與草魚NPY的同源一致性更是高達100%, 表明NPY基因在長期的分子進化過程中高度保守, 由此可猜測NPY基因在各物種中的功能應該比較保守, 在魚類中也應具有調節攝食和能量代謝的功能。與氨基酸序列相似性比較結果一致,系統進化分析顯示鰱NPY與草魚NPY親緣關系最近, 系統進化分析結果與用傳統方法所進行的物種親緣關系分類結果一致。
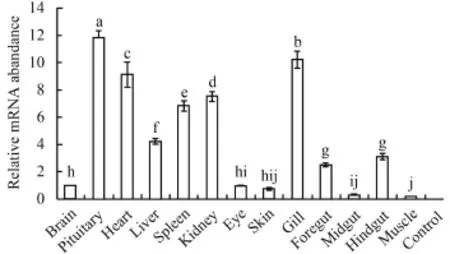
圖 3 NPY在不同組織中的表達(熒光定量PCR檢測)Fig. 3 The expression of NPY mRNA in different tissues of the silver carp (with real-time quantitative PCR)
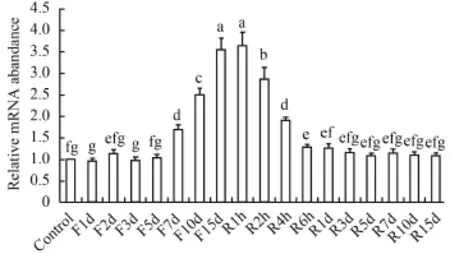
圖 4 禁食-恢復投喂條件下, NPY在腦中的表達Fig. 4 The effect of fasting-refeeding on the level of NPY mRNA in the brain of the silver carp
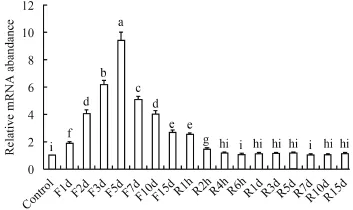
圖 5 在禁食-恢復投喂條件下NPY在肝臟中的表達Fig. 5 ffect of fasting-refeeding on NPY mRNA levels in liver of silver carp
3.2 鰱NPY基因組織表達分析
NPY是一種內源性的下丘腦調節肽, 產生于下丘腦的弓狀核和腦干中的離散細胞群, 主要在腦中發揮作用, 但是大量研究表明NPY不僅分布在神經系統中, 在非神經組織中同樣大量存在[20—23]。在本研究中, NPY在腦垂體、心臟、脾臟、腎臟、鰓和肝臟中大量表達, 在腸道、腦、眼睛、皮膚和肌肉中少量表達, 這與已有文獻報道魚類NPY可以通過神經內分泌系統發揮中樞調節作用, 還可能以旁分泌或自分泌的方式參與魚類外周組織功能調控[24]的觀點一致。研究表明, NPY在南方鲇(Silurus meridionalis)[25]、大西洋鮭[26]、斜帶石斑魚(Epinephelus coioides)[24]、黃顙魚[27]、大西洋鱈(Gadus morhua)[28]的腦中大量表達, 而在本研究中, NPY在腦垂體中表達量最大, 在腦中只有少量表達。推測其原因可能為: (1)上述研究者在采樣過程中沒有將全腦與腦垂體分成兩個組織分別取樣, 而是將二者一起作為腦組織處理, 而本實驗采樣時則將鰱的全腦和腦垂體作為兩個組織分別取樣; (2)魚類的腦垂體分為神經垂體和腺垂體兩部分, 神經垂體主要由下丘腦神經分泌細胞的軸突纖維組成, 起著倉庫的作用, 貯存由神經纖維傳送的下丘腦分泌的部分激素, 例如抗利尿激素和催產素, 當身體需要時才將這些激素釋放到血液中[29]。NPY產生于下丘腦, 推測它是這類激素之一, 由下丘腦分泌但是貯存在神經垂體中, NPY在腦垂體中積累就導致NPY在腦垂體中的表達量比在腦中高。
NPY在非神經組織中的表達存在種間差異: 本研究結果顯示, NPY在所檢測的13種組織中都有表達; Macdonald等[30,31]發現NPY在美洲擬鰈(Pseudopleuronectes americanus)、冬鰩(Raja ocellata)的腦、腸道、肝臟、腎臟、肌肉、心臟和胃中都有表達; 而李振華[32]在大鰭鳠(Mystus macropterus)的心臟、胃、肌肉中均未檢測到NPY表達; Cerdá-Reverter等[33]在海鱸(Dicentrarchus labrax)的肝臟、心臟、腎臟、腸中也未檢測到NPY表達。
NPY在鰱腸道中表達, 說明與哺乳動物和一些魚類一樣, NPY可能影響鰱胃腸道的收縮和排空作用。Dumont等[34]認為NPY在哺乳動物中扮演腦腸肽的角色; Shahbazi等[35]發現NPY能導致大西洋鱈的血管舒張和腸道收縮; Bjenning等[36,37]發現NPY有抑制軟骨魚類胃收縮和胃排空的作用。
3.3 禁食-恢復投喂對鰱NPY表達的影響
下丘腦弓狀核NPY神經元是一個關鍵的攝食中樞, 主要的外周和中樞中關于能量平衡的信號在這里感應和集成, NPY神經元誘導攝食來響應外周代謝狀態[38]。在哺乳動物中, NPY可改變攝食行為,并與脂肪調節密切相關, 在調節能量平衡方面發揮著重要作用[39]。在本研究中, 在禁食-恢復投喂條件下, NPY mRNA的表達量在腦和肝臟中都存在劇烈變化, 表明與哺乳動物一樣, NPY對鰱的攝食和能量代謝起著重要的調節作用。在腦中, 禁食導致NPY mRNA表達量上升, 重新投喂之后下降, 表明NPY起著促進鰱攝食的作用。值得注意的是,Narnaware等[40]發現, 經過72h禁食后, 金魚腦NPY mRNA表達量顯著上升, 隨后恢復投餌3h, NPY表達量快速下降到正常水平; 曹磊等[27]研究黃顙魚NPY發現, 禁食96h后, 黃顙魚腦NPY mRNA表達量顯著增加, 重新投喂后3h NPY的表達量即下降到正常水平; 在本研究中, 禁食前5d, NPY mRNA 的表達量一直無明顯變化, 禁食第7天, NPY的表達量開始顯著上升, 恢復投喂6h后即下降到正常水平; Kehoe等[28]在大西洋鱈中發現, 禁食7d其NPY mRNA表達量都沒有明顯變化。上述研究表明, NPY系統沒有在禁食一開始就呈現出明顯的調節作用, 并且在不同種類的魚中NPY出現調節作用的禁食時間不一致, 推測這可能與各種魚的耐饑餓能力有關,只有饑餓達到一定程度才能引起NPY系統的響應。
與腦中一樣, 在禁食-再投喂條件下, 肝臟中的NPY mRNA水平也發生了劇烈變化, 禁食前5天NPY mRNA表達量顯著上升, 隨后急劇下降直到重新投喂4h后恢復到基本水平, 表明肝臟中的NPY系統對禁食-再投喂條件產生了響應, 也參與鰱攝食和能量代謝的調節。但是, 肝臟中NPY mRNA的表達情況與腦中的明顯不一致, Sucajtys-Szulc等[41]研究慢性限食對大鼠腦和肝臟NPY mRNA的影響時也發現, 長期限食使大鼠腦NPY mRNA的表達量上升, 而肝臟NPY mRNA的表達量卻下降。因此猜測腦和肝臟中的NPY參與動物攝食和能量代謝的方式可能不同, 但關于動物肝臟中的NPY的研究報道較少, NPY在動物肝臟中的具體作用并不十分清楚,NPY在鰱肝臟中的作用機制有待我們進一步研究。
[1]Matteri R L. Overview of central targets for appetite regulation [J]. Animal Science, 2001, 79: E148—E158
[2]Xie X J, Deng L, Zhang B, et al. Advances and studies on ecophysiological effects of starvation on fish [J]. Acta Hydrobiologica Sinica, 1998, 22(2): 181—188 [謝小軍, 鄧利, 張波, 等. 饑餓對魚類生理生態學影響的研究進展.水生生物學報, 1998, 22(2): 181—188]
[3]Tatemoto K, Carlquist M, Mutt V. Neuropeptide Y-a novel brain peptide with structural similarities to peptide YY and pancreatic polypeptide [J]. Nature, 1982, 296(5858): 659—660
[4]Stanley B G, Kyrkouli S E, Lampert S, et al. Neuropeptide Y chronically injected into the hypothalamus: a powerful neurochemical inducer of hyperphagia and obesity [J]. Peptides, 1986, 7(6): 1189—1192
[5]Woods S C, Figlewicz D P, Madden L, et al. NPY and food intake: discrepancies in the model [J]. Regulatory Peptides, 1998, (75—76): 403—408
[6]Gehlert D R. Role of hypothalamic neuropeptide Y in feeding and obesity [J]. Neuropeptides, 1999, 33(5): 329—338
[7]Liao W Q, Liang X F, Fang L. Research of NPY gene and its appetite regulation mechanism [J]. Water Conservancy Related Fisheries, 2005, 25(4): 35—37 [廖婉琴,梁旭方, 方玲. 魚類神經肽Y基因及其食欲調控機理研究. 水利漁業, 2005, 25(4): 35—37]
[8]Silverstein J T, Plisetskaya E M. The effects of NPY and insulin on food intake regulation in fish [J]. Integrative and Comparative Biology, 2000, 40(2): 296—308
[9]Wang Q, Tan X G, Sun W, et al. Expression of recombinant flounder NPY protein in vitro and detection of endogenous NPY in flounder [J]. Marine Sciences, 2014,38(4): 15—19 [王倩, 譚訓剛, 孫威, 等. 牙鲆NPY的體外表達及體內檢測. 海洋科學, 2014, 38(4): 15—19]
[10]López-Pati?o M A, Guijarro A I, Isorna E, et al. Neuropeptide Y has a stimulatory action on feeding behavior in goldfish (Carassius auratus) [J]. European Journal of Pharmacology, 1999, 377(2—3): 147—153
[11]Carpio Y, Acosta J, Morales A, et al. Cloning, expression and growth promoting action of Red tilapia (Oreochromis sp.) neuropeptide Y [J]. Peptides, 2006, 27(4): 710—718
[12]Peterson B C, Waldbieser G C, Riley L G, et al. Pre-and postprandial changes in orexigenic and anorexigenic factors in channel catfish (Ictalurus punctatus) [J]. General and Comparative Endocrinology, 2012, 176(2): 231—239
[13]Zhang S M, Deng H, Wang D Q, et al. Population structure and genetic diversity of silver carp and grass carp from populations of Yangtze River system revealed by RAPD [J]. Acta Hydrobiologica Sinica, 2001, 25(4): 324—330 [張四明, 鄧懷, 汪登強, 等. 長江水系鰱和草魚遺傳結構及變異性的RAPD研究. 水生生物學報,2001, 25(4): 324—330]
[14]China Fishery Statistical Yearbook [M]. Beijing: Chinese Agriculture Press. 2004—2014 [中國漁業統計年鑒. 北京: 中國農業出版社. 2004—2014]
[15]Huising M O, Geven E J W, Kruiswijk C P, et al. Increased leptin expression in common carp (Cyprinus carpio) after food intake but not after fasting or feeding to satiation [J]. Endocrinology, 2006, 147(12): 5786—5797
[16]Lindblom J, Haitina T, Fredriksson R, et al. Differential regulation of nuclear receptors, neuropeptides and peptide hormones in the hypothalamus and pituitary of food restricted rats [J]. Molecular Brain Research, 2005,133(1): 37—46
[17]Tanic N, Perovic M, Mladenovic A, et al. Effects of aging, dietary restriction and glucocorticoid treatment on housekeeping gene expression in rat cortex and hippocampus — evaluation by real time RT-PCR [J]. Journal of Molecular Neuroscience, 2007, 32(1): 38—46
[18]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402—408
[19]Mattews J E, Jansen M, Lyerly D, et al. Pharmacological characterization and selectivity of the NPY antagonist GR231118 (1229U91) for different NPY receptors [J]. Regulatory Peptides, 1997, 72(2—3): 113—119
[20]Yu Y, Liang X F, Li S Y, et al. Molecular cloning and evolutional analysis of NPY, UCP2, LPL and HL gene of Largemouth Bass (Micropterus salmoides) [J]. Acta Hydrobiologica Sinica, 2008, 32(6): 900—907 [于燕, 梁旭方, 李詩盈, 等. 大口黑鱸脂代謝相關基因NPY, UCP2,LPL, HL克隆與分子進化分析. 水生生物學報, 2008,32(6): 900—907]
[21]Aboumder R, Elhusseiny A, Cohen Z, et al. Expression of neuropeptide Y receptors mRNA and protein in human brain vessels and cerebromicrovascular cells in culture[J]. Journal of Cerebral Blood Flow and Metabolism,1999, 19(2): 155—163
[22]Heilig M, Widerl?v E. Neuropeptide Y: an overview of central distribution, functional aspects, and possible involvement in neuropsychiatric illnesses [J]. Acta Psychiatrica Scandinavica, 1990, 82(2): 95—114
[23]Doyon C, Gilmour K M, Trudeau V L, et al. Corticotropin-releasing factor and neuropeptide Y mRNA levels are elevated in the preoptic area of socially subordinate rainbow trout [J]. General and Comparative Endocrinology,2003, 133(2): 260—271
[24]Chen R. Cloning, prokaryotic expression and functions of NPY in orange-spotted grouper (Epinephelus coioides)[D]. Thesis for master of Science. Sun Yat-Sen University, Guangzhou. 2006 [陳蓉. 斜帶石斑魚神經肽Y基因的克隆、原核表達與功能研究. 碩士學位論文, 中山大學, 廣州. 2006]
[25]Yang Y, Peng H W, Li Y L, et al. Molecular cloning and tissue expression analysis of the NPY gene in Silurus meridionalis [J]. Journal of Henan University (Natural Science), 2013, 43(3): 295—300 [楊雁, 彭煥文, 李艷利, 等.南方鲇 (Silurus meridionalis) 神經肽Y基因cDNA克隆及組織表達分析. 河南大學學報 (自然科學版), 2013,43(3): 295—300]
[26]Murashita K, Kurokawa T, Ebbesson L O E, et al. Characterization, tissue distribution, and regulation of agoutirelated protein (AgRP), cocaine-and amphetamine-regulated transcript (CART) and neuropeptide Y (NPY) in Atlantic salmon (Salmo salar) [J]. General and Comparative Endocrinology, 2009, 162(2): 160—171
[27]Cao L, Liang H W, Li Z, et al. Cloning and expression analysis of NPY gene in yellow catfish (Pelteobagrus fulvidraco) [J]. Journal of Northwest A and F University(Natural Science Edition), 2013, 41(7): 1—7 [曹磊, 梁宏偉, 李忠, 等. 黃顙魚神經肽Y基因 (NPY) cDNA全序列的克隆及其表達特征分析. 西北農林科技大學學報 (自然科學版), 2013, 41(7): 1—7]
[28]Kehoe A S, Volkoff H. Cloning and characterization of neuropeptide Y (NPY) and cocaine and amphetamine regulated transcript (CART) in Atlantic cod (Gadus morhua) [J]. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2007,146(3): 451—461
[29]Liu Z F. The progress of checking methods on pituitary disease [J]. Introduction of Japanese Medical Science,1995, 16(2): 88—89 [劉志凡. 垂體疾病檢查方法的進展. 日本醫學介紹, 1995, 16(2): 88—89]
[30]Macdonald E, Volkoff H. Cloning, distribution and effects of season and nutritional status on the expression of neuropeptide Y (NPY), cocaine and amphetamine regulated transcript (CART) and cholecystokinin (CCK) in winter flounder (Pseudopleuronectes americanus) [J]. Hormones and Behavior, 2009, 56(1): 58—65
[31]Macdonald E, Volkoff H. Neuropeptide Y (NPY), cocaine and amphetamine-regulated transcript (CART) and cholecystokinin (CCK) in winter skate (Raja ocellata): cDNA cloning, tissue distribution and mRNA expression responses to fasting [J]. General and Comparative Endocrinology, 2009, 161(2): 252—261
[32]Li Z H. The cDNA cloning and characterization analysis of NPY gene in Mystus macropterus Bleeker [D]. Thesis for master of Science. School of Life Science Southwest University, Chongqing. 2011 [李振華. 大鰭鳠NPY基因cDNA克隆及特征分析. 碩士學位論文, 西南大學生命科學學院, 重慶. 2011]
[33]Cerdá-Reverter J M, Mart??nez-Rodr??guez G, Zanuy S, et al. Cloning the neuropeptide Y exon 2 from sea bass(Dicentrarchus labrax) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1999, 123(2): 181—186
[34]Dumont Y, Martel J C, Fournier A, et al. Neuropeptide Y and neuropeptide Y receptor subtypes in brain and peripheral tissues [J]. Progress in Neurobiology, 1992, 38(2): 125—167
[35]Shahbazi F, Holmgren S, Larhammar D, et al. Neuropeptide Y effects on vasorelaxation and intestinal contraction in the Atlantic cod Gadus morhua [J]. American Journal of Physiology, 2002, 282(5): 1414—1421
[36]Bjenning C, Hazon N, Balasubramaniam A, et al. Distribution and activity of dogfish NPY and Peptide YY in the cardiovascular system of the common dogfish [J]. American Journal of Physiology, 1993, 264(6): 1119—1124
[37]Bjenning C, Holmgren S, Farrell A P. Neuropeptide Y potentiates contractile response to norepinephrine in skate coronary artery [J]. American Journal of Physiology,1993, 265(2): 661—665
[38]Kohno D, Yada T. Arcuate NPY neurons sense and integrate peripheral metabolic signals to control feeding [J]. Neruopeptides, 2012, 46(6): 315—319
[39]Wang J, Wang Y J. Influence of different diet on NPY expression in arcuate nucleus of rats hypothalamus [J]. Journal of Chengde Medical College, 2012, 29(3): 241—243 [王晶, 王英杰. 不同膳食對大鼠下丘腦弓狀核NPY表達的影響. 承德醫學院學報, 2012, 29(3): 241—243]
[40]Narnaware Y K, Peter R E. Effects of food deprivation and refeeding on neuropeptide Y (NPY) mRNA levels in goldfish [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2001,129(2—3): 633—637
[41]Sucajtys-Szulc E, Goykea E, Korczynska J, et al. Chronic food restriction differentially affects NPY mRNA level in neurons of the hypothalamus and in neurons that innervate liver [J]. Neuroscience Letters, 2008, 433(3): 174—177
CLONING AND EXPRESSION OF NPY IN THE SILVER CARP(HYPOPHTHALMICHTHYS MOLITRIX) DURING FASTING AND REFEEDING
YANG Zhen-Yu1,2, WANG Dan2,3, LI Zhong2, LIANG Hong-Wei2, ZHAO Jin-Kun1,2,LUO Xiang-Zhong2and ZOU Gui-Wei2
(1. College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China; 2. Yangtze River Fisheries Research Institute,Chinese Academy of Fisheries Sciences, Wuhan 430223, China; 3. Freshwater Fisheries Research Center of Chinese Academy of Fishery Sciences, Wuxi 214081, China)
NPY plays a significant role in regulating food intake and energy metabolism in teleosts. To understand the biological role of NPY in the silver carp (Hypophthalmichthys molitrix), in this study we determined the full-length cDNA sequence of NPY and investigated the effect of fasting and refeeding on the level of NPY mRNA in the brain and the liver. The full cDNA sequence of NPY consisted of 782 bp, including a 291 bp open reading frame that potentially encodes 96 amino acids, a 68 bp 5′-untranslated region and a 423 bp 3′-untranslated region. Our study on the similarity of the amino acid sequence and the phylogenetic analysis of NPY demonstrated that the NPY gene was relatively conservative during the molecular evolution. The mRNA of NPY was ubiquitously expressed in all the tested tissues and especially abundant in the pituitary. In the brain, the expression of NPY mRNA increased significantly during fasting,and then decreased to the basal level at 6h after refeeding, which indicated that NPY could boost the food intake of the silver carp. In the liver, the expression of NPY mRNA increased significantly until 5d after fasting, then decreased sharply on the 7thday, and finally
to the basal level at 4h after refeeding. NPY was expressed in a tissue-specific pattern in both the brain and the liver. However, the function of NPY in the liver needs further study. Our study provided insights into the biological roles of NPY in the silver carp.
Silver carp; NPY gene; Fasting; Refeeding; Gene expression analysis
10.7541/2016.33
Q344+.1
A
1000-3207(2016)02-0235-08
2015-02-05;
2015-05-20
現代農業產業技術體系建設專項資金(CARS-46-01); “十二五”科技支撐計劃(2012BAD26B02); 中央級公益性科研院所基本科研業務費專項資金(2015JBFM39); 農業部熱帶亞熱帶水產資源利用與養殖重點實驗室開放課題; 中央高校基本科研業務費專項基金資助(2013SC14)資助 [Supported by the earmarked fund for China Agriculture Research System (No. CARS-46-01); National Science and Technology Support Program (No. 2012BAD26B02); National Nonprofit Institute Research Grant of Freshwater Fisheries Research Center (No. 2015JBFM39); Key Laboratory of Tropical& Subtropical Fishery Resource Application and Cultivation, Ministry of Agriculture; Fundamental Research Funds for the Central Universities of China (No. 2013SC14)]
楊鎮宇(1989—), 女, 四川宜賓人; 碩士研究生; 主要從事魚類遺傳育種研究。E-mail: yzhygood@163.com
鄒桂偉, E-mail: zougw@yfi.ac.cn

