飼料中銅、鈣水平對大黃魚幼魚生長、抗氧化酶及脂代謝酶活性的影響
來 杭 黎 明 陶 震 謝奉軍 黎 慶 龔詩雁 王日昕
(寧波大學海洋學院, 寧波 315211)
飼料中銅、鈣水平對大黃魚幼魚生長、抗氧化酶及脂代謝酶活性的影響
來 杭 黎 明 陶 震 謝奉軍 黎 慶 龔詩雁 王日昕
(寧波大學海洋學院, 寧波 315211)
為研究鈣對攝食高銅飼料的大黃魚幼魚生長性能、抗氧化酶類及脂代謝酶類活性的影響, 研究采用2×2雙因子實驗設計, 配制了4組實驗飼料, 共包含2個銅水平(4和24 mg/kg)和2個鈣水平(0.5%和3%), 分別命名為: -Cu-Ca、+Cu-Ca、-Cu+Ca和+Cu+Ca, 飼喂大黃魚幼魚[(4.05±0.31) g]10周, 每個處理組設置3個重復。結果表明, 高銅組(+Cu-Ca和+Cu+Ca)實驗魚的存活率、終末體質量和增重率顯著低于低銅組(-Cu-Ca和-Cu+Ca)(P<0.05); 高銅組實驗魚肝臟和肌肉中的銅含量顯著高于低銅組, 而高鈣組(-Cu+Ca和+Cu+Ca)實驗魚肌肉中的銅含量卻顯著低于低鈣組(-Cu-Ca和+Cu-Ca)(P<0.05); 高銅組實驗魚肝臟中的糖原含量顯著低于低銅組(P<0.05); 實驗魚肝臟中的超氧化物歧化酶、過氧化物酶、谷胱甘肽過氧化物酶、6-磷酸葡糖酸脫氫酶、異檸檬酸脫氫酶和脂肪酸合成酶活性, 高銅組顯著低于低銅組, 而高鈣組卻顯著高于低鈣組, 但硫代巴比妥酸反應物含量和脂蛋白脂肪酶活性正好相反(P<0.05); 飼料中銅和鈣的交互作用顯著影響了實驗魚肌肉中的銅含量、硫代巴比妥酸反應物含量、6-磷酸葡糖酸脫氫酶、脂肪酸合成酶和脂蛋白脂肪酶活性(P<0.05)。研究表明, 鈣能夠緩解攝食高銅飼料對大黃魚幼魚造成的傷害。
大黃魚; 銅; 鈣; 抗氧化酶; 脂代謝酶
銅(Copper, Cu)是生命活動中許多關鍵代謝酶類的重要組成部分, 魚類從食物中攝入的銅達到適宜需求量的4—6倍時會導致銅中毒[1]。魚類銅中毒的典型癥狀包括: 氧化損傷[2]、鰓和肝臟組織病變[3]、生長抑制, 甚至死亡等[4]。研究證實, 銅離子具有較強的底物競爭性抑制作用, 能夠與血液中的清蛋白(Albumin)大量結合, 導致游離脂肪酸由于缺乏足夠的載體而在肝細胞中大量積聚, 從而造成脂代謝失衡和氧化損傷, 這是造成魚類體脂沉積和“脂肪肝”的重要原因之一[5]。受到全球環境問題的影響, 飼料原料(如魚粉、肉骨粉、啤酒酵母及芝麻餅等)中銅含量超標已成為不可控因素。據不完全統計, 大多數魚類對銅的適宜需求量為4—6 mg/ kg, 而市售的動物飼料中銅含量為18.2—119.4 mg/ kg, 是魚類適宜需求量的4—20倍[6]。近年來, 由于飼料中重金屬超標造成魚類養殖業經濟損失的狀況日趨嚴重, 因此探尋魚類銅中毒的緩釋手段就成為亟待解決的重要問題[7]。
愈來愈多的研究發現, 營養素之間存在復雜的相互促進和抑制作用[8]。鈣(Calcium, Ca)被認為是對銅毒性具有直接緩釋作用的營養素[9]。研究發現, 向高銅含量的養殖水體中添加適宜(50 mg Ca/L)的鈣后, 黃顙魚(Pelteobagrus fulvidraco)肝臟中脂代謝相關酶類活性提高, 肝臟組織切片發現,肝細胞排列緊密, “脂肪肝”癥狀得到緩解[10]。然而,通過提高魚類飼料中的鈣水平, 能否對銅毒性造成的生理損傷起到緩釋作用, 迄今尚不十分清楚。
大黃魚(Larimichthys crocea)是我國傳統的四大海水養殖魚類之一, 素有“海水國魚”的美譽。近年來, 養殖大黃魚體脂沉積問題凸顯, “脂肪肝”的高發生率嚴重影響了大黃魚的生長速度和養殖的經濟效益[11]。本研究通過測定攝食不同銅、鈣水平飼料的大黃魚幼魚的生長性能、肝臟抗氧化酶類及脂代謝酶類活性, 分析高銅攝入對大黃魚抗氧化體系和脂質代謝的不利影響, 并評估鈣對魚類銅中毒的緩釋效果。
1 材料與方法
1.1 實驗飼料
采用2×2雙因子實驗設計, 配制4組等氮(粗蛋白46%)、等脂(粗脂肪10%)的半精制飼料, 包含2個銅水平(4和24 mg/kg; 大黃魚對銅的最適需求量為3.41 mg/kg[12]; 養殖海區海水中銅含量實測值為5.10 μg/L)和2個鈣水平(0.5%和3%; 海水魚對鈣的最適需求量約為0.5%[13]; 養殖海區海水中鈣含量實測值為4.01 mg/L), 4組飼料分別被命名為: -Cu-Ca、+Cu-Ca、-Cu+Ca和+Cu+Ca。所有原料經粉碎后過60目篩網, 按比例混合, 加入適量水揉勻, 經擠條機加工成直徑2.0 mm的顆粒狀飼料, 室溫陰干至水分<10%, 置于封口袋中-20℃保存。實驗飼料配方及營養成分見表 1。
1.2 養殖管理及取樣
新購大黃魚幼魚(4.05±0.31) g經商業飼料馴化14d后, 隨機投放到12個養殖網箱中(1.5 m×1.5 m× 2.0 m), 每個網箱60尾, 設置3個重復。飽食投喂每天兩次(05:00—06:00, 17:00—18:00), 持續10周, 詳細記錄投喂量。在養殖過程中, 水溫21—25℃, 鹽度22‰—26‰, 溶解氧(6.8±0.15) mg/L。
在養殖結束后, 所有魚禁食24h。采用MS-222麻醉后稱重, 并記錄存活數; 每個網箱隨機挑選3尾魚, -20℃保存, 用于測定全魚體成分; 每個網箱另選5尾魚, 解剖后分別稱量內臟重和肝臟重, 計算肝體指數和臟體指數, 并將解剖獲得的肝臟保存于-20℃, 用于測定肝臟粗成分、銅和肝糖原含量、抗氧化酶類和脂代謝酶類活性; 剝離背側肌肉保存于-20℃, 用于測定肌肉中的銅含量。
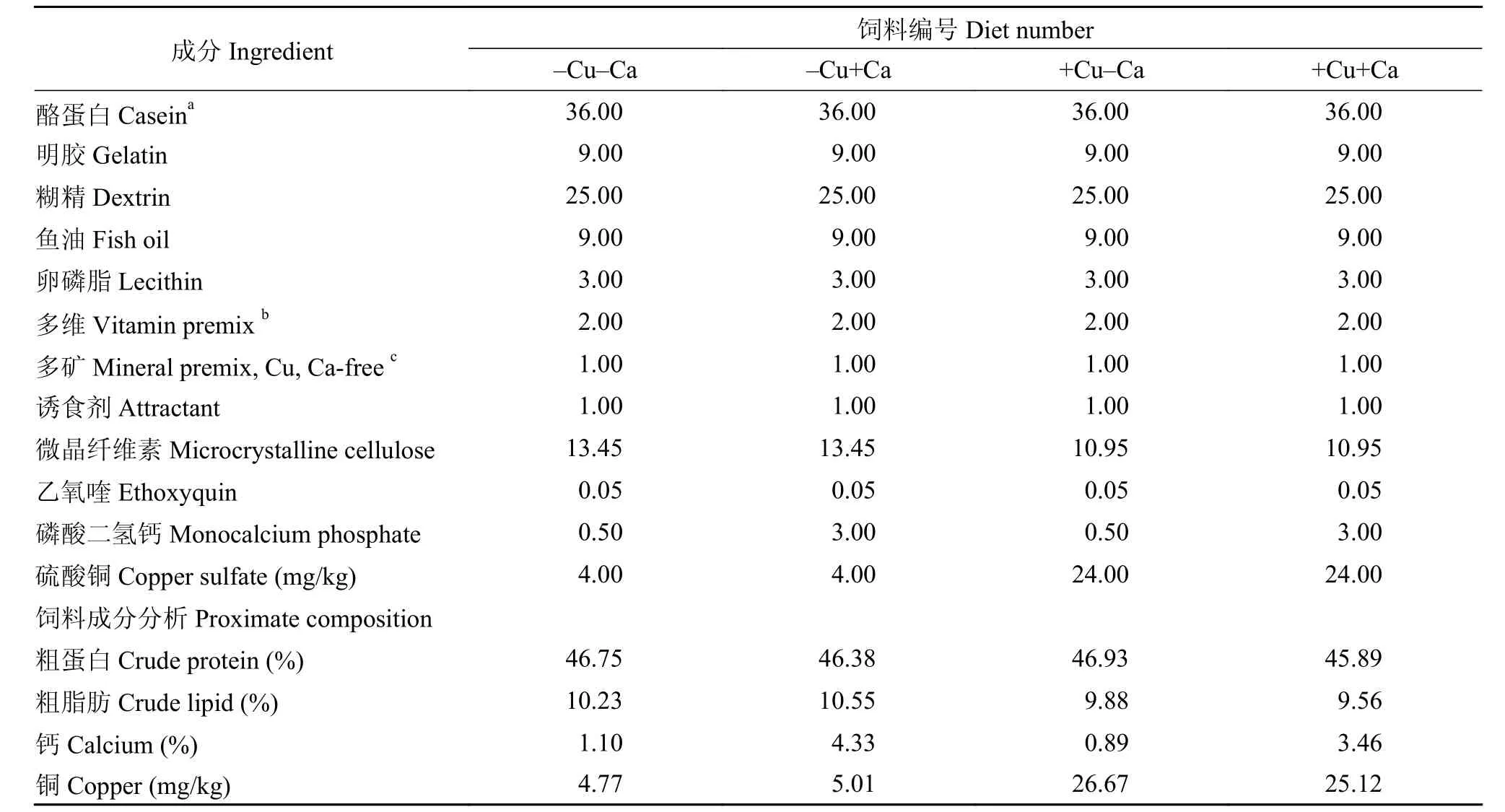
表 1 實驗飼料配方以及營養組成Tab. 1 Ingredient and chemical proximate composition of the experimental diets (%)
1.3 成分分析
實驗飼料及組織樣品成分分析采用AOAC[14]的標準方法。樣品于烘箱中105℃至恒重, 測定水分含量; 碳化后的樣品置于馬弗爐中600℃至恒重,測定灰分含量; 蛋白質含量測定采用FP-528全自動蛋白質分析儀(Leco公司, 美國密歇根); 脂肪含量測定采用2055全自動索氏抽提儀(Foss公司, 瑞典赫加奈斯)。銅、鈣含量測定采用ICP-OES電感耦合等離子體原子發射光譜儀(瓦里安公司, 美國加州)。所有測試均設置3個重復, 下同。
1.4 肝臟抗氧化酶類活性和糖原含量測定
肝臟樣品于預冷的磷酸緩沖液(50 mmol/L, pH 7.4)中勻漿, 勻漿液于4℃環境中2000×g離心15min分離上清液備測。所有測試均采用商業試劑盒(南京建成生物工程研究所, 中國南京), 嚴格按照說明書進行操作。上清液蛋白含量測定采用考馬斯亮藍法, 以牛血清白蛋白為對照品, 于595 nm處測定其吸光度; 超氧化物歧化酶活性(SOD)測定采用比色法, 于550 nm處測定其吸光度。酶活單位定義為每毫克蛋白每分鐘抑制氯化硝基四氮唑藍(NBT)自氧化速率達50%時的酶消耗量為1個酶活單位。過氧化物酶(CAT)活性測定采用比色法, 于 405 nm處測定其吸光度, 酶活單位定義為每毫克蛋白每分鐘使反應體系中吸光度減少0.1的酶消耗量為1個酶活單位。谷胱甘肽過氧化物酶(GPX)活性測定采用比色法, 于412 nm處測定其吸光度, 酶活單位定義為每毫克蛋白每分鐘使反應體系中GSH濃度降低1 μmol/L為1個酶活單位。硫代巴比妥酸反應物(TBARS)含量的測定采用比色法, 于532 nm處測定其吸光度。按肝臟樣品質量︰堿液體積= 1︰3混合, 沸水浴20 min備測, 采用蒽酮比色法于620 nm處測定吸光度, 計算獲得肝臟中糖原(Gn)含量。
1.5 肝臟脂代謝酶類活性測定
肝臟樣品于預冷的緩沖液(0.02 mol/L Tris-HCl, 0.25 mol/L蔗糖, 2 mmol/L EDTA, 0.1 mol/L NaCl, 0.5 mmol/L PMSF, 0.01 mol/L β-巰基乙醇,pH 7.4)中勻漿, 勻漿液于4℃環境中20000×g離心30min分離上清液備測[6]。所有測試均采用商業試劑盒(南京建成生物工程研究所, 中國南京), 嚴格按照說明書進行操作。6-磷酸葡糖酸脫氫酶(6PGD)、蘋果酸酶(ME)、異檸檬酸脫氫酶(ICDH)和脂肪酸合成酶(FAS)活性的測定采用比色法, 于340 nm處測定其吸光度, 酶活單位定義為每毫克蛋白每分鐘使反應體系中底物濃度降低1 μmol/L為1個酶活單位。脂蛋白脂肪酶(LPL)活性的測定采用比色法,于340 nm處測定其吸光度, 酶活單位定義為每毫克蛋白每小時消耗1 μmol游離脂肪酸時的酶消耗量為1個酶活單位。
1.6 計算方法和統計分析
存活率(Survival rate, %)=100×存活尾數/初始尾數;
增重率(Weight gain rate, %)=100×(末體質量-初體質量)/初體質量;
飼料效率(Feed efficiency)=(末體質量-初體質量)/干飼料消耗量;
肝體指數(Hepatosomatic index, %)=100×肝臟重/末體質量;
臟體指數(Viscerosomatic index, %)=100×內臟重/末體質量。
實驗數據采用雙因素方差分析(Two-way ANOVA)進行統計學處理, 結果以平均值±標準差(mean±SD)表示, 顯著性水平設置為P<0.05。所有分析均采用SPSS 18.0.0在Windows操作系統中進行。
2 結果
2.1 生長性能和體成分
為期10周的養殖實驗結束后, 實驗魚的存活率>66.11%, 其中, 高銅組(+Cu-Ca和+Cu+Ca)實驗魚的存活率顯著低于低銅組(-Cu-Ca和-Cu+Ca)(P<0.05),而飼料中鈣水平并未對存活率造成顯著影響(P>0.05)(表 2); 飼料中銅水平顯著影響了實驗魚的生長性能, 高銅組實驗魚的終末體質量和增重率顯著低于低銅組(P<0.05), 而飼料中鈣水平并未顯著影響終末體質量和增重率(P>0.05); 飼料效率、肝體指數和臟體指數未受到飼料中銅和鈣水平的影響(P>0.05); 飼料中銅和鈣的交互作用未對實驗魚的終末體質量、增重率、飼料效率、肝體指數、臟體指數及存活率造成顯著影響(P>0.05)。
飼料中銅和鈣水平并未顯著影響實驗魚全魚和肝臟中的水分、粗蛋白、粗脂肪和灰分含量, 上述指標也未受到飼料中銅和鈣交互作用的顯著影響(P>0.05, 表 3)。實驗魚肝臟和肌肉中的銅含量受到飼料中銅水平的影響, 高銅組顯著高于低銅組,而肌肉中的銅含量還受到飼料中鈣水平的影響, 高鈣組(-Cu+Ca和+Cu+Ca)顯著低于低鈣組(-Cu-Ca和+Cu-Ca)(P<0.05), 但肝臟中的銅含量卻未受到飼料中鈣水平的顯著影響(P>0.05); 實驗魚肝臟中糖原含量受到飼料中銅水平的影響, 高銅組顯著低于低銅組(P<0.05), 但飼料中鈣水平并未對糖原含量造成顯著影響(P>0.05)。飼料中銅和鈣的交互作用顯著影響了實驗魚肌肉中的銅含量(P<0.05), 卻未對肝臟中的銅和糖原含量造成影響(P>0.05, 表 4)。
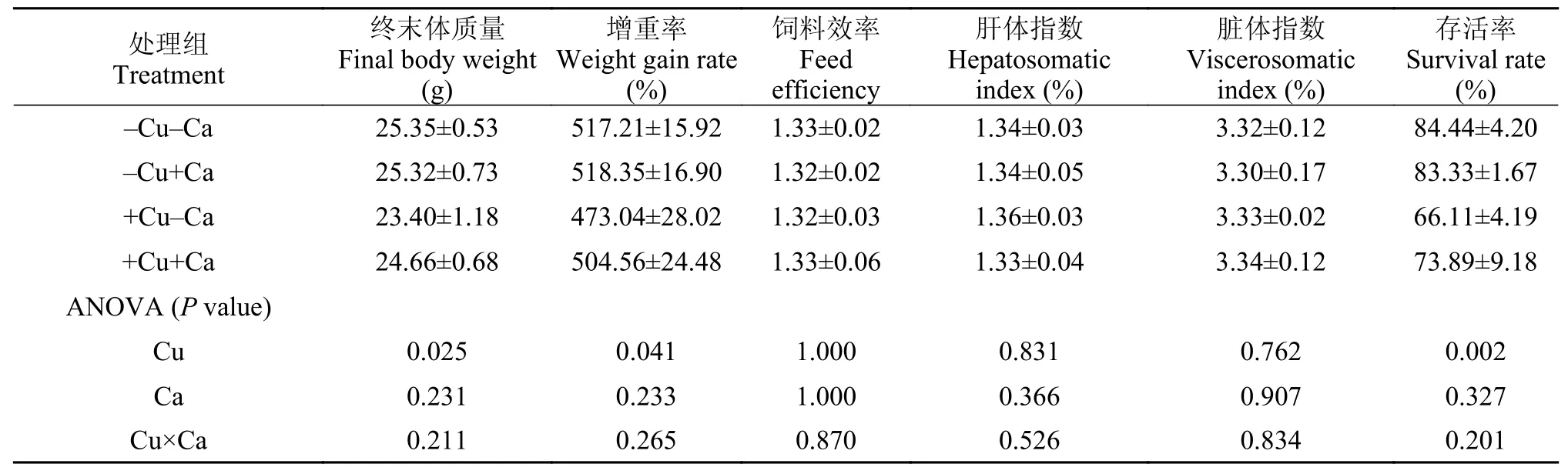
表 2 大黃魚幼魚的存活率和生長性能Tab. 2 The survival and growth performance of juvenile large yellow croaker
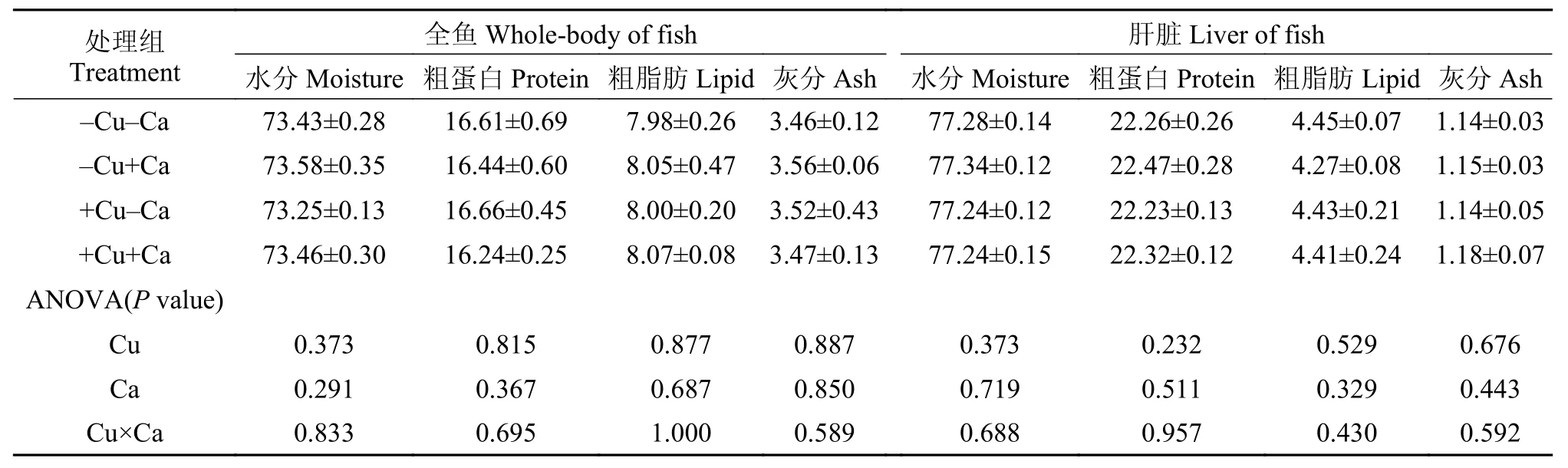
表 3 大黃魚幼魚的全魚和肝臟成分Tab. 3 The whole-body and liver compositions of juvenile large yellow croaker (%)
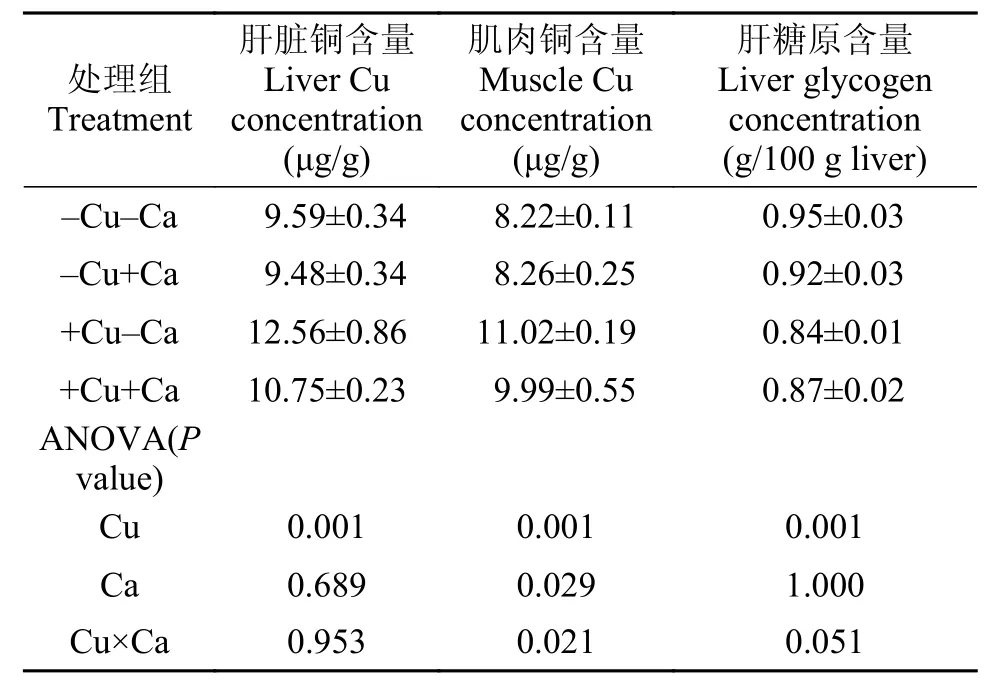
表 4 大黃魚幼魚肝臟和肌肉中的銅及肝糖原含量Tab. 4 The concentrations of liver and muscle Cu and liver glycogen of juvenile large yellow croaker
2.2 肝臟抗氧化酶類活性及過氧化程度
實驗魚肝臟中的超氧化物歧化酶、過氧化物酶和谷胱甘肽過氧化物酶活性受到飼料中銅和鈣水平的影響, 高銅組顯著低于低銅組, 而高鈣組顯著高于低鈣組(P<0.05, 表 5); 高銅組實驗魚肝臟中的硫代巴比妥酸反應物含量顯著高于低銅組, 而高鈣組則顯著低于低鈣組(P<0.05); 實驗魚肝臟中的超氧化物歧化酶、過氧化物酶和谷胱甘肽過氧化物酶活性未受到飼料中銅和鈣交互作用的顯著影響(P>0.05), 但交互作用顯著影響了肝臟中硫代巴比妥酸反應物含量(P<0.05)。
2.3 肝臟脂代謝酶類活性
飼料中銅和鈣水平顯著影響了實驗魚肝臟中6-磷酸葡糖酸脫氫酶、異檸檬酸脫氫酶和脂肪酸合成酶活性, 高銅組顯著低于低銅組, 高鈣組顯著高于低鈣組(P<0.05, 表 6); 脂蛋白脂肪酶活性也受到飼料中銅和鈣水平的顯著影響, 但趨勢正好相反(P<0.05); 實驗魚肝臟中的蘋果酸酶活性僅受到飼料中銅水平的影響, 高銅組顯著低于低銅組(P<0.05),而飼料中鈣水平并未對其活性造成顯著影響(P>0.05); 實驗魚肝臟中的6-磷酸葡糖酸脫氫酶、脂肪酸合成酶和脂蛋白脂肪酶活性受到飼料中銅和鈣交互作用的顯著影響(P<0.05), 而蘋果酸酶和異檸檬酸脫氫酶卻未受到交互作用的影響(P>0.05)。
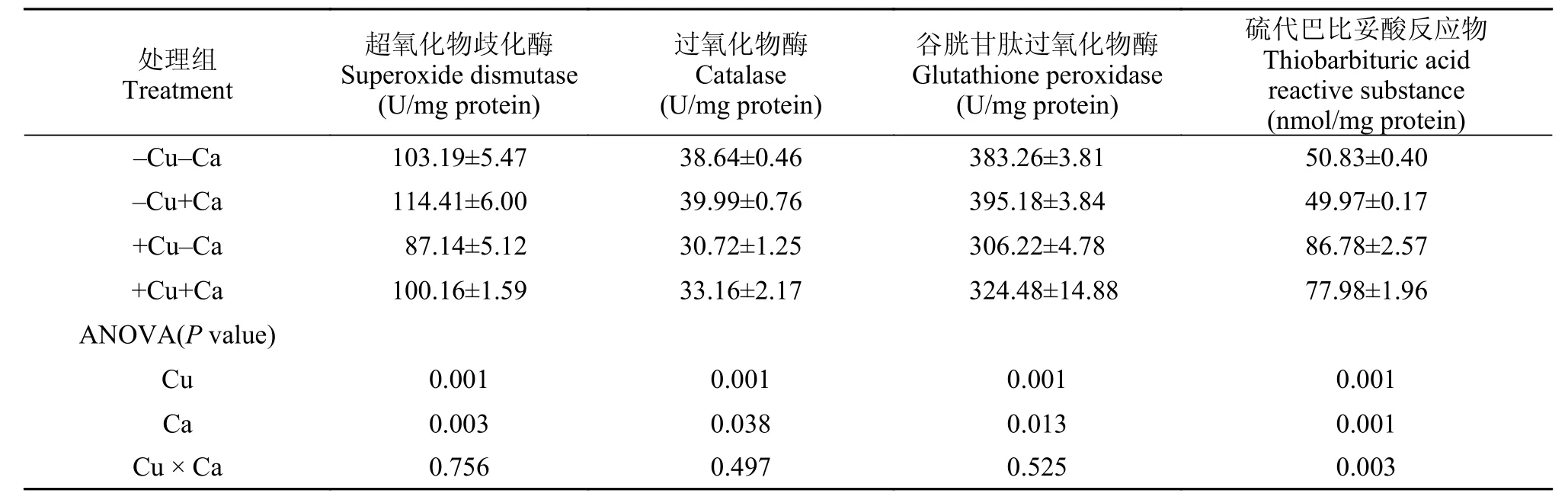
表 5 大黃魚幼魚肝臟中抗氧化酶活性Tab. 5 Liver antioxidant enzyme activities of juvenile large yellow croaker
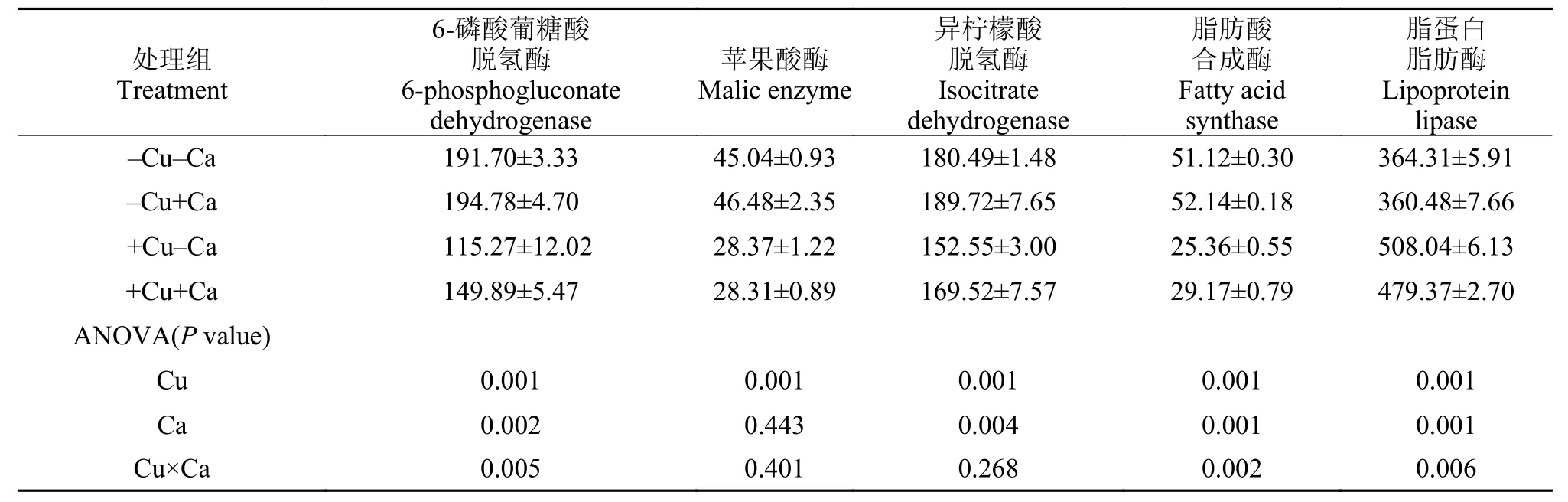
表 6 大黃魚幼魚肝臟中脂肪酸代謝酶活性Tab. 6 Liver fatty acid metabolism enzyme activities of juvenile large yellow croaker (mIU/mg protein)
3 討論
3.1 生長性能和體成分
魚類從食物中攝入銅的含量超過生理耐受上限會影響存活率[15]。在本研究中, 為期10周的養殖實驗結束后, 攝食適宜銅含量飼料(低銅組)的大黃魚存活率保持在較高的水平(>83.33%), 而攝食高銅含量飼料(高銅組飼料中銅含量為適宜需求量的6倍)的大黃魚存活率僅為66.11%—73.89%, 表明大黃魚對飼料中銅含量超標較為敏感。過量的銅攝入不僅會導致魚類死亡, 還會影響其生長性能, 原因可能與機體的解毒耗能有關: 食物中過量的銅會導致魚體血液中游離脂肪酸含量升高, 繼而誘發生理紊亂, 機體為了維持內穩態, 往往會啟動一系列生理適應性反應進行調節, 而代謝支出的提高, 會影響生長對能量的需求[16]。在本研究中, 高銅含量飼料的攝入明顯抑制了大黃魚的生長性能(如增重,-Cu+Ca組>+Cu+Ca組; -Cu-Ca組>+Cu-Ca組)。類似的發現在其他魚類研究中也有報道, 如羅非魚(Oreochromis niloticus×Oreochromis aureus)[17]、石斑魚(Epinephelus malabaricus)[18]、黃顙魚[19]和草魚(Ctenopharyngodon idellus)[20]等。前人的研究提出, 營養素之間存在復雜的相互促進和抑制作用。在正常生理條件下, 食物中的銅進入動物消化道后,在氨基酸絡合劑協助下被運輸到腸黏膜上, 與超氧化物歧化酶或金屬硫蛋白相結合, 通過磷酸化ATP酶介導的銅離子通道轉運進入血液, 載體蛋白在整個過程發揮極其重要的作用。然而, 其他金屬元素如鈣、鐵、鋅等的轉運過程與銅相似, 因此相互間存在著競爭性抑制作用[21]。Wurts和Perschbacher[9]發現, 外源補充鈣對急性銅脅迫下的斑點叉尾(Ictalurus punctatus)具有明顯的毒性緩釋作用。在本研究中, 盡管提高了高銅飼料中鈣的含量, 卻未對大黃魚的生長性能造成影響, 但發現實驗魚的增重指標+Cu+Ca組(20.69 g)>+Cu-Ca組(19.39 g), 基于這個發現, 能否通過進一步提高飼料中的鈣含量或延長養殖周期, 達到緩解魚類生長抑制的目的,尚需進一步研究。
本研究發現, 受到飼料中銅水平的影響, 高銅組實驗魚肝臟和肌肉中的銅含量顯著高于低銅組,而肝臟中的銅含量明顯高于肌肉, 這與前人的研究結果是一致的: Chen等[10]檢測發現, 銅在黃顙魚組織中積累的濃度順序為: 肝臟>鰓>腎臟>脊椎>腸道>肌肉; Tekin-Ozan和Kir[22]報道, 鯉(Cyprinus carpio)肝臟和鰓組織中重金屬含量最高, 而肌肉中重金屬含量最低; Arellano等[23]發現, 銅在塞內加爾鰨(Solea senegalensis)肝臟組織中的含量顯著高于鰓組織。此外, 本研究通過提高高銅飼料中的鈣水平,顯著降低了實驗魚肌肉中的銅含量, 并檢測到飼料中銅和鈣對實驗魚肌肉中的銅含量變化具有顯著的交互作用(P=0.021)。這可能與銅和鈣在動物體內存在競爭性抑制作用有關, 而鈣更容易與載體蛋白相結合[24]。雖然大黃魚肝臟中的銅含量并沒有因為鈣水平的提高發生顯著的變化, 但肌肉作為魚類主要的可食用部分, 銅含量的顯著降低, 從食品安全角度來看是有利的。本研究還發現, 高銅組實驗魚肝臟中糖原含量顯著低于低銅組, 這個發現進一步驗證了前面論述中提到的解毒耗能造成生長性能下降的推測。糖類是生物體的主要能量物質,葡萄糖聚合物通常以糖原的形式儲存于動物體的肝臟和肌肉中, 當能量需求發生時(如饑餓、脅迫等), 糖原能夠快速分解成葡萄糖, 繼而進行氧化供能[25]。
3.2 肝臟抗氧化酶類活性及過氧化程度
魚類攝入過量的銅與載體蛋白結合, 引起血液中游離脂肪酸含量升高, 阻斷β氧化, 大量游離脂肪酸進入非氧化代謝通路生成神經酰胺, 產生大量有毒的自由基(ROS), 導致醛酮類物質過度積累, 通過與蛋白和核酸等發生交聯聚合, 誘發細胞毒性和器官衰竭[26]。在本研究中, 高銅組大黃魚肝臟中的超氧化物歧化酶、過氧化物酶及谷胱甘肽過氧化物酶活性顯著低于低銅組, 而硫代巴比妥酸反應物含量顯著高于低銅組, 表明過量攝入銅會抑制大黃魚抗氧化酶活性, 可能造成醛酮類物質積累, 該發現與前人的研究結果是一致的。姚志峰等[27]發現, 過量銅攝入能夠顯著抑制中華鱘(Acipenser sinensis Gray)幼魚肝臟中超氧化物歧化酶、過氧化氫酶和谷胱甘肽抗氧化酶活性。聶志娟等[28]發現高濃度的銅能夠對刀鱭(Coilia nasus)幼魚肝臟中超氧化物歧化酶和過氧化氫酶活性造成抑制。在本研究中,通過提高高銅飼料中的鈣水平, 發現+Cu+Ca組實驗魚肝臟中抗氧化酶活性顯著高于+Cu-Ca組, 而硫代巴比妥酸反應物的含量顯著低于+Cu-Ca組,提示通過提高飼料中的鈣水平, 能夠對抗氧化酶活
[1]Watanabe T, Kiron V, Satoh S. Trace minerals in fish nutrition [J]. Aquaculture, 1997, 151(1—4): 185—207
[2]Wendelaar Bonga S E. The stress response in fish [J]. Physiological Reviews, 1997, 77(3): 591—625
[3]Monteiro S, Rocha E, Mancera J, et al. A stereological study of copper toxicity in gills of Oreochromis niloticus[J]. Ecotoxicology and Environmental Safety, 2009, 72(1): 213—223
[4]Liu X, Luo Z, Xiong B, et al. Effect of waterborne copper exposure on growth, hepatic enzymatic activities and histology in Synechogobius hasta [J]. Ecotoxicology and Environmental Safety, 2010, 73(6): 1286—1291
[5]Chen Q L, Luo Z, Pan Y X, et al. Differential induction of enzymes and genes involved in lipid metabolism in liver and visceral adipose tissue of juvenile yellow catfish性受到抑制的狀況起到緩釋作用, 并可能降低醛酮類物質的積累。
3.3 肝臟脂代謝酶類活性
魚類應對銅毒性的生理解毒過程會消耗大量的代謝能, 機體往往會通過激活一些重要酶類來參與能量的調節。其中, 肝臟脂蛋白脂肪酶被認為是脂代謝過程中關鍵的限速酶, 能夠催化三酰甘油分解為脂肪酸和單酸甘油酯, 以供組織分解氧化供能[29]。本研究發現, 高銅組實驗魚肝臟中脂蛋白脂肪酶的活性顯著高于低銅飼料組, 表明高銅攝入加速了大黃魚對能量的需求。前人的研究發現, 魚類能夠通過自身的生理適應性調節維持機體的脂穩態, 當機體提出能量需求時, 合成代謝途徑將受到抑制[30]。在本研究中, 高銅組實驗魚肝臟中參與NADPH或脂肪生成的酶類, 如6-磷酸葡糖酸脫氫酶、蘋果酸酶、異檸檬酸脫氫酶和脂肪酸合成酶的活性受到代謝耗能的影響顯著降低(高銅組<低銅組)。然而, 通過提高高銅飼料中的鈣水平,+Cu+Ca組實驗魚肝臟中6-磷酸葡糖酸脫氫酶、異檸檬酸脫氫酶和脂肪酸合成酶的活性顯著高于+Cu-Ca組, 而脂蛋白脂肪酶活性卻顯著低于+Cu-Ca組, 提示高銅飼料中添加適宜的鈣, 能夠緩解機體在解毒過程中對能量的過度需求。
綜上, 飼料中銅水平過高, 會降低大黃魚幼魚的存活率; 攝入過量的銅會抑制大黃魚幼魚肝臟中抗氧化酶類及脂肪合成酶類的活性, 機體通過激活脂肪分解酶類進行供能; 通過提高高銅飼料中的鈣水平, 能夠增強大黃魚幼魚的抗氧化能力, 降低醛酮類物質的積累, 減少代謝耗能。然而, 要徹底弄清鈣對魚類銅中毒的毒性緩釋機制, 尚需開展進一步具體而深入的研究。Pelteobagrus fulvidraco exposed to copper [J]. Aquatic Toxicology, 2013, 136—137: 72—78
[6]Yao L X, Huang L X, Jiang Z Y, et al. Investigation of As, Cu and Zn species and concentrations in animal feeds[J]. Environment Science, 2013, 34(2): 722—739 [姚麗賢, 黃連喜, 蔣宗勇, 等. 動物飼料中砷、銅和鋅調查及分析. 環境科學, 2013, 34(2): 722—739]
[7]Zhao Y J, Jiang M, Gao P, et al. Effects of elevated dietary copper levels on growth performance and copper,iron, zinc concentrations in muscle and hepatopancreas of grass carp Ctenopharyngodon idella [J]. Journal of Yunnan Agricultural University, 2008, 23(6): 798—825 [趙宇江, 蔣明, 高攀, 等. 飼料中高水平銅對草魚生長、肝胰臟和肌肉中銅鐵鋅含量的影響. 云南農業大學學報,2008, 23(6): 798—825]
[8]Lall S P. Nutrition and health of fish [A]. In: Cruz-Suárez L, Ricque-Marie D, Tapia-Salazar M (Eds.), Advances en Nutrición Acuicola V [C]. Mexico: Memorias del V Simposium Internacional de Nutrición Acuícola. 2000,13—23
[9]Wurts W A, Perschbacher P W. Effects of bicarbonate alkalinity and calcium on the acute toxicity of copper to juvenile channel catfish (Ictalurus punctatus) [J]. Aquaculture, 1994, 125: 73—79
[10]Chen Q L, Luo Z, Zheng J L, et al. Protective effects of calcium on copper toxicity in Pelteobagrus fulvidraco: copper accumulation, enzymatic activities, histology [J]. Ecotoxicology and Environment Safety, 2012, 76(2): 126—134
[11]Liu Z Y, Xie Y Q, Lin X J. Histopathological observation of pathological changes in the liver of Pseudosciaena crocea [J]. Marine Fisheries Research, 2007, 28(5): 7—11 [劉振勇, 謝友佺, 林小金. 大黃魚肝臟病變組織病理學觀察. 海洋水產研究, 2007, 28(5): 7—11]
[12]Cao J J, Miao X, Xu W, et al. Dietary copper requirements of juvenile large yellow croaker Larimichthys croceus [J]. Aquaculture, 2014, 432: 346—350
[13]National Research Council (NRC). Nutrient Requirements of Fish and Shrimp [M]. Washington: National Academy Press. 2011, 378
[14]Association of Official Analytical Chemists (AOAC) [M]. Official Methods of Analysis, 17th ed, Association of Official Analytical Chemists, Arlington, VA. 2000, 1-12
[15]Wang W L, Cui X, Li C C, et al. Effect of dietary copper exposure on micronucleus of erythrocyte and accumulation in different tissues of juvenile GIFT tilapia (Oreochromis niloticus) [J]. Asian Journal of Ecotoxicolog,2014, 9(4): 757—764 [王文龍, 崔欣, 李成成, 等. 飼料中銅暴露對吉富羅非魚幼魚血紅細胞微核和組織中銅蓄積的影響. 生態毒理學報, 2014, 9(4): 757—764]
[16]McGeer J C, Szebedinszky C, McDonald D G, et al. Effects of chronic sublethal exposure to waterborne Cu, Cd or Zn in rainbow trout 1: ionoregulatory disturbance and metabolic costs [J]. Aquatic Toxicology, 2000, 50(3): 231—243
[17]Shiau S Y, Ning Y C. Estimating of dietary copper requirements for juvenile tilapia, Oreochromis niloticus×O. aureus [J]. Journal of Animal Science, 2003, 77(2): 287—292
[18]Lin Y, Shih C, Kent M, et al. Dietary copper requirement reevaluation for juvenile grouper, Epinephelus malabaricus, with an organic copper source [J]. Aquaculture,2010, 310(1—2): 173—177
[19]Tan X Y, Luo Z, Liu X, et al. Dietary copper requirement of juvenile yellow catfish Pelteobagrus fulvidraco[J]. Aquaculture Nutrition, 2011, 17(2): 170—176
[20]Tang Q Q, Feng L, Jiang W D, et al. Effects of dietary copper on growth, digestive, and brush border enzyme activities and antioxidant defense of hepatopancreas and intestine for young grass carp (Ctenopharyngodon idella)[J]. Biological Trace Element Research, 2013, 155(3): 370—380
[21]Qian J, Wang Z, Liu G W. Advance of copper metabolism in animal body [J]. Progress in Veterinary Medicine,2003, 24(2): 55—57 [錢劍, 王哲, 劉國文. 銅在動物體內代謝的研究進展. 動物醫學進展, 2003, 24(2): 55—57]
[22]Tekin-Ozan S, Kir I. Seasonal variations of heavy metals in some organs of carp (Cyprinus carpio L., 1758) from Beysehir Lake (Turkey) [J]. Environmental Monitoring and Assessment, 2008, 138(1—3): 201—206
[23]Arellano J M, Storch V, Sarasquete C. Histological changes and copper accumulation in liver and gills of the Senegalese sole, Solea senegalensis [J]. Ecotoxicology and Environment Safety, 1999, 44(1): 62—72
[24]Santore R C, DiToro D M, Paquin P R, et al. Biotic ligand model of the acute toxicity of metals. 2. Application to acute copper toxicity in freshwater fish and Daphnia[J]. Environmental Toxicology and Chemistry, 2001,20(10): 2397—2402
[25]Wang Y R, Li E C, Chen L Q, et al. Effect of acute salinity stress on soluble protein, hemocyanin, haemolymph glucose and hepatopancreas glycogen of Eriocheir sinensis [J]. Acta Hydrobiologica Sinica, 2012, 36(6): 1056—1062 [王悅如, 李二超, 陳立僑, 等. 急性高滲脅迫對中華絨螯蟹雄蟹組織中可溶性蛋白質、血藍蛋白、血糖與肝糖原含量的影響. 水生生物學報, 2012,36(6): 1056—1062]
[26]Savary S, Trompier D, Andréoletti P, et al. Fatty acids induced lipotoxicity and inflammation [J]. Current Drug Metabolism, 2012, 13(10): 1358—1370
[27]Yao Z F, Zhang L Z, Zhuang P, et al. Effects of antioxidant enzyme in liver and acute toxicity of Cu2+on juvenile Chinese sturgeon [J]. Journal of Fishery Sciences of China, 2010, 17(4): 731—738 [姚志峰, 章龍珍, 莊平,等. 銅對中華鱘幼魚的急性毒性及對肝臟抗氧化酶活性的影響. 中國水產科學, 2010, 17(4) :731—738]
[28]Nie Z J, Xu G C, Zhang S L, et al. Acute effects of copper on survival of fingerlings, antioxidant enzyme activities in liver and structure of gill and liver of Coilia nasus[J]. Journal of Fishery Sciences of China, 2014, 21(1): 161—16 [聶志娟, 徐鋼春, 張守領, 等. 銅對刀鱭幼魚的急性毒性及對肝抗氧化酶活性與組織結構的影響. 中國水產科學, 2014, 21(1): 161—168]
[29]Saera-Vila A, Calduch-Giner J A, Gomez-Requeni P, et al. Molecular characterization of gilthead sea bream(Sparus aurata) lipoprotein lipase. Transcriptional regulation by season and nutritional condition in skeletal muscle and fat storage tissues [J]. Comparative Biochemistry and Physiology B, 2005, 142(2): 224—232
[30]Nanton D A, Vegusdal A, R?r? A M B, et al. Muscle lipid storage pattern, composition, and adipocyte distribution in different parts of Atlantic salmon (Salmo salar)fed fish oil and vegetable oil [J]. Aquaculture, 2007,265(1—4): 230—243
EFFECTS OF DIETARY COPPER AND CALCIUM LEVELS ON GROWTH,ANTIOXIDANT ENZYME AND LIPID METABOLISM ENZYME ACTIVITIES OF JUVENILE LARGER YELLOW CROAKER LARIMICHTHYS CROCEA
LAI Hang, LI Ming, TAO Zhen, XIE Feng-Jun, LI Qing, GONG Shi-Yan and WANG Ri-Xin
(School of Marine Science, Ningbo University, Ningbo 315211, China)
To evaluate effects of dietary copper and calcium on juvenile larger yellow croaker Larimichthys crocea,four experimental diets (-Cu-Ca, +Cu-Ca, -Cu+Ca and +Cu+Ca) were formulated containing two different levels of copper (4 and 24 mg/kg) and of cadmium (0.5% and 3%) to feed juvenile large yellow croaker (4.05±0.31) g in triplicate for 10 weeks. The results indicated that the addition of Cu decreased fish survival rate, final body weight and weight gain (P<0.05). As expected, the Cu diets enhanced liver and muscle Cu concentrations, Interestingly, the Ca diets diminished muscle Cu concentration (P<0.05). The supplement of Cu decreased liver glycogen concentration, liver superoxide dismutase, catalase, glutathione peroxidase, 6-phosphogluconate dehydrogenase, isocitrate dehydrogenase, and fatty acid synthase activities, but it it enhanced thiobarbituric acid reactive substance content and lipoprotein lipase activity (P<0.05). The interaction between Cu and Ca on muscle Cu concentration, thiobarbituric acid reactive substance content, 6-phosphogluconate dehydrogenase, fatty acid synthase and lipoprotein lipase activities was identified (P<0.05). This study indicated that calcium supplement mitigated injuries in fish by high copper intake.
Larger yellow croaker; Copper; Calcium; Antioxidant enzyme; Lipid metabolism enzyme
10.7541/2016.31
S965.3
A
1000-3207(2016)02-0217-08
2015-04-23;
2015-09-14
寧波大學“水產”浙江省重中之重開放基金(xkzsc1401, xkzsc1403); 國家自然科學基金(31272661)資助 [Supported by the Open Fund of Zhejiang Provincial Top Key Discipline of Aquaculture in Ningbo University (xkzsc1401, xkzsc1403); the National Natural Science Foundation of China (31272661)]
來杭(1996—), 男, 浙江蕭山人; 本科; 寧波大學海洋人才創新班。E-mail: 1141488669@qq.com
黎明, E-mail: liming1@nbu.edu.cn

