新型苦參堿肟酯類化合物的合成
劉華文, 張 森, 李 東, 劉 旭, 王堅毅, 王立升*
(1. 廣西大學 化學化工學院,廣西 南寧 530004; 2. 廣西中醫藥大學 藥學院,廣西 南寧 530001)
?
·快遞論文·
新型苦參堿肟酯類化合物的合成
劉華文1, 張 森2, 李 東1, 劉 旭1, 王堅毅1, 王立升1*
(1. 廣西大學 化學化工學院,廣西 南寧 530004; 2. 廣西中醫藥大學 藥學院,廣西 南寧 530001)
利用生物活性因子拼接法將活性基團肟酯引入植物源活性化合物苦參堿中對其結構進行修飾,以苦參堿為原料,與亞硝酸叔丁酯反應制得關鍵中間體肟(2); 2與苯甲酰氯類化合物經酯化反應合成了8個新型的苦參堿肟酯類化合物,其結構經1H NMR,13C NMR和MS表征。
苦參堿; 肟酯; 苯甲酰氯; 合成
苦參堿(1)是由豆科植物苦參Sophora flavescens Ait的干燥根、植株及果實經乙醇等有機溶劑提取制成的,屬于生物堿,具有廣泛的藥理作用,如抗腫瘤、抗心律失常[1]、抗炎[2]及抗病毒等,臨床上主要用于慢性病毒性肝炎的治療,毒副作用小,療效好[3]。然而1較低的生物利用度和對中樞神經系統有毒副作用等缺點限制了其臨床應用[4-6]。
1還是一種應用廣泛的天然植物源農藥。目前,國內登記以苦參堿為主要活性的農藥多達幾十種,且母藥含量高達5%[7]。
植物源農藥,具有特定性、天然性的特點,只對特定的生物產生作用,在大自然中能迅速分解,最終產物為二氧化碳和水。其次1是對有害生物具有活性的植物內源化學物質,成分不是單一的,而是化學結構相近的多組和化學結構不相近的多組的結合,相輔相成,共同發揮作用。第三,1因為多種化學物質共同作用,使其不易導致有害物產生抗藥性,能長期使用。第四,對相應的害蟲不會直接完全毒殺,而是控制害蟲生物種群數量不會嚴重影響到該植物種群的生產和繁衍。這種機理和在化學農藥防護副作用凸顯后經過多年研究得出的綜合防治體系中有害生物控制的原則是十分近似的,說明苦參堿與一般高毒、高殘留的化學農藥有著明顯區別,是十分綠色、環保的。
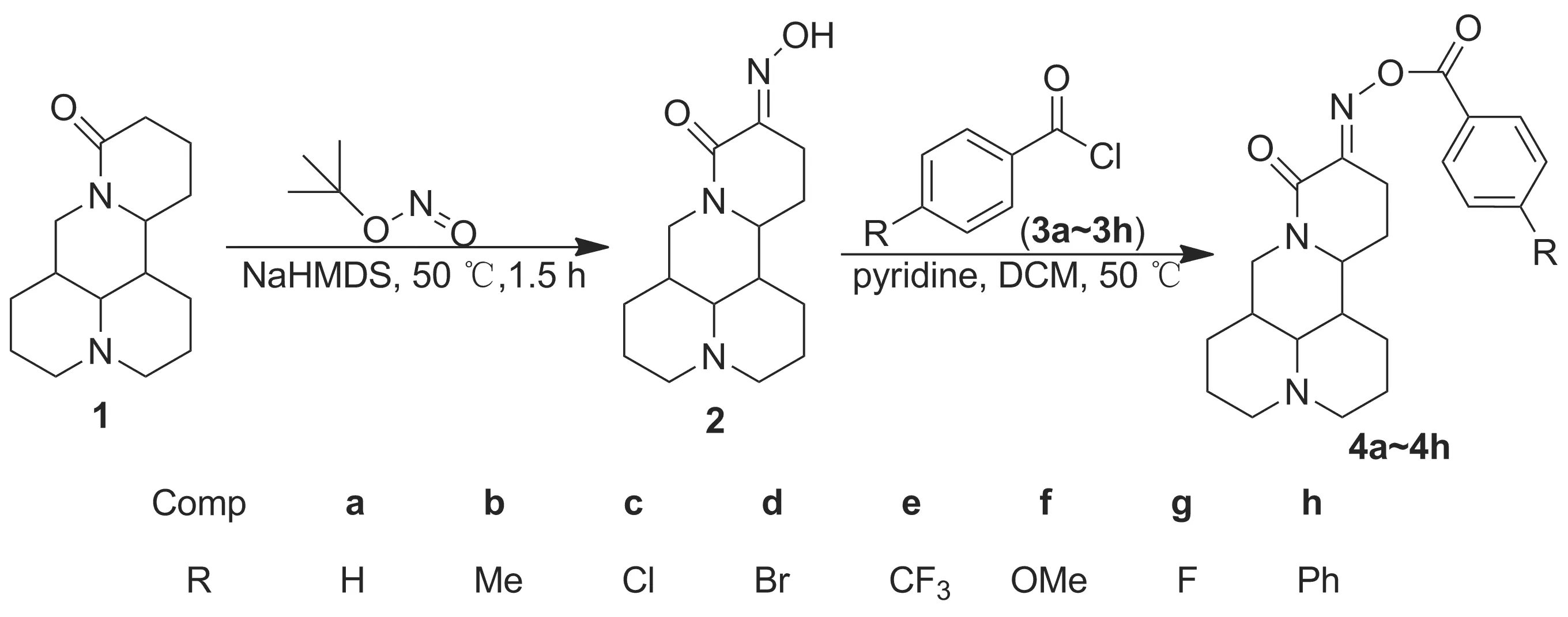
Scheme 1
肟作為一種重要的有機反應中間體,可以用來制備胺、酰胺、噁唑、吡啶、硝酮及肟酯等化合物,在研發中常被選為有效的活性基團,受到醫藥和農藥行業的廣泛關注[8]。
肟酯類化合物具有優良的殺蟲、殺菌及除草活性,不少品種還具有低毒和低殘留等優點。目前該類化合物的分子設計和合成以及生物活性是研究的熱點,因其具有廣泛的生物活性和多變結構類型而倍受人們的關注[9]。
本文采用生物活性因子拼合的方法對苦參堿進行結構修飾,設計并合成了一系列苦參堿衍生物,以期發現活性良好的化合物。以1為原料,與亞硝酸叔丁酯反應制得肟(2); 2與苯甲酰氯類化合物(3a~3h)經酯化反應合成了8個新型的苦參堿肟酯類化合物(4a~4h, Scheme 1),其結構經1H NMR,13C NMR和MS表征。
1 實驗部分
1.1 儀器與試劑
AVANCE III HD 600 MHz型超導核磁共振儀(CDCl3為溶劑,TMS為內標);ThermoFisher型超高效液相-離子阱質譜聯用儀。
所用試劑均為分析純。
1.2 合成
(1) 2的合成
在反應瓶中依次加入1 1.24 g(5 mmol)和甲苯20 mL,攪拌下加入雙(三甲基硅基)氨基鈉5 mL,于室溫反應10 min;加入亞硝酸叔丁酯3 mL,于50 ℃反應1.5 h(TLC檢測)。冷卻至室溫,真空抽濾,濾液濃縮后經硅膠柱層析[洗脫劑:V(石油醚)∶V(乙酸乙酯)=1 ∶1]純化得白色固體2 0.89 g,收率65%, m.p.148~153 ℃;1H NMRδ: 15.21(s, 1H), 4.32(dd,J=12.8 Hz, 4.4 Hz, 1H), 3.98(ddd,J=10.9 Hz, 7.8 Hz, 5.3 Hz, 1H), 3.24(t,J=12.8 Hz, 1H), 2.90~2.76(m, 2H), 2.66(ddd,J=15.4 Hz, 7.4 Hz, 3.9 Hz, 1H), 2.49(ddd,J=15.2 Hz, 10.9 Hz, 3.9 Hz, 1H), 2.32~2.20(m, 1H), 2.07~1.95(m, 2H), 1.90(dd,J=8.8 Hz, 6.9 Hz, 1H), 1.81~1.68(m, 4H), 1.66~1.55(m, 3H), 1.53~1.41(m, 3H), 1.33~1.21(m, 1H);13C NMRδ: 160.94, 142.68, 63.12, 57.08, 57.04, 53.09, 42.48, 41.36, 35.64, 27.57, 26.39, 26.04, 24.76, 20.99, 20.57; MSm/z: 278{[M+H]+}。
(2) 4a~4h的合成(以4a為例)
在反應瓶中依次加入2 1.0 g和二氯甲烷20 mL,攪拌使其溶解;加入吡啶0.5 mL,緩慢滴加10%苯甲酰氯(3a)的二氯甲烷(5 mL)溶液,滴畢,回流反應1.5 h(TLC檢測)。依次用飽和碳酸氫鈉溶液和水洗滌至pH 7,無水硫酸鈉干燥,濃縮后用石油醚/乙酸乙酯重結晶得4a。
分別用3b~3h代替3a,用類似方法合成4b~4h。
4a: 淡黃色固體,收率55%, m.p.142~148 ℃;1H NMRδ: 12~8.06(m, 2H), 7.66~7.61(m, 1H), 7.50(dd,J=10.8 Hz, 4.9 Hz, 2H), 4.51(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.08(ddd,J=10.8 Hz, 8.0 Hz, 5.0 Hz, 1H), 3.28(t,J=12.8 Hz, 1H), 3.22(ddd,J=16.3 Hz, 7.3 Hz, 4.3 Hz, 1H), 2.92~2.78(m, 2H), 2.75~2.63(m, 1H), 2.29(ddt,J=17.2 Hz, 7.3 Hz, 4.9 Hz, 1H), 2.01(dtd,J=15.0 Hz, 12.3 Hz, 2.8 Hz, 2H), 1.85(s, 3H), 1.78~1.70(m, 3H), 1.65(ddd,J=14.3 Hz, 9.1 Hz, 4.5 Hz, 1H), 1.61~1.53(m, 2H), 1.53~1.46(m, 3H);13C NMRδ: 162.89, 158.06, 157.85, 133.64, 129.80, 128.65, 128.55, 63.33, 57.12, 56.82, 52.72, 42.89, 42.38, 35.52, 27.56, 26.41, 23.36, 22.42, 21.04, 20.72; MSm/z: 382{[M+H]+}。
4b: 白色固體,收率53%, m.p. 146~154 ℃;1H NMRδ: 7.96(d,J=8.2 Hz, 2H), 7.27(d,J=8.8 Hz, 2H), 4.49(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.05(ddd,J=10.9 Hz, 8.0 Hz, 5.1 Hz, 1H), 3.26(t,J=12.8 Hz, 1H), 3.18(ddd,J=16.4 Hz, 7.3 Hz, 4.3 Hz, 1H), 2.89~2.77(m, 2H), 2.71~2.62(m, 1H), 2.43(s, 3H), 2.30~2.21(m, 1H), 1.99(dtd,J=14.9 Hz, 12.3 Hz, 2.7 Hz, 2H), 1.88(d,J=15.2 Hz, 2H), 1.83~1.77(m, 1H), 1.77~1.67(m, 3H), 1.67~1.61(m, 1H), 1.61~1.51(m, 2H), 1.51~1.42(m, 3H);13C NMRδ: 163.98, 158.14, 157.56, 144.53, 129.84, 129.36, 125.70, 63.33, 57.12, 56.82, 52.72, 42.89, 42.38, 35.52, 27.56, 26.41, 23.36, 22.42, 21.77, 21.04, 20.72; MSm/z: 396{[M+H]+}。
4c: 白色固體,收率49%, m.p.140~155 ℃;1H NMRδ: 8.04~7.98(m, 2H), 7.49~7.43(m, 2H), 4.49(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.07(s, 1H), 3.28(t,J=12.7 Hz, 1H), 3.18(ddd,J=16.4 Hz, 7.3 Hz, 4.3 Hz, 1H), 2.85(dd,J=31.8 Hz, 10.4 Hz, 2H), 2.74~2.65(m, 1H), 2.33~2.24(m, 1H), 2.04(s, 3H), 1.88(d,J=13.7 Hz, 1H), 1.82(d,J=9.5 Hz, 1H), 1.78~1.70(m, 3H), 1.69~1.62(m, 1H), 1.57(ddd,J=18.4 Hz, 9.5 Hz, 4.2 Hz, 2H), 1.53~1.45(m, 3H);13C NMRδ: 162.15, 157.97, 157.94, 140.24, 131.14, 129.06, 126.90, 63.28, 57.10, 56.88, 52.72, 42.92, 42.35, 35.51, 27.54, 26.40, 23.27, 22.42, 21.02, 20.69; MSm/z: 416{[M+H]+}。
4d: 淡黃色固體,收率40%, m.p.136~141 ℃;1H NMRδ: 7.93(d,J=8.5 Hz, 1H), 7.93(d,J=8.5 Hz, 1H), 7.63(d,J=8.5 Hz, 1H), 7.63(d,J=8.5 Hz, 1H), 4.49(d,J=9.5 Hz, 1H), 4.06(s, 1H), 3.27(t,J=12.4 Hz, 1H), 3.21~3.11(m, 1H), 2.91~2.74(m, 2H), 2.73~2.56(m, 1H), 2.25(t,J=16.2 Hz, 1H), 2.16(s, 1H), 2.01(t,J=18.4 Hz, 2H), 1.87(d,J=13.1 Hz, 1H), 1.80(s, 1H), 1.72(s, 4H), 1.64(d,J=10.4 Hz, 1H), 1.57(d,J=8.9 Hz, 2H), 1.48(s, 3H);13C NMRδ: 162.21, 158.06, 157.92, 131.69, 131.23, 128.91, 127.38, 63.31, 57.08, 56.77, 52.69, 42.87, 42.33, 35.46, 27.51, 26.36, 23.31, 22.44, 20.99, 20.66; MSm/z: 461{[M+H]+}。
4e: 白色固體,收率55%, m.p. 158~170 ℃;1H NMRδ: 8.19(d,J=8.2 Hz, 2H), 7.75(d,J=8.3 Hz, 2H), 4.48(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.07(ddd,J=10.9 Hz, 8.1 Hz, 5.1 Hz, 1H), 3.27(t,J=12.8 Hz, 1H), 3.19(ddd,J=16.3 Hz, 7.2 Hz, 4.3 Hz, 1H), 2.92~2.76(m, 2H), 2.69(ddd,J=16.0 Hz, 11.0 Hz, 4.7 Hz, 1H), 2.34~2.22(m, 1H), 2.04~1.96(m, 1H), 1.95(s, 2H), 1.87(d,J=13.6 Hz, 1H), 1.84~1.78(m, 1H), 1.78~1.69(m, 3H), 1.69~1.61(m, 1H), 1.60~1.52(m, 2H), 1.48(dq, J=6.9 Hz, 4.1 Hz, 3H);13C NMRδ: 161.78, 158.48, 157.78, 131.84, 130.18, 125.72, 125.69, 124.37, 63.27, 57.12, 57.11, 52.73, 42.92, 42.39, 35.51, 27.55, 26.41, 23.31, 22.52, 21.04, 20.71; MSm/z: 412{[M+H]+}。
4f: 淡黃色固體,收率45%, m.p.136~144 ℃;1H NMRδ: 8.03(t,J=5.7 Hz, 2H), 6.96(t,J=5.7 Hz, 2H), 4.49(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.05(ddd,J=11.0 Hz, 8.0 Hz, 5.1 Hz, 1H), 3.88(s, 3H), 3.25(t,J=12.7 Hz, 1H), 3.22~3.12(m, 1H), 2.83(dd,J=31.6 Hz, 10.9 Hz, 2H), 2.71~2.58(m, 1H), 2.32~2.19(m, 1H), 2.05~1.94(m, 2H), 1.89(s, 2H), 1.80(dd,J=16.9 Hz, 8.2 Hz, 1H), 1.76~1.68(m, 3H), 1.68~1.60(m, 1H), 1.55(ddd,J=19.0 Hz, 9.9 Hz, 4.4 Hz, 2H), 1.52~1.43(m, 3H);13C NMRδ: 161.78, 158.48, 157.78, 131.84, 130.18, 125.72, 125.69, 63.34, 57.14, 56.88, 55.53, 52.71, 42.88, 42.37, 35.53, 27.57, 26.43, 23.36, 22.36, 21.06, 20.74; MSm/z: 450{[M+H]+}。
4g: 淡黃色固體,收率49%, m.p.156~162 ℃;1H NMRδ: 8.14~8.07(m, 2H), 7.21~7.13(m, 2H), 4.50(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.12~4.04(m, 1H), 3.28(t,J=12.8 Hz, 1H), 3.19(ddd,J=16.4 Hz, 7.3 Hz, 4.3 Hz, 1H), 2.85(dd,J=31.5 Hz, 10.9 Hz, 2H), 2.73~2.62(m, 1H), 2.34~2.24(m, 1H), 2.02(dt,J=16.2 Hz, 12.0 Hz, 2H), 1.87(s, 2H), 1.83(d,J=11.9 Hz, 1H), 1.74(tdd,J=14.1 Hz, 10.2 Hz, 4.3 Hz, 3H), 1.64(dd,J=24.4 Hz, 10.1 Hz, 1H), 1.61~1.53(m, 2H), 1.53~1.45(m, 3H);13C NMRδ: 161.99, 157.98, 157.88, 132.44, 132.39, 116.01, 115.87, 63.30, 57.12, 56.89, 52.71, 42.92, 42.38, 35.52, 27.55, 26.41, 23.31, 22.42, 21.04, 20.71; MSm/z: 400{[M+H]+}。
4h: 淡黃色固體,收率52%, m.p.120~135 ℃;1H NMRδ: 8.17~8.11(m, 2H), 7.72~7.68(m, 2H), 7.66~7.59(m, 2H), 7.51~7.46(m, 2H), 7.44~7.38(m, 1H), 4.50(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.10~4.03(m, 1H), 3.27(t,J=12.8 Hz, 1H), 3.22(m, 1H), 2.84(dd,J=32.1 Hz, 10.9 Hz, 2H), 2.75~2.64(m, 1H), 2.32~2.24(m, 1H), 2.00(dtd,J=14.9 Hz, 12.2 Hz, 2.6 Hz, 2H), 1.88(d,J=13.6 Hz, 1H), 1.81(dd,J=13.5 Hz, 10.0 Hz, 1H), 1.64(dd,J=15.4 Hz, 11.8 Hz, 4H), 1.64(dd,J=14.7 Hz, 11.1 Hz, 1H), 1.61~1.52(m, 2H), 1.48(dd,J=13.0 Hz, 4.5 Hz, 3H);13C NMRδ: 162.77, 158.07, 157.91, 146.42, 139.80, 134.71, 130.34, 129.01, 128.38, 127.32, 127.21, 63.35, 57.13, 56.95, 52.72, 42.88, 42.40, 35.52, 27.56, 26.42, 23.41, 22.47, 21.05, 20.72; MSm/z: 458{[M+H]+}。
2 結果與討論
2.1 合成
(1) 2的合成
在2的合成中,因為雙(三甲基硅基)氨基鈉為強堿,與水會發生反應,生成氫氧化鈉和六甲基二硅氮烷。水的存在會對苦參堿14-位上碳負離子的生成產生影響,從而導致產率的降低;所以該反應過程中所用甲苯需經無水處理。另外,用硅膠柱層析進行純化時在展開劑中加入少量的三乙胺溶液,純化的效果會得到很大的提高。
(2) 4的合成
在4的合成中,反應條件溫和,副產物少,產率較高。吡啶作為縛酸劑,二氯甲烷作為溶劑,使后處理更加簡單易行。4經濃縮后,用石油醚和乙酸乙酯重結晶,純度得到顯著提升。
(3) 肟酯類化合物的合成
在形成酯的反應中,酰化效果最佳。酰化試劑的酰化能力由強到弱依次為:酰氯、酸酐、酯、羧酸、酰胺。因此,在成酯反應中,采用酰氯。吡啶是一種常用的縛酸劑,本身結構相對穩定,且呈透明無水的溶液狀態,不會對反應物與反應液造成影響,同時吡啶還起到催化作用,在酰氯和肟的反應中,吡啶中的氮原子起到親核試劑,進攻酰氯中的羰基,形成了一個穩定的碳正離子(Scheme 2),從而加快了反應的進行。
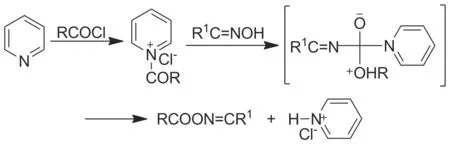
Scheme 2
3 結論
以具有廣泛生物活性的苦參堿為先導化合物,引入肟酯活性基團進行結構修飾改造,通過合成中間體苦參堿肟,然后和苯甲酰氯類化合物進行反應,合成了8個新的苦參堿肟酯類化合物,有關其活性研究正在進行中,有望在醫藥或農藥領域得到應用。
該合成方法簡單、反應條件溫和、收率高等優點,為該類化合物的合成提供了參考。
[1] Li X L, Chu W M, Liu J L,etal. Antiarrhythmic proerties of long-ter,trestment with matrine in arrhythmic rat induced by coronary ligation[J].Biol Pharm Bull,2009,32(9):1521-1526.
[2] Zhang B, Liu Z Y, Li Y Y,etal. Antiinflammatory effects of matrine in LPS-induced acute lung injury in mice[J].Eur J Pharmacol,2011,44(5):573-579.
[3] 黃丹,賴玲. 苦參堿劑型的研究進展[J].廣西醫科大學學報,2014,31(6):1040-1042.
[4] 付海根,唐勝,李迎紅,等. 新型12-N-取代苦參酸衍生物的合成及其抗結核活性[J].合成化學,2014,22(6): 739-743.
[5] 王立升,楊龍力,劉旭,等. 苦參堿磺胺類拼合物的合成[J].合成化學,2015,23(2):140-143.
[6] 艾靜,高煥煥,何樹莊,等. 苦參堿青蒿素和粉防己堿對豚鼠心室肌細胞胞漿鈣的影響[J].中國藥理學報,2001,22(6):512-515.
[7] 田然歌. 苦參堿植物源農藥專利授權與產業化分析[J].農業科學與管理,2015,36(12):12-14.
[8] 孟獻濤. 肟在有機合成中的一些應用[D].保定:河北大學,2009.
[9] Song B A, Liu X H, Yang S,etal. Synthesis and anticancer activity of 2,3,4-trimethoxyacetophenoxime ester containing benzothiazole moiety[J].Chin J Org Chem,2005,23(9):1236-1240.
Synthesis of Novel Matrine Oxime Ester Compounds
LIU Hua-wen1, ZHANG Sen2, LI Dong1,LIU Xu1, WANG Jian-yi1, WANG Li-sheng1*
(1. College of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004, China 2. School of Pharmacy, Guangxi University of Chinese Medicine, Nanning 530001, China)
Matrine was modified by active functional group oxime esterviabiologically active factor splicing. The key intermediate oxime(2) was synthesized by oximic reaction of matrine withtert-butyl nitrite. Eight novel matrine oxime ester compounds were synthesized by esterification of 2 with benzoyl chloride analogs. The structures were characterized by1H NMR,13C NMR and MS.
matrine; oxime ester; benzoyl chloride; synthesis
2016-03-16;
2016-08-31
國家自然科學基金資助項目(21262005)
劉華文(1989-),男,漢族,廣西平南人,碩士研究生,主要從事藥物合成的研究。 E-mail: liuhuawen105@163.com
王立升,教授,博士生導師, E-mail: w_lsheng@163.com
O626.4
A
10.15952/j.cnki.cjsc.1005-1511.2016.10.16071

