樹脂糖苷Albinoside III的新型喹諾糖模塊的合成
孫琳琳, 劉文晶, 于廣利, 李春霞
(中國海洋大學 醫藥學院 海洋藥物教育部重點實驗室 山東省糖科學與糖工程重點實驗室,山東 青島 266003)
?
·研究論文·
樹脂糖苷Albinoside III的新型喹諾糖模塊的合成
孫琳琳, 劉文晶, 于廣利, 李春霞*
(中國海洋大學 醫藥學院 海洋藥物教育部重點實驗室 山東省糖科學與糖工程重點實驗室,山東 青島 266003)
樹脂糖苷Albinoside III是一種良好的多藥耐藥外排泵抑制劑,本文探索了高效構建樹脂糖苷中喹諾糖模塊的方法。從D-葡萄糖硫苷出發,采用一鍋法,經4步反應構建了D-喹諾糖模塊A,總收率58.4%;從4,6-位芐叉保護的D-葡萄糖硫苷出發,通過3-位選擇性的PMB保護,經5步反應構建了正交保護的D-喹諾糖模塊E,總收率28.5%。該合成路線中涉及8個新化合物,其結構經1H NMR,13C NMR和HR-MS(ESI)表征。
樹脂糖苷Albinoside III; D-葡萄糖硫苷; 一鍋法; 正交保護; D-喹諾糖; 合成
樹脂糖苷是旋花科牽牛屬植物的主要活性成份,是一類含有大環內酯結構的糖脂。近年來,墨西哥Rogelio Pereda-Miranda小組[1-3]和中國的孔令義小組[4-5]等從旋花科植物中分離到了多種樹脂糖苷類化合物。生物活性研究發現,樹脂糖苷具有抗菌、抗腫瘤活性及多藥耐藥外排泵抑制活性等作用[1-6]。樹脂糖苷因其新穎獨特的化學結構和多樣的生物活性而倍受藥物化學家的關注。
2012年,墨西哥Sara Cruz-Morales等[7]從月亮藤的種子中提取分離到了樹脂糖苷Albinoside系列化合物,并且證明了Albinoside III(Chart 1)作為多藥耐藥外排泵抑制劑,與長春堿聯合用藥,可抑制乳腺癌MCF-7細胞的增殖。Albinoside III用藥濃度為25 μg·mL-1時逆轉倍量可達2 140倍。樹脂糖苷Albinoside III作為良好的多藥耐藥外排泵抑制劑引起了我們的極大興趣。
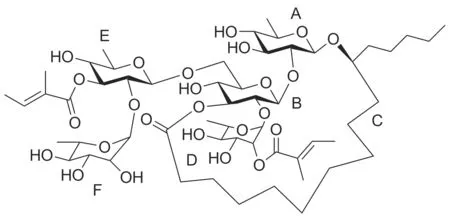
Albinoside III
樹脂糖苷Albinoside III的寡糖鏈由一個D-葡萄糖,兩個L-鼠李糖和兩個D-喹諾糖組成,長鏈脂肪酸為11S-羥基-十六烷酸,修飾性脂肪酸均為2-甲基-2-丁烯酸,內酯環為19元環,內酯鍵處在D-葡萄糖的3-位。該化合物結構復雜,對其進行全合成有相當的難度。
目前已合成的樹脂糖苷[8-12]所含糖的種類主要有D-葡萄糖,D-半乳糖,L-鼠李糖和D-巖藻糖四種,含D-喹諾糖的較少。1995年,Schmidt小組在合成樹脂糖苷Calonyctin A時,初次建立了D-喹諾糖模塊的合成方法[13]。該方法以D-葡萄糖為原料,首先制得1,2 ∶5,6-O-雙異亞丙基-α-D-呋喃葡萄糖,再將3-位經選擇性烯丙基或芐基保護,水解5,6-位丙酮叉保護,6-位羥基形成活性磺酸酯后還原,再將1,2-位丙酮叉水解得到3-位烯丙基或芐基保護的D-喹諾糖。在此基礎上通過1,2-位原酸酯保護和一系列保護基操作后制備D-喹諾糖糖基供體或受體。上述合成D-喹諾糖模塊的路線較為繁瑣且產率較低。因此需要對D-喹諾糖模塊的合成方法進行改進和優化。
本文以Albinoside III中D-喹諾糖模塊的合成為重點,結合該化合物的結構特征,進行兩個D-喹諾糖模塊(模塊A和模塊E)的構建,進而為后期Albinoside III的全合成奠定基礎。其中模塊A的構建需要滿足以下要求:作為糖基供體與長鏈脂肪酸偶聯;2-位保護基可以選擇性脫除,與供體模塊B進行糖苷化;3,4-位需要比較穩定的保護基,最后脫除構建目標物。模塊E的構建需要滿足以下要求:作為糖基供體與受體模塊B進行糖苷化;2-位可以選擇性脫除與供體模塊F進行糖苷化;3-位可以選擇性脫除,替換為修飾性脂肪酸;4-位需要比較穩定的保護基,最后脫除構建目標物。根據上述要求設計了1-S-對甲基苯基-2-O-苯甲酰基-3,4-O-芐基-β-D-喹諾糖模塊A(7, Scheme 1)和1-S-對甲基苯基-2-O-鄰疊氮甲基苯甲酰基-3-O-對甲氧基芐基-4-O-芐基-β-D-喹諾糖模塊E(13, Scheme 2)的合成路線。
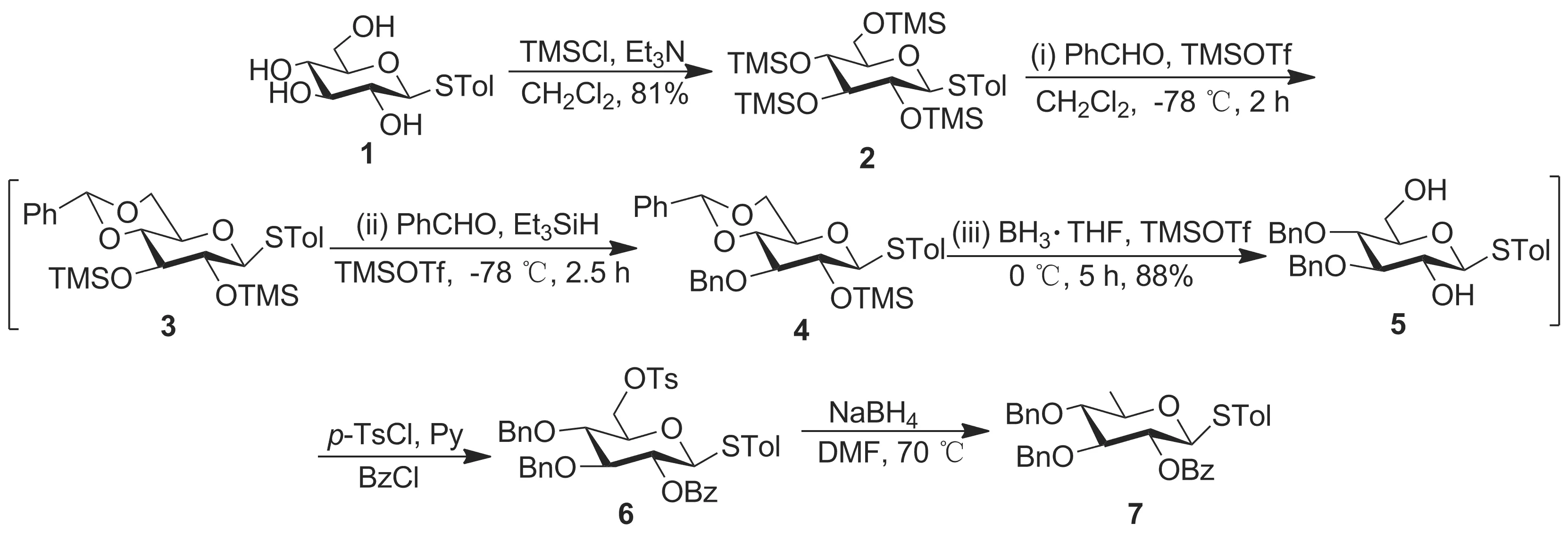
Scheme 1
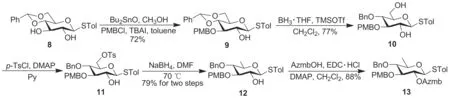
Scheme 2
從D-葡萄糖硫苷(1)[14 ]出發,對其進行全TMS保護制得化合物2,后經一鍋法反應制得3,4-位芐基保護的D-葡萄糖硫苷(5),該一鍋法具體過程為:2經TMSOTf催化的縮醛反應生成4,6-位芐叉保護的中間體3;再以Et3SiH為還原劑,經還原醚化反應生成3-位選擇性芐基保護的中間體4; 4經BH3·THF還原得化合物5。 5的6-位羥基形成活性磺酸酯[15],2-位羥基用Bz保護制得D-葡萄糖硫苷供體6; 6經硼氫化鈉還原合成了D-喹諾糖硫苷供體(7)。該路線采用一鍋法[16]實現了葡萄糖2,3-位的區分,構建了D-喹諾糖模塊A(Scheme 1)。
從4,6-位芐叉保護的D-葡萄糖硫苷(8)[17]出發,在Bu2SnO的介導下,采用葡萄糖3-位選擇性PMB保護的方法[18]實現葡萄糖2,3-位的區分;然后選擇性打開芐叉,6-位羥基形成活性磺酸酯[15],再經硼氫化鈉還原實現了6-位甲基化制得化合物12。選用Azmb保護基(鄰疊氮甲基苯甲酸酯基)[19]保護2-位羥基合成了D-喹諾糖硫苷13,由此構建了正交保護的D-喹諾糖模塊E(Scheme 2)。
在上述合成路線中,化合物2, 5, 7, 9~13均為新化合物,其結構經1H NMR,13C NMR和HR-MS(ESI)表征。
1 實驗部分
1.1 儀器與試劑
P-1020型旋光儀(589 nm,CHCl3為溶劑);DD2 500-MR型核磁共振儀(CDCl3為溶劑,TMS為內標);Micromass Q-TOF ultima Global型質譜儀。
所用試劑均為分析純,其中二氯甲烷、甲醇、甲苯、吡啶和DMF使用前經無水處理。
1.2 合成
(1) 2的合成
將1[14]3.0 g(10.2 mmol)溶于二氯甲烷40 mL中,N2保護,冰浴冷卻,攪拌下加入Et3N 10.8 mL(81.6 mmol),三甲基氯硅烷(TMSCl)7.6 mL(61.2 mmol),逐漸升至室溫,反應12 h(TLC監測)。真空濃縮,殘余物用石油醚稀釋,過濾,濾液濃縮后經硅膠柱層析[洗脫劑:A=V(石油醚) ∶V(乙酸乙酯)=70 ∶1]純化得透明油狀液體2 4.8 g,收率81%;1H NMRδ: 7.43(d,J=8.1 Hz, 2H, ArH), 7.07(d,J=7.9 Hz, 2H, ArH), 4.56(d,J=8.5 Hz, 1H, 1-H), 3.79(dd,J=2.2 Hz, 11.1 Hz, 1H, 6-Ha), 3.62(dd,J=6.3 Hz, 11.2 Hz, 1H, 6-Hb), 3.47~3.39(m, 3H, 2,3,4-H), 3.26~3.24(m, 1H, 5-H), 2.34(s, 3H, ArCH3), 0.24(s, 9H, SiC3H9), 0.17(s, 9H, SiC3H9), 0.16(s, 9H, SiC3H9), 0.11(s, 9H, SiC3H9)。
(2) 5的合成
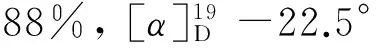
(3) 7的合成
將5 0.22 g(0.47 mmol)溶于10 mL吡啶中,N2保護,攪拌下于室溫加入p-TsCl 0.36 g(1.79 mmol), DMAP 16 mg(0.08 mmol),反應5 h;于50 ℃反應2 h(TLC監測);加入BzCl 98 μL(0.85 mmol),于室溫反應4 h(TLC檢測)。真空濃縮,加入二氯甲烷15 mL,依次用1 mol·L-1鹽酸(2×10 mL),飽和NaHCO3溶液(2×10 mL)和飽和NaCl溶液(2×10 mL)洗滌,無水Na2SO4干燥,減壓蒸除溶劑,殘余物真空干燥得淡黃色油狀粗品6,直接用于下步反應。
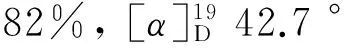
(4) 9的合成
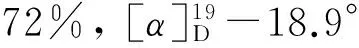
(5) 10的合成
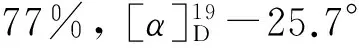
(6) 12的合成
將10 759 mg(1.5 mmol)溶于12 mL吡啶中,N2保護,攪拌下于室溫加入p-TsCl 1.3 g(6.9 mmol)和DMAP 32 mg(0.26 mmol),反應4 h(TLC監測)。減壓濃縮,殘余物加入二氯甲烷20 mL,依次用1 mol·L-1鹽酸(2×10 mL)、飽和NaHCO3溶液(2×10 mL)和飽和NaCl溶液(2×10 mL)洗滌,無水Na2SO4干燥,減壓濃縮得白色固體11粗品。
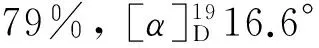
(7) 13的合成
樹脂糖苷Albinoside III作為潛在的多藥耐藥外排泵抑制劑,對其進行全合成研究對于克服腫瘤多藥耐藥問題具有重要意義。D-喹諾糖是樹脂糖苷Albinoside III骨架中重要的模塊,其合成報道較少。目前只有Schmidt小組報道了樹脂糖苷Calonyctin A中D-喹諾糖的合成[13]。樹脂糖苷Albinoside III中D-喹諾糖模塊A的構建既要實現2,3-位的區分,又要將6-位進行甲基化;其中D-喹諾糖模塊E需要進行正交保護,因此合成難度較大。
本文探索了樹脂糖苷Albinoside III中兩個D-喹諾糖模塊的合成方法。文獻中通過原酸酯實現葡萄糖2,3-位區分[20-21]以及通過6-位羥基碘代后還原實現甲基化的方法[22]均比較繁瑣。本文以全TMS保護的D-葡萄糖硫苷2為原料,采用一鍋法通過4,6-位芐叉保護,3-位選擇性芐基化,選擇性打開4,6-位芐叉快速高效地實現了葡萄糖2,3-位區分,然后6-位羥基形成活性磺酸酯后還原構建了模塊A。若以D-葡萄糖為起始原料計算,該方法以7步38.3%的總收率構建了3,4-位芐基保護,2-位Bz保護的D-喹諾糖硫苷供體7(即D-喹諾糖模塊A)。Schmidt小組以9步30.4%的總收率構建了樹脂糖苷Calonyctin A中類似的D-喹諾糖模塊[13]。與Schmidt小組的方法相比,該一鍋法簡化了合成步驟,提高了反應產率。本研究開創了由D-葡萄糖構建D-喹諾糖模塊的新方法,為下一步糖苷化研究奠定了基礎。
另外,本研究構建了正交保護的D-喹諾糖模塊E。在Bu2SnO的介導下,采用葡萄糖3-位選擇性PMB保護的方法實現了葡萄糖2,3-位的區分,選擇性打開4,6-位芐叉,裸露的6-位羥基形成活性磺酸酯后還原,以5步28.5%的總收率構建了D-喹諾糖硫苷供體13(即D-喹諾糖模塊E)。其中,芐基、對甲氧基芐基和鄰疊氮甲基苯甲酰基均可選擇性脫除,如芐基可用Pd/C, H2還原脫除,對甲氧基芐基可在酸性條件下脫除或通過DDQ氧化脫除,Azmb保護基可在溫和的還原條件下通過Staudinger反應脫除(Bu3P, THF-H2O)[19]。該方法為Albinoside III的合成奠定了基礎,同時也為樹脂糖苷類化合物中相關喹諾糖模塊的合成提供了借鑒。
從D-葡萄糖硫苷出發,采用一鍋法,經4步反應構建了D-喹諾糖模塊A,總收率58.4%;從4,6-位芐叉保護的D-葡萄糖硫苷出發,通過3-位選擇性的PMB保護,經5步反應構建了正交保護的D-喹諾糖模塊E,總收率28.5%。該合成路線中涉及8個新化合物。該研究結果為新型的多藥耐藥外排泵抑制劑的合成奠定了基礎,同時也推動了Albinoside系列樹脂糖苷的構效關系研究。
[1] Gomez J C, Miranda R P. Resin glycosides from the herbal drug jalap(Ipomoeapurga)[J].J Nat Prod,2011,74:1148-1153.
[2] Figueroa-Gonzalez G, Jacobo-Herrera N, Zentella-Dehesa A,etal. Reversal of multidrug resistance by morning glory resin glycosides in human breast cancer Cells[J].J Nat Prod,2012,75:93-97.
[3] Castaneda-Gomez J, Figueroa-Gonzalez G, Jacobo N,etal. Purgin II,a resin glycoside ester-type dimer and inhibitor of multidrug efflux pumps from ipomoea purga[J]. J Nat Prod,2013,76:64-71.
[4] Yin Y Q, Li Y, Kong L Y. Pentasaccharide glycosides from the tubers of sweet potato(Ipomoeabatatas)[J].J Agric Food Chem,2008,56:2363-2368.
[5] Yin Y Q, Wang J S, Luo J G,etal. Novel acylated lipo-oligosaccharides from the tubers ofIpomoeabatatas[J].Carbohydr Res,2009,344:466-473.
[6] Barnes C C, Smalley M K, Manfredi K P,etal. Characterization of an anti-tuberculosis resin glycoside from the prairie medicinal plantIpomoealeptophylla[J]. J Nat Prod,2003,66:1457-1462.
[7] Cruz-MoralesS, Castaneda-Gomez J, Figueroa-Gonzalez G,etal. Mammalian multidrug resistance lipopentasaccharide inhibitors from ipomoea alba seeds[J]. J Nat Prod,2012,75:1603-1611.
[8] Lu S F, O,yang Q Q, Guo Z W,etal. Total synthesis of tricolorin A[J].J Org Chem,1997,62:8400-8405.
[9] Larson D P, Heatheoek C H. Synthesis of the macrolactone disaccharide subunit of tricolorin A[J].J Org Chem,1996,61:5208-5029.
[10] 朱星枚. 樹脂糖苷Merremosideb的全合成研究[D].成都:四川大學,2006.
[11] Xie L, Zhu S Y, Shen X Q,etal. Total synthesis of batatoside L[J].J Org Chem,2010,75:5764-5767.
[12] Zhu S Y, Huang J S, Zheng S S,etal. First total synthesis of the proposed structure of batatin VI[J]. Org Lett,2013,16:4154-4157.
[13] Jiang Z H, Geyer A, Schmidt R R. The macrolidic glycolipid calonyctin A,a plant growth regulator:Synthesis,structural assignment,and conformational analysis in micellar solution[J].Angew Chem Int Ed Engl,1995,34(22):2520-2524.
[14] Khiar N, Martin-Lomas M A. Highly convergent synthesis of the tetragalactose moiety of the glycosyl phosphatidyl inositol anchor of the variant surface glycoprotein oftrypanosomabrucei[J].J Org Chem,1995,60:7017-7021.
[15] Lu S F, O'yang Q Q, Guo Z W,etal. The first total synthesis of tricolorin A[J].Angew Chem Int Ed Engl,1997,36(21):2344-2346.
[16] Huang T Y, Zulueta M M L, Hung S C. One-pot strategies for the synthesis of the tetrasaccharide linkage region of proteoglycans[J].Org Lett,2011,13(6):1506-1509.
[17] Greenberg W A, Priestley E S, Sears P S,etal. Design and synthesis of new aminoglycoside antibiotics containing neamine as an optimal core Structure: Correlation of antibiotic activity withinvitroinhibition of translation[J].J Am Chem Soc,1999,121:6527-6541.
[18] Verduyn R, Douwes M, Vander-Klein P A M,etal. Synthesis of a methyl heptaglucoside:Analogue of the phytoalexin elicitor from phytophtoramegasperma[J].Tetrahedr Lett,1993,49:7301-7316.
[19] Love K R, Andrade R B, Seeberge P H. Linear synthesis of a protected H-type II pentasaccharide using glycosyl phosphate building blocks[J]. J Org Chem,2001,66:8165-8176.
[20] Loscher S, Schobert R. Total synthesis and absolute configuration of epicoccamide D,a naturally occurring mannosylated 3-acyltetramic acid[J].Chem Eur J,2013,19:10619-10624.
[21] Wang G F, Lu Z C, Ding N. Differentiating the 2,3-diols of glucopyranosides by 4,6-O-benzylidene-protected-1,2-D-glucopyranosylorthoesters strategy[J].Carbohydr Res,2011,346:2368-2373
[22] Pauwels N, Aspeslagh S, Vanhoenacker G. Divergent synthetic approach to 6″-modifiedα-GalCer analogues[J].Org Biomol Chem,2011,9:8413-8421.
Synthesis of Novel Quinoside Building Blocks of Resign Glycoside Albinoside III
SUN Lin-lin, LIU Wen-jing, YU Guang-li, LI Chun-xia*
(Key Laboratory of Glycoscience and Glycotechnology of Shandong Province, Key Laboratory of Marine Drugs,Ministry of Education, School of Medicine and Pharmacy, Ocean University of China, Qingdao 266003, China)
Resign glycoside albinoside III is a good multi-resistant efflux pump inhibitor. The efficient method to synthesize the quinoside building blocks of Albinoside III was reported. The quinoside building block A was synthesized fromp-tolyl-1-thio-β-D-glucopyranoside through one-pot strategy by four step reactions in total yield of 58.4%. The quinoside building block E was synthesized fromp-methylphenyl-4,6-O-benzylidene-1-thio-β-D-glucopyranoside through regioselective PMB protection by five step reactions in total yield of 28.5%. Eight novel compounds were involved in the synthetic route. The structures were characterized by1H NMR,13C NMR and HR-MS(ESI).
Resign glycoside Albinoside III; D-glucopyranoside; one-pot strategy; orthogonal protection; D-quinoside; synthesis
2016-03-10;
2016-08-31
國家自然科學基金委員會-山東省人民政府聯合資助海洋科學研究中心項目(U1406402); 海洋公益性行業科研專項基金資助項目(201405038); 青島市自主創新重大專項(15-4-13-zdzx-hy)
孫琳琳(1990-),女,漢族,山東德州人,碩士研究生,主要從事藥物化學的研究。 E-mail: sunlinlinenjoylife@163.com
李春霞,教授, Tel. 0532-82032030, E-mail: lchunxia@ouc.edu.cn
O629.11; O621.3
A
10.15952/j.cnki.cjsc.1005-1511.2016.10.16070

