腎臟高濾過與脈搏波傳導速度相關性的研究
林 苗, 溫俊平, 黃惠彬, 梁繼興, 李連濤, 林麗香, 陳 剛
?
腎臟高濾過與脈搏波傳導速度相關性的研究
林苗1, 溫俊平2, 黃惠彬2, 梁繼興2, 李連濤2, 林麗香2, 陳剛2
目的探討腎臟高濾過(RHF)與脈搏波傳導速度(baPWV)之間的相關性。方法2011年6月-2012年1月,在福建省寧德市及武夷山市進行普通人群篩查,共入組6 291例估算腎小球濾過率(eGFR)≥60 mL/min/1.73 m2的受檢者。以糾正年齡、體質量指數、性別、血管緊張素Ⅱ受體拮抗劑或血管緊張素轉換酶抑制劑的使用等因素后,eGFR在第95百分位數以上的人群為RHF組,并根據eGFR將受檢者分為3組:60~90,90~110,≥110 mL/min/1.73 m2,使用多元Logistic回歸分析不同eGFR組與異常baPWV的校正比值比(OR),在RHF組中應用多元線性回歸分析研究eGFR值與baPWV的相關性。結果與eGFR為90~110 mL/min/1.73 m2組比較, baPWV值≥1 400 cm/s的OR和95%CI分別為1.436,1.114~1.851(P=0.005)。在RHF組中,eGFR水平與baPWV值呈正相關, 其相關系數β和95%CI分別為9.291,3.259~15.322(P=0.003)。結論RHF與baPWV異常存在顯著相關性,且這種相關性是獨立于血糖、血壓、體質量指數、血脂水平、吸煙、飲酒和體力活動等因素而存在的。
腎病; 腎小球; 腎小球濾過率; 脈搏; 神經傳導; 動脈硬化
自從2002年腎臟疾病患者生存質量(KDOQI)指南提出慢性腎臟病(chronic kidney disease, CKD)這一定義后,許多大型的流行病學研究表明,估算腎小球濾過率(estimated glomerularfiltrationrate, eGFR)的降低與終末期腎臟病、心血管事件和死亡率密切相關,是心血管事件的危險因素。但直至最近,腎臟高濾過狀態(renal hyperfiltration, RHF)對心血管疾病的發生、發展和預后的影響才逐漸為人們所認識。一項大型的前瞻性研究證實,RHF是預測全因死亡率的重要指標[1]。Matshusita等在一項薈萃分析中發現,eGFR和心血管疾病的全因死亡率的相關性呈U型分布,eGFR>105 mL/min/1.73 m2組較eGFR正常組死亡率明顯升高[2]。脈搏波傳導速度(brachial-ankle pulse wave velocity, baPWV)是評估動脈僵硬度的重要指標,被認為是心血管疾病危險及預后的預測因子之一[3],而RHF與baPWV間的相關性尚不清楚。本研究以福建省2個地區的普通人群為研究對象,分析RHF與心血管危險因素之間的關系,旨在探討RHF與baPWV之間的相關性,為心血管疾病的早期預防提供新的思路。
1 對象與方法
1.1對象2011年6月-2012年1月,采取分階段整群抽樣法在福建省寧德市和武夷山市進行普通人群篩查,共納入eGFR≥60 mL/min/1.73 m2的受檢者6 291例,男性2 911例,女性3 380例,年齡(52.8±9.0)歲(42~61歲)。排除條件:(1)eGFR<60 mL/min/1.73 m2或尿蛋白肌酐比值≥30 mg/g;(2)既往有腎臟病史。
1.2方法
1.2.1分組將受檢者分為RHF組和非RHF組,其中RHF組定義為糾正年齡、體質量指數(body mass index, BMI)、性別、血管緊張素轉換酶抑制劑(angiotensin-converting enzyme inhibitors, ACEI)或血管緊張素受體拮抗劑(angiotensin Ⅱ receptor blocker, ARB)藥物的使用等因素后,eGFR在整個人群95百分位數以上的人群[1]。2組的例數、年齡、性別分布及eGFR等基本資料見表1。與非RHF組比較,RHF組的年齡、BMI、平均動脈壓、高密度脂蛋白(high-density lipoprotein, HDL-C)、baPWV以及男性、吸煙的比例均顯著升高,而體力活動(定義為每周至少5 d,每次持續>10 min中等強度以上的體力活動)、低密度脂蛋白(low-density lipoprotein, LDL-C)、膽固醇(cholesterol, CHOL)及甘油三酯(triglyceride, TG)均較低,2組空腹血糖差別則無統計學意義。另外,再根據eGFR值將6 291例受檢者分為3組,即60~90,90~110和≥110 mL/min/1.73 m2組。
1.2.2收集資料采用調查問卷的形式,收集內容包括年齡、性別、體質量、身高、飲酒、吸煙以及體力活動情況。吸煙定義為在過去6月曾經吸煙;飲酒定義為在過去6月曾經飲酒。受檢者常規禁食、禁飲12 h后留取標本。采用全自動生化儀(美國Beckman公司)檢測血糖、血肌酐、血脂;采用全自動動脈粥樣硬化檢測儀(VP1000,日本Colin公司)測定baPWV。受檢者取仰臥位,靜息5 min后,分別于雙側上臂、腳踝處各綁一血壓袖帶,胸骨左緣第4肋間處放置心音采集裝置,啟動baPWV測定裝置,輸入身高、體質量,記錄5 min的動脈脈搏波形,儀器自動分析測量baPWV值。取樣時間為10 s,同時進行自動增益分析,整個過程均進行嚴格質控,檢查者均經過規范的培訓。baPWV正常參考值為≤1 400 cm/s;根據GFR-EPI公式估算eGFR值[4]。
表1非RHF組與RHF組人群的基本資料
Tab 1Clinical characteristics among hyperfilterers and normofilterers

指 標非RHF組RHF組n5978313年齡/歲52.4±8.954.4±7.3☆男性/%45.070.3☆BMI/kg·m-224.2±3.225.3±3.8☆吸煙史/%26.441.4☆飲酒史/%49.060.6☆體力活動/%9.65.4☆收縮壓/mmHg134.7±19.3139.6±20.2☆舒張壓/mmHg78.9±10.780.4±11.5☆平均動脈壓/mmHg97.3±13.1100.1±13.0☆c空腹血糖/mmol·L-15.9±1.45.9±1.3c血肌酐/μmol·L-161.2±10.463.9±10.8☆cHDL-c/mmol·L-11.4±0.31.3±0.4☆cLDL-c/mmol·L-13.0±0.82.7±0.8☆cCHOL/mmol·L-15.2±1.04.6±1.2☆cTG/mmol·L-11.7±1.31.5±1.4☆baPWV/cm·s-11531.0±357.81613.8±379.7☆eGFR(mL/min/1.73m2)94.7±11.6108.4±7.4☆
1 mmHg=133.3 Pa.RHF:腎臟高濾過; HDL-C:高密度脂蛋白; LDL-C:低密度脂蛋白; CHOL:膽固醇; TG:甘油三酯; baPWV:肱動脈-踝動脈脈搏波傳導速度; eGFR:估算腎小球濾過率.與非RHF組比較,☆:P<0.05.

2 結 果
2.1不同eGFR組baPWV異常(≥1 400cm/s)的OR與eGFR為90~110mL/min/1.73m2組比較,模型二中eGFR≥110mL/min/1.73m2組baPWV值≥1 400cm/s的OR和95%CI分別為1.436,1.114~1.851(P=0.005),與異常baPWV存在顯著的相關性(表2)。

表2 不同腎小球濾過率組與baPWV異常的相關性
eGFR:估算腎小球濾過率.使用多元Logistic回歸分析,校正年齡、性別、體質量指數(模型一);在模型一的基礎上校正年齡、體質量指數、性別、空腹血糖、高密度脂蛋白、低密度脂蛋白、甘油三酯、膽固醇、平均動脈壓、體力活動、吸煙、飲酒等因素(模型二).
2.2RHF組baPWV多元線性回歸分析模型一在校正了性別和BMI因素后,eGFR 與baPWV值呈線性相關,相關系數β和95%CI分別為8.276,0.377~16.157(P<0.05),而模型二在模型一的基礎上校正了HDL-C、LDL-C、CHOL、TG、吸煙、飲酒等因素后,eGFR與baPWV仍顯著正相關,其相關系數β和95%CI分別為9.291,3.259~15.322(P=0.003)。此外,與baPWV值呈線性正相關的因素還包括年齡、空腹血糖和平均動脈壓,而體力活動與baPWV顯著負相關(表3)。
3 討 論
心血管并發癥是CKD的重要并發癥及主要死亡原因,已有研究表明,PWV與慢性腎臟病GFR減退有密切關系,近年來RHF狀態在慢性腎臟病進展中的重要作用逐漸為人們所認識。本研究以福建省2個地區的的普通人群為研究對象,研究RHF與動脈硬化之間的關系,結果顯示,RHF與baPWV異常存在顯著的相關性,與eGFR正常人群比較,RHF組人群baPWV值隨eGFR水平升高而顯著升高,且這種相關性是獨立于血糖、血壓、BMI、血脂水平、吸煙、飲酒和體力活動等因素而存在的。
表3RHF組中eGFR與baPWV多元線性回歸分析
Tab 3Linear regression coefficients (95%CI) describing the association between baPWV (cm/s) and eGFR among RHF group
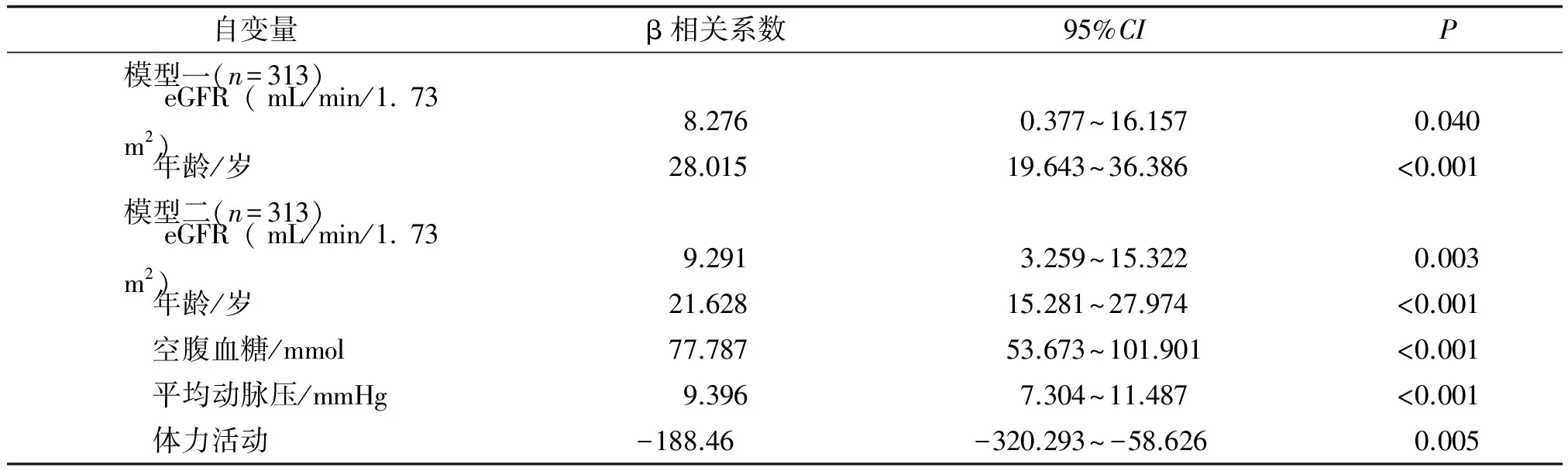
自變量β相關系數95%CIP模型一(n=313) eGFR(mL/min/1.73m2)8.2760.377~16.1570.040 年齡/歲28.01519.643~36.386<0.001模型二(n=313) eGFR(mL/min/1.73m2)9.2913.259~15.3220.003 年齡/歲21.62815.281~27.974<0.001 空腹血糖/mmol77.78753.673~101.901<0.001 平均動脈壓/mmHg9.3967.304~11.487<0.001 體力活動-188.46-320.293~-58.6260.005
1 mmHg=133.3 Pa.eGFR:估算腎小球濾過率.模型一:校正性別、體質量指數;模型二:在模型一的基礎上校正高密度脂蛋白、低密度脂蛋白、甘油三酯、膽固醇、吸煙、飲酒等因素.
越來越多的研究表明,RHF是糖尿病前期和高血壓前期腎臟功能受損的早期標志,與蛋白尿的發生及eGFR短期內快速下降均有著密切關系[5-6]。RHF被認為是代謝綜合征一個新的危險因素[7],與心血管疾病的死亡率和全因死亡率緊密相關[2]。RHF也是原發性高血壓病心臟靶器官損害的早期敏感指標,預示左心室肥厚的發生[8]。此外,eGFR升高與冠狀動脈鈣化、冠狀動脈斑塊面積的大小也存在相關性,是冠狀動脈粥樣硬化性心臟病發展的危險因素[9-10]。因此,RHF與心血管并發癥高危因素緊密相關,可能預示了心血管并發癥的發生、發展和預后。baPWV值反應動脈硬化程度及血管順應性,被公認是評價動脈硬化的經典指標。CKD時動脈僵直使腎臟內微循環功能改變,最終導致eGFR下降[11]。然而,RHF狀態與PWV異常、動脈僵直度的相關性還不十分清楚。Cherney等對1型糖尿病患者是研究提示,早期糖尿病RHF時血管內皮功能已發生改變[12-13]。但上述研究樣本量小,有一定的局限性。本研究探討eGFR≥60 mL/min/1.73 m2普通人群RHF與早期動脈硬化的關系,進一步糾正了血糖、吸煙、血脂、血壓、肥胖等可能引起動脈粥樣硬化的危險因素,結果顯示,與eGFR正常組相比,RHF組baPWV值顯著升高,與前述研究結果一致,提示RHF可能是動脈粥樣硬化的重要危險因素。
RHF狀態與動脈粥樣硬化的相關機制還不十分清楚,有學者認為,早期或臨床前期心臟和腎臟損害可能與微循環系統、冠狀動脈血流、腎臟血流動力學三者的相互作用關系密切,而RHF時炎癥狀態、氧化應激、交感神經興奮、腎素-血管緊張素系統激活和內皮功能損傷可能是發生動脈粥樣硬化的共同機制[14],上述機制共同作用促使冠狀動脈粥樣硬化性心臟病的發生和發展,同時也影響腎臟病的進展。
本研究的優勢是研究的樣本量大,糾正了可能引起PWV升高、動脈粥樣硬化的多種危險因素。然而也存在一定的局限性:(1)利用eGFR值來進行統計可能產生一定的偏差。由于eGFR受年齡、性別等因素影響,國際上尚無RHF狀態的統一定義,因此筆者用糾正年齡、BMI、性別、ACEI/ARB等藥物的使用等因素后eGFR在整個人群95百分位數以上的人群來定義RHF[1,15]。(2)橫斷面分析無法確定RHF和動脈硬化之間的因果關系,因此需要進一步隨訪研究RHF與動脈粥樣硬化之間的關系。(3)本研究糾正了引起動脈粥樣硬化及RHF狀態的多種因素,然而其他因素如飲食等的影響有待于進一步研究。(4)此外,肌肉萎縮也是影響肌酐測定值的重要因素,可能導致eGFR值偏高,因此測定受檢者肌肉質量可能進一步明確RHF和動脈硬化之間的相關性。
盡管存在一定的局限性,本研究仍提示RHF與baPWV值的異常密切相關,在CKD的早期腎功能損傷出現前,RHF已經存在動脈硬化的危險因素,因此對RHF狀態的早期干預可能對預防和治療心血管并發癥有深遠意義。
[1]Park M, Yoon E, Lim Y H,etal. Renal hyperfiltration as a novel marker of all-cause mortality[J].JAmSocNephrol, 2015,26(6):1426-1433.
[2]Matshusita K, van der Velde M, Astor B C,etal. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis[J].Lancet. 2010,375(9731):2073-2081.
[3]Cohn J N. Arterial stiffness, vascular disease, and risk of cardiovascular events[J].Circulation, 2006,113(5):601-603.
[4]Levey A S, Stevens L A, Schmid C H,etal. A new equation to estimate glomerular filtration rate[J].AnnInternMed, 2009,150(9):604-612.
[5]Palatini P. Glomerular hyperfiltration: a marker of early renal damage in pre-diabetes and pre-hypertension[J].NephrolDialTransplant, 2012,27(5):1708-1714.
[6]Bjornstad P, Cherney D Z, Snell-Bergeon J K,etal. Rapid GFR decline is associated with renal hyperfiltration and impaired GFR in adults with type 1 diabetes[J].NephrolDialTransplant, 2015,30(10):1706-1711.
[7]Tomaszewski M, Charchar F J, Maric C,etal. Glomerular hyperfiltration: a new marker of metabolic risk[J].KidneyInt, 2007,71(8):816-821.
[8]Schmieder R E, Messerli F H, Garavaglia G,etal. Glomerular hyperfiltration indicates early target organ damage in essential hypertension[J].JAMA, 1990,264(21):2775-2780.
[9]Choi H M, Hyun Y Y, Lee K B,etal. High estimated glomerular filtration rate is associated with coronary artery calcification in middle-aged Korean men without chronic kidney disease[J].NephrolDialTransplant, 2015,30(6):996-1001.
[10]Eriksen B O, Lochen M L, Arntzen K A,etal. Subclinical cardiovascular disease is associated with a high glomerular filtration rate in the nondiabetic general population[J].KidneyInt, 2014,86(1):146-153.
[11]Smith A, Karalliedde J, De Angelis L,etal. Aortic pulse wave velocity and albuminuria in patients with type 2 diabetes[J].JAmSocNephrol, 2005,16(4):1069-1075.
[12]Cherney D Z, Miller J A, Scholey J W,etal. Renal hyperfiltration is a determinant of endothelial function responses to cyclooxygenase 2 inhibition in type 1 diabetes[J].DiabetesCare, 2010,33(6):1344-1346.
[13]Cherney D Z, Sochett E B. Evolution of renal hyperfiltration and arterial stiffness from adolescence into early adulthood in type 1 diabetes[J].DiabetesCare, 2011,34(8):1821-1826.
[14]Tsioufis C, Tsiachris D, Kasiakogias A,etal. Preclinical cardiorenal interrelationships in essential hypertension[J].CardiorenalMed, 2013,3(1):38-47.
[15]Melsom T, Mathisen U D, Ingebretsen O C, et al. Impaired fasting glucose is associated with renal hyperfiltration in the general population[J].DiabetesCare, 2011,34(7):1546-1551.
(編輯:何佳鳳)
Association between Renal Hyperfiltration and Arterial Stiffness
LIN Miao1, WEN Junping2, HUANG Huibin2, LIANG Jixing2, LI Liantao2, LIN Lixiang2, CHEN Gang2
1. Department of Nephrology; 2. Department of Endocrinology,Fujian Provincial Hospital, Provincial Clinic College of Fujian Medical University, Fuzhou 350001,China
ObjectiveTo investigate the association between renal hyperfiltration (RHF) and the risk of arterial stiffness.MethodsThis study was conducted in Ningde and Wuyishan of Fujian Province.A total of 6 291 participants with estimated glomerular filtration rate (eGFR) more than 60ml/min/1.73 m2were included in this study.RHF was defined as eGFR >95th percentile of the whole population adjusted for age, sex, BMI, and the use of Angiotensin-converting enzyme inhibitors or Angiotensin Ⅱ receptor blockers.Participants were divided into 3 groups based on eGFR values: 60~90,90~110,≥110 mL/min/1.73 m2.Multiple logistic regression and multivariable linear regression were used to analyze the association between RHF and Brachial-ankle pulse wave velocity (baPWV)values after adjustment for potential confounders, such as age, body mass index, smoking status, alcohol consumption, physical activity, fasting glucose, and mean arterial pressure.ResultsCompared to the participants with normal renal-filtration those with eGFR≥110 mL/min/1.73 m2, had an increased risk for baPWV abnormality (≥1 400 cm/s), theOR(fully adjusted odd ratio) was 1.436, while 95%CIwas 1.114~1.851(P=0.005).Among the participants with RHF, increased eGFR was associated with higher baPWV value (β coefficients 9.291,3.259~15.322,P=0.003).ConclusionRHF is associated with an increased risk of arterial stiffnessafter adjustment for a variety of confounding or explanatory variables.
nephrosis; kidney glomerulus; glomerular filtration rate; pulse; neural conduction; arteriosclerosis
2016-04-11
福建省自然科學基金(2014J05083)
福建醫科大學 省立臨床醫學院,福建省立醫院,福州 3500011. 腎內科;2. 內分泌科
林苗(1978-),女,主治醫師,醫學博士
陳剛. Email: chengangfj@163.com
R692.6; R338.11
A
1672-4194(2016)05-0302-04

