HER2 ECD和CA15-3聯合檢測對乳腺癌復發轉移的診斷價值
朱娟娟,胡志軍,沈國棟,周東升,汪亞勤,唐吉斌
HER2 ECD和CA15-3聯合檢測對乳腺癌復發轉移的診斷價值
朱娟娟1,胡志軍1,沈國棟2,周東升1,汪亞勤1,唐吉斌1
選取86例乳腺癌術后病例(復發轉移34例,未復發轉移52例),ELISA法檢測血清HER2胞外段(HER2 ECD)濃度,化學發光免疫分析法檢測糖類抗原15-3(CA15-3)濃度。復發轉移組患者血清中HER2 ECD與CA15-3濃度顯著高于未復發轉移組,二者聯合檢測可提高對乳腺癌復發轉移診斷的靈敏度和特異度,血中HER2 ECD的陽性率與患者組織學分級、淋巴結轉移情況及組織HER2狀態相關,CA15-3陽性率與組織學分級、淋巴結轉移有關。
HER2 ECD;乳腺癌;復發轉移;CA15-3;聯合檢測
HER2屬于受體酪氨酸激酶中的生長因子受體家族,其過表達對乳腺癌是一個獨立的預后因子,提示預后差,容易復發和轉移,目前主要通過免疫組織化學法(immunohistochemistry,IHC)和熒光原位雜交法(fluorescence in situ hybridization,FISH)對組織進行檢測。近年來研究[1]表明,HER2胞外段即HER2 ECD可以從細胞表面切割進入血中循環,可導致與細胞膜關聯的胞內區(p95蛋白)持續活化和下游MAPK及PI3K通路的增強,使細胞增殖失控更具侵襲性。加上其采集方便、可進行準確的定量檢測等優勢,外周血中HER2 ECD檢測越來越得到人們的重視,有望成為IHC和FISH等檢測的有效補充手段[2]。糖類抗原15-3(carbohydrate antigen 15-3,CA15-3)是目前最常用的判斷乳腺癌預后及復發的獨立性因子。該研究通過檢測外周血血清中HER2 ECD與CA15-3在乳腺癌不同發展階段的濃度水平來探討其診斷價值,以期為臨床工作提供理論依據。
1 材料與方法
1.1 病例資料 研究對象為2013年1月~2014年7月在銅陵市人民醫院術后進行放化療治療的病歷資料完整的86例乳腺癌患者,女85例,男1例;年齡31~67歲,中位年齡51歲;浸潤性導管癌82例,大汗腺樣癌、導管原位癌、浸潤性小葉癌、黏液癌各1例。86例患者中34例發生復發轉移,52例未發生復發轉移。
1.2 標本采集 住院患者早晨空腹采集靜脈血3 ml,靜置20 min,3 000 r/min離心10 min,取血清至于潔凈EP管中,于-80℃冰箱凍存備用。
1.3 檢測方法 HER2 ECD采用 ELISA法檢測,試劑盒由美國eBioscience公司提供,所有操作按說明書和實驗操作規程進行。反應結束后于450 nm波長依序測量各孔的吸光度(optical density,OD)值,以標準品濃度和OD值繪制標準曲線,根據標準曲線即可計算樣本的濃度。CA15-3檢測采用全自動化學發光免疫分析儀(ARCHITECT i2000)和配套試劑進行檢測,HER2 ECD以2003年美國FDA規定的15 g/L為臨界值,CA15-3以銅陵市人民醫院檢驗科采用的31.3 U/L為臨界值,高于臨界值即為陽性。
1.4 統計學處理 數據均采用SPSS 19.0軟件進行統計分析。計數資料以例數或百分比表示,組間資料比較采用 χ2檢驗,計量資料比較用非參數Mann-Whitney檢驗,相關性分析用Spearman檢驗,采用受試者工作特征曲線(ROC曲線)對實驗數據進行分析與評價。
2 結果
2.1 乳腺癌復發轉移組和未復發轉移組HER2 ECD及CA15-3濃度的比較 復發轉移組中的HER2 ECD及CA15-3的濃度均顯著高于未復發轉移組,差異有統計學意義(P<0.05),見表1。
2.2 相關性分析 乳腺癌復發轉移組中HER2 ECD與CA15-3的濃度呈正相關性(rs=0.681,P<0.05)。
2.3 HER2 ECD、CA15-3對乳腺癌復發轉移的診斷價值 應用ROC曲線分析實驗所得數據(圖1)。HER2 ECD和CA15-3的曲線下面積(AUC)分別為0.850和0.900,對乳腺癌的復發轉移具有中等診斷價值。以15 g/L為臨界值時,HER2 ECD對乳腺癌轉移復發診斷的靈敏度為 58.8%,特異度為98.1%,符合率為82.6%。以31.3 U/L為臨界值時,CA15-3的靈敏度為73.5%,特異度為98.1%,符合率為96.2%。將二者聯合分析,結果顯示并聯檢測對乳腺癌轉移復發的靈敏度為94.1%,特異度為96.2%,符合率為83.7%,串聯檢測對乳腺癌轉移復發的靈敏度為38.2%,特異度為100.0%,符合率為77.6%。見表2。
2.4 乳腺癌患者血清中HER2 ECD、CA15-3陽性率與患者臨床特征關系 HER2 ECD和CA15-3的陽性率在不同年齡人群中分布差異無統計學意義。在不同組織學分級以及淋巴結轉移狀態患者中HER2 ECD和CA15-3的陽性率差異有統計學意義(P<0.05):Ⅲ級的陽性率要明顯高于Ⅰ級和Ⅱ級,有淋巴結轉移的陽性率也明顯高于無淋巴結轉移患者。除此之外,組織HER2陽性患者的HER2 ECD陽性率明顯高于組織HER2陰性的患者,差異有統計學意義(P<0.05),而CA15-3的陽性率在組織HER2陽性組和陰性組之間的差異無統計學意義。見表3。
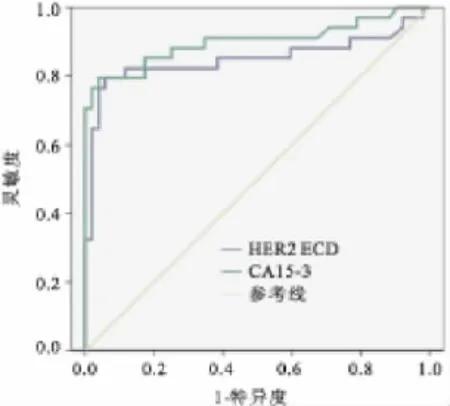
圖1 HER2 ECD和CA15-3的ROC曲線

表1 乳腺癌患者血清中HER2 ECD和CA15-3水平比較[M(P25,P75)]
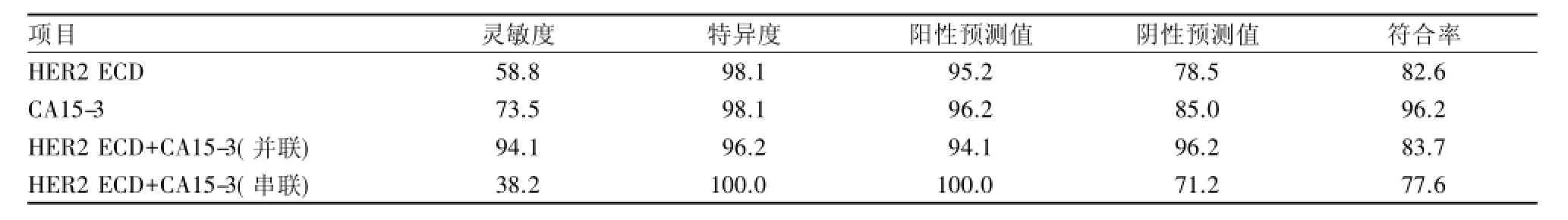
表2 HER2 ECD和CA15-3對乳腺癌復發轉移的診斷價值(%)
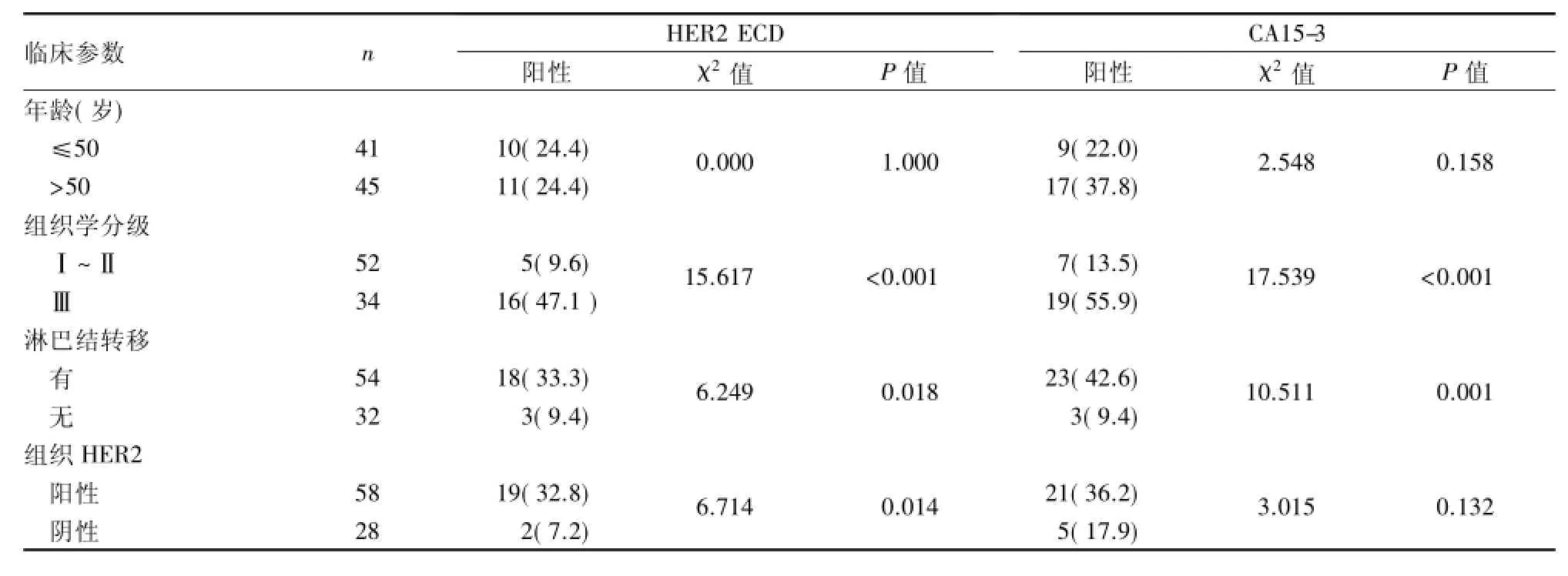
表3 乳腺癌患者HER2 ECD、CA15-3表達情況與患者臨床特征關系[n(%)]
3 討論
乳腺癌是女性最常見的惡性腫瘤之一,目前的治療方法主要以手術為主,而術后監測有無復發轉移對降低死亡率至關重要。外周血中腫瘤指標檢測憑著取材方便、可進行動態監測的優點已在臨床上廣泛應用。
CA15-3是目前公認的用于監測乳腺癌復發轉移的糖類抗原[3],HER2 ECD作為組織HER2蛋白的切割產物不僅反映乳腺癌的腫瘤負荷,還反映腫瘤細胞的生物學活性,已有研究[4-5]顯示升高的HER2 ECD不僅可提示腫瘤的預后復發,還有助于腫瘤的療效判斷[6-7],本研究結果表明HER2 ECD 和CA15-3在復發轉移組中的濃度明顯高于未復發轉移組,并且二者的濃度在復發轉移組中呈正相關性,提示這兩種因子聯合檢測有利于對乳腺癌復發轉移的診斷。研究還用了ROC曲線分析兩種因子對乳腺癌復發轉移的診斷價值,顯示HER2 ECD和CA15-3的AUC分別為0.850和0.900,具有中等診斷價值。本研究并未采用尤登指數(靈敏度+特異度-1)最大時的臨界值,而是采取在臨床接受程度更為廣泛的15 g/L和31.3 U/L作為HER2 ECD和CA15-3的臨界值,結果顯示單獨分析時HER2 ECD的靈敏度稍高于CA15-3,二者特異度相同,與文獻[5]報道略有偏差,可能與樣本數量以及是否限定組織HER2狀態等因素有關。但是二者并聯檢測時可提高診斷的靈敏度,串聯檢測時可提高診斷的特異度,符合文獻[8-9]報道。
本研究還顯示HER2 ECD的陽性率與年齡無關,與組織學分級和淋巴結轉移有關,與文獻[10-11]報道一致。HER2 ECD水平與組織HER2表達之間的相關性尚存有爭議[12-13],其原因可能與樣本來源、數量以及閾值界定不同有關[14],本研究的對象是乳腺癌術后患者,排除了腫瘤負荷的影響,但仍可看出HER2 ECD的陽性率在組織HER2陽性組中明顯高于HER2陰性組,提示HER2 ECD水平的升高對判斷組織HER2陽性的患者術后復發轉移具有重要的臨床意義[2],本研究中有2例組織HER2陰性的患者血中HER2 ECD為陽性,可能與技術誤差及腫瘤細胞的生物學轉變有關。CA15-3在臨床已得到廣泛應用,其水平變化與其局部淋巴結及遠處轉移情況之間存在一致性,尤其是有遠處轉移灶者,本研究顯示CA15-3的陽性率與淋巴結轉移相關和組織學分級相關,而與年齡、組織HER2狀態無關。
綜上所述,HER2 ECD、CA15-3與乳腺癌的病程進展相關,其檢測具有連續性、實時性和方便性的優點,可對腫瘤進行動態監測,二者聯合檢測可為乳腺癌的臨床診斷和治療提供思路和理論指導。
[1] Tse C,Gauchez A S,Jacot W,et al.HER2 shedding and serum HER2 extracellular domain:biology and clinical utility in breast cancer[J].Cancer Treat Rev,2012,38(2):133-42.
[2] 杜 萌,王 濤,江澤飛.乳腺癌患者血清人表皮生長因子受體2胞外域檢測的臨床研究現狀[J].中華乳腺病雜志(電子版),2011,5(5):593-600.
[3] 羅宏濤,魏世鴻,王小虎,等.聯合檢測CA153和CEA在乳腺癌復發轉移監測中的臨床價值[J].甘肅醫藥,2014,33 (10):728-30.
[4] Shao X,Wang X,Xu X,et al.Outcome prediction values of soluble human epidermal growth factor receptor-2 extracellular domain in metastatic breast cancer[J].Int J Clin Exp Pathol,2014,7 (3):1108-13.
[5] Ha J H,Seong M K,Kim E K,et al.Serial serum HER2 measurements for the detection of breast cancer recurrence in HER2-positive patients[J].J Breast Cancer,2014,17(1):33-9.
[6] Kontani K,Kuroda N,Hashimoto S,et al.Clinical usefulness of human epidermal growth factor receptor-2 extracellular domain as a biomarker for monitoring cancer status and predicting the therapeutic efficacy in breast cancer[J].Cancer Biol Ther,2013,14(1):20-8.
[7] Witzel I,Loibl S,von M G,et al.Predictive value of HER2 serum levels in patients treated with lapatinib or trastuzumab-a translational project in the neoadjuvant GeparQuinto trial[J].Br J Cancer,2012,107(6):956-60.
[8] 袁杰清,束 軍,王丹平,等.TXNIP和CEA聯合檢測對良惡性胸腔積液的診斷價值[J].安徽醫科大學學報,2015,50(3):341-4.
[9] 徐昊平,金冶寧,馬 韜,等.血清HER-2單獨及聯合檢測在乳腺癌隨訪中的意義[J].現代腫瘤醫學,2010,18(5):899-903.
[10]Tan L D,Xu Y Y,Yu Y,et al.Serum HER2 level measured by dot blot:a valid and inexpensive assay for monitoring breast cancer progression[J].PLoS One,2011,6(4):e18764.
[11]Ma L,Yang H Y,Han X H,et al.Relationship between serum HER2 extracellular domain levels,tissue HER2 expression,and clinico-pathological parameters in early stage breast cancer[J]. Chin Med J(Engl),2012,125(22):4104-10.
[12]Lam L,McAndrew N,Yee M,et al.Challenges in the clinical utility of the serum test for HER2 ECD[J].Biochim Biophys Acta,2012,1826(1):199-208.
[13]馬 麗,石遠凱,韓曉紅.乳腺癌患者血清中人類表皮生長因子受體2檢測的臨床意義[J].中華檢驗醫學雜志,2012,35 (2):190-2.
[14]Badzek S,Kelovic V L,Plestina S,et al.Serum HER2/ECD value in stage I and II early breast cancer:need of a lower cut-off?[J].Wien Klin Wochenschr,2011,123(23-24):726-31.
R 466.62
A
1000-1492(2016)09-1378-04
時間:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.068.html
2016-04-14接收
安徽省銅陵市衛生局科技計劃項目(編號:衛科研[2012]05);安徽省科技計劃項目(編號:1301042094)
1安徽醫科大學銅陵臨床學院、銅陵市人民醫院臨床檢驗中心,銅陵 2440022安徽醫科大學附屬省立醫院老年醫學科,合肥 230001
朱娟娟,女,主管檢驗師;唐吉斌,男,副教授,副主任檢驗師,責任作者,E-mail:13705628207@163.com

