植物乳桿菌對食源性病原菌作用的研究
李強坤,柳陳堅,張園蓮,常林杰,羅義勇,李曉然*(昆明理工大學生命科學與技術學院,云南 昆明 650500)
植物乳桿菌對食源性病原菌作用的研究
李強坤,柳陳堅,張園蓮,常林杰,羅義勇,李曉然*
(昆明理工大學生命科學與技術學院,云南 昆明 650500)
通過牛津杯法篩選得到幾株高抑菌活性的植物乳桿菌,使用蛋白酶K和NaOH對這幾株桿菌的發酵液上清進行處理,以大腸桿菌O157:H7和金黃色葡萄球菌為指示菌,發現有機酸為主要抑菌物質,但是調節pH值至6.5后的發酵上清液可以對大腸桿菌有較好的抑菌效果。其中植物乳桿菌QB3-3具有長達96 h的持續抑菌效果。電子顯微鏡觀察顯示,植物乳桿菌抗病原菌的主要機理為破壞細胞結構,導致病原菌菌體形態改變,內容物流出,致使細胞死亡。
植物乳桿菌;有機酸;抑菌
食源性病原菌是指能在攝食過程中引起感染或中毒的一類微生物[1],它廣泛存在于食物、環境以及人和動物腸道內,能引起食物腐敗、食源性腹瀉等一系列衛生問題[2-3]。使用抗生素與化學防腐劑可有效控制與殺滅食源性病原菌,然而,使用諸如苯甲酸(鈉)、丙酸鹽、對羥基苯甲酸酯類、硝酸鹽、山梨酸(鉀)等化學防腐劑不但會造成菌株的耐藥性不斷出現,同時也容易引起人的致畸與致癌等危害[4-5],給人類健康造成嚴重威脅。隨著我國國民經濟的不斷發展,人民生活水平的不斷提高,食品安全受到人們越來越多的關注,食品污染造成的疾病已經成為全球性的公共衛生問題,而食源性病原菌污染是引起食品安全問題的主要原因[6]。生物防腐劑對人體健康造成的危害較小,并且具有對食品營養成分及感官性狀影響較小等優勢[7-9],同時還能減少防腐費用及有效延長產品保質期。此外,生物防腐劑還可避免化學防腐中出現的食物鏈的抗生素耐藥性問題[10]。因此,生物防腐不但受到研究者們的關注與重視,同時也深受普通百姓青睞。
乳酸菌是一類能將碳水化合物(主要指葡萄糖)發酵產生乳酸等有機酸的細菌。因其能產生有機酸、細菌素、環二肽、短鏈脂肪酸等多種抑菌活性物質[11-12],故能有效抑制各類病原菌的生長繁殖,從而達到維持機體微生態平衡,發揮相應的益生功能[13]。乳酸菌是被公認為安全(generally recognized as safe,GRAS)的食品級微生物(food-grade microorganisms)。植物乳桿菌(Lactobacillus plantarum)屬于芽孢桿菌綱乳桿菌屬(Lactobacillus)[14],通常存在于發酵蔬菜與果汁中,同時也發現其存在于傳統發酵乳制品與肉類中,其發酵的食品被公認為功能性食品[15]。植物乳桿菌能通過胃并定殖于腸道,發揮其調節腸道菌群平衡、免疫調節、降低血清膽固醇、降血壓和抗氧化等益生作用[15]。
地處西南低緯度地區的云南省因其多民族的文化背景,造就了獨特的飲食風俗,從而富有多樣的傳統發酵食品資源,如乳餅、豆豉。前期研究表明,在云南傳統發酵豆豉與乳餅中存在大量乳酸菌[16],本實驗從中篩選出3 株對食源性病原菌具有高效抑菌效果的植物乳桿菌,初步探究該乳酸菌的抗食源性致病菌的機理。
1 材料與方法
1.1 材料、試劑與培養基
從云南傳統發酵食品(乳餅、豆豉)分離得到3株具有高效抑菌功能的植物乳桿菌AY01、YM4-3、QB3-3菌株、食源性大腸桿菌O157:H7、金黃色葡萄球菌,保存于昆明理工大學生命科學與技術學院應用微生物實驗室。
瓊脂 BIOSHARP公司;蛋白酶K 德國MERCK公司;其他試劑均為分析純。
MRS培養基(g):蛋白胨10.0、Lab-lemco poweder 8.0、酵母提取物4.0、葡萄糖20.0、磷酸氫二鉀2.0、醋酸鈉5.0、檸檬酸三銨2.0、七水硫酸鎂0.2、四水硫酸錳0.05、Tween-80 1 mL。加蒸餾水定容至1 L,121 ℃滅菌15 min,冷卻后4 ℃保存備用。
腦心浸液肉湯(brian heart infusion,BHI)培養基(g):蛋白胨 10.0、牛肉浸粉3.0、氯化鈉5.0、葡萄糖1.0,調pH值至7.4±0.1(25 ℃),加蒸餾水定容至1 L,121 ℃滅菌15 min,冷卻后4 ℃保存備用。
肉湯(LB)培養基(g):蛋白胨 10.0、酵母粉 5.0、氯化鈉 5.0、葡萄糖1.0,調pH值至7.1±0.1(25 ℃),加蒸餾水定容至1 L,121 ℃滅菌15 min,冷卻后4 ℃保存備用。
1.2 儀器與設備
ZHWY-200D恒溫培養振蕩器 中國上海智城公司;ABI 7200 PCR儀 美國Applied Biosystems公司;UV-4802H紫外-可見分光光度計 尤尼柯(上海)儀器有限公司;電鏡、FD-5-12真空冷凍干燥機 美國SIM公司;SX-500高壓滅菌鍋 日本TOMY公司;K3-18高速離心機 德國Sartorius公司;DYCP-31DN電泳儀美國BIO-RAD公司;SYIGLHR/1206凝膠成像系統英國Ingenius公司;BX-51研究級生物顯微鏡 日本Olympus公司;GHP-9160恒溫培養箱 中國恒科學儀器有限公司。
1.3 方法
1.3.1 植物乳桿菌DNA的分離純化
將冷凍保存的菌株解凍后按體積分數4‰接種量接種至MRS肉湯培養基中,35 ℃靜置培養24 h,吸取1.5 mL菌液置于1.5 mL離心管中,4 ℃、8 000 r/min離心10 min,棄去上清。然后加入567 μL TE緩沖液、3 μL蛋白酶K(20 mg/mL)、30 μL 10%十二烷基硫酸鈉(sodium dodecyl sulfate, sodium salt,SDS),充分混勻后,置于37 ℃金屬浴孵育1 h。孵育結束后,加入80 μL十六烷基三甲基溴化銨(hexadecyl trimethyl ammonium bromide,CTAB)裂解液與100 μL 5 mol/L NaCl溶液,充分混勻后放入60 ℃金屬浴孵育15 min。隨后加入780 μL Tris-飽和酚充分振蕩混勻,4 ℃、15 000 r/min離心10 min,取上清液,加入與上清液等體積的氯仿-異戊醇(24∶1,V/V),充分振蕩混勻,4℃、15 000 r/min離心10 min后取上清液,加入0.6倍上清液體積的冷異丙醇,充分混勻后靜置于-80 ℃條件下3 h。隨后取出低溫解凍,4 ℃、18 000 r/min離心15 min,棄去上清液,收集DNA沉淀,加入500 μL 70%的乙醇洗液洗脫2 次,4 ℃、18 000 r/min離心15 min后棄去上清液,置于室溫使DNA沉淀充分干燥后,加入40 μL TE緩沖液。取5 μL DNA提取液與Loading Buffer混合進行1%瓊脂糖凝膠電泳以檢測基因組DNA,并選擇檢測到基因組DNA條帶的樣品,-80 ℃冷凍保存備用。
1.3.2 dnaK基因的PCR擴增反應及序列分析
采用細菌dnaK基因通用引物,用所提取的基因組DNA為模板進行擴增。dnaK通用引物核苷酸序列為:Lpdnak-500F3(5’-CCGTTCTTRTCRATRTCRAA-3’);Lpdnak-1710R5(5’-GAAAYYCAAGTYGGHGAAGT-3’)。用聚合酶鏈式反應(polymerase chain reaction,PCR)試劑盒進行擴增,PCR擴增反應程序為:94 ℃預變性5 min;94 ℃變性1 min,58 ℃退火1 min,72 ℃延伸1.5 min,35 個循環;72 ℃延伸7 min。PCR反應完成后,將擴增產物經1 g/mL瓊脂糖凝膠電泳檢測,電泳后將凝膠浸泡于含有20 μg/mL EB的TAE緩沖液中10 min,之后于紫外燈216 nm波長下照射,觀察條帶是否呈現橙色。將PCR產物純化后,由上海生工生物工程股份有限公司進行核苷酸序列分析,提交至美國國家生物技術信息中心(National Center for Biotechnology Information,NCBI),用BLAST分析工具(http://www.ncbi.nlm.nih. gov/BLAST)將核苷酸序列與GenBank中已知核苷酸序列進行同源性對比。若被檢菌株與參考菌株核苷酸序列同源性大于97%,將被認為是同一個菌種。最后用MEGA6.05軟件的Neighbor-Joining法進行比對分析和建立系統發育樹,Bootstrap重復1 000 次。
1.3.3 植物乳桿菌發酵上清液的制備
解凍保存的植物乳桿菌AY01、YM4-3、QB3-3,將濃度為1×109CFU/mL的植物乳桿菌菌液按體積分數4‰的接種量分別接種至滅菌的MRS肉湯培養基中,37 ℃恒溫靜止培養24 h后,再將其按體積分數4‰的接種量接種至300 mL錐形瓶中擴大培養72 h,隨后4 ℃、12 000 r/min離心10 min后吸取上清液,分別將各菌株150 mL培養上清液分成3 等份,每種菌的3等份發酵上清液分別進行以下處理:1 份加入50 mg的蛋白酶K,終質量濃度為1 mg/mL,45 ℃水浴3 h;1 份加入NaOH溶液調pH值至6.5;1 份不做任何處理。將經上述處理的上清液用真空冷凍干燥法進行濃縮,濃縮后用0.9%生理鹽水將粉末溶解為終質量濃度為0.5 mg/mL的溶液,最后用0.22 μm濾膜過濾除菌后,備用。
1.3.4 病原指示菌的制備
將-80 ℃冷凍保存的大腸桿菌O157:H7、金黃色葡萄球菌取出并迅速解凍,按體積分數4‰的接種量分別將其接種至5 mL LB液體培養基和BHI液體培養基,37 ℃,150 r/min振蕩培養15 h,同時控制光密度值(optical density,OD)在0.2~0.8范圍內。將培養好的菌液稀釋后進行平板計數。大腸桿菌的菌落濃度為1.95×109CFU/mL,金黃色葡萄球菌的菌落濃度為2.83×109CFU/mL,再將活化好的病原菌菌液進行梯度稀釋,用于抑菌實驗。
采用牛津杯法進行抑菌實驗,在底層平板中倒入10 mL 2%普通瓊脂培養基,待其凝固后,按等邊三角形放置3 個牛津杯。待上層培養基(大腸桿菌為LB瓊脂培養基,金黃色葡萄球菌為BHI瓊脂培養基)冷卻至50 ℃左右時,取20 μL病原指示菌稀釋液倒入25 mL 1%的上層瓊脂培養基中,使大腸桿菌的終菌落總數為1.56×105CFU/mL,金黃色葡萄球菌的終菌落總數為2.26×105CFU/mL,搖勻后倒板。上層培養基凝固后取出牛津杯,在3 個孔中分別加入50、100、150 μL的抑菌物質(即植物乳桿菌發酵上清液),再用0.9%生理鹽水定容至每孔150 μL,置于4 ℃直至抑菌液體完全擴散至瓊脂培養基中,再置于37 ℃培養16 h,觀察并測定抑菌圈的直徑,每個實驗做3 組平行。
病原指示菌敏感度的判定標準:抑菌圈直徑>20 mm為極度敏感;抑菌圈直徑15~20 mm為高度敏感;抑菌圈直徑l0~15 mm為中度敏感;抑菌圈直徑<10 mm為低度敏感;無抑菌圈為不敏感[17]。
1.3.5 植物乳桿菌QB3-3菌株抑菌效果的實時監測
將50 μL活化的大腸桿菌O157:H7、金黃色葡萄球菌菌液添加至450 μL生理鹽水中,吸取20 μL病原菌稀釋液添加至5 mL相應的液體培養基中,分別向病原菌液體培養基中添加200、400、600 μL植物乳桿菌QB3-3發酵上清液,另外,將未添加任何抑菌溶液的病原菌菌液做為空白對照,在150 r/min,37 ℃的條件下振蕩培養,前12h每隔1 h測定其在600nm波長處的OD值,之后每隔12 h測一次。
1.3.6 植物乳桿菌產生的抑菌物質對指示菌抑菌作用的電子顯微鏡觀察
吸取200 μL植物乳桿菌QB3-3菌株發酵上清液至經過培養3 h且初始大腸桿菌濃度為1×109CFU/mL、5 mL的LB液體培養基中,于37 ℃、200 r/min振蕩培養15 h;將200 μL 0.9%生理鹽水添加至相同條件的LB液體培養基中作為陰性對照。培養結束后,4 ℃,3 000 r/min離心10 min取沉淀,用0.75%生理鹽水洗脫菌體2 次,用1.5 mL固定液將菌體固定。用掃描電鏡與透射電鏡觀察病原菌形態變化,探討植物乳桿菌源抑菌物質的抑菌機理。
采用同樣方法分析植物乳桿菌產生的抑菌物質對金黃色葡萄球菌的抑菌機理。
2 結果與分析
2.1 3 株植物乳桿菌亞種的鑒定
植物乳桿菌群包括Lb. paraplantarum、Lb. pentosus 2個種和Lb. plantarum ssp. plantarum、Lb. plantarum ssp. argentoratensis 2 個亞種,由于16S rRNA基因同源性較高,不能將植物乳桿菌鑒定到種或亞種的水平,而乳酸菌含有的編碼適應酸環境的伴侶蛋白DnaK的dnaK基因常用于亞種的鑒定[18]。通過對植物乳桿菌AY01、YM4-3、QB3-3的dnaK基因的核苷酸序列進行分析和同源性比對發現,從云南省石林縣傳統發酵乳餅的發酵酸水中分離得到的植物乳桿菌AY01菌株屬于Lb. paraplantarum(序列同源性為99%),而分別從云南省丘北縣與易門縣傳統發酵豆豉分離得到的菌株QB3-3與YM4-3和Lb. plantarum與Lb. plantarum ssp. plantarum的同源性均高于99%,比對結果見圖1。由此可以將這2 株植物乳桿菌鑒定為植物乳桿菌植物乳桿亞種。
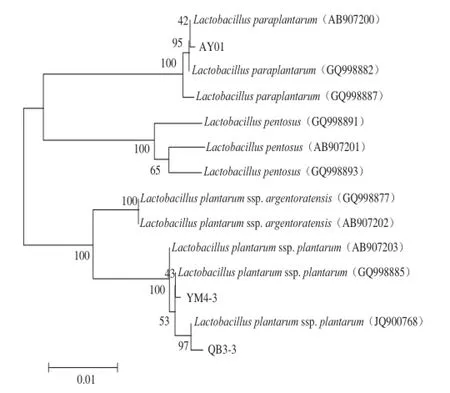
圖1 dnaKdnaK基因序列比對的植物乳桿菌亞種的系統進化樹Fig. 1 Phylogenetic tree for L. plantarum subspecies based on dnaK gene sequence alignment
2.2 植物乳桿菌發酵上清液的抑菌活性
3 株植物乳桿菌的抑菌實驗表明,發酵上清原液與經蛋白酶K處理上清液對2 株病原菌均有抑菌作用(表1),對大腸桿菌的抑菌效果明顯優于金黃色葡萄球菌。經NaOH調節pH值為6.5后,除添加高劑量(150 μL)植物乳桿菌YM4-3時,對金黃色葡萄球菌呈現微弱抑菌活性外,其余2 株植物乳桿菌對上述2 株食源性致病菌均未呈現抑菌效果。綜合分析抑菌效果,植物乳桿菌QB3-3抑菌效果最好,其次是植物乳桿菌YM4-3。3 株植物乳桿菌的發酵上清液均顯示較佳的抑菌效果,但對2 株病原菌產生抑菌效果所需的發酵上清液體積不同,100 μL的培養上清液即對大腸桿菌產生較好的抑菌效果,而150 μL的培養上清液才對金黃色葡萄球菌產生較好的抑菌效果。

表1 植物乳桿菌發酵上清液對食源性病原菌的抑菌效果Table 1 Antimicrobial effect ofL. plantaarruumm against foodborne pathogennss
植物乳桿菌的抑菌物質主要分為蛋白類和非蛋白類物質,蛋白類抑菌物質主要為細菌素,是一種核糖體合成的抗菌肽,這些化合物可以作為安全的天然食品生物防腐劑[19]。但細菌素并不是這3 株植物乳桿菌的主要抑菌物質[20-21]。乳酸菌產生的非蛋白類物質主要為有機酸,大多數乳酸菌發酵碳水化合物生成乳酸、乙酸和蘋果酸等有機酸,使環境pH值降低,抑制病原菌的生長,同時確保自身生長繁殖不受影響[22]。植物乳桿菌的抑菌效果主要依賴其代謝產物,其中,有機酸就是其中的主要抑菌物質。
2.3 植物乳桿菌QB3-3抑菌效果的實時監測
根據3 株植物乳桿菌抑菌實驗,選擇抑菌效果最好的QB3-3進行長時間抑菌實時監測。監測數據通過軟件Prism 6作圖分析得圖2、3。植物乳桿菌QB3-3在對大腸桿菌和金黃色葡萄球菌長達96 h的抑菌過程中,發酵原液的抑菌效果最佳,經蛋白酶K處理的上清液抑菌效果次之,調節pH值至6.5的上清液抑菌效果最差。

圖3 植物乳桿菌QB3-3對金黃色葡萄球菌抑菌效果的實時監測Fig. 3 Real-time monitoring of the antimicrobial effect of L. plantarum QB3-3 against S. aureus
值得注意的是,當發酵上清液為600 μL時,即使pH值調至6.5,也對大腸桿菌有很好的抑菌效果。在Tulini等[23]的研究中,植物乳桿菌所產生的細菌素對革蘭氏陰性細菌不產生抑菌作用,而在本實驗中,調節pH值后的發酵上清液主要的抑菌成分應為細菌素等蛋白質類抑菌物質,在較高添加量時表現出對大腸桿菌很好的抑制作用,說明研究細菌素的抑菌效果時,需對發酵上清液進行濃縮。并且,應對植物乳桿菌QB3-3所產的細菌素做更進一步的研究。
2.4 植物乳桿菌抑制致病菌的電子顯微鏡觀察


圖4 抑菌物質處理后的食源性病原菌電子顯微鏡圖Fig. 4 Photomicrographs of three L. plantarum strains with antibiotic susceptibility to E. coli O157:H7 and S. aureus
植物乳桿菌產生的抑菌物質對大腸桿菌的抑菌效果最好,并能持續較長時間,推測與革蘭氏陰性菌和陽性菌的細胞壁不同有關。由圖4可知,抑菌物質處理后的實驗組和未經處理的對照組中,大腸桿菌菌體表面存在明顯差異:1)正常生長狀態的大腸桿菌菌體表面光滑、無空洞現象;經抑菌物質處理后的大腸桿菌菌體表面有黏絲狀物質出現,菌體表面有褶皺并伴隨有空洞。2)正常生長的金黃色葡萄球菌表面均勻光滑,無缺口;抑菌物質處理后的金黃色葡萄球菌細胞的內壁和外壁空間距離拉大,內壁濃縮并擠壓細胞內容物,致使細胞壁出現裂口,內容物流出致死。在以前的研究中,Dieuleveux等[24]用掃描電鏡觀察經苯乳酸作用前后的Listeria monocytogenes的超微結構后推測,苯乳酸的作用位點為細胞壁,與溶菌酶的抗菌機理相似,不同于Nisin等細菌素作用于細胞膜。袁景環等[25]研究表明,苯乳酸具有殺菌作用,同時有一定的溶菌作用。通過掃描電鏡和透射電鏡觀察顯示,經苯乳酸作用后的致病菌的菌體形態發生明顯改變,部分菌體破裂,細胞質流出。這些研究與本研究結果相似,因此,可以推測有機酸對細菌的作用靶點主要為細胞壁,而其具體的作用位點和抗菌機理有待進一步研究。
3 結 論
通過對dnaK基因序列比對分析,確定植物乳桿菌AY01為Lb. paraplantarum(序列同源性為99%),YM4-3和QB3-3均為Lb. plantarum ssp. plantarum。
實驗分別使用植物乳桿菌AY01、YM4-3、QB3-3的發酵上清液,NaOH處理后的發酵上清液、蛋白酶K處理后的發酵上清液,進行對病原微生物大腸桿菌O157:H7和金黃色葡萄球菌的抑菌實驗。結果表明,這3 株菌的主要抑菌物質為有機酸,其中菌株YM4-3和QB3-3具有微弱的非酸類抑菌物質。電子顯微鏡結果顯示,經發酵液處理后的病原菌菌體結構發生變化,內容物流出,可見這3 株植物乳桿菌抗菌主要機理為破壞病原菌細胞結構,細胞內物質流出,致使細胞死亡。這些植物乳酸菌可作為優良的菌株,經改造后用于食品的防腐,具有良好的應用前景。
[1] LU X, YI L H, DANG J, et al. Purification of novel bacteriocin produced by Lactobacillus coryniformis MXJ 32 for inhibiting bacterial foodborne pathogens including antibiotic-resistant microorganisms[J]. Food Control, 2014, 46: 264-271. DOI:10.1016/ j.foodcont.2014.05.028.
[2] 孫香云, 劉學雙, 高悅. 秦皇島市北戴河區引起食源性腹瀉的病原菌[J]. 職業與健康, 2013, 29(18): 2332-2334. DOI:10.13329/j.cnki. zyyjk.2013.18.033.
[3] 陶景淵. 淺談急性腸胃炎癥狀及治療方法[J]. 求醫問藥(學術版), 2012, 10(7): 267.
[4] 劉付香, 李玲, 梁炫強. 生物防治黃曲霉毒素污染研究進展[J]. 中國生物防治, 2010 (1): 96-101.
[5] 任廣鳴. 化學防腐劑對豆腐貯存質量和營養成份的影響[J]. 食品科學, 1988, 9(12): 41-44.
[6] 王曉, 朱珠英, 張素燕, 等. 食品中食源性病原菌污染現況研究[J]. 浙江預防醫學, 2011, 23(5): 12-16. DOI:10.3969/ j.issn.1007-0931.2011.05.004.
[7] 沈德中. 生物防治—防止果蔬腐爛的新途徑[J]. 食品科學, 1990, 11(1): 55-58.
[8] 盧劍. 微生物防腐劑及其在食品工業中的應用[J]. 食品科學, 2005, 26(8): 453-457. DOI:10.3969/j.issn.1008-5467.2003.09.012.
[9] 樊星, 張昊, 郭慧媛, 等. 乳酸菌抑菌功能的研究進展[J]. 中國乳業, 2012(9): 52-54. DOI:10.3969/j.issn.1671-4393.2012.09.014.
[10] 張小平, 顧瑞霞. 益生菌發酵牛初乳對致病菌抑制作用的研究[J]. 中國乳品工業, 2005, 33(3): 10-12. DOI:10.3969/ j.issn.1001-2230.2005.03.003.
[11] SCHNüRER J, MAGNUSSON J. Antifungal lactic acid bacteria as biopreservatives[J]. Trends in Food Science & Technology, 2005, 16(1/2/3): 70-78. DOI:10.1016/j.ti fs.2004.02.014.
[12] REIS J A, PAULA A T, CASAROTTI S N, et al. Lactic acid bacteria antimicrobial compounds: characteristics and applications[J]. Food Engineering Reviews, 2012, 4(2): 124-140. DOI:10.1007/s12393-012-9051-2.
[13] 楊玉紅. 乳酸菌的抑菌活性及在肉品保鮮中的應用[J]. 肉類工業, 2013(6): 50-54. DOI:10.3969/j.issn.1008-5467.2013.06.016.
[14] 洪偉, 薛正蓮. 1株植物乳桿菌的抑菌作用及其生物學特性的研究[J]. 生物學雜志, 2014(6): 51-54. DOI:10.3969/ j.issn.2095-1736.2014.06.051.
[15] 倪冬冬, 李洪軍, 賀稚非. 新疆藥桑果乳桿菌發酵飲料研制[J].食品工業科技, 2014, 35(24): 208-212. DOI:10.13386/ j.issn1002-0306.2014.24.036.
[16] 熊駿, 韓瑞娜, 張忠華, 等. 豆豉中高效抑菌活性乳酸菌的篩選及其抑菌研究[J]. 中國微生態學雜志, 2011, 23(6): 485-490.
[17] 張文, 韓廣泉, 王凱, 等. 乳酸菌對中草藥的發酵及抑菌活性檢測[J].飼料博覽, 2014(1): 4-7.
[18] HUANG C H, LEE F L. The dnaK gene as a molecular marker for the classifi cation and discrimination of the Lactobacillus casei group[J]. Antonie Van Leeuwenhoek, 2011, 99(2): 319-327. DOI:10.1007/ s10482-010-9493-6.
[19] GUINANE C M, COTTER P D, HILL C, et al. Microbial solutions to microbial problems; lactococcal bacteriocins for the control of undesirable biota in food[J]. Journal of Applied Microbiology, 2005, 98(6): 1316-1325. DOI:10.1111/j.1365-2672.2005.02552.x.
[20] 丁軻, 倪學勤, 潘康成, 等. 三株乳酸桿菌體外抑菌試驗的研究[J]. 飼料工業, 2003, 24(3): 19-21. DOI:10.3969/j.issn.1001-991X.2003.03.007.
[21] 熊濤, 宋蘇華, 黃濤, 等. 植物乳桿菌NCU116抑菌性能的研究[J]. 食品與發酵工業, 2012. 38(6): 97-101. DOI:10.13995/j.cnki.11-1802/ ts.2012.06.032.
[22] 宮路路, 龔福明, 李曉然, 等. 豆豉中高產乳酸乳酸菌的篩選及其產酸條件的優化研究[J]. 中國微生態學雜志, 2013, 25(5): 516-520. DOI:10.13381/j.cnki.cjm.2013.05.007.
[23] TULINI F L, WINKELSTROETER L K, de MARTINIS E C P. Identifi cation and evaluation of the probiotic potential of Lactobacillus paraplantarum FT259, a bacteriocinogenic strain isolated from Brazilian semi-hard artisanal cheese[J]. Anaerobe, 2013, 22: 57-63. DOI:10.1016/j.anaerobe.2013.06.006.
[24] DIEULEVEUX V, VANDERPYL D, CHATAUD J, et al. Purifi cation and characterization of anti-Listeria compounds produced by Geotrichum candidum[J]. Applied and Environmental Microbiology, 1998, 64(2): 800-803.
[25] 袁景環, 貢漢生, 孟祥晨. 苯乳酸的抗菌作用及其抗菌機理的初步研究[J]. 食品工業, 2009, 30(5): 14-17.
Antagonistic Mechanism of Lactobacillus plantarum against Foodborne Pathogenic Bacteria
LI Qiangkun, LIU Chenjian, ZHANG Yuanlian, CHANG Linjie, LUO Yiyong, LI Xiaoran*
(Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500, China)
In this study, Oxford cup method was used to screen Lactobacillus plantarum strains with antibacterial effect. The fermentation supernatants from these strains were either treated with protease or adjusted for pH using NaOH before being tested for their ability to inhibit the foodborne pathogenic bacteria Escherichia coli O157:H7 and Staphylococcus aureu. Results showed that organic acid was the major antibacterial compound, yet when adjusted to pH 6.5 the fermentation supernatants had better inhibition ability against E. coli O157:H7. L. plantarum strain QB3-3 showed antibacterial effect for up to 96 h. In addition, the antagonistic mechanism of L. plantarum against foodborne pathogens was due to destruction of the cell structure resulting in morphological changes, leakage of cell contents and fi nally apoptosis as observed via electron microscopy.
Lactobacillus plantarum; organic acid; antibacterial activity
10.7506/spkx1002-6630-201611004
Q939.9
A
1002-6630(2016)11-0018-06
李強坤, 柳陳堅, 張園蓮, 等. 植物乳桿菌對食源性病原菌作用的研究[J]. 食品科學, 2016, 37(11): 18-23. DOI:10.7506/
spkx1002-6630-201611004. http://www.spkx.net.cn LI Qiangkun, LIU Chenjian, ZHANG Yuanlian, et al. Antagonistic mechanism of Lactobacillus plantarum against foodborne pathogenic bacteria[J]. Food Science, 2016, 37(11): 18-23. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201611004. http://www.spkx.net.cn
2015-07-08
國家自然科學基金地區科學基金項目(31160309)
李強坤(1992—),男,本科,研究方向為生物工程。 E-mail:1764761547@qq.com
*通信作者:李曉然(1984—),女,副教授,博士,研究方向為微生物分子生態學。E-mail:starkeyran@163.com

