一體化生物加工過程生產乙醇的研究進展
李心利,朱玉紅,汪保衛,付晶,王智文,陳濤
(天津大學化工學院,系統生物工程教育部重點實驗室,天津 300072)
一體化生物加工過程生產乙醇的研究進展
李心利,朱玉紅,汪保衛,付晶,王智文,陳濤
(天津大學化工學院,系統生物工程教育部重點實驗室,天津 300072)
一體化生物加工過程(consolidated bioprocessing,CBP)指通過對理想底盤微生物的開發和利用來實現一步轉化木質纖維素為生物產品的生物加工程序。本文回顧了一體化生物加工過程的研究背景,簡述了其開發理念和技術路線,全面綜述了近年來該技術在轉化木質纖維素生產二代生物乙醇研究中的不同策略及最新的研究進展。分析了CBP系統中自然菌株、重組菌株和共培養菌株在轉化木質纖維素生產生物乙醇時的優點和瓶頸因素。研究了基因工程、代謝工程等工程手段和技術在克服此技術中的阻礙性因素及提升乙醇得率等方面的應用價值和潛力。最后,論述了組學及合成生物學等新興生物技術對CBP生物乙醇的貢獻和二代生物乙醇的商業化發展現狀及CBP乙醇未來所面臨的機遇與挑戰。
一體化生物加工過程;木質纖維素;生物乙醇;發酵;生物技術
乙醇(酒精),作為國防、醫療、有機合成、食品等行業中的重要原料,主要通過化學法和生物發酵法兩種途徑合成,其中生物發酵法又經歷一代糧食乙醇、二代非糧食乙醇即木質纖維素基生物乙醇。在化石能源、糧食危機日益嚴重和可利用耕地逐年下降的今天,使得化學合成和一代生物法制備乙醇都受到了不同程度的約束而被逐漸放棄。因此,開發二代基于木質纖維素的生物乙醇就受到了越來越多的關注[1]。木質纖維素是一種能源密度小,成分多樣化,結構復雜的固態、髙聚、天然可再生的清潔能源物質,主要由纖維素(35%~37%)、半纖維(23%~25%)和木質素(18%~22%)等構成[2]。傳統生物法制備木質纖維素基生物乙醇時,木質纖維素首先要經過復雜的預處理程序,如化學法和物理法等,來破壞其復雜的物理結構,隨后預處理過的木質纖維素進一步被各種水解酶糖化為可被微生物代謝的單糖物質而進行乙醇發酵[3]。因此傳統木質纖維素乙醇發酵程序主要分為:①木質纖維素的預處理;②預處理物質的酶水解(糖化);③乙醇的發酵;④產品的分離純化[4]。同時這些復雜的加工過程還可以被整合到一系列不同的發酵程序之中,如分步糖化發酵(separate hydrolysis and fermentation,SHF)、同步糖化發酵(simultaneous saccharification and fermentation,SSF)、同步糖化共發酵(simultaneous saccharification and co-fermentation,SSCF)等。以上技術方法的應用雖然在不同程度上克服了生物乙醇發酵時存在的障礙,但是考慮到其復雜的加工程序及對昂貴水解酶的依賴性等問題而使其在工業實際應用方面并不占據優勢[4-5]。為了解決傳統生物乙醇發酵工藝存在的問題,近年來人們在木質纖維素的利用方面進行了大量的探索性研究;同時隨著系統生物學和代謝工程等學科的發展以及合成生物學和 “組學”等新興生物技術的應用,人們對微生物細胞的遺傳背景和代謝網絡有了更加深入的研究和更加精細的調控;在此基礎上研究者提出了一種新穎的木質纖維素發酵技術——一體化生物加工過程(consolidated bioprocessing,CBP),并取得了豐碩的成果;從而為未來可再生生物能源的利用及大宗生物產品的生產提供了優選的機制[6]。
本文從CBP的原理和技術理念出發,系統闡述了自然菌株、重組菌株及共培養菌株在不同CBP策略下生產生物乙醇的研究進展,探討了系統代謝工程、基因組學乃至合成生物學等新興技術對CBP生物乙醇菌株構建的影響及對CBP木質纖維素生產生物乙醇的貢獻,簡析了CBP生物乙醇發酵所面臨的主要問題和挑戰及其商業化現狀,展望了CBP木質纖維素生產生物乙醇的未來。
1 CBP的原理及CBP系統微生物
一體化生物加工過程指通過對理想底盤微生物的開發,使其具有一步代謝木質纖維素的能力,致使傳統木質纖維素發酵過程中水解酶的生成、底物的糖化與發酵、乙醇的生產程序被封閉整合到由單一或者微生物菌群來完成的一步生物加工過程之中(如圖1所示)。此生物反應器系統簡化了傳統發酵工藝的復雜性,降低了工業發酵成本,極大地提升了底物的轉化率和產品得率[7]。

圖1 CBP系統的理想架構和反應機制[12]
自CBP概念被提出至今,“魯棒性”底盤微生物的開發一直是CBP系統成敗的關鍵。理想的CBP微生物必須具有以下能力:①能夠合成和分泌復雜的高活性水解酶;②能夠代謝己糖、戊糖等多種糖底物;③能夠高轉化率和高產量;④高耐受性[8]。生物燃料研究的先驅者LYND等提出CBP微生物有兩種合適的來源即自然(native)或重組(recombinant)[6,9]。這些自然菌株或重組菌株主要包括細菌類,如嗜熱厭氧菌屬(Thermoanaerobacterium sp.)、梭菌屬(Clostridium)、埃希氏菌屬(Escherichia)、端胞菌屬(Terminosporus)、芽胞桿菌屬(Bacillus)等;真菌類,如青霉屬(Penicillium)、木霉屬(Trichoderma)、脈胞菌屬(Neurospora)、根霉屬(Rhizopus)及白腐真菌(White rot basidiomycetes)和酵母菌屬中的釀酒酵母菌(Saccharomyces cerevisiae)、馬克斯克魯維酵母菌(Kluyveromyces marxianus)等;部分放線菌類(Actinobacillus)及其他稀有菌類如白蟻腸道菌等。雖然這些微生物在代謝木質纖維素類底物方面均具有各自的代謝優勢,但是其代謝能力和產品的發酵能力卻有很大的差距。近年來,隨著各種新興生物技術和高通量技術被應用于CBP微生物及新型水解酶的開發研究之中,越來越多的理想CBP系統微生物被開發,同時在模擬微生物代謝機理及利用木質纖維素生產生物基產品等方面都有較好的成果[10]。本文作者課題組基于CBP理念,同時結合合成生物學方法等篩選了不同來源的半纖維素水解酶并進行了組合優化,構建一株能夠快速代謝木聚糖的大腸桿菌(Escherichia coil)工程菌株;并進一步通過基因工程手段優化了水解酶的表達分泌水平,提高了半纖維素的水解能力;最終實現了利用大腸桿菌一步轉化半纖維素為琥珀酸的一體化生物加工過程,證實了通過CBP進行半纖維素到琥珀酸轉化的可行性,為其進一步改良以及利用木質纖維素向其他化學品的轉化奠定了基礎[11]。
2 CBP木質纖維素基乙醇策略
依據對微生物生理功能的系統解析與代謝調控機理機制的研究,開發CBP木質纖維素生產生物乙醇的策略主要有:①自然菌株策略;②工程菌株策略;③共培養策略。同時此三類CBP策略中的微生物不但具有合成和分泌高活力、復雜水解酶系的能力(http://www.cazy.org/)而且能夠實現同步糖化[如圖2(a)和圖2(b)所示]與代謝木質纖維素和生物乙醇的生產[4]。
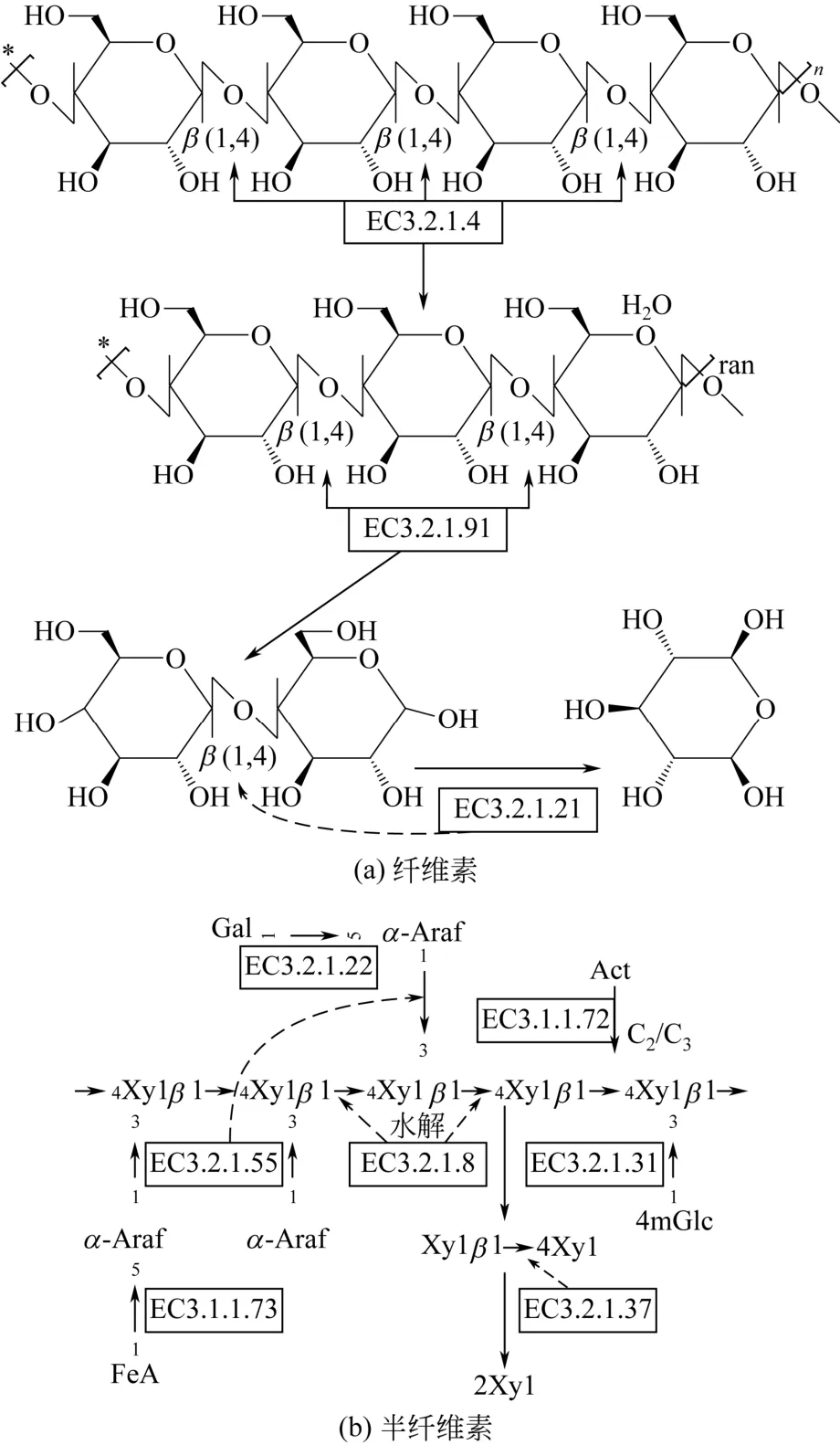
圖2 纖維素及半纖維素
2.1自然菌株策略
自然菌株在CBP生物乙醇生產中的優勢是其天然就具備良好的水解木質纖維素材料的能力。盡管如此,這類菌株依然存在由木質纖維素向生物乙醇轉化的瓶頸。例如,大部分自然菌株并不能將木質纖維素水解產生的單糖充分地轉化為生物乙醇,同時由于絕大多數菌株受到基因編輯技術匱乏的限制,而無法對其進行有效的代謝改造,就使得菌株在耐受性、水解酶的活力、產品的得率等方面的不足而成為了其推廣的限制性因素。因此,目前利用自然策略進行CBP乙醇生產的主要挑戰在于快速有效地開發不同自然菌株的基因操作技術,而菌株代謝網絡構建與發酵機理研究則是后續研究方向。
2.1.1細菌生物乙醇發酵
在野生型細菌中,只有部分菌株能夠代謝木質纖維素生產生物乙醇、丁醇等生物產品,而且主要集中于天然纖維素水解菌株中的耐熱厭氧菌屬、梭菌屬等。如模式菌株熱纖梭菌(Clostridium thermocellum)能夠合成和分泌20種高活性纖維素水解酶且具有寬泛的糖代謝范疇而被直接用于生物乙醇發酵研究中。同時在共培養和工程菌株改造方面梭菌屬也受到了同樣到了廣泛的關注(如表1所示)[14-15]。KUMAGAI等[14]利用自然型的熱纖梭菌(C. thermocellum)在厭氧條件下分別發酵預處理后的日本扁柏(Hinoki cypress)和桉樹(Eucalyptus)硬木時,CBP法生產生物乙醇的得率分別達到了79.4mg/g和73.1mg/g底物。同時近年來隨著研究的深入,越來越多的自然型木質纖維素水解菌株被發現并被應用于乙醇、丁醇、生物氫等產品的生產研究中且取得了一定的進展。例如,SIGURBJORNSDOTTIR等[29]在冰島溫泉中成功的分離出了一株能夠代謝纖維素等底物同時能夠生產乙醇、生物氫的嗜熱厭氧桿菌屬菌株(Thermoanaerobacterium AK54),發酵利用預處理的纖維素生產乙醇和氫時其產量分別達到了1.13g/L和0.11g/L。
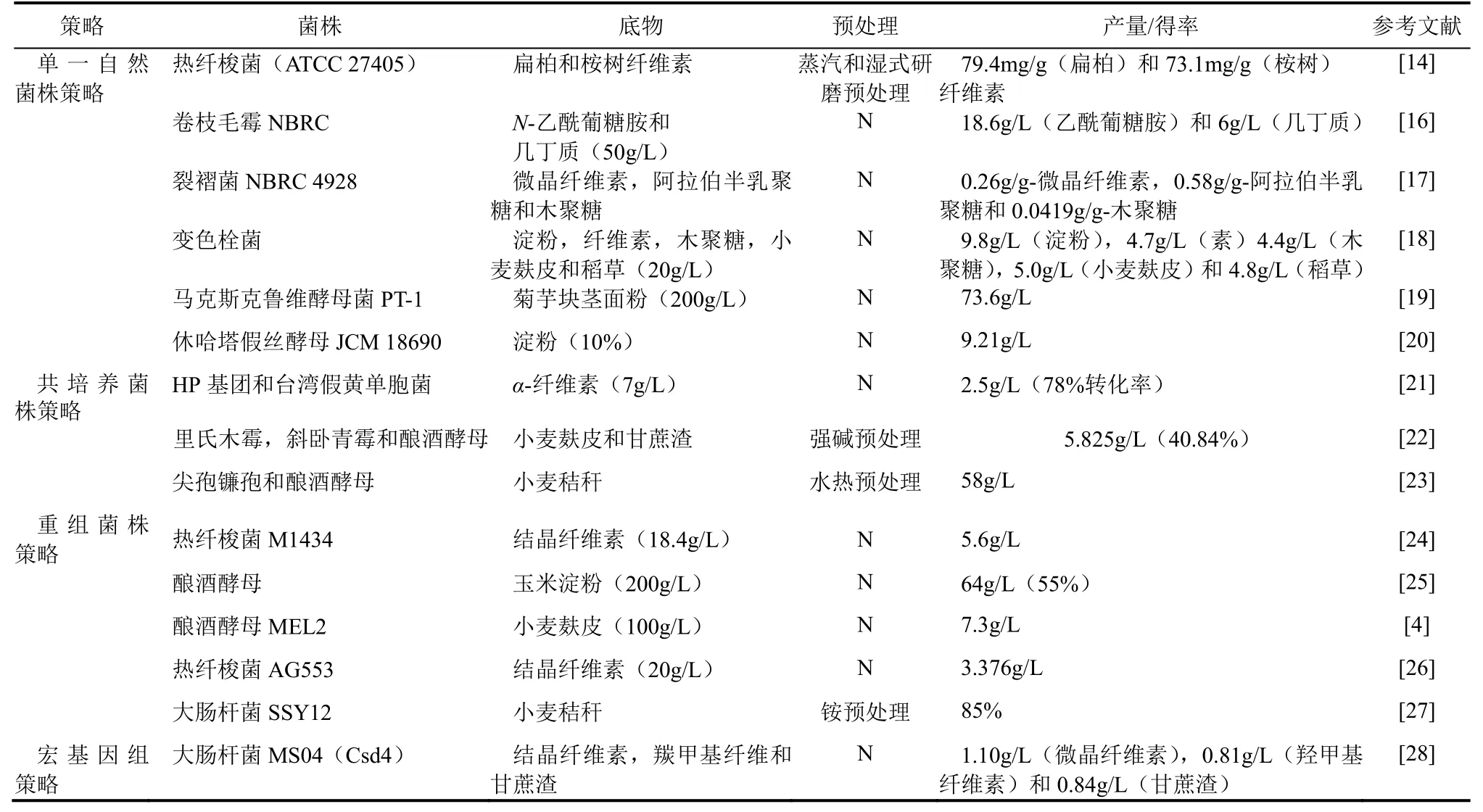
表1 不同CBP生物乙醇發酵策略及系統微生物
2.1.2絲狀真菌生物乙醇發酵
自然真菌發酵纖維素轉化生物乙醇的研究中,研究者的目光首先主要聚焦于絲狀真菌,如木霉菌(Trichoderma)、脈孢霉(Neurospora)、鐮孢屬(Fusarium)等,此類真菌不但具有水解纖維素及幾丁質(Chitin)等物質的能力,而且對很多的抑制劑如羧酸、醛等也有很好的耐受性,同時在構建各種纖維素代謝基因工程菌株研究中,此類菌株的多種纖維素水解酶基因常常被看作是最合適的候選基因[4,30]。因此利用絲狀真菌生產生物乙醇為擴充CBP系統的可用底物和微生物種類都提供了更多可選因素。INOKUMA等[16]首次通過分離篩選到一株可以代謝N-乙酰葡糖胺(N-GlcNAc)以及幾丁質的自然型卷枝毛霉菌(Mucor circinelloides),利用此菌株在厭氧條件下經過72h的發酵發現其可以代謝50g/L的N-乙酰葡糖胺生產18.6g/L乙醇,其產率達到了0.75g/L/h。同樣值得注意的是,其他種類的絲狀真菌在CBP發酵中也有很好的應用價值。例如絲狀真菌中的米曲霉菌(Aspergillus oryzae)在傳統的日本生物基化學品發酵工廠及如今的CBP乙醇研究中均得到很好的開發和利用[31-32]。
2.1.3白腐菌生物乙醇發酵
白腐類真菌不但能夠合成和分泌多種木質纖維素降解酶,如纖維素酶、過氧化物酶和漆酶等,而且具有與乙醇代謝強相關的酶系和降解木質素的能力,因此利用此類真菌通過CBP加工木質纖維素生產乙醇同樣具有巨大的潛在優勢[33]。但是一些研究發現,白腐類真菌中僅有很少的一部分能夠直接代謝己糖物質生產生物乙醇,如黃孢原毛平革菌(Phanerochaete chrysosporium)、灰質隔孢伏革菌(Peniophora cinerea)[34]。HORISAWA等[17]從土壤中分離篩選到一株可以有效的代謝戊糖和己糖的裂褶菌NBRC4928(Schizphylhls commne),通過CBP發酵工藝在厭氧條件下利用此菌株分別代謝微晶纖維素(MCC)、木聚糖(xylan)以及阿拉伯半乳聚糖(arabinogalactan)底物來生產生物乙醇,產品的得率分別達到了0.26g/g微晶纖維素、0.0419g/g-木聚糖和0.0508g/g阿拉伯半乳聚糖。OKAMOTO課題組[18]同樣利用白腐類真菌如變色栓菌(Trametes versicolor)、香栓菌(Trametes suaveolens)等進行CBP系統發酵生物乙醇,也同樣取得了很好的研究結果(如表1所示)。更加值得關注的是此類真菌在耐受性方面也有很好的表現,研究發現部分白腐真菌在乙醇的耐受性方面相比于乙醇發酵的工程菌株同樣具有巨大的優勢;如毛柄金錢菌(Flammulina velutipes)對乙醇的耐受度最高可以達120g/L[35]。未來隨著基因工程、代謝工程及合成生物學的應用和發展,白腐真菌在未來的CBP生物乙醇生產中必將受到更多的關注和應用。
2.1.4酵母菌生物乙醇發酵
利用酵母屬真菌代謝纖維素生產乙醇時,由于常用的模式酵母菌株如樹干畢赤酵母菌(pichia stipitis)、釀酒酵母菌(S. cerevisiae)等均不具有水解纖維素的能力。工程菌株雖然能夠水解纖維素但是也存在著菌株代謝溫度和水解酶催化溫度之間的差異[36]。因此,近年來研究者不斷尋找既能水解纖維素又不受溫度限制的天然酵母菌株,且取得了一些研究成果。HU等[19]通過分離篩選得到一株具有高菊粉(inulin)酶活性并且可以耐高溫的天然酵母屬菌株馬克斯克魯維酵母(kluyveromyces marxianus PT-1),在200g/L的菊粉底物濃度,40℃條件下高溫厭氧發酵,在48h內積累乙醇73.6g/L,達最大理論得率的90%。除此之外,具有相同木質纖維素代謝潛力的酵母菌株如嗜寒酵母屬(Cryophilic yeast Mrakia spp),葡萄牙棒孢酵母(Clavispora)等也有被陸續報道于CBP應用(如表1所示)[37]。
2.2重組菌株策略
木質纖維素乙醇發酵不但可以利用天然的木質纖維素水解菌株,而且還可以通過工程菌株來實現此目的。天然菌株的優勢是其具有強大的水解酶生產能力,但是在乙醇的耐受性、產物得率等方面存在著不足;而工程菌株,雖然可以克服前者的不足,但是異源水解酶的引進和表達同樣是一個巨大的障礙[38]。因此,如何構建理想的CBP纖維素發酵工程菌株就成為了研究的重點。基于CBP理念,工程菌株的構建主要包括兩個方向:一是改造天然能夠水解纖維素的微生物提高其乙醇發酵能力,二是改造天然高產乙醇的微生物,賦予其能夠有效代謝木質纖維素的能力。
2.2.1改造天然纖維素水解菌株用于CBP乙醇
(1)強化對產物及抑制劑的耐受性來提升乙醇產量。通常在發酵木質纖維素生產生物乙醇過程中會產生的大量的抑制劑,如醛、酸、酚等。研究表明這些物質均會對菌體生長、水解酶酶活和水解效率等產生巨大的影響,因此通過提升菌株的“魯棒性”對提升乙醇的產量將有極好的促進作用[39]。GEORGIEVA等[40]采用連續固定化反應系統技術來研究高溫條件下CBP乙醇發酵時,發現在此技術中厭氧型嗜熱菌[Thermoanaerobacter mathranii(Δldh)]對乙酸和抑制劑的耐受度可以達到10g/L,極大地提升了菌株的抗逆性和對抑制劑的耐受性。同時使底物轉化率達到了68%~76%,乙醇的得率達到了0.39~0.42g/g,其得率可以達到以單糖為碳源時的發酵得率。值得注意的是,菌株對乙醇的耐受性同樣是影響乙醇得率的關鍵因素,為此提升乙醇的耐受性同樣能夠極大地提升乙醇的產量。HUANG等[41]利用基因突變和基因組重排方法,使里氏木霉(Trichoderma reesei)對乙醇的耐受性提高到了4%(體積比),同時使乙醇的產量提升了5倍,達到了9.7g/L。BROWN等[42]在研究熱纖梭菌(C. thermocellum)的乙醇耐受機制時發現,突變其乙醇脫氫酶(adhE*)后可以促使該菌株對乙醇的耐受度提高5~8倍,而達到50~80g/L,并且此菌株在后續的乙醇發酵試驗中同樣取得了良好的實驗效果。
(2)利用代謝工程手段提升乙醇的產量。在乙醇發酵時,乙酸、乳酸、琥珀酸等副產物生成都會競爭乙醇合成途徑的代謝流而降低乙醇的產量,因此可以采用敲除副產物生成的策略來提升乙醇產量和得率(如圖3所示)。ARGYROS等[24]通過代謝工程手段在熱纖梭菌(C. thermocellum)內敲除乳酸代謝途徑基因(ldh)和乙酸生成途徑基因(Pta),導致乙醇生成選擇性比例相較于出菌株增加了40倍,而達到了40∶1(乙醇∶有機酸)。乙醇得率較野生株提升了4.2倍,產量達到了5.61g/L,而且消除了副產物有機酸的生成。值得關注的是在強化乙醇產量時,過表達影響乙醇合成相關的代謝流途徑對乙醇產量的提高同樣有很好的促進作用(如圖3所示)。GUEDON等[43]在解纖維素梭菌(C. cellulolyticum)菌株內過表達異源運動發酵單胞菌(Zymomonas mobilis)丙酮酸脫羧酶(pdc)及乙醇脫氫酶(adh),致使纖維素消耗速率增加了150%,同時乙醇得率提升了53%。
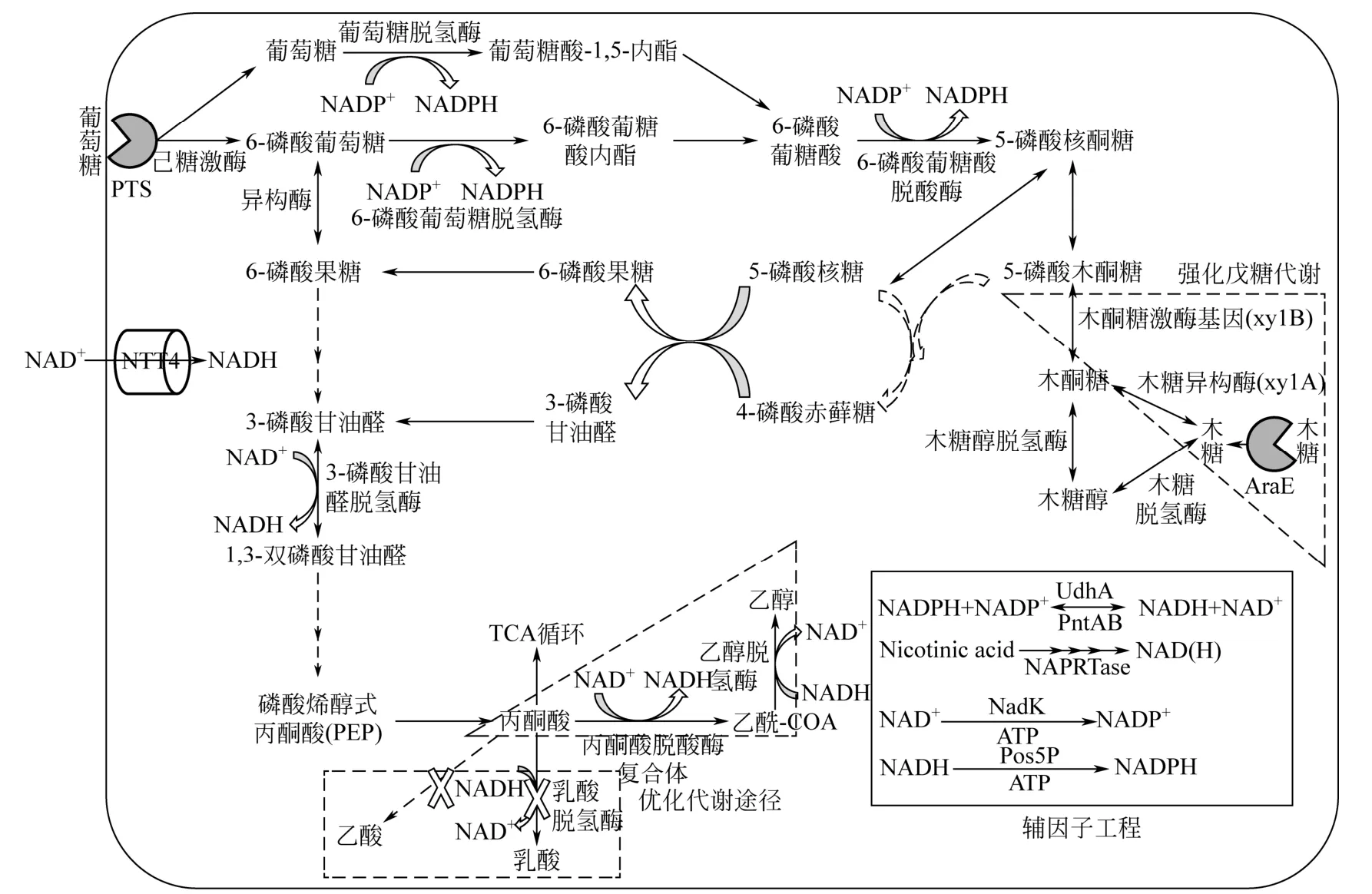
圖3 生物乙醇代謝系統簡析[13,45]
(3)輔因子工程來提升乙醇產量。乙醇代謝時代謝途徑中充足還原力的供給是一個最關鍵的影響因素,因此增加NADH輔因子的再生降低輔因子的消耗將對乙醇的合成具有關鍵促進作用(如圖3所示)。YAO等[44]利用代謝工程手段在嗜熱厭氧桿菌屬(Thermoanaerobacter Mathranii)菌株內過表達NADH依賴性的甘油脫氫酶基因(glda),同時敲除乳酸脫氫酶基因(ldh)來阻斷NADH氧化途徑來輔助輔因子NADH的再生來強化乙醇的得率,發現嗜熱厭氧桿菌屬菌株[T. mathranii BG1G1(Δldh,PxylGldA)]的代謝流可以快速的轉向乙醇生成方向,進而使乙醇的產率達到0.47g/L/h,為最大理論得率的97%。一個值得注意的趨勢是,如今許多研究者都在關注通過輔因子工程來提升代謝產物的產率和轉化率[45],如在大腸桿菌(E. coli)中過表達NADPH依賴型的酵母線粒體NAD(H)激酶基因(Pos5p),使產品GDP-L-海藻糖和己內酯產量分別提高了51%和96%。
(4)改造糖代謝相關的途徑提升乙醇量。由于木質纖維素水解后產生多種單糖,因此提高微生物對這些糖的利用率同樣可以提高乙醇的產量。ALI等[46]通過過表達尖芽孢鐮刀菌(Fusarium Oxysporum)自身的己糖轉運蛋白(hexose transporter,Hxt)促使乙醇的產量提升了近39%,同時過表達纖維素水解酶基因,增加基因表達劑量同樣可以提升微生物的糖代謝速率,從而影響乙醇產量。ANASONTZIS等[47]通過過表達尖孢鐮孢菌(F. oxysporum)內源木聚糖酶基因2(xylanase 2),致使乙醇產量提高了60%。雖然通過以上不同的策略可以極大地解決此類菌株在CBP木質纖維素發酵中的問題,但是由于此類菌株在乙醇發酵及得率方面和傳統的乙醇菌株,如酵母菌,相比較還存在著很大的差距,因此開發更有效的乙醇發酵工程菌株仍然是一個巨大的挑戰。
2.2.2改造天然乙醇生產菌株用于CBP乙醇
利用木質纖維素生產生物乙醇已經成為未來的發展方向,因此賦予傳統乙醇發酵模式菌株木質纖維素發酵利用能力在開發二代生物乙醇研究中將有更大的應用前景,并能很好地豐富CBP系統的內容。
(1)改造菌株利用纖維素類生物質。工程菌株代謝纖維素時主要依賴于3種纖維素酶,同時值得注意的是不同聚合度的纖維素在水解時需要酶種類也存在差異性[如圖2(a)、圖2(b)所示],因此研究者重點關注了不同水解酶組合的引入及表達水平的提高等方面來增加工程菌株的水解能力。MUNJAL等[27]通過過表達異源類芽孢桿菌(Paenibacillus sp.)的內切葡聚糖酶基因(Endo5A)及葡糖苷酶基因(Gluc1C)構建了一株能夠代謝纖維素的大腸桿菌(E. coli)菌株,在厭氧條件下發酵生產乙醇時,使乙醇的轉化率達到了最大理論值的85%。同樣VAN ROOYEN等[48]過表達扣囊復膜孢酵母菌(Saccharomycopsis fibuliger)的葡糖苷酶基因(Bgll)于釀酒酵母菌(S. cerevisiae),成功地使其可以代謝纖維二糖。TSAI等[49]構建一個多纖維素水解酶系表面展示組合(synthetic yeast consortium,SYC)來過表達水解纖維素的關鍵水解酶,通過SYC的發酵水平與利用等量的水解酶來水解纖維素相比,乙醇產量提升了2.6倍,達到了3.5g/L,產率0.49g/g,為理論值的95%。對于半纖維素、菊粉、阿拉伯木聚糖等底物也存在同樣的應用原理。在混合木質纖維素碳源中,為了同時代謝這些底物,可以考慮同時表達不同水解酶基因或者是通過共培養等策略(表1)來完成底物的代謝發酵問題。
(2)提升菌株對戊糖及戊聚糖的利用能力。研究發現部分乙醇菌株對戊糖的運輸和代謝方面存在著缺陷,以木聚糖物質為例,在利用釀酒酵母菌代謝木聚糖類物質的過程中會產生大量冗余的木糖、阿拉伯糖等而影響乙醇得率,但是,發現這些問題均可以通過修飾糖轉運與代謝通路而得到解決(如圖3所示)。SAKAMOTO等[50]在釀酒酵母菌(S. cerevisiae)中通過表面展示過表達3種半纖維素水解酶[如圖2(b)所示]以及3種木糖代謝途徑關鍵基因,賦予了工程菌株可以一步代謝半纖維素的能力,并使乙醇的產率達到了0.37g/(L·h)。值得注意的是,對于木糖和阿拉伯糖的代謝在不同的自然菌株中均發現有能夠運輸和代謝這些糖的關鍵基因和操縱子存在。同時研究發現運輸蛋白AraE能夠同時運輸木糖和阿拉伯糖(如圖3所示),但其轉遠效率直接受到阿拉伯糖操縱子的影響以及葡萄糖的碳代謝抑制。本文作者課題組利用野生型枯草芽孢桿菌168(Bacillus subtilis)進行實驗室進化和反向代謝工程操作,成功重構了一株高效代謝木糖和阿拉伯糖的三基因突變株[B. subtilis168(Δupp,comP:T1121X,sinR:T319C,araR:A184G)],這一性狀使其具有很好的CBP系統菌株改造潛力,也為未來CBP木質纖維素生產生物基化學品開拓了道路[51]
2.3共培養或合成微生物菌群(Synthetic microbial consortium)策略
工業化成本、代謝穩定與否是CBP系統微生物的一個重要指標。以往的生物乙醇發酵主要是利用單一菌株如自然菌株、工程菌株等為主的一代、二代發酵技術來完成,但是存在著混合底物利用、耐受性、代謝穩定性、代謝負擔等問題。隨著對自然界微生物共生共存原理的認知加深,以及對不同微生物代謝特點及代謝網絡的研究不斷深入,以微生物共培養為主的第三代發酵技術在CBP乙醇生產研究中取得了長足進展。PASCHOS等[23]通過共培養尖孢鐮孢菌(F. oxysporum)和釀酒酵母(S. cerevisiae),通過同步糖化發酵程序在厭氧條件下發酵預處理的小麥秸稈生產乙醇,使乙醇的產量比單菌株發酵模式增加了19%,達到了58g/L。共培養策略的實施前提是必須構建一個穩定的共培養共表達系統。DU等[21]通過分析篩選16個不同的天然微生物基團得到了一個能夠穩定利用纖維素并生產乙醇的HP微生物菌群(如表1所示)基團,在55℃及7g/L纖維素為碳源的條件下發酵時,可以使78%的底物轉化成乙醇,產量達到了2.5g/L。值得注意的是,穩定的共培養系統在不同種類水解混合糖的代謝能力和乙醇得率方面也有很好的體現;如共培養僅能代謝己糖的纖維素水解菌熱纖梭菌(C. thermocellum)和代謝戊糖的微生物可以有效地降低不同種微生物之間的底物競爭而實現乙醇產量的最大化。XU等[52]共培養僅能代謝己糖的纖維素水解菌株熱纖梭菌(C. thermocellum)和代謝戊糖的嗜熱乳酸梭菌(C. thermolacticum),發現混合菌在降低發酵代時及提升乙醇的得率方面都得到了很好的結果。
3 新興生物技術對CBP生物乙醇的貢獻
近幾年,宏基因組學、蛋白質組學、代謝組學以及合成生物學、轉錄組學等分析技術以及高通量篩選技術的快速發展,為發展商業化、工業化的CBP乙醇產業提供了一個全新的思路。尤其是近年來高速發展的合成生物學技術在設計構建理想化的微生物細胞工廠以及篩選更高效的水解酶類方面的應用更是為CBP生物乙醇的發展提供了一個強大的助力[53]。同時在多纖維素酶催化水解纖維素的研究工作中,宏基因組學以及蛋白質組學等組學技術在探索和設計一些新型高效能、耐熱型、pH穩定型的新型水解酶方面同樣提供了強大的技術支撐。在未來的CBP生物工廠的構建中,通過不同的組學技術來開發新的模塊化的纖維素酶體系以及結合“奇異”的工程技術應用,而使開發出全新的de novo CBP微生物代謝途徑成為了可能[28]。對于一個更加理想化的CBP微生物,除了能夠合成分泌高活性的水解酶系,還必須要耐受在生物質預處理及發酵階段的有害物質及發酵產物。對此,面臨發酵抑制物及高濃度產物等干擾因素時,系統生物學、轉錄組學、代謝組學等技術方法已經被廣泛的用于探索微生物及水解酶系的分子和基因表達特點及作用機制。同時在應對抑制因子存在的環境下,全局轉錄因子工程和質子泵排毒機制等方法策略也被用于研究酶的催化、表達機理之中[54],并且在一些研究中宏基因組學也已被充分的應用于開發CBP生物基產品底盤微生物的研究之中。
4 CBP乙醇的商業化研究進展
在過去的十年中,研究者通過對不同CBP乙醇生產策略和新興生物技術手段的綜合開發和運用,已然攻克了諸多的CBP乙醇生產難題,并且在小規模的實驗性探索方面取得了可觀的成果[4]。但是對于發展和構建更大規模的商業化CBP乙醇而言許多的問題和障礙依然存在,如成本和能耗、發酵周期、產物得率及酶等方面[55]。盡管發展商業化的二代乙醇依然處于一個起步階段并要克服很多的困難,但是依然有許多的研究者和企業在此方面取得了巨大的進步[53]。MASCOMA公司[56]以其本身專利性的二代Mascoma農作物加工技術(Mascoma Grain Technology,MGT)而首次使CBP乙醇生產商業化成為了可能,而且是一個最具代表性的工業化CBP乙醇開發領航者。2011年,Valero可再生燃料公司(VRF)和太平洋乙醇公司通過利用Mascoma的CBP乙醇技術,其所生產的二代乙醇占據了美國乙醇總量的9%。除此之外,Qteros公司[57]同樣成功的開發出了一種以梭菌屬(C. phytofermentans)為標志性的“Q Microbe”技術,并且可以很好地服務于CBP乙醇的商業化發展。值得注意的是,其他的公司如DSM POET,Abengoa,Iogen及LanzaTech等也在追逐著CBP乙醇發展的商業化步伐[58]。不僅在國外,國內的眾多纖維素乙醇企業和研究團體在二代乙醇研究中同樣取得了較好的成果。中國科學院廣州能源研究所等通過對限制CBP乙醇生產的關鍵因素進行攻關,成功地實現了萬噸級的乙醇生產示范工程[59]。同時其他的企業如濟南圣泉、河南天冠和山東龍力生物、中糧集團等在二代乙醇研發方面也均取得很好的成果。同時由意大利Mossi Ghisolfi集團和丹麥的生物制藥企業諾維信投資的世界最大的木質纖維素乙醇工廠已于2015年開始在安徽阜陽承建,極大地推動了中國在生物質能源方面的發展。但是這些企業所研發的商業化二代乙醇技術并非真正意義上的CBP乙醇工藝,其依然采用了傳統額外添加酶的方法來實現生物質的降解和乙醇的生產;同時在二代CBP乙醇發酵工業中,低于5000t的裝置屬于中試裝置;而萬噸級的裝置則可劃分于中試和產業化推廣之間,即示范工程;而大于萬噸以上的裝置方屬于產業化。有鑒于此,這些商業化乙醇生產的規模也只能歸于中式和初級放大的階段而非實際意義上的工業化和商業化發展[60]。不僅于此,這些半商業化的二代乙醇在底物的利用方面也只局限于玉米芯、甘蔗渣等底物而無法達到更多工業化的生產要求。盡管如此,這些生物乙醇商業化的歷史性探索和成功案例同樣為未來發展最優化和大規模的商業化木質纖維素基乙醇尤其是為CBP乙醇的工業化發展提供了清晰的現實案例。因此在可預見的將來,CBP乙醇的發展必將走進商業化和工業化的藍圖。
5 結語與展望
在過去的幾十年內,CBP系統在轉化纖維素生產生物燃料方面取得了巨大的進展,也為解決化石能源危機提供了一個新的視角和參考依據。在近幾年的CBP木質纖維素發酵生物乙醇研究中,不同的纖維素乙醇轉化方法以及大量的自然和工程微生物都被應用于CBP生物乙醇生產的研究和分析中,同時也包括不同的發酵策略和發酵工藝的發展。除此之外,宏基因組學、合成生物學、代謝工程等高通量技術在開發理想CBP系統微生物、解析酶的催化代謝機制、新酶的研究方面也取得了巨大的進展。盡管CBP生物乙醇技術在一定程度克服了許多的挑戰和困難,但是對于大規模的商業應用還是面臨著一定的技術難題和挑戰。為了開發出更加合理的CBP乙醇發酵過程,改進工業發酵的不足,未來的發展方向和挑戰主要集中于以下幾個方面。
(1)改善CBP系統微生物在水解酶的合成、分泌、酶活及催化效率、水解酶生產中的代謝負擔和異源基因表達的不穩定性問題。隨著代謝工程、合成生物學、宏基因組學的發展,越來越多的生物學手段被應用于研究水解酶的特性、催化位點及催化機制;并開發出了一系列新的催化效率高、熱穩定性好、pH穩定的新酶同時被應用于CBP菌株的構建之中。同時新的基因工程技術如表面展示、信號肽、酶基團等在改善CBP系統微生物的發酵表現方面也將有很好的促進作用。
(2)縮短發酵代時及提升乙醇產量。隨著代謝工程的應用及微生物代謝機制和網絡的不斷解析,從而使人們可以更加精確的定位和阻斷副產物代謝途徑、特異性的引進新的代謝途徑、結合工程手段來增加輔因子NADH的再生同時結合新型高活力水解酶的利用等,這些技術和方法在提高乙醇產量、縮短發酵代時等方面都將具有很好的促進作用。
(3)解決CBP微生物對產物及抑制劑耐受性。幾年來,隨著全局型轉錄因子工程和質子泵排毒機制被應用于弱化產物及抑制劑對水解酶及微生物的毒害,同時結合木質纖維素預處理技術和方法的應用均可以極大地降低有毒物質對微生物以及酶的影響進而提升發酵表現。
(4)拓寬底物利用范圍,降低生產成本。近年來隨著對代謝工程、基因工程和合成生物學的應用以及對菌株代謝機理的解析及代謝網絡的模擬化重構操作,人們已經可以理性的設計和構建出能夠共利用各種底物的模式化工程菌株,如釀酒酵母菌、枯草芽孢桿菌等,并且實現了菌株糖代謝能力從無到豐的推進。同時結合不同CBP策略的使用,已經促使部分的基因或者代謝工程菌被應用到CBP乙醇的生產之中,而且取得了極好的效果。
未來,隨著代謝工程整合系統生物學、合成生物學以及進化工程即所謂的的系統代謝工程(systems metabolic engeering,SME)的應用,以及基因組學、轉錄物組學、蛋白質組學、代謝組學、計算機生物學等分析技術以及高通量篩選平臺快速發展及各學科的相互結合和滲透同時參考理性的設計理念,相信隨著人們對CBP發酵機理的理解和認知,必將在可預見的未來攻克CBP領域所存在的種種壁壘,最終實現對木質纖維素材料的綜合開發利用,并能極大地降低生產成本和滿足經濟化的商業應用,從而使人類度過化石原料和糧食資源匱乏所帶來的能源和糧食危機。
[1] SANTOS L V D,GRASSI M C D B,GALLARDO J C M,et al. Second-generation ethanol: the need is becoming a reality[J]. Industrial Biotechnology,2016,12(1):40-57.
[2] HENDRIKS A T,ZEEMAN G. Pretreatments to enhance the digestibility of lignocellulosic biomass[J]. Bioresource Technology,2009,100 (1):10-18.
[3] MOOD S H,GOLFESHAN A H,TABATABAEI M,et al. Lignocellulosic biomass to bioethanol,a comprehensive review with a focus on pretreatment[J]. Renewable and Sustainable Energy Reviews,2013,27(6):77-93.
[4] SALEHI JOUZANI G,TAHERZADEH M J. Advances in consolidated bioprocessing systems for bioethanol and butanol production from biomass: a comprehensive review[J]. Biofuel Research Journal,2015,2(1):152-195.
[5] ENNES D,ABUBACKAR H N,DIAZ M,et al. Bioethanol production from biomass:carbohydrate vs syngas fermentation [J]. Journal of Chemical Technology & Biotechnology,2016,91(2):304-317.
[6] LYND L R,VAN ZYL W H,MCBRIDE J E,et al. Consolidated bioprocessing of cellulosic biomass:an update[J]. Current Opinion in Biotechnology,2005,16(5):577-583.
[7] OLSON D G,MCBRIDE J E,SHAW A J,et al.Recent progress in consolidated bioprocessing[J].Current Opinion in Biotechnology,2012,23(3):396-405.
[8] DEN HAAN R,VAN RENSBURG E,ROSE S H,et al. Progress and challenges in the engineering of non-cellulolytic microorganisms for consolidated bioprocessing[J].Current Opinion in Biotechnology,2015,33:32-38.
[9] 鄭宗寶,趙美娜,陳濤,等. 基于重組策略的一體化生物加工過程最新進展[J].生物工程學報,2013,29(10):1354-1362.
[10] BRETHAUER S,STUDER M H.Consolidated bioprocessing of lignocellulose by a microbial consortium[J].Energy & Environmental Science,2014,7(4):1446-1453.
[11] ZHENG Z B,CHEN T,ZHAO M N,et al.Engineering Escherichia coli for succinate production from hemicellulose via consolidated bioprocessing[J].Microbial Cell Factories,2012,11(1):37-48.
[12] UNREAN P.Bioprocess modelling for the design and optimization of lignocellulosic biomass fermentation [J].Bioresources and Bioprocessing,2016,3(1):1-9.
[13] 王鏡巖,朱圣庚,徐長法.生物化學[M].北京:高等教育出版社,2002.
[14] KUMAGAI A,KAWAMURA S,LEE S H,et al. Simultaneous saccharification and fermentation and a consolidated bioprocessing for Hinoki cypress and Eucalyptus after fibrillation by steam and subsequent wet-disk milling[J].Bioresource Technology,2014,162(162):89-95.
[15] TAYLOR M P,ELEY K L,MARTIN S,et al.Thermophilic ethanologenesis: future prospects for second-generation bioethanol production[J].Trends in biotechnology,2009,27(7):398-405.
[16] INOKUMA K,TAKANO M,HOSHINO K.Direct ethanol production from N-acetylglucosamine and chitin substrates by Mucor species[J].Biochemical Engineering Journal,2013,72(11):24-32.
[17] HORISAWA S,ARIGA O,SAKUMA Y.Direct ethanol production from cellulosic materials by consolidated biological processing using the wood rot fungus Schizophyllum commune[J].Bioresource Technology,2015,197:37-41.
[18] OKAMOTO K, UCHII A,KANAWAKU R,et al. Bioconversion of xylose,hexoses and biomass to ethanol by a new isolate of the white rot basidiomycete Trametes versicolor [J].Springerplus,2014,3(3):1-9.
[19] HU N,YUAN B,SUN J,et al.Thermotolerant Kluyveromyces marxianus and Saccharomyces cerevisiae strains representing potentials for bioethanol production from Jerusalem artichoke by consolidated bioprocessing[J].Applied Microbiology and Biotechnology,2012,95(5):1359-1368.
[20] TANIMURA A,KIKUKAWA M,YAMAGUCHI S,et al. Direct ethanol production from starch using a natural isolate,Scheffersomyces shehatae: toward consolidated bioprocessing[J].Scientific Reports,2015,5:9593.
[21] DU R,YAN J,LI S,et al.Cellulosic ethanol production by natural bacterial consortia is enhanced by Pseudoxanthomonas taiwanensis[J]. Biotechnology for Biofuels,2015,8(1):1-10.
[22] LIU Y,ZHANG Y,XU J,et al.Consolidated bioprocess for bioethanol production with alkali-pretreated sugarcane bagasse[J].Applied Energy,2015,157:517-522.
[23] PASCHOS T,XIROS C,CHRISTAKOPOULOS P. Simultaneous saccharification and fermentation by co-cultures of Fusarium oxysporum and Saccharomyces cerevisiae enhances ethanol production from liquefied wheat straw at high solid content[J].Industrial Crops and Products,2015,76:793-802.
[24] ARGYROS D A,TRIPATHI S A,BARRETT T F,et al. High ethanol titers from cellulose by using metabolically engineered thermophilic,anaerobic microbes[J]. Applied & Environmental Microbiology,2011,77(23):8288-8294.
[25] FAVARO L,VIKTOR M J,ROSE S H,et al.Consolidated bioprocessing of starchy substrates into ethanol by industrial Saccharomyces cerevisiae strains secreting fungal amylases[J].Biotechnology and Bioengineering,2015,112(9):1751-1760.
[26] PAPANEK B,BISWAS R,RYDZAK T,et al.Elimination of metabolic pathways to all traditional fermentation products increases ethanol yields in Clostridium thermocellum [J].Metabolic Engineering,2015,32:49-54.
[27] MUNJAL N,JAWED K,WAJID S,et al.A constitutive expression system for cellulase secretion in Escherichia coli and its use in bioethanol production[J].PLoS One,2015,10(3): e0119917.
[28] LOACES I,AMARELLE V,MUNOZ GUTIERREZ I,et al. Improved ethanol production from biomass by a rumen metagenomic DNA fragment expressed in Escherichia coli MS04 during fermentation[J].Appied Microbiol Biotechnology,2015,99(21):9049-9060.
[29] SIGURBJORNSDOTTIR M A,ORLYGSSON J.Combined hydrogen and ethanol production from sugars and lignocellulosic biomass by Thermoanaerobacterium AK54,isolated from hot spring[J].Applied Energy,2012,97(3):785-791.
[30] ALI S S,NUGENT B,MULLINS E,et al.Fungal-mediated consolidated bioprocessing: the potential of Fusarium oxysporum for the lignocellulosic ethanol industry[J].AMB Express,2016,6(1):13-26.
[31] MACHIDA M,YAMADA O,GOMI K.Genomics of Aspergillus oryzae: learning from the history of Koji mold and exploration of its future[J].DNA Research,2008,15(4):173-183.
[32] HOSSAIN S K M.Bioethanol fermentation from non-treated and pretreated corn stover using Aspergillus oryzae [J].Chemical Engineering Research Bulletin,2013,16(1):33-44.
[33] THORN R G,REDDY C A,HARRIS D,et al.Isolation of Saprophytic basidiomycetes from soil[J].Applied and Environmental Microbiology,1996,62(11):4288-4292.
[34] OKAMOTO K,IMASHIRO K,AKIZAWA Y,et al. Production of ethanol by the white-rot basidiomycetes Peniophora cinerea and Trametes suaveolens[J].Biotechnology Letters,2010,32(7):909-913.
[35] OKAMURA T,OGATA T,MINAMOTO N,et al. Characteristics of wine produced by mushroom fermentation[J]. Bioscience,Biotechnology and Biochemistry,2014,65(7):1596-1600.
[36] YANASE S,HASUNUMA T,YAMADA R,et al. Direct ethanol production from cellulosic materials at high temperature using the thermotolerant yeast Kluyveromyces marxianus displaying cellulolytic enzymes[J]. Applied Microbiology and Biotechnology,2010,88(1):381-388.
[37] TSUJI M,YOKOTA Y,KUDOH S,et al. Improvement of direct ethanol fermentation from woody biomasses by the Antarctic basidiomycetous yeast,Mrakia blollopis,under a low temperature condition[J].Cryobiology,2014,68(2):303-305.
[38] AKINOSHO H,YEE K,CLOSE D,et al.The emergence of Clostridium thermocellum as a high utility candidate for consolidated bioprocessing applications[J].Frontiers in Chemistry,2014,66(2):1-18.
[39] VIOLA E,ARCIERI G,ZIMBARDI F,et al. Evaluation of a pilot-scaled paddle dryer for the production of ethanol from lignocellulose including inhibitor removal and high-solids enzymatic hydrolysis[J].Biotechnology Reports,2016,9:38-45.
[40] GEORGIEVA T I,MIKKELSEN M J,AHRING B K. Ethanol production from wet-exploded wheat straw hydrolysate by thermophilic anaerobic bacterium Thermoanaerobacter BG1L1 in a continuous immobilized reactor [J].Applied Biochemistry and Biotechnology,2008,145(1-3):99-110.
[41] HUANG J,CHEN D,WEI Y,et al.Direct ethanol production from lignocellulosic sugars and sugarcane bagasse by a recombinant Trichoderma reesei strain HJ48[J].The Scientific World Journal,2014,3:435-451.
[42] BROWN S D,GUSS A M,KARPINETS T V,et al.Mutant alcohol dehydrogenase leads to improved ethanol tolerance in Clostridium thermocellum[J].Proceedings of the National Academy of Sciences,2011,108(33):13752-13757.
[43] GUEDON E,DESVAUX M,PETITDEMANGE H. Improvement of cellulolytic properties of Clostridium cellulolyticum by metabolic engineering[J].Applied and Environmental Microbiology,2002,68(1):53-58.
[44] YAO S,MIKKELSEN M J.Metabolic engineering to improve ethanol production in Thermoanaerobacter mathranii[J].Applied Microbiology and Biotechnology,2010,88(1):199-208.
[45] 王白云,王曉玥,王智文,等.大腸桿菌氧化還原輔因子代謝工程[J]. 化學進展,2014,26(9):1609-1618.
[46] ALI S S,NUGENT B,MULLINS E,et al.Insights from the fungus Fusarium oxysporum point to high affinity glucose transporters as targets for enhancing ethanol production from lignocellulose[J]. PLoS One,2013,8(1):268-277.
[47] ANASONTZIS G E,ZERVA A,STATHOPOULOU P M,et al. Homologous overexpression of xylanase in Fusarium oxysporum increases ethanol productivity during consolidated bioprocessing(CBP)of lignocellulosics[J].Journal of Biotechnology,2011,152(1-2):16-23.
[48] VAN ROOYEN R,HAHN-HGERDEL B,LA GRANGE D C,et al. Construction of cellobiose-growing and fermenting Saccharomyces cerevisiae strains[J].Journal of Biotechnology,2005,120(3):284-295.
[49] TSAI S L,OH J,SINGH S,et al.Functional assembly of minicellulosomes on the Saccharomyces cerevisiae cell surface for cellulose hydrolysis and ethanol production[J].Applied and Environmental Microbiology,2009,75(19):6087-6093.
[50] SAKAMOTO T,HASUNUMA T,HORI Y,et al. Direct ethanol production from hemicellulosic materials of rice straw by use of an engineered yeast strain codisplaying three types of hemicellulolytic enzymes on the surface of xylose-utilizing Saccharomyces cerevisiae cells[J].Journal of Biotechnology,2012,158(4):203-210.
[51] ZHANG B,LI N,WANG Z W,et al.Inverse metabolic engineering of Bacillus subtilis for xylose utilization based on adaptive evolution and whole-genome sequencing [J].Applied and Environmental Microbiology,2015,99(2):885-896.
[52] XU L,TSCHIRNER U. Improved ethanol production from various carbohydrates through anaerobic thermophilic co-culture[J].Bioresource Technology,2011,102(21):10065-10071.
[53] SCHUSTER B G,CHINN M S.Consolidated bioprocessing of lignocellulosic feedstocks for ethanol fuel production [J].Bioenergy Research,2013,6(2):416-435.
[54] ALPER H,STEPHANOPOULOS G. Engineering for biofuels:exploiting innate microbial capacity or importing biosynthetic potential[J].Nature Reviews Microbiology,2009,7(10):715-723.
[55] 胡徐騰.纖維素乙醇開發進展[J]. 化工進展,2011,30(1):137-143.
[56] DORAN K,STERN L,PILGRIM C. Mascoma and Lallemand ethanol technology announce commercial agreement with Pacific ethanol for drop in MGT? yeast product and commercial roll-out progress[EB/OL]. Business Wire,2012: [2016-04-16]. http://www.businesswire.com/news/home/20120329005708/en/Masco ma-Lallemand-Ethanol-Technology-Announce-Commercial-Agreement.
[57] FREEMAN S. Qteros biofuels start-up closes Chicopee facility[EB/OL]. MassLive,2012:[2016-04-16]. http://www.masslive. com/news/index.ssf/2012/04/qteros_biofues_startup_close.html.
[58] 段黎萍.纖維素乙醇的商業化現狀及經濟分析[J]. 化工進展,2008,27(6):867-871.
[59] 朱漢斌. 研究突破纖維素乙醇產業化技術瓶頸[N]. 中國科學報,2015-11-02(4).
[60] 李振宇,李頂杰,黃格省,等. 燃料乙醇發展現狀及思考[J]. 化工進展,2013,36(7):1457-1467.
Progress in bioethanol production via consolidated bioprocessing
LI Xinli,ZHU Yuhong,WANG Baowei,FU Jing,WANG Zhiwen,CHEN Tao
(School of Chemical Engineering and Technology,Tianjin University,Key Laboratory of Systems Bioengineering,Tianjin 300072,China)
Consolidated bioprocessing(CBP),refers to bioprocessing by exploitation and utilization of ideal chassis microorganisms to directly convert lignocellulose into bioproducts in one processing. The research background,development concepts and technology roadmaps of the CBP were briefly introduced in this paper. Subsequently,we comprehensively reviewed the different strategies and the recent research progress in CBP lignocellulose to second generation bioethanol production. Then,the advantages and bottleneck factors of the native,recombinant and co-culture strains used in CBP bioethanol fermentation were analyzed. The genetic engineering,metabolic engineering and other techniques' application value and potential for overcoming the barrier factors of CBP bioethanol production and increasing bioethanol yield were assessed. Ultimately,this review provided a brief commentary on the contribution of emerging biotech,such as ‘omics' and synthetic biology and on CBP bioethanol production and the recent conditions of the lignocellulosic bioethanol production toward commercialization scale,as well as opportunities and challenges in the future.
consolidated bioprocessing;lignocellulose;bioethanol;fermentation;biotechnology
TK 6;TQ 92
A
1000-6613(2016)11-3600-11
10.16085/j.issn.1000-6613.2016.11.033
2016-03-23;修改稿日期:2016-04-17。
國家973計劃(2012CB725203)及國家863計劃(2012AA02A702,2012AA022103) 項目。
李心利(1989—),男,碩士研究生。E-mail lixin_li@tju.edu.cn。聯系人:陳濤,副教授,博士生導師,研究方向為代謝工程和合成生物學。E-mail chentao@tju.edu.cn。

