PEG/α-環糊精準聚輪烷水凝膠與BSA相互作用的光譜學研究
林集端,趙珺,2
(1華僑大學化工學院生物工程與技術系,福建 廈門 361021;2華僑大學油脂及天然產物研究所,福建 廈門 361021)
PEG/α-環糊精準聚輪烷水凝膠與BSA相互作用的光譜學研究
林集端1,趙珺1,2
(1華僑大學化工學院生物工程與技術系,福建 廈門 361021;2華僑大學油脂及天然產物研究所,福建 廈門 361021)
聚乙二醇(PEG)與環糊精(CD)自組裝形成的準聚輪烷水凝膠可作為蛋白緩釋載體。在此三元體系中,PEG、CD和蛋白質之間可能存在一定的相互作用。本文以牛血清白蛋白(BSA)為模型蛋白,通過紫外-可見吸收光譜,熒光光譜,X射線粉末衍射(XRD)和NOESY譜分析等技術,研究BSA在PEG/α-CD準聚輪烷水凝膠中結構的變化。結果表明BSA對水凝膠的生成速率具有顯著的影響。通過熒光光譜和同步熒光光譜分析可知,BSA在水凝膠中其三級結構發生輕微變化,致使最大熒光發射波長發生紅移,而Trp和Tyr殘基在水凝膠中其微環境發生了微小變化。這些變化隨著BSA濃度的提高而趨于顯著。對比XRD譜圖發現,水凝膠在加入BSA前后,2θ = 6.56°、11.54°、12.06°、20.56°、22.04°、26.04°這些衍射角位置的譜峰發生明顯變化,說明BSA對PEG/α-CD準聚輪烷的晶型有一定的改變,反映了BSA與水凝膠不只是單純的混合,而且存在形成復合物而改變蛋白質結構的可能性。2D NOESY譜圖也表明BSA與PEG/α-CD準聚輪烷之間存在氫原子的相互耦合作用,證明了兩者之間的相互作用。
準聚輪烷水凝膠;牛血清白蛋白;環糊精;聚乙二醇;光譜;X射線粉末衍射
自從HARADA等[1-2]首次報道了基于聚乙二醇(polyethylene glycol,PEG)和環糊精(cyclodextrin,CD)的超分子組裝體以來,此類超分子組裝體在納米器件、傳感器、分子轉換器、體內給藥釋放系統、基因釋放載體以及組織工程支架材料等方面得到了多方面的應用[3-4]。在這一組裝體中,PEG穿過α-CD的空腔,形成準聚輪烷[5],并依靠氫鍵、疏水相互作用等次級鍵形成亞穩態的凝膠狀物。這類水凝膠可作為蛋白質或酶的緩釋載體,例如HIGASHI等[6-7]將PEG修飾胰島素或溶菌酶,而后分別與α-或γ-CD混合,制備出一種固相載藥緩釋體系。他們還報道了PEG/α-CD水凝膠對血清免疫球蛋白IgG分子具有穩定化作用[8]。
到目前為止,盡管PEG/α-CD準聚輪烷水凝膠的合成與應用方面有很多研究,但在研究三元體系中蛋白質空間構象的變化及其影響方面卻鮮有報導。探索準聚輪烷水凝膠與蛋白質形成的復合物結構,以及PEG/α-CD對蛋白質結構及活性的影響,對其在緩釋給藥方面的應用具有重要意義。白蛋白是血漿中最豐富的蛋白質,其蛋白質結構早已為人們所知,它可作為許多內源性和外源性化合物的存放和轉運蛋白,對生命活動有著十分重要的作用,因此本研究將牛血清白蛋白(bovine serum albumin,BSA)作為模型蛋白,通過紫外吸收光譜、熒光光譜、X射線粉末衍射(XRD)等技術,研究PEG/α-CD準聚輪烷水凝膠和BSA之間的相互作用。
1 實驗部分
1.1主要原料
聚乙二醇(PEG),相對分子質量1000,分析純,西亞試劑有限公司;α-環糊精(α-CD),分析純,南京奧多福尼生物科技有限公司;牛血清白蛋白(BSA),阿拉丁試劑有限公司;二水合磷酸二氫鈉、十二水合磷酸氫二鈉,分析純,國藥集團化學試劑有限公司;去離子水為實驗室自制。
1.2主要儀器設備
UV1800型紫外/可見分光光度計,上海美譜達儀器有限公司;FLS920型全功能熒光光譜儀,英國Edinburgh公司;X射線粉末衍射儀,日本理學株式會社;冷凍干燥機,日本愛朗公司;500MHz/AVANCE Ⅲ型高分辨率核磁共振波譜儀,瑞士Bruker公司。
1.3準聚輪烷水凝膠生成動力學考察
用pH7.4的磷酸鹽緩沖液配制濃度為0.02g/mL的PEG溶液和0.09g/mL的α-CD溶液,并將1.6 mL α-CD溶液和0.8mL PEG溶液相混合(A液);用上述PEG溶液配制濃度為6mg/mL的BSA溶液(B液),按一定配比加入A液混勻,并控制溶液中BSA濃度分別為0、0.33mg/mL、0.66mg/mL、1.00mg/mL、1.33mg/mL、1.66mg/mL、2.00mg/mL,用UV1800型紫外/可見分光光度計在600nm波長下測定準聚輪烷水凝膠生成過程中濁度隨時間的變化曲線,即動力學曲線,檢測時間為20min。對數據點進行曲線擬合,而后求導,取拐點處的導數值為最大生成速率vmax,并將此點對應的時刻記為臨界時間tc。
1.4水凝膠中BSA的熒光光譜分析
用上述磷酸鹽緩沖液配制濃度為8×10-6mol/L的BSA溶液。在25℃下,將PEG/α-CD準聚輪烷水凝膠與BSA混合,常溫放置2h,測定溶液的熒光光譜。其中,BSA溶液2mL,準聚輪烷的加入量分別為0、10μL、20μL、40μL、80μL、160μL、320μL。以290nm為激發波長,在FLS920型全功能熒光光譜儀上記錄300~500nm波長范圍內的發射光譜。同時測定溶液的同步熒光光譜,即激發和發射單色器同時進行掃描,保持發射波長λem與激發波長λex之間的波長差Δλ=20nm,測定不同濃度水凝膠中BSA的發射峰強度和峰位的變化。
1.5X射線粉末衍射分析
取0.09g/mL的α-CD溶液和0.02g/mL的PEG按體積比2∶1混合,靜置2h,生成準聚輪烷水凝膠后,冷凍干燥24h,制得粉末狀樣品。按同樣方法,在準聚輪烷水凝膠中加入BSA,控制BSA濃度為5mg/mL,靜置2h后冷凍干燥制樣。XRD測試條件為:發射源CuKα(λ=0.154056 nm,40kV,30mA),步長0.02°,掃描速度(2θ)為5°/min。
1.6NOESY譜分析BSA結構的變化
用D2O配置0.09g/mL的α-CD和0.02 g/mL的PEG溶液按體積比2∶1混合,加入BSA,使其濃度為60mg/mL,靜置2h,生成準聚輪烷后,測NOESY譜。另外,測準聚輪烷BSA的NOESY譜。2D NOESY譜采用90°脈沖序列(90°-T1-90°-Tm-90°-T2),混合時間為200ms,采樣數據點陣2048×256;實驗溫度為30℃。
2 結果與討論
2.1準聚輪烷水凝膠生成動力學及BSA的影響
準聚輪烷水凝膠形成過程的動力學曲線如圖1所示。PEG與α-CD混合后,經過一段時間后,濁度快速上升,而在達到拐點后濁度上升的速率逐漸減緩,最終達到極值,表現出“S”形曲線。圖1表明,隨著水凝膠中BSA濃度的增加,達到同樣濁度所需的時間逐漸變長,表明水凝膠的生成速率下降。通過曲線擬合及求導而得不同BSA濃度下vmax和tc的值及其變化情況,如圖2所示。從圖2中可看出,隨著BSA濃度的提高,vmax逐漸下降,而tc逐漸延長。這一現象說明BSA與水凝膠之間存在一定的相互作用,BSA的存在將延緩PEG與α-CD的自組裝。這一方面可能是由BSA與α-CD的相互作用所致,主要表現為BSA的局部疏水性區域的芳香族氨基酸殘基(如苯丙氨酸Phe、色氨酸Trp、酪氨酸Tyr等)被未反應的α-CD所占據,導致BSA與PEG的競爭反應致使反應速率降低[9-10]。另一方面,BSA與PEG也存在相互作用,當PEG分子量大到一定程度時,會與蛋白質相互纏繞,將蛋白質包裹住,使BSA無形中阻礙了PEG的自由度,導致PEG與CD的碰撞概率降低[11]。
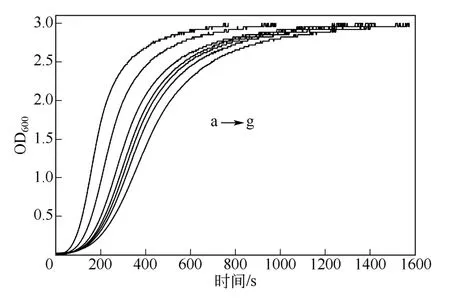
圖1 BSA對準聚輪烷形成的影響
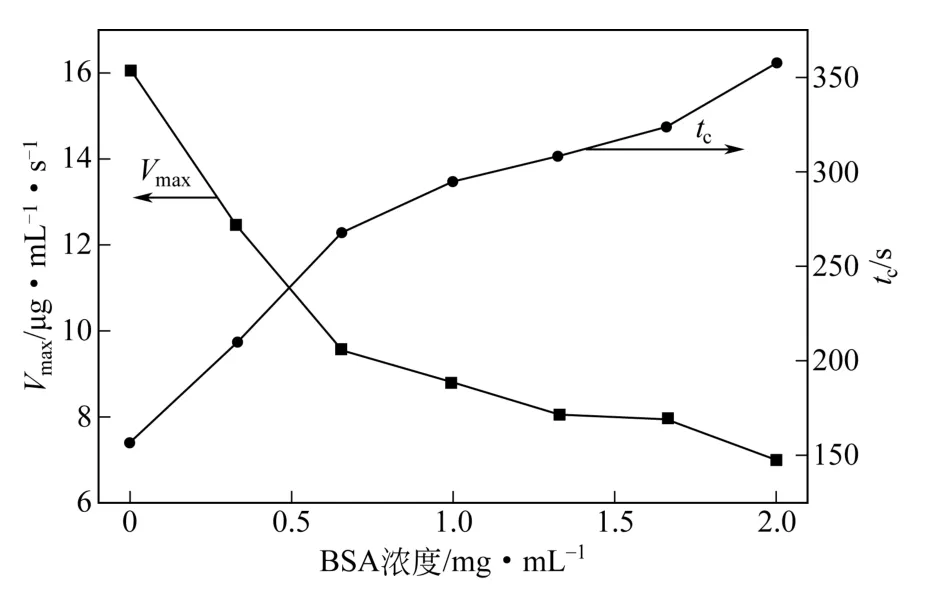
圖2 不同BSA濃度下準聚輪烷形成的Vmax與tc
2.2準聚輪烷水凝膠對BSA熒光強度的影響
BSA是一種熒光較強的蛋白質,每個BSA分子含有26個Phe殘基,19個Tyr殘基和2個Trp殘基,這3種氨基酸殘基自身都具有熒光性。在測定蛋白質的熒光光譜時,通常Phe和Tyr的能量會轉移到Trp上,因此,大多數蛋白質(包括BSA)所顯現的熒光幾乎都是Trp的熒光。在BSA中,2個Trp殘基分別位于134位和213位,而熒光主要是由213位的Trp殘基引起的[12]。在2.1節中提到BSA與準聚輪烷發生了相互作用,為了進一步的說明這種相互作用的存在,測定了在不同量的準聚輪烷存在下的BSA的熒光光譜。圖3為在加入不同量的準聚輪烷水凝膠時BSA的熒光光譜。從圖3可知,水凝膠自身并不具有熒光性,但是當加入量增大到一定程度時,BSA的熒光強度隨著水凝膠濃度的增加逐漸降低。作者認為這可能是由于準聚輪烷水凝膠形成的過程中,逐漸把蛋白質包裹在其中,當凝膠的量大時,在物理結構上會顯得比較硬,使得蛋白質分子被束縛在其中,空間上變得“擁擠”,分子運動受到一定限制,甚至會造成三級結構的改變,導致Trp殘基周圍微環境的變化,從而使BSA的熒光強度降低。但是在水凝膠濃度比較低時,其結構較松軟,對BSA的束縛程度小,所以熒光強度的降低并不明顯。另外,據RAWAT等[13]的報道,聚乙二醇會和BSA發生相互作用,當BSA分子的三級結構在溶液中稍微發生解折疊時,Trp殘基會逐漸暴露在溶液中并與聚乙二醇發生相互作用,致使BSA熒光強度降低并紅移。在本實驗中,BSA的熒光光譜也發生了5nm的輕微紅移,這與RAWAT等的結論一致。
由以上的分析可以得到BSA的三級結構發生了輕微的變化,至少蛋白質的部分部位發生了變化。為進一步說明這種變化的存在,測定了BSA的同步熒光光譜,設定Δλ=20nm,考察另一種氨基酸殘基Tyr殘基微環境的變化,結果如圖4所示。從圖4中可以看到,隨著加入的水凝膠量的增加,熒光強度會逐漸降低,并且發生輕微的藍移現象,說明Tyr殘基的微環境也發生了微小的變化。由此可以基本確定當BSA中加入準聚輪烷水凝膠時,蛋白結構會有一定的變化,但變化幅度很小。HIGASHI等[6,12]所做的緩釋體系的研究結果也間接證明這一結論。
2.3BSA與PEG/α-CD準聚輪烷在固相時的XRD衍射圖譜分析
為了探討BSA與PEG/α-CD體系在固相狀態下的相互作用,可采用XRD圖譜進行比較分析。圖5為BSA與準聚輪烷相互作用前后,BSA、準聚輪烷及其三元水凝膠體系的XRD圖譜。比較準聚輪烷與BSA/水凝膠的XRD圖,可以看到兩者的峰形大體上一致,但在6.56°、11.54°、13.16°、20.56°這些2θ值的位置,BSA/水凝膠具有一些新的峰,而在11.36°、13.08°、22.04°等處BSA/水凝膠不具有準聚輪烷的衍射峰。比較BSA與BSA/準聚輪烷的XRD圖可以看到,BSA在與準聚輪烷混合前后峰形發生了很大的變化,BSA除了在22°和32°~34°的峰與BSA/水凝膠比較一致外,其余角度的BSA衍射峰在與準聚輪烷混合后均消失。由此可以得出結論,BSA與準聚輪烷不只是單純的混合,它們在溶液中會發生一定的相互作用,甚至可能生成復合物,致使水凝膠的晶型結構發生變化。
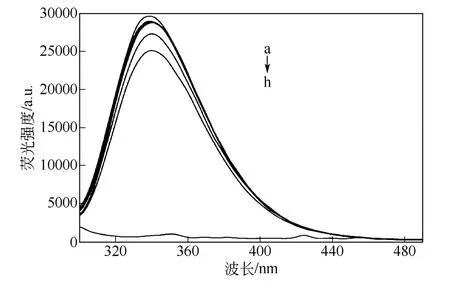
圖3 不同準聚輪烷濃度下BSA的熒光光譜
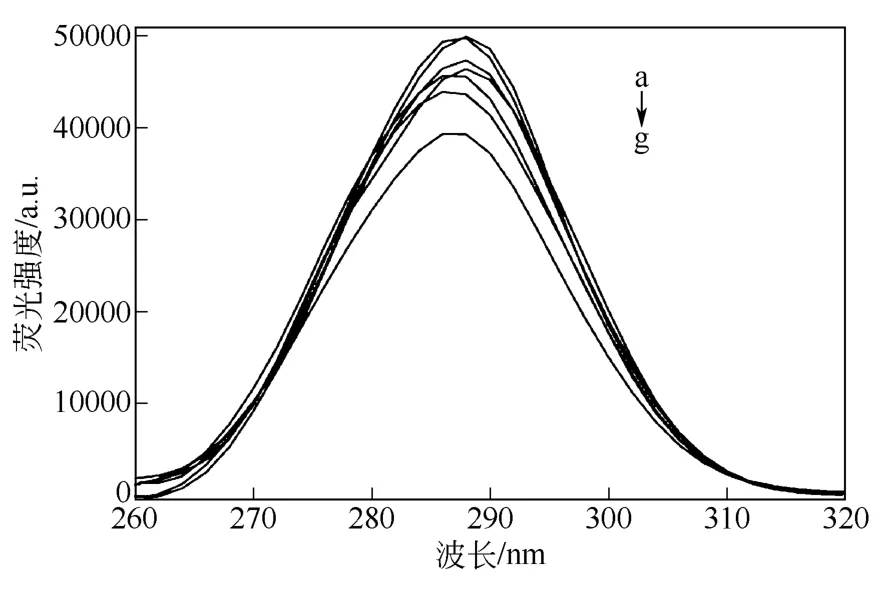
圖4 不同準聚輪烷濃度下BSA的同步熒光光譜
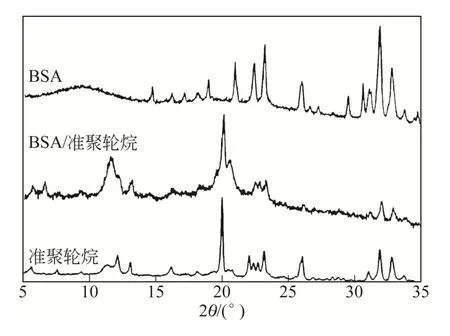
圖5 X射線粉末衍射圖
2.4BSA與PEG/α-CD準聚輪烷相互作用的NOESY譜
二維核磁共振中的NOESY譜是研究蛋白結構變化的一種常用手段,可用于分析化合物內所有空間距離相近的氫原子對。圖6為BSA與PEG/α-CD準聚輪烷相互作用前后的NOESY譜。從圖中可以看出BSA與PEG/α-CD結合前后兩者部分基團的化學位移都發生的一定的變化。比較圖6(a)和圖6(b),在BSA與準聚輪烷結合前后,在化學位移1.3附近,BSA的氫原子發生了偏移,可歸屬為BSA中脂肪族氨基酸(纈氨酸、亮氨酸、異亮氨酸等)側鏈氫原子的峰[14],說明BSA中脂肪族氨基酸側鏈與準聚輪烷的空間距離近,可以發生一定的相互作用。BSA中芳香族氨基酸氫原子的特征峰出現在3~4.5附近,但與PEG/α-CD準聚輪烷的峰存在交疊。比較圖6(a)和圖6(c)在3.4~4和5附近的峰,可以看出PEG/α-CD準聚輪烷的峰發生了明顯的變化,說明PEG/α-CD準聚輪烷氫原子與BSA中的氫原子之間產生了相互耦合作用。基于以上討論可以認為,BSA與PEG/α-CD準聚輪烷之間存在相互作用。
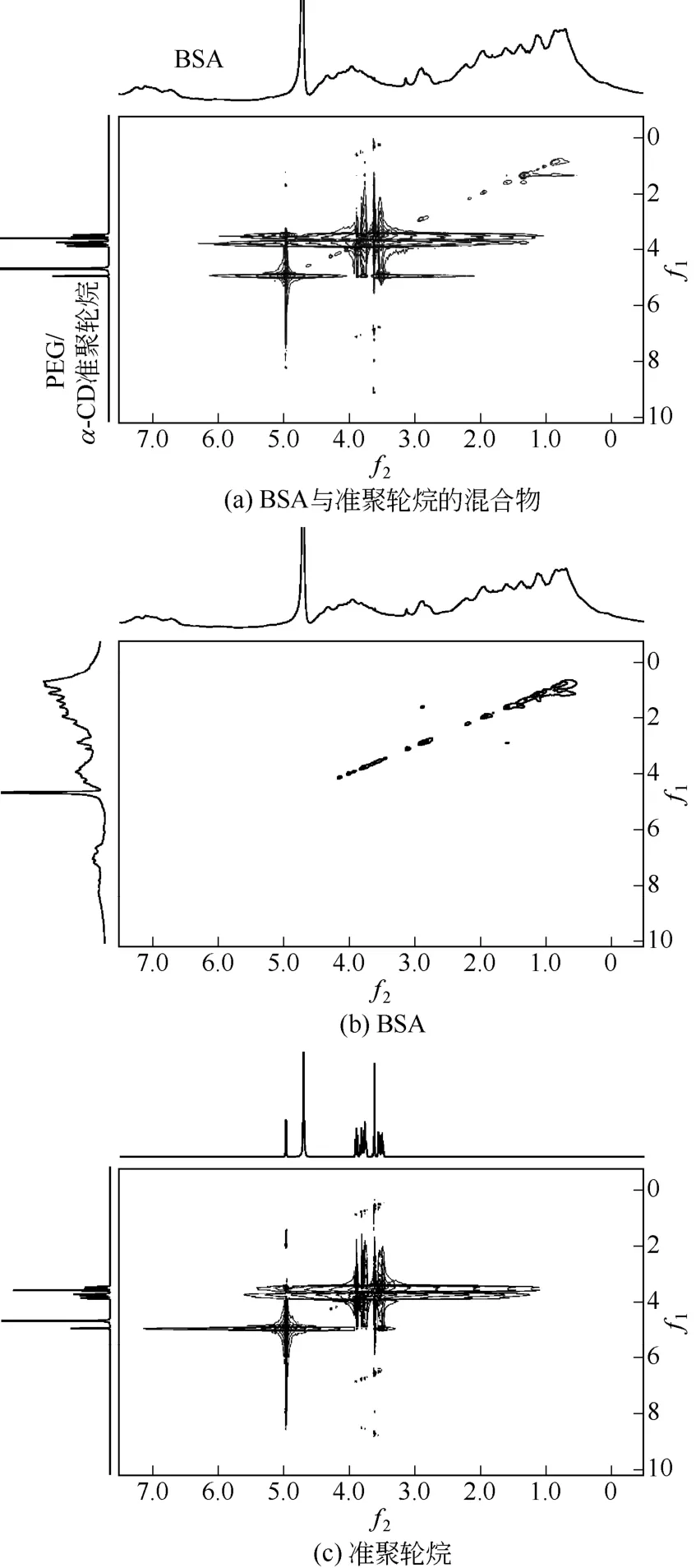
圖6 BSA與PEG/α-CD準聚輪烷相互作用的NOESY譜
3 結 論
通過紫外-可見吸收光譜、熒光光譜、XRD、NOESY譜分析等技術對BSA和準聚輪烷水凝膠混合物的分析,可以得出以下主要結論。
(1)在準聚輪烷水凝膠體系中,隨著BSA濃度的提高,BSA會抑制PEG和α-CD的穿環反應而使水凝膠的形成速率減緩。
(2)BSA與準聚輪烷形成的三元體系中,它們的作用是相互的,不僅是BSA會影響準聚輪烷的形成速率和晶型結構,而且當準聚輪烷濃度逐漸增大時,BSA的構象也會受到準聚輪烷的影響而發生變化。
[1] HARADA A,KAMACHI M. Complex formation between poly(ethylene glycol) and α-cyclodextrin[J]. Macromolecules,1990,23(10):2821-2823.
[2] HARADA A,LI J,KAMACHI M. The molecular necklace:a rotaxane containing many threaded α-cyclodextrins[J]. Nature,1992,356(6367):325-327.
[3] HARADA A. Cyclodextrin-based molecular machines[J]. Acc. Chem. Res.,2001,34(6):456-464.
[4] WENZ G,HAN B H,MULLER A. Cyclodextrin rotaxanes and polyrotaxanes[J]. Chem. Rev.,2006,106(3):782-817.
[5] GIBSON H W,BHEDA M C,ENGEN P T. Rotaxanes,catenanes,polyrotaxanes,polycatenanes and related materials[J]. Prog. Polym. Sci.,1994,19(5):843-945.
[6] HIGASHI T,HIRAYAMA F,MISUMI S,et al. Polypseudorotaxane formation of randomly-pegylated insulin with cyclodextrins:slow release and resistance to enzymatic degradation[J]. Chem. Pharm. Bull.,2009,57(5):541-544.
[7] HIGASHI T,HIRAYAMA F,YAMASHITA S,et al. Slow-release system of pegylated lysozyme utilizing formation of polypseudorotaxanes with cyclodextrins[J]. Int. J. Pharm.,2009,374(1/2):26-32.
[8] HIGASHI T,TAJIMA A,OHSHITA N,et al. Design and evaluation of the highly concentrated human IgG formulation using cyclodextrin polypseudorotaxane hydrogels[J]. AAPS Pharm. Sci. Tech.,2015,16(6):1290-1298.
[9] ROGOZEA A,MATEI I,TURCU I M,et al. EPR and circular dichroism solution studies on the interactions of bovine serum albumin with ionic surfactants and beta-cyclodextrin[J]. J. Phys. Chem. B,2012,116(49):14245-14253.
[10] LIU Y,LIU Y,GUO R. Insights into cyclodextrin-modulated interactions between protein and surfactant at specific and nonspecific binding stages[J]. J. Colloid Interface Sci.,2010,351(1):180-189.
[11] WU J,ZHAO C,LIN W,et al. Binding characteristics between polyethylene glycol(PEG)and proteins in aqueous solution[J]. J. Colloid Interface Sci.,2014,2(20):2983-2992.
[12] HIGASHI T,HIRAYAMA F,MISUMI S,et al. Design and evaluation of polypseudorotaxanes of pegylated insulin with cyclodextrins as sustained release system[J]. Biomaterials,2008,29(28):3866-3871.
[13] RAWAT S,RAMAN S C,SAHOO D K. Molecular mechanism of polyethylene glycol mediated stabilization of protein[J]. Biochem. Biophys. Res. Commun.,2010,392(4):561-566.
[14] OI W,ISOBE M,HASHIDZUME A,et al. Macromolecular recognition:discrimination between human and bovine serum albumins by cyclodextrins[J]. Macromol. Rapid Comm.,2011,32:501-505.
Spectroscopic study of the interaction between PEG/α-cyclodextrin pseudopolyrotaxane hydrogel with BSA
LIN Jiduan1,ZHAO Jun1,2
(1Department of Bioengineering and Biotechnology,College of Chemical Engineering,Huaqiao University,Xiamen 361021,Fujian,China;2Institute of Oil and Natural Products,Huaqiao University,Xiamen 361021,Fujian,China)
Self-assembled pseudopolyrotaxane hydrogel formed by polyethylene glycol(PEG)and cyclodextrin(CD)can be used as a slow-release carrier for proteins. In this ternary system,there may be certain interactions between PEG,CD and proteins. With bovine serum albumin(BSA)as the model protein,the structure changes of BSA in the PEG/α-CD pseudopolyrotaxane hydrogel was studied by ultraviolet-visible absorption spectrum,fluorescence spectrum,powder X-ray diffraction(XRD)techniques,and NOESY spectra. The results showed that BSA had a significant effect on the formation rate of the hydrogel. The fluorescence and synchronous fluorescence spectrum analysis showed that the ternary structure of BSA had minor changes in the hydrogel,which led to red-shift of the maximum fluorescence emission wavelength,and the microenvironment of Trp and Tyr residues also changed slightly in the hydrogel. These changes became more significant with the increasing of BSA concentration. Moreover,when BSA was added,the diffraction angles in XRD spectra at 2θ = 6.56°,11.54°,12.06°,20.56°,22.04°and 26.04°showed remarkable changes compared with those of the pure pseudopolyrotaxane,demonstrating that the crystalline pattern of PEG/α-CD pseudopolyrotaxane was changed in the presence of BSA. The results reflected that BSA was not simply physically mixed with the PEG/α-CD pseudopolyrotaxane hydrogel,but that it might prefer to form complexes with the hydrogel. 2D NOESY spectra also showed that the presence of mutual coupling of hydrogen atoms between BSA and PEG/α-CD,demonstrated the interaction between them.
pseudopolyrotaxane hydrogel;bovine serum albumin;cyclodextrin;polyethylene glycol;spectroscopy;powder X-ray diffraction
O 636.1
A
1000-6613(2016)11-3590-05
10.16085/j.issn.1000-6613.2016.11.031
2016-01-28;修改稿日期:2016-06-15。
福建省自然科學基金(2013J05028)、華僑大學引進人才科研啟動項目(11BS408)及華僑大學研究生科研創新能力培育計劃項目。
林集端(1990—),男,碩士研究生,研究方向為環糊精水凝膠。聯系人:趙珺,博士,講師。E-mail zhaojun@hqu.edu.cn。

