二穗短柄草成熟胚再生體系建立及農桿菌介導轉化研究
胡文祥,楊幗一, 劉 童, 趙惠賢,2, 劉香利,2
(1.西北農林科技大學生命科學學院,陜西楊陵 712100; 2.旱區作物逆境生物學國家重點實驗室,陜西楊陵 712100)
?
二穗短柄草成熟胚再生體系建立及農桿菌介導轉化研究
胡文祥1,楊幗一1, 劉 童1, 趙惠賢1,2, 劉香利1,2
(1.西北農林科技大學生命科學學院,陜西楊陵 712100; 2.旱區作物逆境生物學國家重點實驗室,陜西楊陵 712100)
為建立二穗短柄草組織培養及遺傳轉化體系,以二穗短柄草BD21-3成熟胚為外植體,對成熟胚愈傷誘導、分化以及農桿菌侵染條件進行了研究。結果表明,在含有2.5 mg·L-12,4-D的培養基上,愈傷組織出愈率最高為93.83%;在含有0.2 mg·L-1KT的分化培養基上,分化率最高為38.18%;對二穗短柄草胚性愈傷組織農桿菌轉化和GUS染色結果表明,侵染的過程中農桿菌菌液濃度OD600為0.6、侵染時間為5 min時轉化率最高。
二穗短柄草;成熟胚;愈傷組織;農桿菌
擬南芥作為重要的模式植物在植物基因功能研究中起著非常重要的作用,但擬南芥屬于雙子葉植物,其與單子葉植物在進化上關系較遠,而許多禾谷類植物的性狀,如抗病性、穗與穎殼發育相關基因分析、籽粒產量和品質相關基因功能驗證等研究,以擬南芥為模擬植物就有一定的限制和不足。水稻(Oryzasativa)作為第一個完成全基因組測序的禾本科植物,具有基因組小、功能基因組資源廣泛等多方面的優勢[1-2]。但水稻由于生長周期長,對生長環境要求高,尤其是在高產基因試驗方面要求更高,且它很早就從冷季型禾本科中分離出來,其作為禾本科其他亞科的模式植物就有一定的局限性[3]。因此,需要尋找一種新型的、更合適的禾草模式植物。
二穗短柄草(Brachypodiumdistachyon)屬于禾本科早熟禾亞科短柄草族短柄草屬,一年生溫帶植物,與模式植物擬南芥有很多共同的特點:基因組小、植株矮小、自花授粉、繁殖力強、生長周期短、遺傳資源豐富等[4-9]。擁有模式植物所必備的生物學特性,且與很多重要的谷類作物如小麥、大麥、燕麥、玉米、水稻、高粱等以及許多牧草與草坪草有較近的親緣關系,其基因與小麥有很高的相似性和共線性[10-11]。二穗短柄草的這些特性使其成為重要的禾谷類模式植物。
作為功能基因組研究的模式植物,其組織培養再生及遺傳轉化體系的建立至關重要。目前,幼胚是二穗短柄草胚性愈傷組織在組織培養和遺傳轉化中使用最多的外植體。Draper等[10]研究發現,在加有2.5 mg·L-12,4-D的LS培養基上,二穗短柄草ABR1的胚性愈傷組織誘導率達到了45%;并初步證明了基因槍法轉化二穗短柄草的可行性。Christiansen等[12]用基因槍法獲得了二倍體二穗短柄草和多倍體二穗短柄草的轉基因植株,但其得到的轉化效率均在5%左右或更低。之后,更多學者嘗試用基因槍法轉化二穗短柄草,但基因槍轉化法最顯著的缺點是多拷貝插入,從而造成不規則的分離,穩定性差,試驗成本較高。Vogel等[9]對來源于美國國家植物種質系統(NPGS)的二穗短柄草二倍體品系進行了農桿菌介導的轉化研究,發現3個二倍體品系的再生率為4%~11%,多倍體品系的再生率為0.4%~15%。與基因槍轉化相比,農桿菌介導的轉化中,T-DNA插入常常是一個或最多幾個位點的插入。用農桿菌轉化擬南芥和水稻的轉基因植物中,平均僅有1.5和1.4個拷貝T-DNA的插入[13-14]。農桿菌已被用來轉化多種禾本科植物,成為某些禾本科植物轉化的常規方法[15]。
成熟胚因取材方便,生理狀態較為一致,是禾谷類作物如小麥、水稻等轉基因研究的理想外植體。目前國內外對二穗短柄草成熟胚的再生與遺傳轉化研究報道很少[16]。因此,本試驗以二穗短柄草品系BD21-3的成熟胚為外植體材料,通過對成熟胚愈傷組織誘導、分化、生根以及農桿菌侵染條件的研究,建立二穗短柄草成熟胚組織培養再生及轉化體系,以期為小麥等禾谷類作物的品質改良、遺傳轉化以及基因功能驗證奠定理論基礎。
1 材料與方法
1.1材 料
二穗短柄草品系BD21-3溫室種植后的成熟種子用于成熟胚培養;農桿菌菌株GV3101由本研究室保存;載體選用pCAMBIA3301[內含bar基因(膦絲菌素乙酰轉移酶基因)、gus報告基因(β-葡糖苷酸酶基因)],其T-DNA區如圖1。

35S promoter:花椰菜花葉病毒啟動子 35S promoter:Cauliflower mosaic virus圖1 pCAMBIA3301質粒T-DNA區Fig.1 T-DNA region of pCAMBIA3301
愈傷組織誘導及繼代培養基:MS基本培養基 + 2.5 mg·L-12,4-D + 0.6 mg·L-1CuSO4+ 0.5 mg·L-1酸水解酪蛋白 + 30 g·L-1蔗糖 + 7 g·L-1瓊脂;共培養培養基:MS基本培養基 + 2.5 mg·L-12,4-D + 0.2 mmol·L-1乙酰丁香酮 + 10 g·L-1葡萄糖(固體培養基另加7 g·L-1瓊脂);愈傷組織分化培養基:MS基本培養基 + 500 mg·L-1酸水解酪蛋白 + 30 g·L-1蔗糖 + 7 g·L-1瓊脂,添加不同濃度的KT、6-BA;生根培養基:1/2 MS基本培養基 + 0.6 mg·L-1IAA + 15 g·L-1蔗糖 + 7 g·L-1瓊脂。以上培養基pH均為5.8,并在121 ℃下高壓滅菌20 min后備用。
1.2方 法
1.2.1種子預處理
二穗短柄草BD21-3種子于超凈工作臺中用75%乙醇消毒45 s,無菌水沖洗3~5次,然后用0.2%的次氯酸鈉消毒3~5 min,無菌水沖洗3~5次,于無菌水中浸泡過夜后在超凈工作臺中剝取成熟胚。
1.2.2愈傷組織誘導及繼代
將剝取的二穗短柄草BD21-3的成熟胚置于愈傷組織誘導培養基中,24±2 ℃暗培養誘導愈傷組織,每2周繼代一次,2周后統計愈傷組織出愈率,7~8周后統計胚性愈傷率。
出愈率= 愈傷組織數/接種的胚數×100%
胚性愈傷率=胚性愈傷組織數/接種的胚數×100%
1.2.3愈傷組織分化及植株再生
將生長7~8周的胚性愈傷組織轉至生根培養基中,24±2 ℃、光暗比16/8 條件下培養2~3周后觀察分化情況,統計分化植株。將分化后高于3 cm的幼苗轉入生根培養基進行生根。再生率=再生綠苗數/胚性愈傷組織數×100%
1.2.4成熟胚愈傷組織的農桿菌轉化及瞬時表達檢測
胚性愈傷組織農桿菌轉化:挑取含有質粒pCAMBIA3301的農桿菌GV3101單菌落,接種于含有50 mg·L-1卡那霉素和30 mg·L-1利福平的YEB液體培養基;28 ℃培養48 h后,按1%接種擴大培養;28 ℃培養4~6 h后至OD600值約為0.6和0.8, 5 000 r·min-1離心5 min收集菌體;用液體的共培養培養基懸浮,分別侵染生長狀態良好的胚性愈傷組織,分別侵染5 min 和15 min。侵染結束后用無菌濾紙吸干成熟胚胚性愈傷組織表面液體;將胚性愈傷組織接種到固體的共培養培養基中,24±2 ℃黑暗共培養3 d 后進行GUS組織化學染色。
GUS組織化學染色:GUS組織化學檢測參照Jefferson等[17]的方法進行。共培養3 d后的胚性愈傷組織用無菌水洗去表面的農桿菌,浸入X-Gluc溶液,37 ℃保溫染色24~48 h,95%乙醇脫色,觀察藍色反應,統計藍色愈傷組織數。
GUS陽性率=出現藍斑愈傷數/轉化愈傷數×100%
2 結果與分析
2.1愈傷發生與胚性愈傷組織的形成
二穗短柄草BD21-3成熟胚接到繼代培養基上7 d左右就會形成乳白色的愈傷組織(圖2A),愈傷組織生長狀況良好。隨著不斷繼代,愈傷組織進一步生長膨大,5~7周后開始形成淡黃色、顆粒狀的胚性愈傷組織(圖2B)。從表1可以看出,在誘導培養基上,兩批材料的出愈率均較高,分別為92.5%和93.8%,胚性愈傷組織形成率分別為62.3%和55.2%。
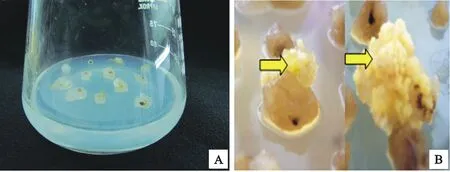
A:二穗短柄草成熟胚誘導的愈傷組織;B:繼代后形成的胚性愈傷組織
A:Callus induced by the mature embryo ofBrachypodiumdistachyon;B:Embryonic callus after several rounds

圖2 成熟胚愈傷組織誘導Fig.2 Callus induction of mature embryo表1 成熟胚的誘導率Table 1 Frequency of callus induction from mature embryo
2.2不同激素配比對二穗短柄草成熟胚胚性愈傷組織再生的影響
二穗短柄草成熟胚愈傷組織經過繼代7~8周后開始形成致密的胚性愈傷組織,將胚性愈傷組織轉至加有不同濃度KT的分化培養基中,生長2周后愈傷組織逐漸分化出綠芽(圖3A),進一步分化形成植株(圖3B),分化結果統計如表2。由表2可以看出,隨著KT濃度的增加,愈傷組織分化率成先上升后降低的趨勢,在KT濃度為0.2 mg·L-1時,其再生率達到最高,為38.18%。曾嘗試在含有0.2 mg·L-1KT的分化培養基中加入不同濃度的6-BA,結果發現加入6-BA后,胚性愈傷組織并沒有正常分化和再生,且隨著6-BA濃度的增加,褐化逐漸加深并且最終導致愈傷死亡。
2.3IAA對植株生根的影響
分化小苗轉至生根培養基后逐漸分化形成根(圖4),觀察10株分化小苗的生根狀況發現,10 d后,加入IAA的生根培養基中分化小苗可形成根,而不加IAA的培養基中的分化小苗則未出現根;20 d后兩種處理的分化小苗均能形成根,但加IAA的培養基中小苗生根數目較多(圖5)。

A:胚性愈傷組織分化出綠芽;B:胚性愈傷組織分化
A:Green buds on embryonic callus;B:Differentiation of embryonic callus
圖3胚性愈傷組織分化
Fig.3Differentiation of embryonic callus

圖4 二穗短柄草再生植株及其生根Fig.4 Regeneration and rooting of Brachypodium distachyon

圖5 不同時間下兩種培養基中分化小苗的生根數Fig.5 Number of roots differentialion seeding with different duration in two types medium
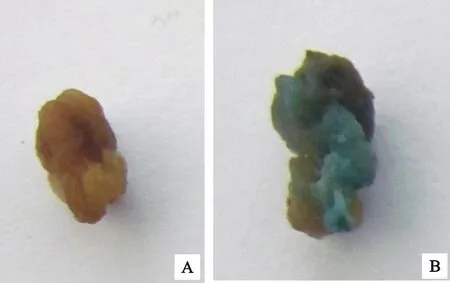
A:對照;B:侵染后愈傷組織
A:Control;B:Callus after infection
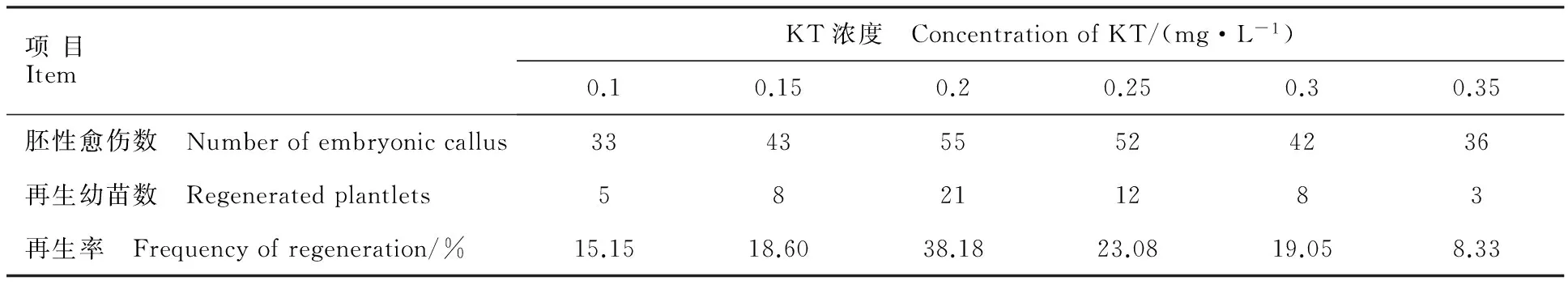
圖6 GUS染色Fig.6 GUS staining表2 不同KT濃度對二穗短柄草再生的影響Table 2 Effects of different concentration of KT on regeneration of Brachypodium distachyon
2.4成熟胚胚性愈傷組織的農桿菌侵染和瞬時表達檢測
為了確定二穗短柄草成熟胚愈傷組織農桿菌侵染的最適菌液濃度和侵染時間,選用生長狀態良好的胚性愈傷組織,用含有GUS報告基因質粒pCAMBIA3301的農桿菌侵染,共培養3 d后進行GUS瞬時染色。對照未染色,轉化后的愈傷組織被染成藍色(圖6),對GUS染色后的陽性愈傷組織進行統計,結果如表3。隨著侵染時間延長,愈傷組織褐化增加,GUS陽性率降低,菌液濃度OD600為0.6、侵染時間為5 min時,GUS陽性率最高,為66.00%。

表3 不同菌液濃度與侵染時間的GUS染色結果Table 3 GUS activity under different bacterial concentration and different infection duration
3 討 論
在植物組織培養中,2,4-D是人們常用的、最有效的植物激素之一。低濃度的2,4-D有促進植物生長發育的作用,當2,4-D濃度為1.0~3.0 mg·L-1時,對胚性愈傷組織的形成具有非常重要的作用[18]。在早期的研究中,Bablak等[19]將3個二穗短柄草品系B200、B373和B377的成熟胚剝至N6和MS培養基上,發現加有2.5 mg·L-12,4-D的MS和N6培養基最適合二穗短柄草胚性愈傷組織的形成。之后,Draper等[10]以二穗短柄草ABR1幼胚為材料,研究其胚性愈傷組織誘導與再生,同樣發現在加了2.5 mg·L-12,4-D的LS培養基上,其胚性愈傷組織誘導率為45%。本研究選用了Bablak所述的含2.5 mg·L-12,4-D的MS培養基進行成熟胚愈傷組織誘導,發現二穗短柄草BD21-3成熟胚愈傷組織的誘導率可達90%以上,且胚性愈傷組織誘導率達到了50%以上,與吳雪莉等[20]以幼胚為外植體得到的愈傷組織和胚性愈傷組織研究結果相似。同時高于Draper等[10]的報道,說明成熟胚可高效地誘導形成胚性愈傷組織。
在愈傷組織分化方面,Vogel等[9]報道,在0.23 mg·L-1KT下,短柄草19個基因型的幼胚愈傷組織分化率在0~90%。董 芳等[21]報道,在加有0.2 mg·L-1KT 和0.5~1.0 mg·L-16-BA下,ABR6和ABR102的幼胚最高分化率分別為64.12%和71.25%;KT較6-BA效果更明顯,6-BA濃度越高褐化現象越嚴重,且分化率沒有明顯提高。本試驗對KT濃度和6-BA濃度進行了摸索,發現在加有0.2 mg·L-1KT的分化培養基中,分化率最高達到了38.18%,同時還發現在加了6-BA的培養基中,胚性愈傷褐化嚴重,且分化受到嚴重抑制,最終導致愈傷組織死亡。
二穗短柄草遺傳轉化研究主要側重于幼胚的轉化。Vogel等[9]構建了一種農桿菌介導的遺傳轉化體系,成功轉化了19個株系中的10種,其轉化率為0.4%~15%。隨后,Vogel等[22]在原有的轉化體系基礎上改進了轉化方法,用濾紙替代培養基進行共培養,使得最終的轉化率提高了15倍,使得二穗短柄草的遺傳轉化達到了與水稻轉化體系相同的效率[23]。本試驗對農桿菌侵染條件進行了摸索,初步確定二穗短柄草BD21-3的農桿菌侵染菌液的濃度為OD600=0.6,侵染時間為5 min,其GUS活性最高,達到了66.00%。該研究為二穗短柄草遺傳轉化以及利用二穗短柄草BD21-3進行小麥、大麥等谷類作物的基因功能研究奠定了基礎。
[1]Havukkala I J.Cereal genome analysis using rice as a model [J].CurrentOpinioninGenetics&Development,1996,6:711-714.
[2]Tyagi A K,Mohanty A.Rice transformation for crop improvement and functional genomics [J].PlantScience,2000,158:1-18.
[3]Gaut B S.Evolutionary dynamics of grass genomes [J].NewPhytologist,2002,154:15-28.
[4]Caetano-Anolles G.Evolution of genome size in the grasses [J].CropScience,2005,45:1809-1816.
[5]Catalan P,Olmstead R G.Phylogenetic reconstruction of the genusBrachypodiumP.Beauv.(Poaceae) from combined sequences of chloroplastndhFgene and nuclear ITS [J].PlantSystemEvolution,2000,220:1-19.
[6]Kellogg E A.Evolutionary history of the grasses [J].PlantPhysiology,2001,125:1198-1205.
[7]王宏歸,王保莉,林辰濤,等.二穗短柄草Bd21的形態學觀察[J].西北農業學報,2007,16(6):296-300.
Wang H G,Wang B L,Lin C T,etal.Morphology ofBrachypodiumdistachyon(L.) [J].ActaAgriculturaeBoreali-occidentalisSinica,2007,16(6):296-300.
[8]Shi Y,Draper J,Stace C.Ribosomal DNA variation and its phylogenetic implication in the genusBrachypodium(Poaceae) [J].PlantSystematicsandEvolution,1993,188:125-138.
[9]Vogel J P,Garvin D F,Leong O M,etal.Agrobacterium-mediated transformation and inbred line development in the model grassBrachypodiumdistachyon[J].PlantCellTissueandOrganCulture,2006,84:199-211.
[10]Draper J,Mur L A J,Jenkins G,etal.Brachypodiumdistachyon.A new model system for functional genomics in grasses [J].PlantPhysiology,2001,127:1539-1555.
[11]Hasterok R,Marasek A,Donnison I S,etal.Alignment of the genomes ofBrachypodiumdistachyonand temperate cereals and grasses using bacterial artificial chromosome landing with fluorescenceinsituhybridization [J].Genetics,2006,173:349-362.
[12]Christiansen P,Andersen C H,Didion T,etal.A rapid and efficient transformation protocol for the grassBrachypodiumdistachyon[J].PlantCellReports,2005,23:751-758.
[13]Feldmann K A.T-DNA insertion mutagenesis inArabidopsis:Mutational spectrum [J].PlantJournal,1991,1:71-82.
[14]Jeon J S,Lee S,Jung K H,etal.T-DNA insertional mutagenesis for functional genomics in rice [J].PlantJournal,2000,22:561-570.
[15]Cheng M,Lowe B A,Spencer T M,etal.Invited review:Factors influencingAgrobacterium-mediated transformation of monocotyledonous species [J].InVitroCellular&DevelopmentalBiology-Plant,2004,40:31-45.
[16]吳雪莉.基因槍法和農桿菌介導二穗短柄草(Brachypodiumdistachyon)成熟胚愈傷組織的遺傳轉化[D].南京:南京農業大學,2009.
Wu X L.Particle bombardment andAgrobacterium-mediated transformation ofBrachypodiumdistachyonthrough embryogenic calli derived from mature embryos [D].Nanjing:Nanjing Agricultural University,2009.
[17]Jefferson R A,Kavanagh T A,Bevan M V,etal.GUS fusion:β-Glucuronidase as a sensitive and versatile gene fusion marker in higher plants [J].EMBOJournal,1987,6:3901-3907.
[18]Chang Y,von Zitzewitz J,Hayes P M,etal.High frequency plant regeneration from immature embryos of an elite barley cultivar(HordeumvulgareL.cv.Morex) [J].PlantCellReports,2003,21:733-738.
[19]Bablak P,Draper J,Davey M R,etal.Plant regeneration and micropropagation ofBrachypodiumdistachyon[J].PlantCellTissueandOrganCulture,1995,42:97-107.
[20]吳雪莉,劉金星,Nielsen K K,等.二穗短柄草幼胚再生體系及農桿菌介導轉化的初步研究[J].草業學報,2010,19(5):9-16.
Wu X L,Liu J X,Nielsen K K,etal.Agrobacterium-mediated transformation ofBrachypodiumdistachyonthrough embryogenic calli derived from immature embryos [J].ActaPrataculturaeSinica,2010,19(5):9-16.
[21]董 芳,蔡高磊,張 荻,等.二穗短柄草幼胚愈傷組織誘導及高頻再生體系的建立[J].麥類作物學報,2010,30(6):1048-1052,1064.
Dong F,Cai G L,Zhang D,etal.Callus induction and establishment of high-frequency plant regeneration system from immature embryos ofBrachypodiumdistachyon[J].JournalofTriticeaeCrop,2010,30(6):1048-1052,1064.
[22]Vogel J,Hill T.High-efficiencyAgrobacterium-mediated transformation ofBrachypodiumdistachyoninbred line Bd21-3 [J].PlantCellReports,2008,27:471-478.
[23]Tyagi A,Mohanty A.Rice transformation for crop improvement and functional genomics [J].PlantScience,2000,158:1-18.
Establishment ofBrachypodiumdistachyonRegeneration System from Mature Embryos and the Study ofAgrobacterium-mediated Transformation
HU Wenxiang1,YANG Guoyi1,LIU Tong1,ZHAO Huixian1,2,LIU Xiangli1,2
(1.College of Life Science,Northwest A&F University,Yangling,Shaanxi 712100,China;2.State Key Laboratory of Crop Stress Biology for Arid Areas,Yangling,Shaanxi 712100,China)
To establish the regeneration and genetic transformation system ofBrachypodiumdistachyon,the mature embryos ofBrachypodiumdistachyonBD21-3 were used as explant,and the factors affecting the callus induction and theAgrobacteriuminfection were studied in this research. The results showed that the frequency of callus induction was 93.83% on the basic media with 2.5 mg·L-12,4-D. The maximum regeneration frequency (38.18%) was observed on the differential media containing 0.2 mg·L-1KT. The GUS staining showed that the highest GUS activity was obtained when the concentration ofAgrobacteriumwas OD600=0.6 and infection incubation duration was 5 min.
Brachypodiumdistachyon; Mature embryo; Callus;Agrobacterium
時間:2016-05-10
2015-12-09
2016-01-04
國家自然科學基金項目(31101205);國家生命科學與技術人才培養基地大學生創新性實驗計劃項目(1310712082)
E-mail:huwenxiangapple@foxmail.com
劉香利(E-mail: liuxianglii@163.com)
S519;S330
A
1009-1041(2016)05-0589-06
網絡出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160510.1623.016.html

