分子動力學模擬別構抑制劑Efavirenz對HIV-1逆轉錄酶的作用
孟現美 張少龍 張慶剛(山東師范大學物理與電子科學學院,濟南250014)
分子動力學模擬別構抑制劑Efavirenz對HIV-1逆轉錄酶的作用
孟現美張少龍*張慶剛*
(山東師范大學物理與電子科學學院,濟南250014)
為了理解非核苷類逆轉錄酶抑制劑(NNRTIs)與HIV-1逆轉錄酶(RT)的相互作用機制,利用新力場ff12SB對未結合和結合Efavirenz(EFV)逆轉錄酶的三種RT大分子體系分別進行了100 ns的長時間動力學模擬。通過分析EFV對RT結構的影響、不同殘基柔性和不同體系構象的動力學行為等,發現EFV的結合會導致RT結構變化,從而影響RT的活性;證實了EFV的“分子楔”作用;還發現EFV的結合不但引起“拇指關節炎”,而且引起輕度“手指關節炎”;整個模擬過程中沒有出現不同構象間的躍遷,但是無別構分子時的RT張開構象表現出明顯的閉合傾向。這些結果有助于理解NNRTIs的抑制機制和RT構象變化的動力學性質。另外,還比較分析了模擬方法對計算結果的影響,對大分子體系的動力學模擬具有重要借鑒意義。
HIV-I逆轉錄酶;逆轉錄酶抑制劑;別構抑制劑;分子動力學模擬;構象
doi:10.3866/PKU.WHXB201511302
1 引言
逆轉錄酶(RT)在I型人體免疫缺陷病毒(HIV-1)復制過程中,可以催化病毒RNA基因組使之逆轉錄為雙鏈DNA病毒前體,因此是發明抗艾滋病(anti-AIDS)新藥的一個重要靶酶1。目前,以RT為靶治療艾滋病的藥物中,非核苷類RT抑制劑(NNRTIs)被認為是一類具有前景的特效藥2-4。NNRTIs也稱為別構抑制劑,結合在RT的非活性位,可以避免活性位點或底物的選擇性壓力,具有廣譜抗HIV-1耐藥性的特點。如圖1A所示,RT是一個由p66和p51兩個亞基組成的異二聚體5。p66亞基由DNA聚合酶和RNase H結構域構成,其中,DNA聚合酶結構域形狀類似于握杯的右手形,它的3個子域形象地稱之為手指(fingers)、手掌(palm)和拇指(thumb)子域,并通過所謂的連接子(connection)與RNase H結構域連接在一起。p51亞基具有與p66聚合酶結構域同樣的氨基酸序列,但折疊方式不同。如圖1B所示,在p66的拇指和手掌連接處有一個疏水性口袋結構(NNRTI-BP),NNRTIs可以進入并束縛在袋內6。圖中顯示的EFV (Efavirenz)屬于第二代NNRTIs類藥物。
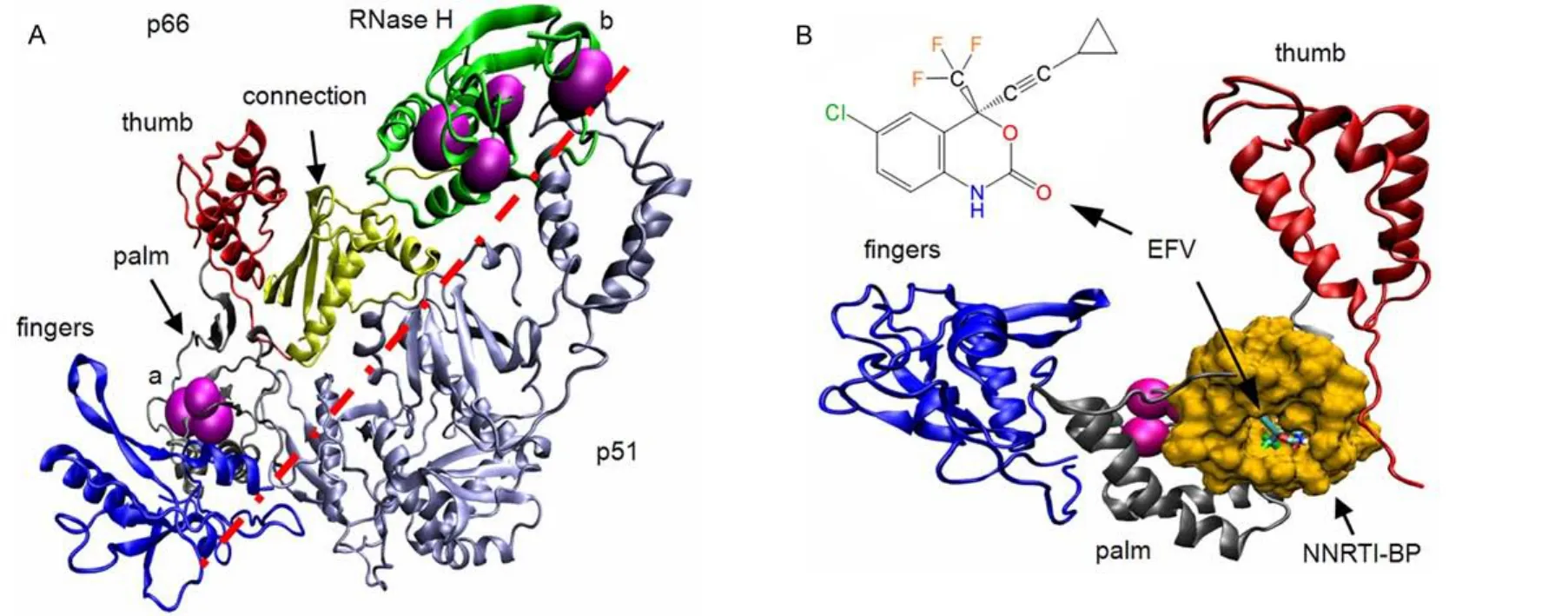
圖1 逆轉錄酶(RT)和別構抑制劑(EFV)的結構Fig.1 Structures of reverse-transcriptase(RT)and the allosteric inhibitor(EFV)
然而,關于NNRTIs和RT的作用機制當前還無一致的理解。一般觀點是建立在實驗晶體數據分析基礎上的“拇指關節炎”或“分子楔”模型7-9,但最近的熒光實驗卻意味NNRTIs的作用會使手指-拇指“握度松動(grip loosening)”,從而抑制聚合催化過程10。理論上也相應地開展了許多工作11-16,主要是利用分子動力學方法研究具有不同初始結構和不同底物的RT動力學性質。由于RT體系過大,所以模擬時間一般只有幾個納秒,所得計算結果也不同。例如,文獻11(3 ns)和12(2.5 ns)的模擬結果支持“拇指關節炎”模型;文獻13 (1 ns)模擬結果表明,去掉NNRTIs后拇指子域會迅速從張開塌向閉合狀態轉變;文獻14(1.1 ns)模擬結果表明,底物會增加RT的柔性。近來,兩個較長時間的動力學模擬結果更是引人關注:Ivetac和McCammon15利用GROMACS程序和GROMOS力場,對具有不同原子初速度的體系副本進行了30 ns的模擬,發現無論APO(無任何抑制劑)還是結合NNRTI的RT體系,其構象發生轉變的幾率都相當可觀(分別為50%和25%);Wright等16用AMBER9和ff03力場進行的計算(模擬時間達100 ns,但步長較大為4 fs)發現,被別構抑制劑撐開的拇指子域可以重返類似APO的閉合狀態。顯然,這些模擬結果有悖于一般的“拇指關節炎”觀點,意味著RT的構象變化和NNRTI的作用機制可能并不像一般認為的那樣。換句話說,無論APO還是加上NNRTI后,RT體系的能量曲面上都可能存在兩個極值點,分別對應張合狀態,且兩個極值點間過渡態的勢壘不高,常溫熱力學運動就會引起從開放狀態到閉合狀態的轉變。如果情況果真如此,藥就將失去抑制功能,抗逆轉錄病毒治療必須考慮這種情況。因此,應該弄清這些模擬結果的可靠性,或者說了解這些現象的發生幾率。對這些問題的闡明將有助于深入理解NNRTIs的抑制機制和聚合酶結構域構象變化的動力學性質,從而為設計更有效的抑制劑提供理論啟發。
分子動力學模擬結果的可靠性依賴于模擬方法和策略,先進的力場、較小的步長、較長的模擬時間以及體系動力學過程的充分穩定平衡將有助于改進計算結果,得到更可信的信息17-19。新的GPU大規模并行計算技術的出現為生物大分子模擬計算提供了更加高效的平臺;新力場ff12SB20,21考慮到了側鏈χ1扭轉勢的重要性僅次于骨架扭轉勢,不只對蛋白的主鏈φ′/ψ′扭轉勢參數做了進一步調整,并且也修正了17個氨基酸側鏈的扭轉勢參數,從而改善了勢函數的精度。
本文采用先進的ff12SB力場,使用GPU計算技術,利用AMBER12程序包20,對結合和未結合別構抑制劑EFV的三種RT體系進行了模擬計算。為了敘述簡潔,結合EFV的RT體系簡稱EBR;未結合EFV,拇指子域為打開的RT體系簡稱為APOO,拇指子域為閉合的簡稱為APOC。研究目的是,(1)別構抑制劑EFV是如何結合到RT的非活性位并影響RT構象;(2)EFV結合到非活性位后對RT穩定性(即結構柔性)會產生怎樣的影響;(3)通過先進的力場、較小的時間步長、較長的模擬時間和嚴格的模擬初始結構,重點探究不同初始構象條件下,RT拇指子域構象的動力學演化性質,以期驗證張合兩個狀態間可能的轉變信息,進而弄清NNRTIs和RT的作用機制。
2 理論計算方法
體系的初始構象取自蛋白質庫(PDB ID:1DLO,1IKW和1HQU)。1DLO中只包含RT,1IKW中包含RT和EFV,1HQU中包含RT和HBY (別構抑制劑)。其中,所有帶別構抑制劑的RT晶體結構都是不完整的,在1IKW中,p51亞基缺失殘基217-231。由于1HQU的晶體結構具有較高的分辨率(0.27 nm),并結合了別構抑制劑,所以我們借助該晶體補全1IKW缺失的殘基,補全的1IKW中,RT共擁有983個殘基。另外,相對于1DLO,1IKW中的RT殘基序列有兩處發生變異,即p66亞基上S280C和E478Q。對于1DLO和1IKW中的RT,因為組成RT的各氨基酸參數預存在庫文件中,所以直接利用AMBERTools12的LEaP模塊,根據ff12SB力場為RT賦鍵參數和靜電參數,并補全缺失的氫原子;對1IKW中的EFV,其力參數和靜電信息是沒有預存的,需要計算生成,我們利用sqm模塊中的AM1-BCC擬合EFV的電荷分布,其力場參數采用GAFF力場參數22和擬合電荷時在Antechamber程序中生成的參數。這樣,處理過的1IKW中的RT和EFV結合在一起組成體系EBR,RT單獨作為體系APOO;處理過的1DLO中的RT作為體系APOC。三個體系外圍都加了1 nm厚的截角八面體水盒子,并分別添加10、10和8個氯離子使之呈電中性。
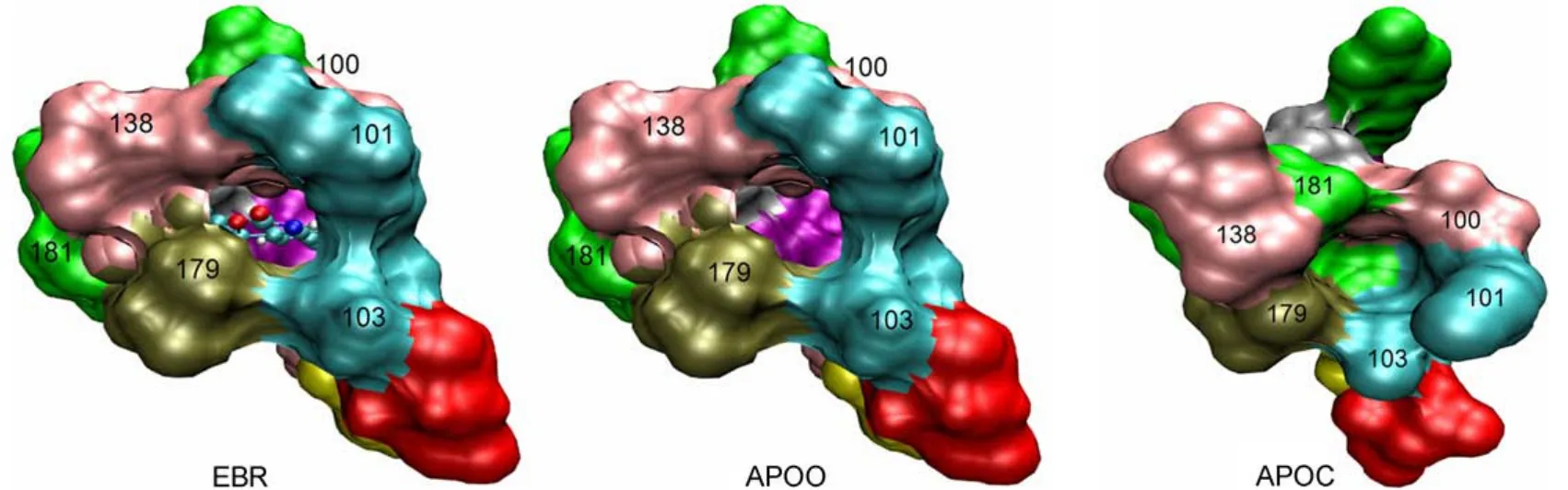
圖2 三個NNRTI-BP體系中結合口袋入口處的初始構象Fig.2 Starting conformations of entrance of the binding pocket in the three RT systems
為了消除原子間的過近接觸,采用AMBER12的PMEMD模塊對三個體系進行能量最小化,先進行25000步最陡下降法計算,后進行25000步共軛梯度法計算,這樣就得到了具有不同初始構象的三個模擬計算樣本。圖2示出了它們的別構袋口處構象,可以清楚看出,EBR、APOO和APOC的袋口分別處于張開、張開、閉合。接下來將上述三個體系的溫度在300 ps內從0 K加熱到300 K,然后進行200 ps的常溫常壓動力學平衡計算,最后對三個體系分別進行100 ns的分子動力學模擬。計算中,時間步長取2 fs,每隔5 ps記錄一次坐標文件,并使用SHAKE算法限制含氫原子的鍵的變化23。模擬過程中同時計算監測系統的總能量、動能和密度隨時間的變化情況。文中所有的結構圖均采用VMD軟件24,25完成。
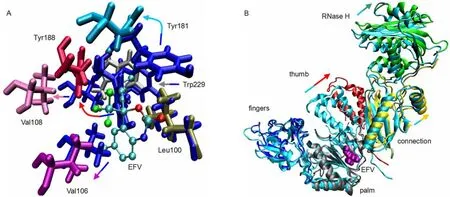
圖3EFV與RT結合后引起的RT結構變化Fig.3 RT structure changes caused by binding EFV
3 結果與討論
3.1EFV與RT結合引起的結構變化
NNRTI-BP由p66亞基上許多含芳環的殘基(Tyr181、Tyr188、Phe227、Trp229、Tyr232),疏水殘基(Lys101、Lys103、Ser105、Val106、Val108、Asp192、Glu224等)以及p51亞基的Glu138組成。口袋的入口位于p66和p51亞基的接合部,由p66亞基的Leu100、Lys101、Lys103、Val179、Tyr181和p51亞基的Glu138環繞組成(圖2)7,26。通過圖2可以看出,沒有結合EFV的APOC體系,在NNRTIBP相應位置存在一個表面凹陷,袋口是閉合的。當EFV結合到RT上時,袋口張開,即RT結構發生了變化,這種變化可以分為結構上的短程和長程變化(圖3)。短程變化如圖3A所示,主要是構成NNRTI-BP的氨基酸位置和取向的變化。變化比較明顯的是Tyr181(淺藍色)、Tyr188(大紅色)和Trp229(灰色)側鏈,未結合EFV時,這三個氨基酸的芳環側鏈指向疏水區核心,EFV的結合造成了側鏈顯著的扭轉,使之遠離疏水核心,從而制造出一個可以容納小分子抑制劑的疏水空間。在這個過程中Val106(粉色)和Val108(紫紅色)兩個殘基發生了明顯的外向位移。進入疏水口袋的EFV通過氫鍵與芳環之間的π鍵和van der Waals等作用與口袋周圍的氨基酸形成穩定的復合物。為了研究EFV導致的RT長程結構變化,將兩個體系的手指子域中Cα原子進行疊合,如圖3B所示,即保持手指位置相對不變,然后測量其它子域方位的相對變化。發現,EFV的結合使拇指子域外旋約38°,連接子和RNase H結構域的位置也分別遠離手指12°和15°。另外我們還發現,RT結合EFV后,p51亞基上的手指、手掌、拇指子域和連接子也分別移動9°、12°、14°和18°。
3.2RMSD變化
均方根偏差(RMSD)是衡量體系穩定性的重要參量20,27,它反映蛋白質分子在動力學模擬過程中偏離初始結構的程度。我們使用AMBER12中的ptraj程序分析了EBR、APOO和APOC三體系的骨架碳原子Cα相對于初始結構的RMSD隨時間的變化(圖4)。可以看出,在整個模擬過程中,體系EBR(紅線)結構的RMSD無論其數值大小還是漲落幅度均明顯低于APOO(黑線)和APOC(藍線),說明體系EBR的穩定性優于APOO和APOC。
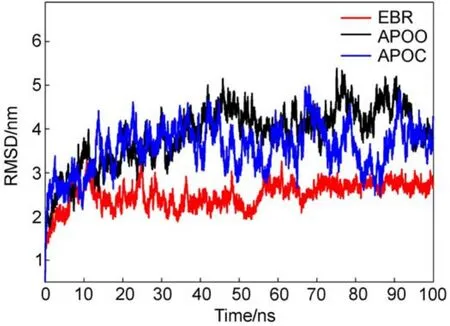
圖4 三體系骨架碳原子Cα的RMSD隨時間的變化Fig.4 Time dependences of root mean square deviation (RMSD)of the backbone Cαatoms for the three systems
具體看,EBR體系的RMSD變化情況比較簡單,最初0-12 ns不太穩定,是一個由小變大趨于平衡的過程,12 ns之后直到模擬結束的100 ns,其值基本穩定在0.24 nm附近,上下浮動范圍約為0.04 nm。對于APOO和APOC兩個體系,在整個模擬時間內,其RMSD表現出了相似的特征,在開始的0-40 ns內,兩個體系的RMSD無論在變化趨勢還是波動幅度上幾乎都是重合的,RMSD值由0.2 nm上升到0.4 nm;在之后的整個模擬時間內,APOO和APOC的RMSD也表現了相似的波動性,只是APOC的RMSD值較小波動幅度較大,二者的RMSD平均值分別約為0.40和0.36 nm,浮動范圍約為0.04和0.10 nm。
EBR體系較小的RMSD值表明,結合別構抑制劑EFV后,RT結構穩定性變好,或者說EFV增加了體系的剛性,這正是一般認為的別構抑制劑NNRTIs的“楔子”作用,它阻止了相關子域的柔性。對于APOO和APOC兩個體系,其RMSD在整個模擬時間內表現出的相似性意味著,沒有抑制劑時,張開狀態(APOO)與閉合狀態(APOC)具有類似的動力學行為。值得注意的是,這時APOC的RMSD雖然具有較小的平均值但卻具有很寬的波動幅度,其最大值與APOO的相近,而最小值卻與EBR的相當,意味著APOC的狀態很不穩定,結構變化忽大忽小。而與之相對,EBR總是維持在結構變化較小的狀態,APOO傾向于保持在結構變化較大的狀態。這說明APOO和APOC兩體系比EBR具有較大結構柔性,而APOC的結構在動力學過程中更易發生變化,即時柔時剛。顯然,不同體系所表現的這些不同動力學行為只有通過較長的模擬時間才能獲得充分取樣,這解釋了為什么之前文獻13,14通過短時間模擬得到的結果是矛盾的。
3.3B因子分析
B因子(B-factor)描述體系中各個殘基在動力學過程中偏離其平均結構的程度,反映殘基的柔軟程度,可以用來研究分子動力學過程中蛋白的一些性質變化20。圖5給出了EBR、APOO和APOC三體系中所有殘基的B因子,它們取自模擬過程中體系的RMSD數值較小且穩定的時段,分別為,EBR:74-88 ns,APOO:12-32 ns,APOC:48-62 ns。
圖5A是三體系中RT全部983個殘基的B因子變化情況。可以看出,p51和p66亞基中距別構抑制劑EFV結合位較遠的連接子和RNase H結構域,即320號之后的殘基,三體系相應殘基的B因子變化不大,說明別構抑制劑的加入對這些部位影響不大。然而,距離別構位較近的聚合酶活性區,包括手指、手掌和拇指子域,即1到320號殘基,三體系相應殘基的B因子差別非常明顯。
拇指和手指子域的構象變化和柔性直接關系到RT的催化功能,所以有必要詳細了解別構抑制劑對這兩個子域構象的影響和作用機制,為便于觀察,圖5B放大了這些區域。可以看出,對于手指子域,APOC(藍線)的B因子普遍較小,APOO(黑線)的普遍較大;EBR(紅線)大部分與APOC相當甚至偏小,只有小部分(60-70,135-145)較大,與APOO相當。這說明無EFV結合時,閉合狀態(APOC)下手指子域的柔性明顯較小,而張開狀態(APOO)下手指子域總體上表現出較大柔性。對于結合了EFV的體系EBR,其拇指子域的B因子普遍變小,表明別構抑制劑對拇指子域的柔性具有明顯抑制作用,這正是所謂“拇指關節炎”效應;值得注意的是,這時手指子域大部分殘基(1-60,70-86)的柔性也變小了,說明EFV對這些殘基也具有抑制作用,手指也患了“關節炎”,只是癥狀較輕。對于手掌子域,三個體系的B因子差別不大,說明手掌子域具有較強的剛性,手指拇指的張合以及EFV的加入對手掌子域骨架支撐結構的影響不大。

圖5 三個RT體系全部殘基(A)和聚合酶活性區殘基(B)的B因子Fig.5 B-factors of all the residues of the three RT systems(A)and the polymerase domain(B)
綜上所述,別構抑制劑EFV對手掌子域骨架殘基的剛性影響很小;對拇指子域絕大部分殘基的柔性有明顯抑制;對RT手指子域大部分殘基的柔性也有抑制作用。這個結果有利地證明了關節炎模型。而且,我們的結果表明EFV不但引起“拇指關節炎”,也使手指患上了輕度“關節炎”,這是之前文獻沒有報道的。
3.4構象變化
蛋白分子中某些原子間的距離變化常常能反映整個體系構象的變化,這種距離分析方法可以給出直觀清楚的構象變化信息。為了理解RT上手形構象的動力學性質,我們計算了手指子域頂端Lys66和拇指子域頂端Leu289的Cα原子之間的距離L(圖6A)在動力學過程中的變化。這個距離由于是拇指和手指遠端間的距離,因此能夠較好地反映手形的張合程度。
圖6B直觀地給出了動力學過程中三個體系手形區域平均結構的疊合示意圖。三個平均結構均取自RMSD值較小且穩定的模擬時段,分別為,EBR:74-88 ns,紅色;APOO:12-32 ns,黃色;APOC:48-62 ns,藍色。可以看出,三個體系的拇指子域結構表現出明顯差異:APOC的拇指子域向手指子域方向大幅度靠攏,發生握合;相對APOO,EBR的拇指子域發生了明顯的向外張開偏移。然而比較起來,三體系手指子域的構象變化很小。這說明別構抑制劑或RT初結構對體系動力學結構的影響主要體現在拇指子域,或者說拇指子域的構象對RT的性質(結構及由此引起的活性)起著重要作用,這個直觀圖像與實驗上的“拇指關節炎模型”相符。
圖6C清楚地表明,無“楔子”的閉合狀態下(APOC),L在整個動力學過程中基本不變,保持在1.49 nm附近;EBR和APOO兩個體系的L值大小及波動幅度相似,其值都在3.8 nm左右,變化幅度約為±0.5 nm。這個結果給出的物理圖像是:在整個動力學模擬過程中,APOC保持握緊的手形;EBR和APOO則保持張開的手形,而且二者張開的程度相當。圖6D給出了三個體系中L值的幾率(時間)分布函數P,它不但反映手形的張合程度,更重要的是它反映了系統構象的穩定程度。因為,一個確定的L值對應一個確定的構象或手形,所以P函數曲線的形狀對應構象的變化程度或者結構穩定程度。圖6D中,APOC的P(L)分布(藍線)是一高聳的中心位于1.49 nm的單峰,表明該體系在整個動力學模擬過程中,處于一種穩定的構象結構,從自由能曲面上看,代表閉合狀態對應一個較深的能量極小值點,體系的相點被牢牢的束縛在極值點附近做小幅振動。特別是,1.49 nm處的峰不但高聳尖銳而且對稱性極高,這意味無別構分子加入時,握合的手形是一個非常穩定的狀態,除非有外力作用,在等溫平衡熱力學條件下不會自動轉變成張開狀態。這就是說,正常情況下,RT總是傾向于閉合的活性狀態,具有加工合成病毒的功能。這個結果與實驗一致,但不同于Ivetac和McCammon15先前的模擬結果,他們通過改變體系中原子的初始速度使四個副本中的兩個發生了由閉合到張開的狀態躍遷。值得注意的是,這種構象變化都發生在模擬運行的初期,因此可以推斷,這種躍遷與原子初速度的賦值有關,即這些發生躍遷的樣本體系相點的初速度剛好處于通向勢壘較低的勢能峽谷中,從而在程序對體系增溫(對原子速度乘以大于1的系數)至300 K時,推動體系越過勢壘進入另一能量極值點。另外,計算誤差和力場誤差也都可能引起不準確的結果。EBR體系的P(L)也是一個對稱性良好,中心位于3.84 nm處的單峰,表明體系也始終穩定在相應的自由能極值點附近,這正是所謂的“分子楔”作用。比較而言,APOO的P(L)是一個不對稱分布,在主峰3.74 nm左側相距約0.30-0.70 nm處出現了一臺梯。從構象上說,這個臺梯結構反映了體系的構象由張開向閉合轉變的趨勢或征兆。換言之,盡管APOO大部分時間處于張開的初構象,但與EBR不同的是,它存在由張開向閉合轉變的明顯傾向,并有相當的幾率處于半握合狀態,這個結果也與實驗一致,即自然的APOO總是趨于具有活性的閉合構象。
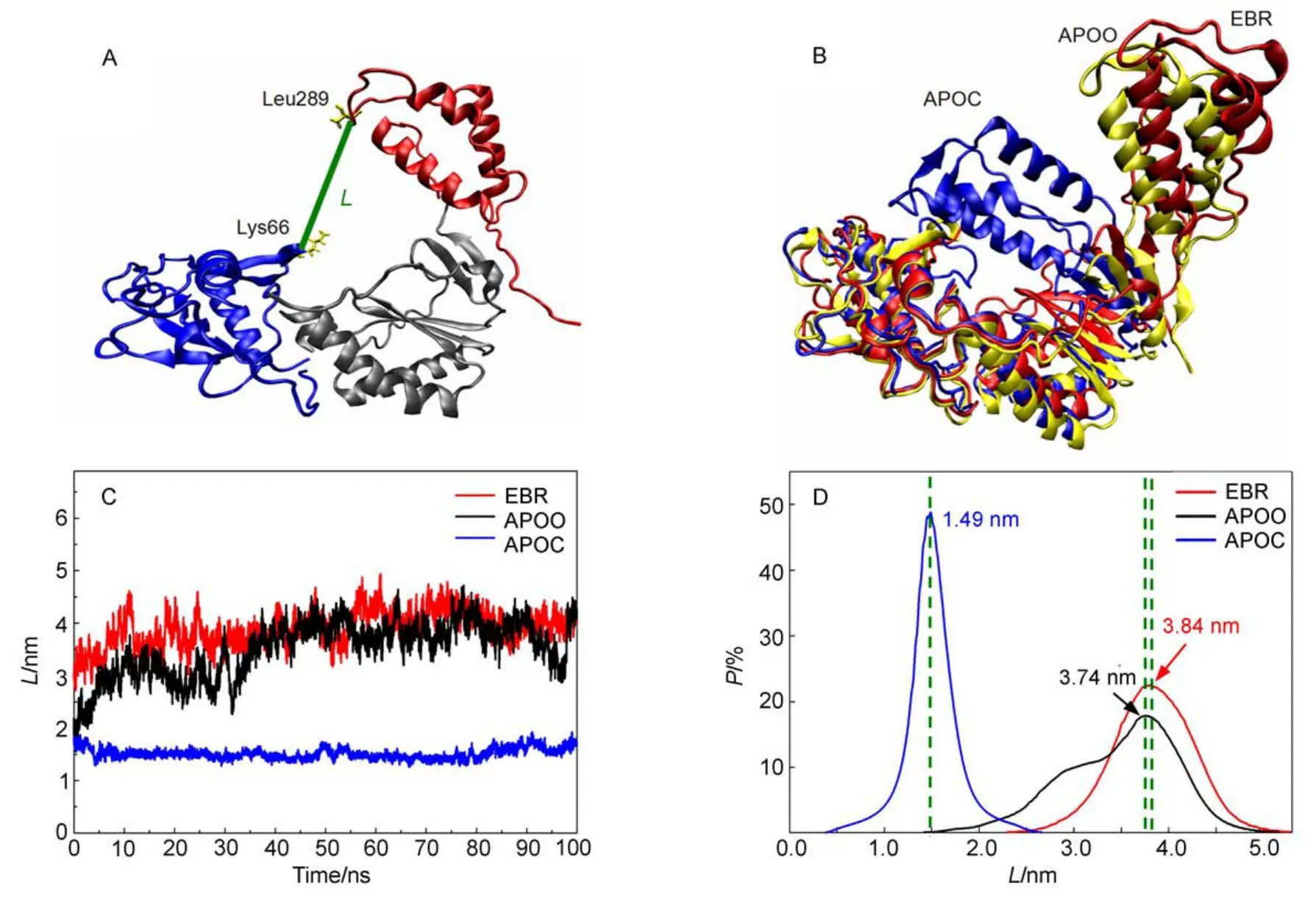
圖6 100 ns動力學模擬過程中RT手形握合狀態的變化Fig.6 Conformation changes of the RT hand opening and closing in the 100 ns dynamics simulations
綜上所述,可以看出,相對于RMSD和B因子分析,手指頂端Lys66和拇指頂端Leu289的Cα原子間距離L的分析給出了體系在動力學過程中更加直觀的物理圖像和更加清晰的動力學性質。我們的結果支持基于實驗晶體資料基礎上的“拇指關節炎”或“分子楔”模型,并與文獻11,12報道的模擬結果一致。第一次揭示了APOO由張開狀態向閉合構象轉變的傾向和動力學性質,即APOO的張開構象也是一個相對穩定的能量極點,只是相應于閉合方向的勢能面比較低平,這成為APOO由張向合轉變的驅動力。我們沒有得到文獻16報道的構象躍遷現象,原因可能是所用力場不同,也可能是他們使用較大時間步長積累的誤差所致,更可能與模擬開始時原子的初速度隨機賦值及隨后的加溫過程有關,因為文獻報道的構型轉變均發生在模擬開始階段。
4 結論
運用GPU大規模并行計算技術,采用AMBER12和ff12SB力場,對三種RT大分子體系分別進行了100 ns較長時間的分子動力學模擬,研究了別構抑制劑的結合對體系結構和不同子域殘基柔性的影響。主要結論是:(1)當別構抑制劑EFV結合到RT上的特定別構位后,會導致體系結構的變化,這個變化會影響RT的活性,從而實現別構抑制劑對RT功能的控制。(2)通過系統地分析相關體系的RMSD以及殘基的B因子,發現對于RT,別構抑制劑的作用不但撐開拇指和手指子域,而且增強了兩個子域殘基的剛性,證實了“分子楔”模型觀點。值得說明的是我們的結果不但驗證了“拇指關節炎”觀點,而且預測了輕度“手指關節炎”癥狀。(3)通過手指頂端Lys66和拇指頂端Leu289的Cα原子間距離L的分析發現,無別構抑制劑加入時,握合的手形是一個非常穩定的狀態,即自然條件下,RT總是傾向于閉合的活性狀態,具有加工合成病毒的功能。EBR體系的張開狀態也是一個穩定狀態。比較而言,盡管APOO大部分時間處于張開的初構象,但與EBR不同的是,它存在由張開向閉合轉變的明顯傾向,并有相當的幾率處于半握合狀態,說明自然的APOO傾向于具有活性的閉合構象。這些結果與實驗一致,并證實了別構抑制劑NNRTIs的“分子楔”作用。另外,通過比較不同文獻報告的模擬結果,我們認為,動力學模擬結果可能對模擬方法和策略具有很強的依賴性,包括模擬時間長短、時間步長的大小、模擬開始結構的準備、力場的精度以及原子初速度的隨機賦值(原子的初速度應具有熱力學平衡分布的特點,即Maxwell分布)等,精確的力場和模擬過程中體系的良好動力學平衡是得到可靠模擬結論的必要條件。最后強調的是,我們的計算結果表明,一旦RT體系穩定在開放或閉合狀態,則狀態改變是一種小概率事件,常溫下(300 K)僅靠熱力學效應似乎很難使體系在兩態之間發生躍遷。對這些問題的闡述將有助于更加詳細地理解NNRTIs的抑制機制和聚合酶結構域構象變化的動力學性質,從而為設計更有效的抑制劑提供理論依據。然而,要得到這些問題的確切結論,需要進行多樣本和更長時間的分子動力學模擬計算。希望我們的工作能給其他研究者,尤其是從事模擬計算的人員帶來啟發。
References
(1)Mathers,C.D.;Loncar,D.PLoS Med.2006,3(11),e442. (2)De Clercq,E.Chem.Biodivers.2004,1,44.
(3)Ren,J.;Stammers,D.K.Trends Pharmacol.Sci.2005,26, 4.doi:10.1016/j.tips.2004.11.003
(4)Zhu,R.X.;Wang,F.;Liu,Q.;Kang,T.G.Acta Chim.Sin. 2011,69(15),1731.[朱瑞新,王飛,劉琦,康廷國,化學學報,2011,69(15),1731.]
(5)Jacobo-Molina,A.;Arnold,E.Biochemistry 1991,30(26), 6351.doi:10.1021/bi00240a001
(6)Lawtrakul,L.;Beyer,A.;Hannongbua,S.;Wolschann,P. Monatsh.Chem.2004,135(8),1033.
(7)Sluis-Cremer,N.;Temiz,N.A.;Bahar,I.Curr.HIV Res.2004, 2(4),323.doi:10.2174/1570162043351093
(8)Bakan,A.;Bahar,I.Proc.Natl.Acad.Sci.U.S.A.2009,106 (34),14349.doi:10.1073/pnas.0904214106
(9)Kohlstaedt,L.A.;Wang,J.;Friedman,J.M.;Rice,P.A.; Steitz,T.A.Science 1992,256(6),1783.doi:10.1126/ science.1377403
(10)Liu,S.X.;Abbondanzieri,E.A.;Rausch,J.W.;Le Grice,S.F. J.;Zhuang,X.W.Science 2008,322(5904),1092.doi: 10.1126/science.1163108
(11)Shen,L.L.;Shen,J.H.;Luo,X.M.;Cheng,F.;Xu,Y.C.; Chen,K.X.;Arnold,E.;Ding,J.P.;Jiang,H.L.Biophys.J. 2003,84(6),3547.doi:10.1016/S0006-3495(03)75088-7
(12)Zhou,Z.;Madrid,M.;Evanseck,J.D.J.Am.Chem.Soc.2005, 127(49),17253.doi:10.1021/ja053973d
(13)Madrid,M.;Jacobo-Molina,A.;Ding,J.;Arnold,E.Proteins 1999,35(3),332.
(14)Madrid,M.;Lukin,J.A.;Madura,J.D.;Ding,J.;Arnold,E. Proteins 2001,45(3),176.
(15)Ivetac,A.;McCammon,A.J.J.Mol.Biol.2009,388(3), 644.doi:10.1016/j.jmb.2009.03.037
(16)Wright,D.W.;Sadiq,S.K.;De Fabritiis,G.;Coveney,P.V. J.Am.Chem.Soc.2012,134(31),12885.doi:10.1021/ ja301565k
(17)Chen,J.Z.;Wang,J.N.;Zhu,W.L.;Li,G.H.J.Comput. Aided Mol.Des.2013,27(11),965.
(18)Luo,F.;Gao,J.;Cheng,Y.H.;Cui,W.;Ji,M.J.Acta Phys.-Chim.Sin.2012,28(9),2191.[羅芳,高劍,成元華,崔巍,計明娟.物理化學學報,2012,28(9),2191.] doi:10.3866/PKU.WHXB201207063
(19)Zhang,H.;Lu,J.R.;Mu,J.B.;Liu,J.B.;Yang,X.Y.;Wang, M.J.;Zhang,R.B.Acta Phys.-Chim.Sin.2015,31(10),566. [張賀,盧俊瑞,穆江蓓,劉金彪,楊旭云,王美君,張瑞波,物理化學學報,2015,31(10),566.]doi:10.3866/PKU. WHXB201501061
(20)Case,D.A.;Darden,T.A.;Cheatham,T.E.,III;Simmerling, C.L.;Wang,J.;Duke,R.E.;Luo,R.;Walker,R.C.;Zhang, W.;Merz,K.M.;Roberts,B.P.;Hayik,S.;Roitberg,A.E.; Seabra,G.;Swails,J.M.;Kolossváry,I.;Wong,K.F.;Paesani, F.;Vanicek,J.;Wolf,R.M.;Liu,J.;Wu,X.;Brozell,S.R.; Steinbrecher,T.;Gohlke,H.;Cai,Q.;Ye,X.;Wang,J.;Hsieh, M.J.;Cui,G.;Roe,D.R.;Mathews,D.H.;Seetin,M.G.; Salomon-Ferrer,R.;Sagui,C.;Babin,V.;Luchko,T.;Gusarov, S.;Kovalenko,A.;Kollman,P.A.AMBER 12;University of California:San Francisco,CA,2012.
(21)Meng,X.M.;Wang,J.L.;Zhang,S.L.;Zhang,Q.G.ActaChim.Sin.2013,71(8),1167.[孟現美,王加磊,張少龍,張慶剛,化學學報,2013,71(8),1167.]doi:10.6023/A13030327
(22)Lindorff,L.K.;Piana,S.;Palmo,K.;Maragakis,P.;Klepeis,J. L.;Dror,R.O.;Shaw,D.E.Protein Force Field 2010,78(8), 1950.
(23)Chen,J.Z.;Zhang,D.L.;Zhang,Y.X.;Li,G.H.Int.J.Mol. Sci.2012,13(2),2176.
(24)Humphrey,W.;Dalke,A.;Schulten,K.J.Mol.Graphics 1996, 14(1),33.doi:10.1016/0263-7855(96)00018-5
(25)The Theoretical and Computational Biophysics Group.VMD, Revision 1.8.7;NIH Center for Macromolecular Modeling and Bioinformatics,the Beckman Institute,University of Illinois at Urbana-Champaign.
(26)Beyer,A.;Lawtrakul,L.;Hannongbua,S.;Wolschann,P. Monatsh.Chem.2004,135(7),1047.
(27)De Clercq,E.Nat.Rev.Drug Discov.2007,6(12),1001. doi:10.1038/nrd2424
Effect of the Allosteric Inhibitor Efavirenz on HIV-1 Reverse Transcriptase by Molecular Dynamics Simulation
MENG Xian-MeiZHANG Shao-Long*ZHANG Qing-Gang*
(School of Physics and Electronics,Shandong Normal University,Jinan 250014,P.R.China)
To understand the allosteric modulation dynamics of non-nucleoside reverse transcriptase inhibitors (NNRTIs),various models and suggestions have been derived from crystallography and simulation.Here,using a new force field,ff12SB,and GPU parallel computing technology,we performed 100-ns-long molecular dynamics simulations on three reverse transcriptase(RT)systems,one bound to inhibitor Efavirenz(EFV)and the others free.Analyses of the influence of the EFV on the conformation of the RT,flexibility of residues and dynamic behaviors of the systems were conducted.The simulations indicate that EFV binding induces structural distortion of the RT,whereas the configuration of the RT is more stable during dynamics,along with a decreasing extent of motion of the residues.EFV suppresses the flexibility of the thumb subunit and reduces that of most residues in the fingers subdomain as well,suggesting that EFV causes not only the so-called“thumb arthritis”but also a slight“fingers arthritis”.No conformational transition occurred throughout the entire simulations and the samples maintained their starting conformations,i.e.,free RT with a closed conformation stayed in the functional state and EFV-bound RT remained in open conformation.However,EFV-free RT with an initially open conformation exhibited an evident trend toward the closed state.These results agree with the models from experiments,and present a useful insight into the allosteric inhibition mechanism of NNRTIs.In addition,the simulation methodology has been discussed in detail and will be of significance to the computational simulation of large biological molecules.
HIV-1 reverse transcriptase;Nonnucleoside reverse transcriptase inhibitor; Allosteric inhibitor;Molecular dynamics simulation;Conformation
September 14,2015;Revised:November 25,2015;Published on Web:November 30,2015.*Corresponding authors.ZHANG Qing-Gang,Email:zhangqg@sdnu.edu.cn;Tel:+86-531-86180349. ZHANG Shao-Long,Email:slzhang@sdnu.edu.cn;Tel:+86-531-86182521.
O641
The project was supported by the National Natural Science Foundation of China(11274206).
國家自然科學基金(11274206)資助項目
?Editorial office ofActa Physico-Chimica Sinica

