血漿活化蛋白C水平在老年糖尿病腎病動脈粥樣硬化形成中的機制
張林霞 孫 茜 孫 波
(唐山工人醫院,河北 唐山 063000)
?
血漿活化蛋白C水平在老年糖尿病腎病動脈粥樣硬化形成中的機制
張林霞孫茜孫波
(唐山工人醫院,河北唐山063000)
目的探討血漿活化蛋白C(APC)在老年糖尿病腎病(DN)動脈粥樣硬化(AS)形成。方法2型糖尿DN病未接受透析治療的老年患者60例和本院體檢中心52例健康志愿者。ELISA法檢測可溶性血栓調節蛋白(sTM)、可溶性血管細胞黏附分子(sVCAM)-1、可溶性血管內皮細胞蛋白C受體(sEPCR)、APC水平,超聲檢測頸動脈內-中膜厚度(IMT)。根據尿蛋白嚴重程度將60例患者分為微量蛋白尿組26例(30 mg/d<尿蛋白量≤300 mg/d)和蛋白尿組34例(尿蛋白量>300 mg/d);根據患者IMT水平分為IMT<0.1 cm組12例、0.1 cm≤IMT≤0.12 cm組14例、IMT>0.12 cm組34例;分析與血管內皮損傷指標的關系。結果糖尿病腎病患者IMT水平與24 h尿白蛋白、sTM、sVCAM-1、sEPCR呈明顯正相關(P<0.05);APC水平與24 h尿白蛋白、sTM、sVCAM-1、IMT呈明顯負相關(P<0.05);對照組、微量蛋白尿組、蛋白尿組之間sTM、sVCAM-1、sEPCR、APC、IMT均有統計學差異(P<0.05);不同頸動脈IMT組之間APC水平有統計學差異(P<0.05)。結論老年DN患者血漿APC水平與病情嚴重程度和IMT呈負相關,APC水平降低可能導致炎性介質水平升高和內皮細胞損傷而參與DN患者AS的發生發展。
血漿活化蛋白C;糖尿病腎病;動脈粥樣硬化
蛋白C是一類由肝臟合成的維生素K依賴性蛋白酶,經凝血酶活化后成為激活的蛋白C(APC)。APC作為一種體內重要保護因子,具有抗凝、抗炎、抗氧化應激等作用。炎性反應為誘發血管內皮損傷的主要機制,相關研究顯示,APC能夠通過改善敗血癥患者體內炎癥狀態,防止腎損傷,外源性APC還能夠緩解糖尿病腎病(DN)進展〔1〕。而DN患者體內APC水平降低加重體內炎性反應和內皮細胞損傷能否促進動脈粥樣硬化(AS)形成至今尚未明確。同時考慮到DN多發于老年人群〔2〕,而AS也是誘發老年人全身性疾病的重要原因。因此,本次研究擬分析DN患者血漿APC、炎性介質水平、內皮細胞損傷情況,并探討與其AS的相關性。
1 資料與方法
1.1一般資料選取2014年1~12月本院收治的2型糖尿病DN未接受透析治療的患者60例。篩選標準:年齡≥60歲,患者及其家屬自愿參與本次研究并簽署知情同意書;糖尿病病程≥6年,糖尿病視網膜病變;尿白蛋白量>30 mg/d;無嚴重應激狀態。入選本研究前2個月內未使用免疫抑制劑、激素,以及其他可引發腎損傷的藥物。男36例,女24例;年齡60~78歲,平均(67.29±8.87)歲。選取同期本院體檢中心52例健康老年志愿者為對照組,男32例,女20例;年齡56~74歲,平均(65.07±6.32)歲;入選者血壓、血常規、尿常規、尿微量蛋白、肝腎功能均正常。
1.2方法
1.2.1頸動脈內-中膜厚度(IMT)檢測采用美國GEVivid7Pr0彩色多普勒超聲診斷儀檢測IMT,由本院同一名超聲科醫師單盲檢測,IMT值取兩側最大值,≥1 mm為IMT增厚,分叉處>1.2 mm為斑塊。
1.2.2實驗室指標檢測清晨抽取兩組研究對象空腹肘靜脈血,放于枸櫞酸鈉抗凝管中,5 000 r/min離心30 min,取上清置于-80℃超低溫冰箱中保存待測。采用ELISA法檢測可溶性血栓調節蛋白(sTM)、可溶性血管細胞黏附分子(sVCAM)-1、可溶性血管內皮細胞蛋白C受體(sEPCR)、APC,試劑盒購于上海心語生物科技有限公司。采用貝克曼庫爾特ACCESS2化學發光免疫分析儀檢測全段甲狀旁腺激素(iPTH);邁瑞Bc2600全自動血球分析儀檢測血常規;邁瑞BS-400全自動生化分析儀檢測血生化。
1.3統計學分析采用SPSS13.0軟件進行t檢驗,多組間進行單因素F檢驗;進行兩變量直線相關分析。
2 結 果
2.1IMT、APC與各指標相關性分析DN患者IMT水平與24 h尿白蛋白、sTM、sVCAM-1、sEPCR呈明顯正相關(P<0.05);APC水平與24 h尿白蛋白、sTM、sVCAM-1、IMT呈明顯負相關(P<0.05),見表1。
2.2不同程度蛋白尿患者血管內皮損傷指標比較根據患者尿蛋白嚴重程度分為微量蛋白尿組26例(30 mg/d<尿蛋白量≤300 mg/d)和蛋白尿組34例(尿蛋白量>300 mg/d),方差分析顯示,對照組、微量蛋白尿組、蛋白尿組之間sTM、sVCAM-1、sEPCR、APC、IMT均有統計學差異(P<0.05),見表2。
2.3不同IMT病變患者血管內皮損傷指標比較根據患者IMT水平分為IMT<0.1 cm組12例、0.1 cm≤IMT≤0.12 cm組14例、IMT>0.12 cm組34例。方差分析顯示,三組間APC水平差異有統計學意義(P<0.05),見表3。

表1 DN患者IMT、APC與各指標相關性分析
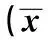
表2 不同程度蛋白尿患者血管內皮損傷指標比較±s)
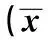
表3 不同IMT病變患者血管內皮損傷指標比較±s)
3 討 論
機體處于長時間高血糖狀態可增強體內氧化應激、炎性介質、PKC等信號途徑,損傷內皮細胞,這是DN患者AS發生、發展的主要原因。相關研究顯示,外源性APC可有效抑制DN小鼠腎功能的惡化,因此推測,APC水平下降能夠加快腎功能和進展速度〔3〕。
本次研究中DN患者APC水平明顯降低,說明該類患者AS與APC對內皮細胞保護能力降低有關。隨著蛋白尿程度、IMT的增加APC水平明顯降低,說明隨著患者腎臟病情的惡化,APC水平降低,導致對細胞的保護作用明顯減弱,加重了AS進程。血管內皮細胞表面均存在sTM受體、sEPCR表達,當內皮細胞受到損傷時,sTM受體、sEPCR從細胞膜表面脫落,使細胞表面sTM受體、sEPCR密度降低。脫落到血漿中的sEPCR雖然仍能夠與APC結合,但會抑制APC活性。本研究結果提示患者血管內皮細胞受到了明顯損傷,進一步引發APC水平下降,加速AS進程。但也有研究顯示,糖尿病患者APC受體表達水平與正常人無明顯差異〔4,5〕,而本次研究的DN患者病程較長,同時存在腎損害,病情較重,血管內皮細胞受損較嚴重,可能導致與相關研究結論不同。
血管壁表面微炎性狀態也是AS形成的重要機制〔6〕。sVCAM-1多表達于內皮和平滑肌細胞,誘導炎性因子黏附,參與AS形成〔7〕。糖尿病患者血管壁表面sVCAM-1水平明顯提升,但在AS早期sVCAM-1表達更明顯,且與腎功能密切相關,可作為DN早期血管損害的標志物。本研究提示DN患者體內APC水平隨病情進展而降低,導致抗炎作用減弱,體內炎性反應增強,促進AS的形成。
1陳婭,丁涵露,王莉,等.Ad-FLT-1/PC對糖尿病腎病動脈粥樣硬化大鼠炎癥因子表達的影響〔J〕.中華醫學雜志,2015;95(24):1961-5.
2周穎,馮烈.老年糖尿病腎病腎內動脈阻力指數異常與頸動脈粥樣硬化的相關性〔J〕.中國老年學雜志,2015;35(15):4227-8.
3錢書虹,錢慶文.對氧磷酶2 C311S與對氧磷酶1 Q192R基因多態性與糖尿病腎病的關系〔J〕.中華腎臟病雜志,2010;26(2):132-3.
4劉坤,高志敏.脂聯素與2型糖尿病及其血管并發癥關系的研究進展〔J〕.醫學綜述,2012;18(1):126-9.
5Keller SA,Moore CC,Evans SL,etal.Activated protein C alters inflammation and protects renal function in sepsis〔J〕.J Surg Res,2011;168(5):e103-6.
6劉鵬,王德寶,張鳳梅,等.替米沙坦對早期糖尿病腎病患者血漿同型半胱氨酸及頸動脈內膜中層厚度的影響〔J〕.中國全科醫學,2012,15(21):2431-3.
7楊生,張魯寧.糖尿病腎病與脂聯素、血管細胞黏附分子-1的相關性〔J〕.中國老年學雜志,2010;30(21):3155-6.
〔2015-12-30修回〕
(編輯李相軍)
河南省醫學科技攻關計劃項目(No.201304053)
張林霞(1970-),女,碩士,副主任醫師,主要從事老年腎臟、心臟等疾病研究。
R587
A
1005-9202(2016)17-4186-03;doi:10.3969/j.issn.1005-9202.2016.17.023

