復方苦參注射液增加耐克唑替尼ALK陽性肺癌細胞H2228對克唑替尼的敏感性
高海祥 閆 莉 蘇 艷
(河北省人民醫院呼吸內科一科,河北 石家莊 050051)
?
復方苦參注射液增加耐克唑替尼ALK陽性肺癌細胞H2228對克唑替尼的敏感性
高海祥閆莉蘇艷
(河北省人民醫院呼吸內科一科,河北石家莊050051)
目的探討復方苦參注射液是否增加耐克唑替尼ALK陽性肺癌細胞H2228(H2228/CR)對克唑替尼的敏感性。方法采用CCK8方法觀察復方苦參注射液、克唑替尼對H2228/CR細胞增殖的影響。取對數生長期H2228/CR細胞,加入不同濃度的復方苦參和克唑替尼,CCK8試劑測定各孔光吸收值(A),取平均值。計算藥物作用72 h后的增殖抑制率。根據抑制率計算相應藥物的IC50,然后選擇適宜的復方苦參注射液濃度與克唑替尼聯合,重復CCK8法,計算兩藥聯合72 h后的細胞增殖抑制率及聯合后克唑替尼的IC50,計算逆轉倍數。結果復方苦參注射液、克唑替尼對H2228/CR細胞增殖具有抑制作用,該作用與濃度呈正相關。復方苦參注射液、克唑替尼對H2228/CR細胞的IC50分別為584.6 μl/ml和3 426.3 nmol/L。復方苦參注射液聯合不同濃度克唑替尼后對H2228/CR細胞較單用克唑替尼增殖抑制作用明顯增強,聯合用藥后克唑替尼的IC50為494 nmol/L,逆轉耐藥倍數為6.93。H2228/CR對克唑替尼敏感性明顯增強。結論相對單一應用克唑替尼易產生耐藥性的缺點,二者聯合運用可有效提高H2228/CR對克唑替尼敏感性。
耐克唑替尼ALK陽性肺癌細胞H2228(H2228/CR);復方苦參注射液;克唑替尼
治療非小細胞性肺癌(NSCLC)的靶向藥物中,表皮生長因子受體(EGFR)和間變性淋巴瘤激酶酪氨酸激酶(ALK)抑制劑(TKIs)最常用,它可使帶有EGFR突變和(或)ALK融合基因的NSCLC患者癥狀得到明顯改善、提高生存率〔1〕。克唑替尼作為ALK抑制劑在臨床試驗中表現尤為突出,經克唑替尼治療的患者90%以上腫瘤縮小,57%的患者獲得客觀緩解〔2〕。在2013版美國國立綜合癌癥網絡(NCCN)指南上,推薦其作為一線治療藥用于ALK陽性的NSCLC患者。但幾乎所有經其治療的患者在初次治療9~12個月后均出現了耐藥〔3〕,如何降低耐藥性,已成為靶向藥物治療NSCLC患者的最大難題。本研究根據復方苦參注射液能夠抑制腫瘤血管形成從而控制腫瘤生長〔4〕的臨床用藥經驗,通過體外實驗進一步驗證復方苦參注射液是否能增加耐克唑替尼ALK陽性肺癌細胞H2228(CH2228/CR)對克唑替尼的敏感性。
1 材料和方法
1.1材料耐克唑替尼ALK陽性肺癌H2228細胞(購自ATCC); 克唑替尼(美國輝瑞公司);復方苦參注射液(山西振東金晶制藥有限公司);膽囊收縮素八肽(CCK8)試劑(日本同仁);酶聯免疫檢測儀(奧地利TECAN公司)
1.2方法應用CCK8方法觀察復方苦參注射液、克唑替尼對〔H2228/(CR)〕細胞增殖的影響。取對數生長期的H2228/CR細胞,用 0.25%胰酶消化,制成單細胞懸液后,用全自動細胞計數儀計數,以3×104/ml細胞濃度接種于96孔板中,100 μl/孔,其中1孔留作空白組,在37℃、5%CO2細胞培養箱中培養24 h,以使細胞充分貼壁。然后加入不同濃度的復方苦參注射液和克唑替尼,使得復方苦參注射液每孔終濃度分別為50、100、200、400、800 μl/ml,克唑替尼每孔終濃度分別為10、30、90、270、810 nmol/L,陰性對照組每孔加入100 μl普通培養液,空白孔加200 μl普通培養液(不加細胞),每個濃度組設3個復孔。再次置于培養箱中培養72 h,每孔加入CCK8試劑20 μl,繼續溫育2 h,最后采用酶標儀測定各孔OD值,波長取450 nm。取3個復孔的平均值。計算藥物作用72 h后的增殖抑制率。抑制率=〔1-(實驗組平均OD值-空白組平均OD值)/(陰性對照組平均OD值-空白組平均OD值)〕×100%。根據抑制率計算兩種藥物的IC50,選擇適宜的復方苦參注射液濃度與克唑替尼聯合作用于H2228/CR細胞,重復CCK8方法,計算兩藥聯合72 h后的細胞增殖抑制率,計算逆轉倍數。
1.3統計學方法應用SPSS19.0軟件行t檢驗。
2 結 果
2.1復方苦參注射液、克唑替尼對H2228/CR細胞增殖的影響復方苦參注射液、克唑替尼對H2228/CR細胞增殖具有抑制作用,該作用與濃度呈正相關,即濃度越大,抑制作用越強。復方苦參注射液50、100、200、400、800 μl/ml組細胞抑制率分別為(1.2±0.5)%、(4.5±1.3)%、(10.3±2.1)%、(32.1±4.5)%、(66.7±9.7)%;克唑替尼10、30、90、270、810 nmol/L組細胞抑制率分別為(2.8±0.5)%、(6.2±0.9)%、(11.9±1.6)%、(16.7±1.8)%、(29.7±3.4)%。根據冦氏改良公式,復方苦參注射液、克唑替尼對H2228/CR細胞的IC50分別為584.6 μl/ml和3 426.3 nmol/L。
2.2復方苦參注射液聯合克唑替尼對H2228/CR細胞增殖的影響根據復方苦參注射液對H2228/CR的增殖抑制作用結果,選擇濃度為100 μl/ml苦參注射液與不同濃度克唑替尼聯合作用于H2228/CR,表明復方苦參注射液聯合不同濃度克唑替尼后對H2228/CR細胞較單用克唑替尼增殖抑制作用明顯增強,聯合用藥后克唑替尼的IC50為494 nmol/L,逆轉耐藥倍數為6.93。H2228/CR對克唑替尼敏感性明顯增強。見圖1。
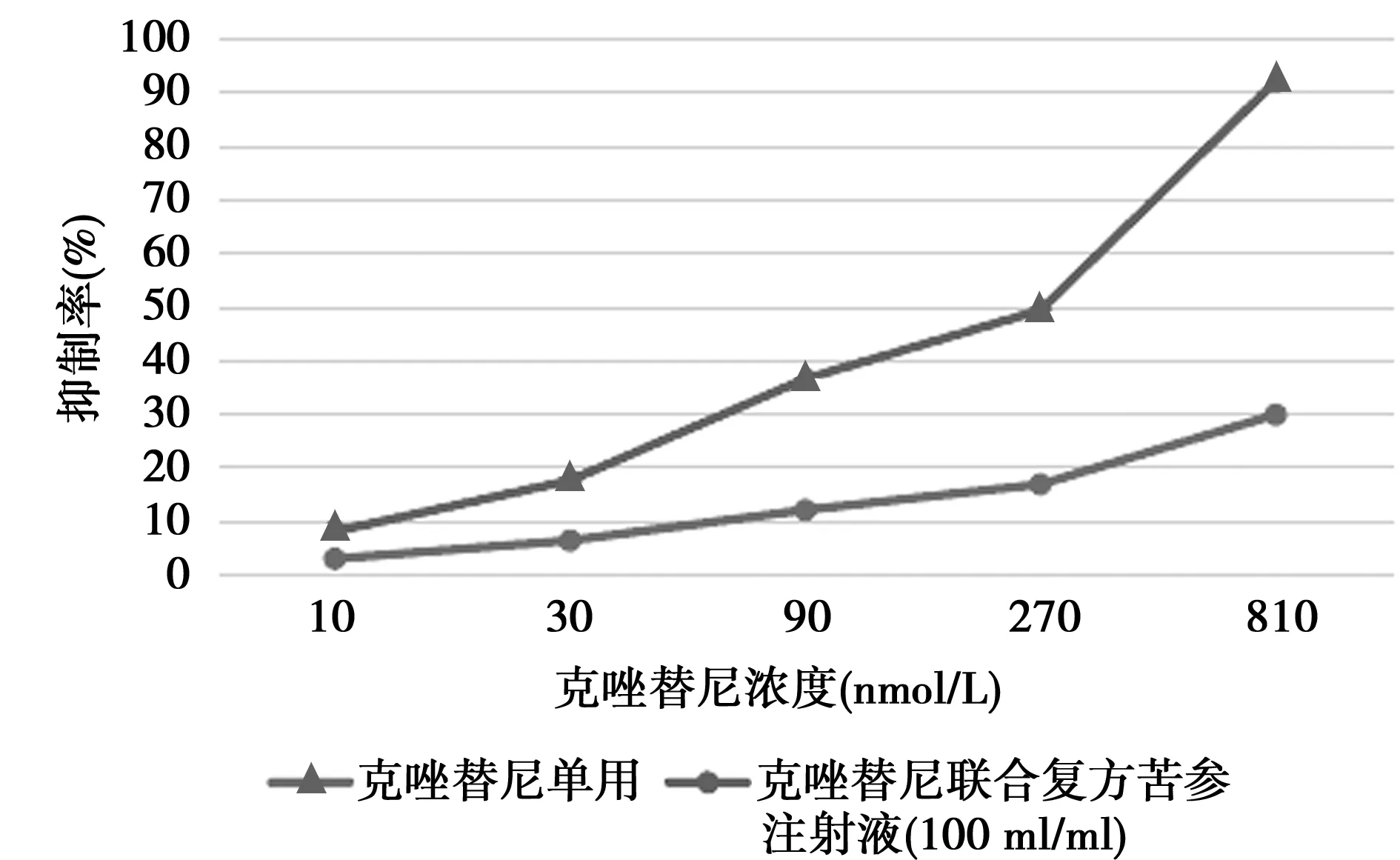
圖1 克唑替尼單用與聯合復方苦參對H22288/CR細胞增殖的影響
3 討 論
克唑替尼屬靶向治療藥物,是ALK競爭性抑制劑。藥理作用為劑量依賴式抑制細胞內ALK與抑制c-Met激酶,從而抑制腫瘤細胞的生長〔5〕。3%~7%的NSCLC患者ALK基因陽性,因此,自克唑替尼應用以來,NSCLC ALK陽性患者中位生存時間和生存率明顯提高〔6~8〕。然而,這部分患者在經過1~2年治療后出現不同程度的克唑替尼耐藥現象。耐藥的機制可能為:(1)ALK繼發性耐藥突變。ALK繼發性耐藥突變約占耐藥原因的37%,其中ALK激酶區突變約占28%,而ALK基因拷貝數擴增占9%。ALK激酶區突變是最早明確的耐藥機制〔9〕。體內外研究顯示,ALK激酶區突變包括L1196M、L1152R、G1202R、G1269A、1151Tins、S1206Y、C1156Y、F1174C和D1203N。(2)驅動基因轉換。ALK陽性腫瘤細胞的生長和遷移主要受ALK及其下游信號通路來實現,當克唑替尼阻斷該信號通路時,腫瘤細胞則通過驅動基因轉換激活其他信號傳導通路替代原有通路。這些轉換驅動基因中最為常見的是EGFR突變或磷酸化、KRAS突變和c-KIT擴增。(3)腫瘤異質性。NSCLC是基因突變和細胞異質性最大的腫瘤之一。同一ALK陽性NSCLC患者,可能存在兩種不同的激酶及突變,另外,不同的時間檢測也可能出現不同的驅動基因突變。
祖國醫學認為熱毒瘀結是肺癌發病機制主要特征之一,故清熱解毒法作為肺癌治療的基本法則在臨床上廣為應用。復方苦參注射液又名巖舒,主要功效為清熱解毒,散結消腫。主要由苦參、土茯苓等多味中藥組成。其中苦參具有清熱、解毒、燥濕作用,現代藥理研究認為苦參的主要成分為苦參堿。其作用機制為通過影響端粒酶活性,殺傷惡性腫瘤細胞,同時誘導腫瘤細胞分化、促進腫瘤細胞凋亡。還可提高正常細胞免疫功能,對自然殺傷細胞和 T細胞亞群作用明顯,是一種良好的細胞免疫調節劑,最后還可通過阻斷腫瘤細胞和內皮細胞的黏附,達到抑制腫瘤細胞的轉移的作用〔10〕。土茯苓具有解毒、除濕、止痛功效,現代藥理研究認為其主要成分茯苓多糖及茯苓總皂甙具有抗腫瘤作用。復方苦參注射液聯合化學治療及分子靶向治療各種惡性腫瘤療效顯著,尤其在減毒增效方面,同時具有一定的抗腫瘤作用。陳南江等〔11〕研究發現復方苦參注射液能顯著減輕化療引起的疼痛不適、惡心嘔吐、發熱乏力等不良反應,提高人體免疫力,抑制惡性腫瘤細胞生長,延長腫瘤患者生存期,提高患者的生活質量。司維柯等〔11〕研究表明,復方苦參注射液不但能對惡性腫瘤細胞具有直接的殺傷作用,而且還能誘導惡性腫瘤細胞分化、促進細胞凋亡,同時還可抑制腫瘤細胞侵襲與轉移。
本實驗,觀察到復方苦參注射液即使在體外對耐克唑替尼ALK陽性肺癌H2228細胞仍具有增殖抑制作用,且抑制作用隨藥物濃度增加而增加,顯示出復方苦參注射液具有多靶點抗腫瘤作用機制。克唑替尼作為ALK抑制劑,前期實驗表明其對ALK陽性肺癌H2228細胞有明顯抑制作用,IC50為302 nmol/L,與蘇翠云〔13〕試驗中測得的334 nmol/L極為接近。但是當ALK陽性肺癌H2228細胞對克唑替尼產生耐藥后,藥物的敏感性明顯下降,相應的IC50明顯上升。但是與小劑量的復方苦參注射液聯合應用后,對細胞增殖抑制作用明顯增強,抑制率明顯升高。我們推測可能因復方苦參注射液抗腫瘤譜廣,作用靶點及信號通路廣泛、時間持久、不易耐藥,其不但可對惡性腫瘤細胞起到直接的殺傷作用,而且還能誘導惡性腫瘤細胞分化、促進惡性腫瘤細胞凋亡,最后還可抑制腫瘤細胞侵襲與轉移,逆轉克唑替尼耐藥。因此與克唑替尼聯合后增效作用明顯。本從體外實驗進一步驗證了復方苦參注射液聯合克唑替尼的臨床減毒增效作用。
1Rosell R,Carcereny E,Gervais R,etal.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre,open-label,randomised phase 3 trial〔J〕.Lancet Oncol,2012;13(3):239-46.
2Zou HY,Li Q,Lee JH,etal.An orally available small-molecule inhibitor of c-Met,PF-2341066,exhibits cytoreductive antitumor efficacy through antiproliferative and antiangiogenic mechanisms〔J〕.Cancer Res,2007;67(9):4408-17.
3Chen Z,Fillmore CM,Hammerman PS,etal.Non-small-cell lung cancers:a heterogeneous set of diseases〔J〕.Nat Rev Cancer,2014;14(8):535-46.
4李敏,錢曉萍,劉寶瑞.復方苦參注射液聯合熱療抗血管生成作用的實驗研究〔J〕.實用臨床醫藥雜志,2007;11(5):57-61.
5Shaw AT,Yeap BY,Mino-Kenudson M,etal.Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK〔J〕.J Clin Oncol,2009;27(26):4247-53.
6Kwak EL,Bang YJ,Camidge DR,etal.Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer〔J〕.New Engl J Med,2010;363(18):1693-703.
7Camidge DR,Bang YJ,Kwak EL,etal.Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer:updated results from a phase 1 study〔J〕.Lancet Oncol,2012;13(10):1011-9.
8Shaw AT,Kim DW,Nakagawa K,etal.Crizotinib versus chemotherapy in advanced ALK-positive lung cancer〔J〕.New Engl J Med,2013;368(25):2385-94.
9Doebele RC,Pilling AB,Aisner DL,etal.Mechanisms of resistance to crizotinib in patients with ALK gene rearranged non-small cell lung cancer〔J〕.Clin Cancer Res,2012;18(5):1472-82.
10王兵,王國俊.氧化苦參堿對腫瘤誘導血管內皮細胞增殖的抑制作用〔J〕.實用腫瘤雜志,2000;15(5):297-300.
11陳南江,李杭,譚詩生.復方苦參注射液聯合紫杉醇治療老年晚期非小細胞肺癌臨床觀察〔J〕.上海中醫藥雜志,2006;40(9):22-3.
12司維柯,高利宏,劉斌,等.苦參堿誘導人肝癌細胞分化、凋亡時對 G1細胞周期調節因子的調控〔J〕.癌癥,2001;20( 8):848-51.
13蘇翠云.克唑替尼、TAE684對EML4-ALK陽性肺癌細胞株H2228作用的研究〔D〕.南寧:廣西醫科大學,2013.
〔2015-12-31修回〕
(編輯袁左鳴)
2016年度河北省醫學科學研究重點課題計劃(20160065)
高海祥(1979-),男,在讀博士,主治醫師,主要從事呼吸腫瘤、呼吸系統感染性疾病研究。
R734.2
A
1005-9202(2016)17-4159-03;doi:10.3969/j.issn.1005-9202.2016.17.010

