鴉膽子苦醇抑制人非小細胞肺癌A549細胞轉移的機制
陳 果 李 蔚 李小惠
(四川省醫學科學院 四川省人民醫院,四川 成都 610072)
?
鴉膽子苦醇抑制人非小細胞肺癌A549細胞轉移的機制
陳果李蔚李小惠
(四川省醫學科學院 四川省人民醫院,四川成都610072)
目的探討鴉膽子苦醇對人非小細胞肺癌A549細胞轉移能力的抑制作用及其機制。方法采用Reed-Muench法計算鴉膽子苦醇對A549細胞的半數致死濃度(LC50);通過CCK-8測定細胞活力繪制增殖曲線和流式細胞周期測定鴉膽子苦醇對A549細胞增殖能力的影響;采用Transwell法檢測鴉膽子苦醇對A549細胞株轉移的抑制情況,以及在半數致死濃度的鴉膽子苦醇濃度下不同時間對細胞轉移的抑制率;應用Western印跡法檢測細胞轉移相關蛋白的表達情況。結果非小細胞肺癌A549細胞的增殖能力在鴉膽子苦醇處理后基本沒有變化;鴉膽子苦醇處理后A549細胞的轉移能力與對照組相比明顯下降,且在一定作用時間范圍內有時間依賴性;腫瘤轉移相關蛋白(BRF)2、胰島素樣生長因子結合蛋白-2(IGFBP-2)、CD151的表達水平在鴉膽子苦醇處理后的細胞中明顯下調。結論鴉膽子苦醇是潛在的抗非小細胞肺癌的藥物,有必要進一步闡明其抗非小細胞肺癌的分子機制,為臨床治療提供一定的指導意義。
鴉膽子苦醇;非小細胞肺癌;A549細胞;轉移
隨著當今分子生物學技術和臨床治療水平的快速發展,非小細胞肺癌的臨床治療手段特別是新型的分子藥物靶向治療有了較明顯的進步,但是肺癌的易轉移性仍然是治療的主要難題〔1,2〕。鴉膽子苦醇(Brusatol)是一種苦木內酯類化合物,從鴉膽子中提取獲得。鴉膽子性苦寒,具有殺蟲止痢和抗瘧、抗腫瘤等功效〔3〕。目前關于鴉膽子苦醇抗白血病、抗胰腺癌和前列腺癌中的重要作用均有報道,但未見有其對肺癌轉移能力抑制的研究〔4〕。本文初步探討鴉膽子苦醇對非小細胞肺癌A549細胞轉移的抑制能力及其相應的分子機制。
1 材料與方法
1.1試驗藥物鴉膽子苦醇,購自成都植標化純生物技術有限公司。
1.2試劑非小細胞肺癌A549細胞,購自中科院上海細胞所。膽囊收縮素八肽(CCK-8),購自上海易色醫療科技有限公司;24孔,孔徑8.0 μm,Transwell板,購自北京樂博生物科技有限公司;1640培養基、胎牛血清購自美國Hyclone公司;0.25%胰蛋白酶購自美國Gibco公司;腫瘤轉移相關蛋白2(BRF2)、胰島素樣生長因子結合蛋白-2(IGFBP-2)、CD151、β-actin單克隆抗體購自Proteintech公司;辣根過氧化酶標記的羊抗兔、羊抗鼠抗體購自北京中杉金橋。
1.3儀器倒置相差顯微鏡:德國Leica 公司;二氧化碳孵箱:美國Thermo Fisher 公司;垂直電泳系統、蛋白轉印系統:北京六一;無菌操作臺:蘇凈集團安泰公司;凝膠成像系統:美國Bio-Rad公司。
1.4方法
1.4.1細胞培養A549細胞用5 ml含10%胎牛血清(FBS)的1640培養基于含37℃、飽和濕度、5%CO2的恒溫培養箱中培養,細胞呈單層貼壁生長,后續實驗取狀態良好的對數期細胞進行。
1.4.2半數致死濃度計算將生長狀態良好的對數期細胞按2 000個/孔的細胞量接種于96孔板中,鴉膽子苦醇用無血清培養基稀釋,按0.01~10 μmol/L十倍稀釋設置濃度梯度,每孔加100 μl。于培養箱中孵育,2 d后觀察細胞生長狀態,細胞發生壞死標記為陽性,細胞未有壞死標記為陰性。統計數據,用Reed-Muench算法進行計算。
1.4.3細胞增殖能力測定A549細胞經半數細胞致死濃度的鴉膽子苦醇處理6 h和12 h后胰酶消化,按每孔2 000個細胞的量接種于96孔板中,用CCK-8法分別測定0、1、2、3、4、5 d的吸光值,數據繪制成曲線圖。半數細胞致死濃度的鴉膽子苦醇處理A549細胞6 h和12 h后胰酶消化,按每組樣品2×106的量收集細胞于EP管中,75%乙醇固定過夜,用含100 μg/ml RNA酶、30 μg/ml PI和2‰的TritonX-100染液染色,細胞流式儀分析,用ModFit處理數據。
1.4.4細胞轉移能力的測定A549細胞經半數細胞致死濃度的鴉膽子苦醇分別處理2、6、12、24、48 h后用胰酶消化收集細胞,每個樣品孔200 μl,無血清1640培養基重懸5×104個細胞于Transwell上室中,下室采用含20%FBS的1640培養基900 μl,恒溫培養箱中孵育24 h,用棉簽擦去上室殘留細胞,磷酸鹽緩沖液(PBS)清洗,甲醇中固定30 min,室溫吹干,用結晶紫染色1 min,PBS清洗,將上室薄膜用小刀切下,于載玻片上,固定,封片,觀察計數。
1.4.5Western印跡檢測細胞內轉移相關蛋白表達上步驟中同批次細胞,經PBS清洗后,加入RIPA細胞裂解液,冰上裂解細胞30 min,12 000 r/min離心10 min,用考馬斯亮藍染色法進行蛋白質濃度測定。同樣量的蛋白經十二烷基硫酸鈉-聚丙烯酰胺(SDS-PAGE)凝膠電泳進行蛋白分離,蛋白電泳完成后通過蛋白轉印系統將PAGE膠上的蛋白轉印到適當大小的硝酸纖維素膜上,用5%的脫脂奶粉進行封閉,按1∶1 000的稀釋倍數配置抗體,4℃孵育過夜,第2天取出后洗去殘余的一抗,按1∶5 000的稀釋倍數配置二抗,室溫孵育2 h后洗去殘余的二抗,用增強化學發光法(ECL)顯色,對比轉移相關蛋白表達變化。
1.5統計學方法應用SSPS17.0和Graphpad prism 5統計軟件進行處理。
2 結 果
2.1梯度濃度鴉膽子苦醇處理A549細胞觀察細胞生長狀態,采用Reed-Muench算法計算得出半數致死濃度為(0.70 ± 0.06)μmol/L。0.01μmol/L濃度的鴉膽子苦醇處理A549細胞后細胞生長狀態良好,10 μmol/L濃度的鴉膽子苦醇處理A549細胞后細胞多數發生壞死。見圖1。
2.2CCK-8實驗結果半數致死濃度的鴉膽子苦醇處理A549細胞6 h和12 h后,與未處理前相比其增殖能力沒有明顯變化;細胞流式周期分析結果顯示,半數致死濃度的鴉膽子苦醇處理A549細胞6 h和12 h后與未處理前相比其細胞周期變化不明顯。見圖2,圖3。
2.3Transwell實驗結果0.70 μmol/L的鴉膽子苦醇處理A549細胞6 h后,A549細胞的轉移能力略有下降;處理12 h后,細胞的轉移能力明顯下降。見圖4。
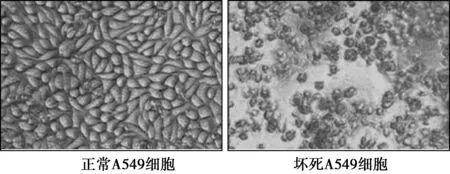
圖1 A549細胞生長狀態(×200)

圖2 A549細胞增殖曲線圖

A:對照組;B:鴉膽子苦醇處理處理6 h;C:鴉膽子苦醇處理處理12 h;下圖同圖3 A549細胞周期

圖4 0.70 μmol/L的鴉膽子苦醇處理A549細胞不同時間細胞遷移能力(×200)
2.4Western印跡檢測結果細胞轉移相關蛋白BRF2、IGFBP-2、CD151的表達水平均有不同程度的下調。與細胞轉移能力相應,在鴉膽子苦醇處理6 h后蛋白表達量開始下降,在12 h后蛋白表達明顯下調。見圖5。

圖5 鴉膽子苦醇處理A549細胞不同時間段細胞轉移相關蛋白的表達
3 討 論
目前發現,天然抗腫瘤藥物通過不同的作用方式抑制腫瘤生長,如抑制腫瘤細胞的增殖;或者通過誘導腫瘤細胞的分化而使腫瘤細胞失去干性;誘導腫瘤細胞的凋亡以及抑制腫瘤細胞的黏附能力從而抑制腫瘤的遷移、侵襲和浸潤轉移等。本研究發現,鴉膽子苦醇能夠抑制非小細胞肺癌A549細胞的遷移能力,而且在一定范圍內藥物對腫瘤細胞遷移能力抑制的效果具有時間和劑量依賴性。半數致死濃度(0.70 μmol/L)的鴉膽子苦醇處理A549細胞后其遷移能力發生明顯下降,進一步檢測發現鴉膽子苦醇可能通過調節細胞內遷移相關蛋白的表達而影響細胞的遷移。
在腫瘤細胞的侵襲轉移過程中腫瘤微血管網絡的形成對轉移的進程起著非常關鍵的作用。腫瘤中微血管網絡的存在不僅能夠為腫瘤細胞的生長提供豐富的營養物質,而且能夠促進腫瘤細胞的遷移和侵襲,為腫瘤細胞的轉移提供必要的通道〔5〕。肺癌組織內的微血管極為豐富,造成其更易發生侵襲與轉移,這也是目前肺癌治療困難的主要原因之一。因此,研究肺癌腫瘤組織中微血管網絡的形成機制,并針對其相應的機制采取有效的干預措施,能夠抑制肺癌中微血管網絡的形成,進而降低肺癌細胞的侵襲和轉移能力,從而在一定程度上降低肺癌的死亡率。
本研究發現鴉膽子苦醇能夠下調細胞中IGFBP-2的表達。IGFBP-2是屬于胰島素樣生長因子家族的蛋白成員之一,能通過與胰島素生長因子(IGF)相互作用而發揮其生物學功能〔6〕。已有研究證實非小細胞肺癌組織中IGFBP-2的表達有明顯的上調,而且其與非小細胞肺癌腫瘤的侵襲轉移能力密切相關〔7〕。BRF2主要參與RNA聚合酶Ⅲ催化的miRNA的產生。BRF2基因與miRNA的相互關系決定了其在腫瘤發生、發展中所起的重要作用〔8〕。研究表明BRF2基因在肺鱗癌的發生發展過程中扮演著重要的角色,與腫瘤的侵襲轉移等過程存在密切的關系〔9〕。CD151是四跨膜蛋白(TM4SF)家族的成員之一〔10〕,主要參與調控信號傳導,細胞的激活、發展、增殖和運動、腫瘤侵襲與轉移等多種生物學功能〔11,12〕。臨床研究表明,CD151蛋白在多種人類常見的惡性腫瘤中表達水平均有一定上調,且與這些腫瘤的預后關系緊密〔13〕。這與本研究發現非小細胞肺癌A549細胞中CD151蛋白的表達也受鴉膽子苦醇的影響相符合。
綜上所述,鴉膽子苦醇通過調節細胞內轉移相關蛋白的表達而對非小細胞肺癌的轉移能力有明顯的抑制作用。鴉膽子苦醇可以作為潛在的治療非小細胞肺癌的中成藥物,為肺癌的臨床治療提供一定的指導意義。
1Johnson DH,Schiller JH,Bunn PA Jr.Recent clinical advances in lung cancer management〔J〕.J Clin Oncol,2014;32(10):973-82.
2Rao JS,Gondi C,Chittivelu S,etal.Inhibition of invasion,angiogenesis,tumor growth,and metastasis by adenovirus-mediated transfer of antisense uPAR and MMP-9 in non-small cell lung cancer cells〔J〕.Mol Cancer Ther,2005;4(9):1399-408.
3Olayanju A,Copple IM,Bryan HK,etal.Brusatol provokes a rapid and transient inhibition of Nrf2 signaling and sensitizes mammalian cells to chemical toxicity—implications for therapeutic targeting of Nrf2〔J〕.Free Radic Biol Med,2015;78(2):202-12.
4Cuendet M,Gills JJ,Pezzuto JM.Brusatol-induced HL-60 cell differentiation involves NF-kappaB activation〔J〕.Cancer Lett,2004;206(1):43-50.
5Hanrahan V,Currie MJ,Gunningham SP,etal.The angiogenic switch for vascular endothelial growth factor(VEGF)-A,VEGF-B,VEGF-C,and VEGF-D in the adenoma-carcinoma sequence during colorectal cancer progression〔J〕.J Pathol,2003;200(2):183-94.
6Park K,Gad E,Goodell V,etal.Insulin-like growth factor-binding protein-2 is a target for the immunomodulation of breast cancer〔J〕.Cancer Res,2008;68(20):8400-9.
7Lu H,Wang L,Gao W,etal.IGFBP2/FAK pathway is causally associated with dasatinib resistance in non-small cell lung cancer cells〔J〕.Mol Cancer Ther,2013;12(12):2864-73.
8Cabarcas S,Schramm L.RNA polymerase Ⅲ transcription in cancer:the BRF2 connection〔J〕.Mol Cancer,2011;10(1):1-10.
9Lockwood WW,Chari R,Coe BP,etal.Integrative genomic analyses identify BRF2 as a novel lineage-specific oncogene in lung squamous cell carcinoma〔J〕.PLoS Med,2010;7(7):e1000315.
10Caplan M,Kamsteeg EJ,Ouffield A.Tetraspan proteins:regulators of renal structure and function〔J〕.Curr Opin Nephrol Hypertens,2007;16(4):353-8.
11Levy S,Shoham T.Protein-protein interactions in the tetraspanin web〔J〕.Physiology,2005;20(2):218-24.
12Fedor B,Elena O.Tetraspanins as regulators of protein trafficking〔J〕.Traffic,2007;8(2):89-96.
13Yue S,Mu W,Z?ller M.Tspan8 and CD151 promote metastasis by distinct mechanisms〔J〕.Eur J Cancer,2013;49(13):2934-48.
〔2015-10-12修回〕
(編輯袁左鳴)
The inhibitory effects of brusatol on the migration of human non-small cell lung carcinoma A549 cells and its molecular mechanism
CHEN Guo,LI Wei,LI Xiao-Hui.
Sichuan Provincial People's Hospital,Chengdu 610072,Sichuan,China
ObjectiveTo explore the inhibitory effects of brusatol on the migration of human non-small cell lung carcinoma A549 cells and its molecular mechanism.MethodsReed-Muench method was used to calculate the lethal concentration of 50%(LC50) of brusatol on A549 cell.Transwell method was used to detect the inhibitory effect of A549 cell lines migration after deal with brusatol,and different inhibition rate of migration with different concentration of brusatol.Western blot was used to detect the expression of cell metastasis associated proteins.ResultsThe migration of A549 cell was down-regulated compared with that of control group after dispose with brusatol.Cell metastasis associated proteins BRF2,IGFBP-2 and CD151 were obviously reduced expressions in cell after dispose with brusatol.ConclusionsHrusatol is a potential anticancer drug against the non-small cell lung carcinoma,the further molecular mechanism should be revealed to provide significance guiding for clinical treatment.
Brusatol;Non-small cell lung carcinoma;A549 cell;Migration
國家“973”計劃項目(No.2011CB708133);四川省科技廳項目(No.2015SZ0042)
李蔚(1966-),女,主任醫師,主要從事肺癌、COPD等疾病的治療及機制研究。
陳果(1981-),女,碩士,主要從事非小細胞肺癌的治療及其相關機制研究。
R736
A
1005-9202(2016)16-3897-03;doi:10.3969/j.issn.1005-9202.2016.16.012

