N-乙酰半胱氨酸對抑郁模型大鼠行為及神經遞質的影響
羅國帥,楊建立,司紀劍,王麗莉,王承展
N-乙酰半胱氨酸對抑郁模型大鼠行為及神經遞質的影響
羅國帥1,楊建立2△,司紀劍2,王麗莉2,王承展1
目的觀察N-乙酰半胱氨酸(NAC)對抑郁模型大鼠行為、各腦區單胺遞質的影響,探討NAC潛在的抗抑郁作用及機制。方法選取成年雄性SD大鼠32只,隨機分為模型組、氟西汀(FLX)組、NAC組、對照組,每組8只;前3組單籠孤養,釆用連續6周慢性輕度不可預見性應激(CUS)的方法建立慢性抑郁大鼠模型,并于第3周末至第6周末對NAC組和FLX組分別給予NAC和FLX灌胃,模型組和對照組給予同體積生理鹽水灌胃。CUS前、后及干預后以體質量測量、糖水消耗實驗、曠場實驗對大鼠行為進行評估;以庫侖陣列電化學高效液相色譜法測定各組大鼠前額葉(PFC)、紋狀體(ST)、杏仁核(AM)和海馬(HIP)單胺神經遞質去甲腎上腺素(NE)、5-羥色胺(5-HT)、多巴胺(DA)水平。結果(1)干預后對照組、NAC組、FLX組較模型組大鼠體質量增加多、糖水消耗量多、水平運動距離長、直立次數多、糞便粒數少(均P<0.05)。(2)與對照組相比,模型組大鼠前額葉、紋狀體、杏仁核、海馬等腦區單胺神經遞質NE、DA和5-HT水平明顯降低(均P<0.05);與模型組相比,NAC組、FLX組前額葉、紋狀體、杏仁核、海馬等NE、DA、5-HT濃度顯著升高(均P<0.05)。結論NAC和FLX均可有效改善抑郁模型大鼠的抑郁行為,并在總體上提高前額葉、紋狀體、杏仁核、海馬等腦區單胺神經遞質的水平。
抑郁癥;乙酰半胱氨酸;氟西汀;物理刺激;大鼠,Sprague-Dawley
抑郁障礙(depression disorder)又稱抑郁癥(depression),是一種常見的、慢性、復發性精神科疾病[1]。抑郁癥以顯著而持久的心境抑郁及興趣喪失為主要特點,臨床上可伴有罪惡感、注意力下降、反復出現的自殺觀念和行為等。Beyer等[2]研究顯示,25%~50%的抑郁障礙患者一生中至少有1次自殺行為,其中約6%~19%死于自殺。隨著社會的發展和社會壓力的加大,抑郁障礙的發病率呈逐年上升,重度抑郁癥全球患病率超過16%[3]。然而抑郁癥的發病機制仍然并不完全清楚。
炎癥/免疫反應在抑郁癥發病中發揮作用的觀點已得到廣泛驗證,但其機制并不完全清楚。有研究顯示,在為期6個月的隨機對照雙盲試驗中,服用N-乙酰半胱氨酸(NAC,1 000 mg每天2次)的患者較對照組蒙哥馬利-艾斯伯格抑郁評分(Montgomer-Asberg Depression Rating Scale,MADRS)明顯降低[4]。據此,本研究通過觀察對抑郁模型大鼠灌胃NAC干預后的行為學及腦組織中單胺神經遞質水平的改變,探討NAC對抑郁癥的作用,以期找到抑郁癥治療的新方案。
1 材料與方法
1.1實驗材料
1.1.1實驗動物清潔級成年雄性SD大鼠32只[許可證號:SYXK(京)2011-0039,北京維通利華實驗動物技術有限公司],體質量180~200 g,喂養于濕度40%~50%,溫度(20± 2)℃的獨立通氣籠(individual ventilated cages,IVC)系統,晝夜比為12 h/12 h(光照時間為07:00—19:00),食物和水充分供給,自由攝取。大鼠在動物房適應性飼養3 d后開始實驗。本研究所有對動物的實驗操作均遵守中國國家科學技術委員會頒布的《中華人民共和國實驗動物管理條例》。
1.1.2藥品及試劑NAC購自Sigma-Aldrich公司。氟西汀(fluoxetine hydrochloride,FLX)購自禮來蘇州制藥有限公司。注射用生理鹽水(NS)購自北京化工廠。去甲腎上腺素(NE)、多巴胺(DA)、5-羥色胺(5-HT)購自美國Sigma公司。其余試劑均為實驗室自制。
1.1.3主要設備與儀器Med曠場測驗箱購自美國MED Associates公司;電子秒表(型號HS-80TW-1DF)購自日本CASIO公司;-80℃低溫冰箱[MDF-C8V(N)]購自日本SANYO公司;冷凍高速離心機(Himac CR22)、臺式高速離心機(Eppendorf)均購自日本HITACHI公司;組織勻漿器(Model PRO 2000)購自美國Pro Scientific公司;振蕩儀(Vortex-Genie 2)購自Scientific Industries公司;ESA Model 5600A-HPLC系統購自惠澤(ESA)公司。
1.2方法
1.2.1動物分組及給藥32只大鼠適應性喂養3 d,按照隨機數字表法分為對照組、模型組、NAC組、FLX組,每組8只。對照組每籠4只、飼養6周,其余3組單籠孤養,接受6周造模,并于第3周末至第6周末對NAC組和FLX組分別給予NAC(150 mg/kg)和FLX(10 mg/kg)灌胃,模型組和對照組給予同體積生理鹽水灌胃。各組均于每天上午9:00—10:00灌胃。
1.2.2慢性輕度不可預見性應激(CUS)參考Liu等[5]的抑郁癥造模方法,每天隨機給予7種應激因子中的1種,相同刺激不可連續出現,使大鼠不能預料刺激的發生,以避免產生適應性反應。應激因子包括:熱應激(45℃,每次5 min,每天1次),潮濕墊料24 h,明暗顛倒24 h,夾尾巴(尾部近體端1/3處,每次1 min,每天1次),禁食24 h,禁水24 h,電擊足底(電壓60 V,每次電擊10次,每次間隔5 s,每只大鼠每天10次)。
1.2.3行為評估采用體質量測量、糖水消耗實驗和曠場實驗分別于CUS前、后及干預后對大鼠行為進行評估。(1)體質量測量:記錄CUS前、后和干預后體質量,并計算CUS后和干預后的體質量增加量。(2)糖水消耗實驗:禁水24 h后,將所有大鼠均置于單籠內,給予1%濃度蔗糖水200 mL,1 h后取出水瓶并測量剩余糖水體積,以此作為糖水消耗量(mL)。(3)曠場試驗:曠場設置于暗室,由不透明鋼板制成,大小100 cm×100 cm×40 cm(長×寬×高),實驗時將大鼠置于曠場的中心,由攝像機拍攝,Smart virsion2.5軟件記錄并分析大鼠5 min內的行為并記錄運動總路程,人工同步記錄大鼠直立次數、糞便粒數。實驗前預跑30 s,每次實驗后打掃曠場,清除糞便,并用醫用乙醇擦拭以消除大鼠遺留氣味。
1.2.4樣本采集(1)大鼠最后一次行為學測試后各組大鼠斷頭取腦,置于預冷的PBS緩沖液中浸泡5 min,隨即迅速于冰面上分離出前額葉(PFC)、紋狀體(ST)、杏仁核(AM)和海馬(HIP)組織,并根據實驗要求分裝2份于凍存管中,置于液氮中保存待測。(2)庫倫列陣高效液相色譜法測定各組大鼠各腦區單胺神經遞質的水平。以3,4二羥基芐胺(DHBA)為內標,測定大鼠各腦區NE、DA和5-HT的含量。色譜柱:Zorbax Eclipse XDB-18C(150 mm×4.6 mm,5 μm),加EasyGuard預柱;流動相:含一水檸檬酸80 mmol/L,檸檬酸三鈉73.4 mmol/L,1-辛烷磺酸鈉0.12 mmol/L,乙二胺四乙酸二鈉0.1 mmol/L,18%甲醇的混合溶液,pH 4.3;流速1.0 mL/ min;柱溫25℃;進樣量10 μL;測定電極電勢-150 mV和400 mV。
1.3統計學方法數據錄入后使用Excel 2010進行整理,采用SPSS 16.0統計軟件進行統計分析,計量資料以均數±標準差表示,多組間比較采用單因素方差分析(ANOVA),若存在差異,則進一步進行LSD-t法兩兩比較。以P<0.05為差異有統計學意義。
2 結果
2.1CUS前大鼠行為評估各組大鼠在體質量、糖水消耗量、水平運動距離、直立次數以及糞便粒數差異均無統計學意義,各組大鼠行為基本一致,見表1。
Tab.1Comparison of behavioral assessment before CUS between four groups表1 CUS前各組大鼠行為測試結果比較(n=8,)
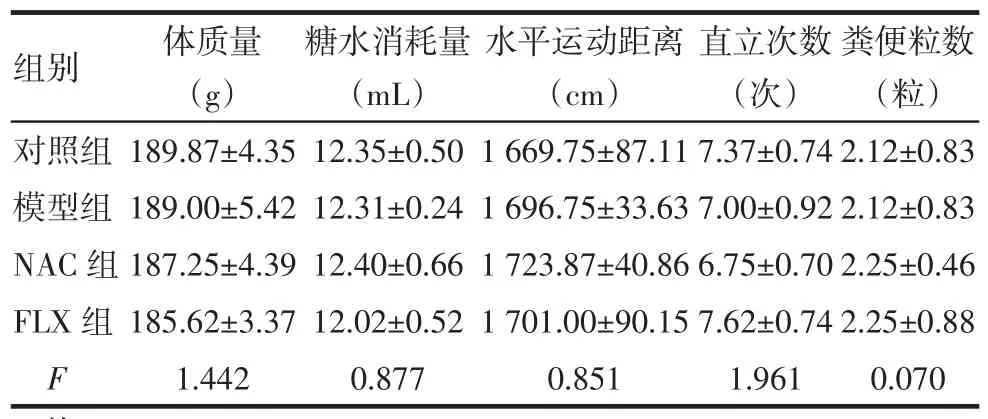
Tab.1Comparison of behavioral assessment before CUS between four groups表1 CUS前各組大鼠行為測試結果比較(n=8,)
均P>0.05
組別對照組模型組NAC組FLX組F糞便粒數(粒)2.12±0.83 2.12±0.83 2.25±0.46 2.25±0.88 0.070體質量(g)189.87±4.35 189.00±5.42 187.25±4.39 185.62±3.37 1.442糖水消耗量(mL)12.35±0.50 12.31±0.24 12.40±0.66 12.02±0.52 0.877水平運動距離(cm)1 669.75±87.11 1 696.75±33.63 1 723.87±40.86 1 701.00±90.15 0.851直立次數(次)7.37±0.74 7.00±0.92 6.75±0.70 7.62±0.74 1.961
2.2CUS后大鼠行為評估第21天后,模型組、NAC組、FLX組體質量增加量、大鼠糖水消耗量、水平運動距離、直立次數均較對照組少,糞便粒數多(P<0.05),而該3組間差異無統計學意義(均P>0.05),提示造模成功,見表2。
Tab.2Comparison of behavioral assessment after CUS between four groups表2 CUS后各組大鼠行為測試結果比較(n=8,)
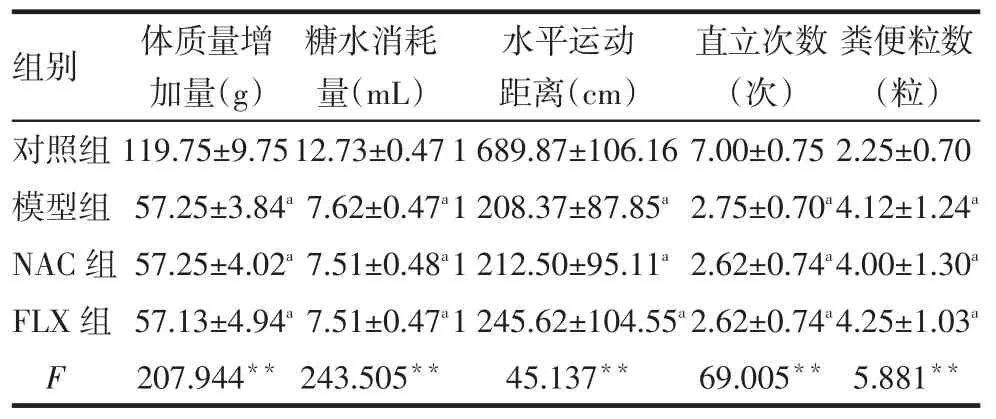
Tab.2Comparison of behavioral assessment after CUS between four groups表2 CUS后各組大鼠行為測試結果比較(n=8,)
**P<0.01;a與對照組比較,P<0.05
組別對照組模型組NAC組FLX組F體質量增加量(g)119.75±9.75 57.25±3.84a 57.25±4.02a 57.13±4.94a 207.944**糖水消耗量(mL)12.73±0.47 7.62±0.47a 7.51±0.48a 7.51±0.47a 243.505**水平運動距離(cm)1 689.87±106.16 1 208.37±87.85a 1 212.50±95.11a 1 245.62±104.55a 45.137**直立次數(次)7.00±0.75 2.75±0.70a 2.62±0.74a 2.62±0.74a 69.005**糞便粒數(粒)2.25±0.70 4.12±1.24a 4.00±1.30a 4.25±1.03a 5.881**
2.3干預后大鼠行為評估干預后,模型組、NAC組、FLX組較對照組體質量增加量少,大鼠糖水消耗量少,但NAC組和FLX組均高于模型組。模型組較對照組水平運動距離短,直立次數少,糞便粒數多,而NAC組和FLX組較模型組水平運動距離長,直立次數多,糞便粒數少(P<0.05),且該2組與對照組差異無統計學意義(P>0.05)。上述指標在NAC組與FLX組間差異均無統計學意義(P>0.05),見表3。
Tab.3Comparison of behavioral assessment after intervention between four groups表3 干預后各組大鼠行為評估結果比較(n=8,)
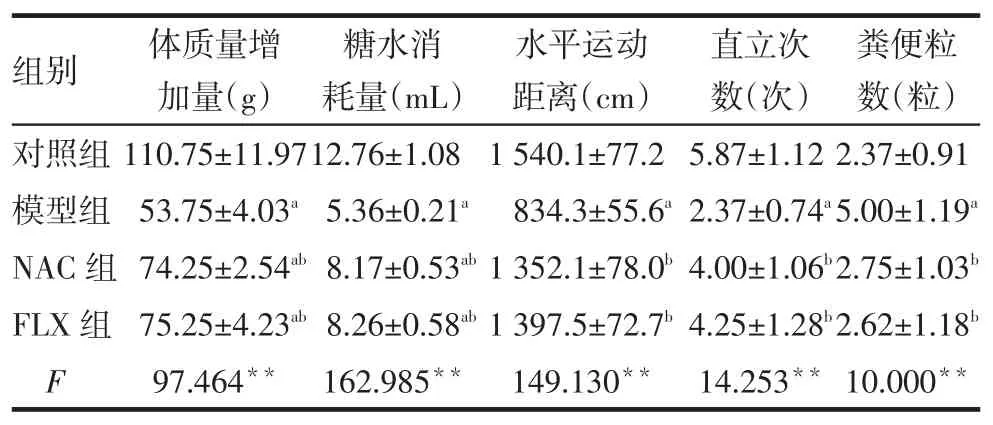
Tab.3Comparison of behavioral assessment after intervention between four groups表3 干預后各組大鼠行為評估結果比較(n=8,)
**P<0.01;a與對照組比較,b與模型組比較,P<0.05
組別對照組模型組NAC組FLX組F體質量增加量(g)110.75±11.97 53.75±4.03a 74.25±2.54ab 75.25±4.23ab 97.464**糖水消耗量(mL)12.76±1.08 5.36±0.21a 8.17±0.53ab 8.26±0.58ab 162.985**水平運動距離(cm)1 540.1±77.2 834.3±55.6a 1 352.1±78.0b 1 397.5±72.7b 149.130**直立次數(次)5.87±1.12 2.37±0.74a 4.00±1.06b 4.25±1.28b 14.253**糞便粒數(粒)2.37±0.91 5.00±1.19a 2.75±1.03b 2.62±1.18b 10.000**
2.4干預后大鼠各腦區單胺神經遞質結果干預后,模型組較對照組各腦區單胺神經遞質水平均降低,NAC組、FLX組較模型組水平均升高(P<0.05);但NAC組和FLX組前額葉DA、NE水平,海馬區DA水平仍低于對照組,而該2組4個腦區其他指標水平與對照組差異無統計學意義(P>0.05),見表4。
Tab.4Comparison of monoamine neurotransmitters of brain regions between four groups表4 各組大鼠各腦區單胺神經遞質水平比較(n=8,)
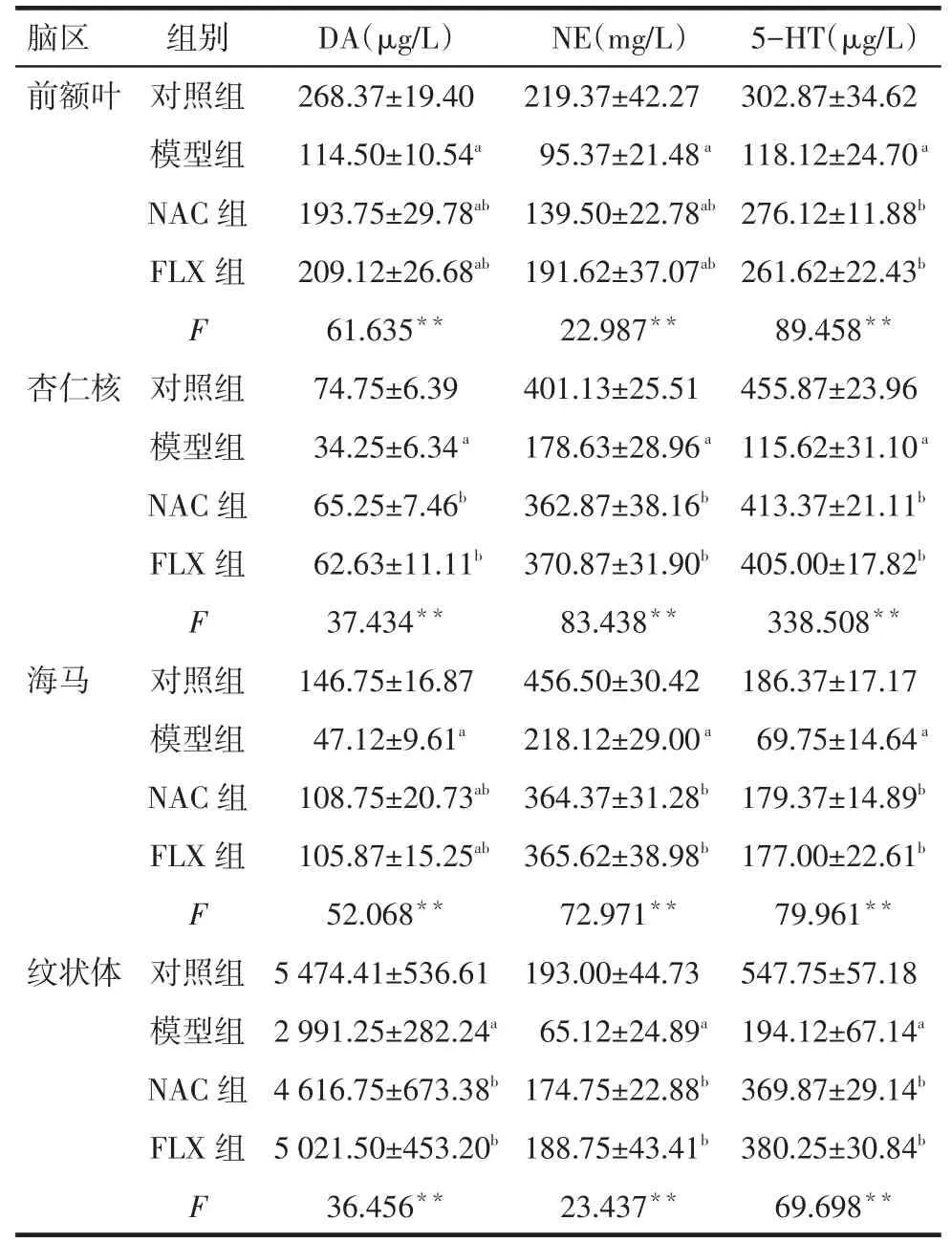
Tab.4Comparison of monoamine neurotransmitters of brain regions between four groups表4 各組大鼠各腦區單胺神經遞質水平比較(n=8,)
**P<0.01;a與對照組比較,b與模型組比較,P<0.05
腦區前額葉杏仁核海馬紋狀體組別對照組模型組NAC組FLX組F對照組模型組NAC組FLX組F對照組模型組NAC組FLX組F對照組模型組NAC組FLX組F DA(μg/L)268.37±19.40 114.50±10.54a 193.75±29.78ab 209.12±26.68ab 61.635**74.75±6.39 34.25±6.34a 65.25±7.46b 62.63±11.11b 37.434**146.75±16.87 47.12±9.61a 108.75±20.73ab 105.87±15.25ab 52.068**5 474.41±536.61 2 991.25±282.24a 4 616.75±673.38b 5 021.50±453.20b 36.456**NE(mg/L)219.37±42.27 95.37±21.48a 139.50±22.78ab 191.62±37.07ab 22.987**401.13±25.51 178.63±28.96a 362.87±38.16b 370.87±31.90b 83.438**456.50±30.42 218.12±29.00a 364.37±31.28b 365.62±38.98b 72.971**193.00±44.73 65.12±24.89a 174.75±22.88b 188.75±43.41b 23.437**5-HT(μg/L)302.87±34.62 118.12±24.70a 276.12±11.88b 261.62±22.43b 89.458**455.87±23.96 115.62±31.10a 413.37±21.11b 405.00±17.82b 338.508**186.37±17.17 69.75±14.64a 179.37±14.89b 177.00±22.61b 79.961**547.75±57.18 194.12±67.14a 369.87±29.14b 380.25±30.84b 69.698**
3 討論
抑郁障礙病因復雜,研究者們已就抑郁障礙開展了大量的分子生物學研究,但確切的致病因素尚無定論。有研究表明免疫反應與氧化應激可能參與抑郁癥的發病過程,一些炎癥因子及氧化應激指標可能成為抑郁癥的生物標志物,抗炎藥物可能對抑郁癥有輔助治療作用[6]。
3.1NAC的抗抑郁作用首次行為評估各組大鼠行為差異無統計學意義。3周CUS后行為評估顯示,模型組、NAC組、FLX組大鼠與對照組相比抑郁樣行為增多,提示CUS可引起大鼠抑郁樣行為,結果與Liu等[5]的結果一致。干預后的行為評估,模型組大鼠較對照組抑郁樣行為多(糖水消耗量少、水平運動距離短、直立次數少、糞便粒數多),提示模型組抑郁狀態得到維持;NAC組、FLX組大鼠抑郁樣行為較模型組少,提示NAC、FLX均可能逆轉模型組大鼠抑郁樣行為。其中,FLX對模型組大鼠抑郁樣行為的作用與張國棟等[7]的研究一致,NAC組與FLX組無差異,提示NAC對CUS大鼠抑郁樣行為的逆轉效果與FLX類似。
3.2NAC抗抑郁的機制抑郁障礙伴有免疫炎癥系統的激活,此時核因子(NF)-κB活化并且海馬類神經干細胞的增殖減少,NF-κB與應激所導致的抑郁樣行為密切相關[8]。同時,NF-κB的活化伴隨著白細胞介素(IL)-1、IL-2、IL-6、IL-8、腫瘤壞死因子(TNF)-α等炎性細胞因子水平的增高,而后者的分泌同時也可以促進NF-κB的活化,從而放大增效炎癥反應,并使之持續[6]。國外已有研究證實,細胞因子在抑郁癥的發病中起著重要作用,并認為抑郁癥伴隨免疫炎癥反應系統(IRS)的激活,炎性細胞因子如IL-6、超敏C反應蛋白(hs-CRP)的分泌增加[9]。NAC可抑制NF-κB的激活和蛋白IκBα表達,減少NF-κBp65表達的核轉位,減少細胞因子和炎癥介質的釋放,減輕免疫炎癥反應。國內研究顯示,NAC可減輕炎癥細胞侵潤[10]。
3.3NAC對大腦單胺類神經遞質的影響既往研究指出,應激刺激如強迫游泳所產生的行為反應由大腦中神經回路調節,這種調節很大程度上是通過自主神經系統、神經內分泌系統和免疫系統來完成的[11]。與模型組大鼠相比,NAC組在干預后行為學的改變也是由中樞神經系統調節的。必須強調的是,這種行為學改變是抗抑郁藥理研究方面特別有效的評估指標[12]。與模型組相比,NAC組、FLX組在前額葉區5-HT水平增加。前額葉皮質血清素可調節焦慮和情緒狀態。前額葉區5-HT水平增加,表明這一腦區血清素降解降低,可能是因為單胺氧化酶的活性降低,這與多種抗抑郁藥干預SD大鼠后的研究一致[13]。
杏仁核附著在海馬的末端,呈杏仁狀,作為邊緣系統的一部分參與大腦對記憶與情感反應的處理,主要功能有產生情緒、識別情緒和調節情緒、控制學習和記憶等。與模型組相比,NAC組、FLX組杏仁核DA水平增加,有可能NAC及FLX是通過抑制杏仁核DA代謝來達到抗抑郁作用的。
海馬是應激反應的作用靶區,參與情緒反應、學習、記憶、認知、行為和免疫調節等多種基本生理調節,其損傷與抑郁情緒的發生密切相關。與對照組相比,模型組大鼠大腦海馬存在NE、5-HT、DA等神經遞質功能的降低,NAC與FLX可以有效提高大鼠大腦海馬NE、5-HT和DA等遞質水平,從而發揮其抗抑郁作用。研究表明,這一大腦區域的單胺類神經遞質減少與抑郁癥的發病有關,海馬NE濃度的增加,可以改善抑郁模型大鼠的學習任務[14],尤其是大腦發育的早期階段[15]。
紋狀體作為基底神經節的主要組成部分,包括豆狀核和尾狀核,作為邊緣系統-皮質-紋狀體神經環路的組成部分,參與抑郁癥的病理生理改變。模型組大鼠大腦紋狀體區存在5-HT、DA、NE等神經遞質功能的降低,與模型組相比NAC、FLX亦可以有效提高大鼠大腦紋狀體區5-HT、DA、NE等遞質水平,從而發揮其抗抑郁作用。
綜上所述,NAC和FLX一樣,可以明顯改善抑郁模型大鼠行為指標,如體質量增加、自主活動增加、快感興趣提高、絕望無助行為減少。NAC和FLX能夠提高抑郁模型大鼠前額葉、杏仁核、海馬、紋狀體等腦區單胺神經遞質的水平,從而發揮其抗抑郁作用。
[1]Shen YC.Psychiatry[M].Beijing:People's Medical Publishing House,2009:548.[沈漁邨.精神病學[M].北京:人民衛生出版社,2009:548].
[2]Beyer JL,Weisler RH.Suicide behaviors in bipolar disorder:a review and update for the clinician[J].Psychiatr Clin North Am,2016,39(1):111-123.doi:10.1016/j.psc.2015.09.002.
[3]Bielczyk NZ,Buitelaar JK,Glennon JC,et al.Circuit to construct mapping:a mathematical tool for assisting the diagnosis and treatment in major depressive disorder[J].Front Psychiatry,2015,6:29.doi:10.3389/fpsyt.2015.00029.
[4]Berk M,Copolov DL,Dean O,et al.N-Acetyl cysteine for depressivesymptomsinbipolardisorder-adouble-blind randomized placebo-controlled trial[J].Biol Psychiatry,2008,64(6):468-475.doi:10.1016/j.biopsych.2008.04.022.
[5]Liu D,Wang Z,Gao Z,et al.Effects of curcumin on learning and memory deficits,BDNF,and ERK protein expression in rats exposed to chronic unpredictable stress[J].Behav Brain Res,2014,271:116-121.doi:10.1016/j.bbr.2014.05.068.
[6]Rosenblat JD,McIntyre RS.Bipolar disorder and inflammation[J]. Psychiatr Clin North Am,2016,39(1):125-137.doi:10.1016/j. psc.2015.09.006.
[7]Zhang GD,Dong J,Li Y,et al.Expression of S100B in hippocampus of depression model rats induced by chronic unpredictable stress and the effect of fluoxetine in bolcking it[J].Chin J Behav Med& Brain Sci,2013,22(11):978-981.[張國棟,董嬌,李晏,等.慢性應激抑郁模型大鼠海馬組織S100B表達及氟西汀的干預作用[J].中華行為醫學與腦科學雜志,2013,22(11):978-981].doi:10.3760/ema.j.issn.1674-6554.2013.11.006.
[8]Koo JW,Russo SJ,Ferguson D,et al.Nuclear factor-kappa B is a critical mediator of stress-impaired neurogenesis and depressive behavior[J].Proc Natl Acad Sci U S A,2010,107(6):2669-2674. doi:10.1073/pnas.0910658107.
[9]Zunszain PA,Anacker C,Cattaneo A,et al.Glucocorticoids,cytokinesandbrainabnormalitiesindepression[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(3):722-729. doi:10.1016/j.pnpbp.2010.04.011.
[10]Wang JY,Yu HZ,Wu JP,et al.The intervention of N-acetylcysteine on the pulmonary fibrosis of chronic ethanol ingestion in rats[J]. Tianjin Med J,2012,40(10):1034-1036.[王靜宜,于洪志,武俊萍,等.N-乙酰半胱氨酸對慢性飲酒大鼠肺纖維化的干預作用[J].天津醫藥,2012,40(10):1034-1036].doi:10.3969/j. issn.0253-9896.2012.10.021.
[11]Jankord R,Herman JP.Limbic regulation of hypothalamo-pituitaryadrenocortical function during acute and chronic stress[J].Ann N Y Acad Sci,2008,1148:64-73.doi:10.1196/annals.1410.012.
[12]Cryan JF,Page ME,Lucki I.Differential behavioral effects of the antidepressants reboxetine,fluoxetine,and moclobemide in a modifi edforcedswimtestfollowingchronictreatment[J]. Psychopharmacology(Berl),2005,182(3):335-344.
[13]Shishkina GT,Iudina AM,Dygalo NN.Effects of fluoxetine on locomotor activity:possible involvement of dopamine[J].Zh Vyssh Nerv Deiat Im I P Pavlova,2006,56(4):523-528.
[14]Srikumar BN,Raju TR,Shankaranarayana Rao BS.The involvement of cholinergic and noradrenergic systems in behavioural recovery following oxotremorine treatment to chronically stressed rats[J]. Neuroscience,2006,143(3):679-688.
[15]Brummelte S,Mc Glanaghy E,Bonnin A,et al.Developmental changes in serotonin signaling:Implications for early brain function,behavior and adaptation[J].Neuroscience,2016,pii:S0306-4522(16)00177-9.doi:10.1016/j.neuroscience.2016.02.037.
(2016-03-04收稿2016-06-03修回)
(本文編輯李鵬)
Effects of N-acetylcysteine on behavior and monoamine neurotransmitters in rats with chronic unpredictable stress
LUO Guoshuai1,YANG Jianli2△,SI Jijian2,WANG Lili2,WANG Chengzhan1
1 Tianjin Medical University,Tianjin 300070,China;2 Tianjin Anding Hospital△
E-mail:yangjianli0722@163.com
ObjectiveTo investigate effects of N-acetylcysteine(NAC)on changes of the behavior and the monoamine neurotransmitters in prefrontal cortex(PFC),striatum(ST),amygdala(AM)and hippocampus(HIP)in rat model of chronic unpredictable stress(CUS),and to explore the possible mechanisms related to the NAC.MethodsThirty-two male Sprague-Dawle(SD)rats were divided into CUS group,fluoxetine group(FLX),NAC group and control group(n=8 for each group).Rats in CUS group,NAC group and FLX group were all fed alone and received CUS for 6 weeks to establish CUS model.Rats in NAC group and FLX group were given NAC and FLX by daily intragastric administration respectively during the last 3 weeks,while rats in CUS group and control group were given the same volume of solvent.Behavioral assessment including weight measurement,sucrose water consumption test,and opened field test were used for evaluation before and after CUS,and before and after intervention.The concentrations of the monoamine neurotransmitters(NE,DA,5-HT)in PFC,ST,AM and HIP were measured with Coul array HPLC.Results(1)There were more increases in weight gain,sucrose consumption,and distance of horizontal moving and number of up-right,while the number of feces was less,after intervention in control group,NAC group and FLX group than those of CUS group(P<0.05).(2)Neurotransmitters including NE,DA and 5-HT were significantly decreased in PFC,ST,AM and HIP in CUS group compared with that of control group(P<0.05).The monoamine neurotransmitter(NE,DA and 5-HT)were significantly increased in the brain region(PFC,ST,AM and HIP)in NAC group and FLX group than those of CUS group(P<0.05).ConclusionNAC and fluoxetine can effectively improve the depressive behavior of the CUS rats,increase the contents of monoamine neurotransmitters including NE,DA and 5-HT in PFC,AM,ST and HIP brain regions.
depressive disorder;acetylcysteine;fluoxetine;physical stimulation;rats,Sprague-Dawley
R749.4
A
10.11958/20160092
1天津醫科大學(郵編300070);2天津市安定醫院
羅國帥(1988),男,碩士在讀,主要從事抑郁癥及精神分裂癥的治療研究
E-mail:yangjianli0722@163.com

