生理及病理狀態下大鼠海馬θ節律振蕩與空間學習記憶的相關性研究
劉 旭,岳興華,鄭燕萍
(天津中醫藥大學第一附屬醫院臨床實驗室,天津 300193)
生理及病理狀態下大鼠海馬θ節律振蕩與空間學習記憶的相關性研究
劉旭,岳興華,鄭燕萍
(天津中醫藥大學第一附屬醫院臨床實驗室,天津300193)
[目的]探討生理及病理狀態下,麻醉大鼠感覺刺激誘導的海馬膽堿能θ(theta)節律振蕩與其空間學習記憶行為的相關性,分析海馬膽堿能θ節律振蕩在空間學習記憶中的作用,同時為其用作評估大鼠空間學習記憶能力的電生理指標提供實驗依據。[方法]使用同一批大鼠進行Morris水迷宮測試和在體海馬膽堿能θ節律振蕩的自身相關比較實驗。實驗主要指標包括:大鼠在水迷宮定位航行實驗中的逃避潛伏期、空間探索實驗中在目標象限的游泳時間百分比、可見平臺實驗中的逃避潛伏期、游泳速度以及由夾尾刺激誘導θ節律振蕩的功率峰值(Ppeak)及其對應的頻率值(Fpeak)。[結果]雙側海馬注射全長的淀粉樣β蛋白(Aβ)明顯的損害了大鼠在水迷宮中的學習(P<0.05)及記憶(P<0.01)能力,同時壓抑了感覺刺激誘導的膽堿能θ節律振蕩的Ppeak(P<0.01)。正常對照組(生理組)及Aβ海馬注射組(病理組)大鼠膽堿能θ節律振蕩的Ppeak均與定位航行實驗中逃避潛伏期呈明顯負相關(正常對照組:r=-0.803,P<0.05;Aβ海馬注射組:r=-0.764,P<0.05),且與空間探索實驗中目標象限游泳實驗百分比呈明顯正相關(正常對照組:r=0.762,P<0.05;Aβ海馬注射組:r=0.771,P<0.05)。將兩組數據合并后,膽堿能θ節律振蕩Ppeak與逃避潛伏期和目標象限游泳時間百分比的相關性更高,分別為:r=-0.896(P<0.01)和r=0.888(P<0.01)。[結論]感覺刺激誘導的大鼠海馬膽堿能θ節律振蕩的功率值與其空間學習記憶能力存在良好的相關性,提示海馬膽堿能θ節律振蕩作為一種神經網絡同步化電活動可能參與學習記憶行為,而其功率大小可用于間接評估實驗動物的空間學習記憶能力,為中醫治療阿爾茨海默病(AD)的實驗研究提供動物模型的基礎。
海馬θ節律振蕩;空間學習記憶;淀粉樣β蛋白;阿爾茨海默病
近年來,隨著人口老齡化的進程加速,老年癡呆的發病率逐年升高,已成為繼心臟病、腫瘤、中風后的第四大死亡病因。從歷史研究看中醫對該病認識及治療的發展脈絡清晰,中醫雖沒有關于老年癡呆病名的直接記載,但是綜合其臨床表現,屬于中醫癡呆、呆病、善忘等范疇。中醫認為老年癡呆病位在腦,與腎、心、脾、肝等功能密切相關,其關鍵在于腎。多屬本虛標實證,本虛主因在于腎精不足,髓海虧虛;標實在于肝氣瘀滯所致痰濁與瘀血相互作用蒙蔽腦竅,令清空失靈神識迷蒙。因此在辨證施治中,主要以補益腎虛為主,輔以活血化瘀、同時重視疏肝解郁和化痰逐痰等。而中醫藥手段包括:針灸、電針等對阿爾茨海默病(AD)診療的實驗研究就是中醫治療發展的前提,而實驗研究的學習認知記憶動物模型的設立是之前一系列工作的基礎。位于顳葉的大鼠海馬體作為“空間認知地圖”與空間記憶、情景記憶密切相關,諸如AD等具有海馬損傷的神經病變常表現有空間學習記憶功能障礙。依據“淀粉樣β蛋白級聯假說”,AD患者海馬的損傷極可能是由具有神經毒性的淀粉樣β蛋白(Aβ)在海馬中異常沉積所致[1]。大量相關實驗也證實,在淀粉樣β蛋白前體蛋白(APP)轉基因小鼠模型[2]及Aβ注射的嚙齒動物模型[3]中,均存在與AD相關表現,包括老年斑沉積、神經炎性反應、神經網絡同步化活動異常、突觸可塑性減低及學習記憶功能減退等[4]。
海馬對空間記憶的編碼主要依賴一種頻率在3~12 Hz的神經網絡同步化振蕩活動,即“θ節律振蕩”。研究發現大鼠在不同的行為狀態下可表現出兩種不同頻率的θ節律振蕩—膽堿能θ節律振蕩(cholinergic theta rhythm)與非膽堿能θ節律振蕩(noncholinergic theta rhythm)。當大鼠處于警覺性靜止狀態、烏拉坦麻醉狀態或被動全身旋轉狀態時,可記錄到頻率在3~7 Hz的θ節律振蕩,這種θ節律振蕩可被阿托品所壓抑,為膽堿能θ節律振蕩;當實驗動物處于跑動、行走、攀爬等主觀運動狀態時,可記錄到頻率在7~12 Hz的θ節律振蕩,這種θ節律振蕩不受阿托品影響,為非膽堿能θ節律振蕩[5]。另具研究表明,海馬非膽堿能θ節律振蕩通過與gamma節律振蕩(30~100 Hz)嵌套生成更為復雜的神經網絡同步化電活動直接參與了空間學習記憶的編碼及突觸可塑性的調節[6]。除此之外,筆者之前的一項相關實驗研究也表明海馬損傷可導致膽堿能θ節律振蕩的壓抑及空間學習記憶能力的損傷,初步提示膽堿能θ節律振蕩與空間學習記憶也可能存在一定的相關性[7]。故本研究旨在通過自身相關比較實驗進一步探討證明生理及病理兩種不同狀態下,大鼠海馬膽堿能θ節律振蕩活動與空間學習記憶能力的相關性,為膽堿能θ節律振蕩活動作為評估實驗動物空間學習記憶能力的電生理指標提供實驗依據。
1 材料與方法
1.1材料實驗動物隨機選擇運動能力及視覺正常的成年健康雄性SD大鼠(體質量180~200 g,由山西醫科大學實驗動物中心提供)。全長淀粉樣β蛋白(Aβ1-42)購自美國Abcam公司,使用微量二甲基亞砜(DMSO)將其充分溶解并加生理鹽水稀釋至最終濃度2.5 g/L,37℃孵育36 h,孵育期間保持間斷性振蕩,使其最終老化成寡聚體。溶劑中DMSO終濃度低于0.1%,經證實為生理無效濃度[8],對學習記憶及神經網絡活動均無影響。
1.2方法
1.2.1手術依據隨機數表將20只SD大鼠分成兩組:正常對照組(雙側海馬注射溶劑)與Aβ海馬注射組(雙側海馬注射Aβ1-42)。大鼠注射水合氯醛(0.3 g/kg,i.p)進行麻醉后,使用雙臂數顯腦立體定位儀(RWD68004,RWD Life Science,China)加以固定,碘伏消毒備皮后切開頭部皮膚以暴露頭骨,依據大鼠腦立體圖譜確定給藥點并使用骨鉆鉆孔,借助微量給藥泵(KDS 310 Plus,KDS scientific,USA)將溶劑(2 μL)或藥物(Aβ1-42,2 μL)緩慢推注至大鼠雙側海馬CA1區(前囟后3.0 mm,旁開2.2 mm,深度3.0 mm,注射速度為0.15 μL/min),注射后留針5 min以保證藥物的充分擴散并防止虹吸。使用骨蠟封閉顱骨注射孔并進行手術縫合。術后置于溫箱中待其蘇醒。術后恢復2周后進行后續的行為學及電生理實驗。
1.2.2Morris水迷宮測試Morris水迷宮測試是評估海馬結構相關空間學習記憶能力的經典行為學實驗[9]。宮體由一個圓形金屬水池(直徑150 cm,高50 cm)及一個圓形逃避平臺(直徑14 cm,高30 cm)構成。宮體內部被漆成黑色并均勻劃分為4個象限,通過簾布將宮體與外界環境隔離,并在整個實驗過程中保障行為學實驗室的安靜,以避免外界環境因素對實驗結果造成干擾。簾布內側貼有與4個象限相對應的顏色形狀各異的視覺標識。實驗過程中宮體水溫保持在(23±2)℃。
1.2.2.1定位航行實驗定位航行實驗為測試的1~5 d,用以對大鼠的空間學習能力加以評估。在本實驗階段,黑色逃避平臺藏匿于水面以下1~2 cm處,固定放置于第一象限中心。每天分4次將大鼠從各個象限的中點投入到宮體中,投放象限的順序由隨機數表產生。出于逃生的本能,大鼠會在宮體內做逃避式游泳直至找到平臺,大鼠從入水到找到平臺的時間為逃避潛伏期。大鼠找到平臺后允許在平臺上休息15 s。如若大鼠未能在120 s內找到平臺,需誘導至平臺上并停留15 s。通過行為學記錄分析系統(Ethovision 3.0,Noldus Information Technology,Wageningen,the Netherlands)捕捉記錄大鼠的游泳軌跡及逃避潛伏期用于分析。
1.2.2.2空間探索實驗定位航行實驗結束后(第6天)進行空間探索實驗,用于檢測實驗動物的空間記憶能力。在該實驗階段,需移除逃避平臺,大鼠分4次隨機從其中一個象限的中點投入宮體中,自由游泳120 s,通過行為學記錄分析系統記錄大鼠在120 s內的游泳軌跡及在目標象限(第一象限)的游泳時間百分比。
1.2.2.3可見平臺實驗空間探索實驗4 h后,進行可見平臺實驗,用以排除大鼠視力及運動能力對實驗結果的干擾。在該實驗階段,將白色逃避平臺放入第一象限的中心位置,并高出水面1~2 cm以使其可見。大鼠分4次隨機從其中一個象限的中點投入宮體中,通過行為學記錄分析系統記錄大鼠到達可見平臺的逃避潛伏期及游泳速度。
1.3在體海馬局部場電位膽堿能θ節律振蕩的誘導記錄Morris水迷宮測試后,進行海馬膽堿能θ節律振蕩的誘導及記錄。大鼠經烏拉坦(1.3 g/kg,i.p)充分麻醉后固定于雙臂數顯腦立體定位儀上,體溫通過反饋調節溫控裝置(Temperature controller 69000,RWD,China)控制在(37±0.5)℃。消毒備皮并切開顱部皮膚暴露顱骨,依據大鼠腦立體定位圖譜在顱骨上鉆孔(前囟后3.4 mm,中線旁開2.5 mm),利用微推進器(MO-10,Narishige,Japan)將環氧絕緣固化微電極(A-M systerm,5 MΩ)下至海馬CA1區(皮質表面下2.2 mm左右)。局部場電位信號通過前置放大器放大后,經由光纜導入到生物電信號處理放大工作站中(RX7 workstation,TDT,USA),實驗中采樣頻率設置為500 Hz,濾波參數設置為帶通0.1~250 Hz,待波形穩定后,記錄基礎局部場電位2 min,隨后給予固定強度的夾尾刺激1 min以誘導θ節律振蕩,記錄刺激后的局部場電位10 min,選擇夾尾后6~8 min的信號進行分析。整個實驗結束后,大鼠通過注射過量烏拉坦行安樂死。
1.4統計學處理Morris水迷宮實驗采用定位航行實驗5 d內大鼠找到水下平臺的逃避潛伏期、空間探索實驗中大鼠在目標象限的游泳時間百分比、可見平臺實驗中大鼠找到可見平臺的逃避潛伏期及游泳速度。在體海馬局部場電位膽堿能θ節律振蕩分析其功率峰值(Ppeak)及其對應的頻率值(Fpeak),使用Matlab 7.7進行數據處理。結果以均數±標準差(±s)表示,采用SPSS 18.0進行分析統計,組間比較用t檢驗進行分析,其他數據采用正態性檢驗和兩樣本Pearson相關性分析,以P<0.05為差異有統計學意義。
2 結果
2.1雙側海馬注射Aβ1-42損傷大鼠空間學習記憶能力如表1所示,定位航行實驗的2~5 d,Aβ海馬注射組大鼠找到水下逃避平臺的潛伏期明顯長于正常對照組(P<0.05,表1);在第6天的空間探索實驗中,Aβ海馬注射組大鼠在目標象限游泳時間百分比明顯少于正常對照組(P<0.05,表2);而在可見平臺實驗中,兩組大鼠到達可見平臺的逃避潛伏期及平均游泳速度均無顯著差異(P>0.05,表3)。
2.2雙側海馬注射Aβ1-42壓抑大鼠海馬膽堿能θ節律振蕩如表4所示,對兩組大鼠θ頻率段的功率峰值(Ppeak)以及與其對應的頻率值(Fpeak)進行了比較。Aβ海馬注射組大鼠θ節律振蕩Ppeak明顯低于正常對照組(P<0.001);而兩組大鼠鼠θ節律振蕩Fpeak無顯著差異(P>0.05)。
表1 海馬注射Aβ1-42對大鼠定位航行實驗逃避潛伏期的影響(±s)Tab.1 Effect of intrahippocampal injection of Aβ1-42on the escape latency of rats in place navigation test(±s)

表1 海馬注射Aβ1-42對大鼠定位航行實驗逃避潛伏期的影響(±s)Tab.1 Effect of intrahippocampal injection of Aβ1-42on the escape latency of rats in place navigation test(±s)
注:與對照組相比,aP<0.05。
定位航行實驗逃避潛伏期(s)第1天 第2天 第3天 第4天 第5天對照組 10 81.31±8.15 44.11±3.96 32.68±2.42 28.41±2.37 27.52±1.42 Aβ注射組 10 100.5±5.15 76.45±7.04a47.78±3.71a41.52±1.80a40.99±2.01a組別 動物數
表2 海馬注射Aβ1-42對大鼠空間探索實驗目標象限游泳時間百分比的影響(±s)Tab.2 Effect of intrahippocampal injection of Aβ1-42on the percentage of swimming time in the target quadrant of rats in probe trial test(±s)

表2 海馬注射Aβ1-42對大鼠空間探索實驗目標象限游泳時間百分比的影響(±s)Tab.2 Effect of intrahippocampal injection of Aβ1-42on the percentage of swimming time in the target quadrant of rats in probe trial test(±s)
注:與對照組相比,aP<0.05。
組別 動物數 空間探索實驗目標象限游泳時間百分比(%)對照組 10 42.42±1.54 Aβ注射組 10 28.57±2.07a
表3 海馬注射Aβ1-42對大鼠視力及運動能力的影響(±s)Tab.3 Effect of intrahippocampal injection of Aβ1-42on visual acuity and motor ability in rats(±s)

表3 海馬注射Aβ1-42對大鼠視力及運動能力的影響(±s)Tab.3 Effect of intrahippocampal injection of Aβ1-42on visual acuity and motor ability in rats(±s)
組別 動物數 可見平臺逃避潛伏期(s)平均游泳速度(m/s)對照組 10 12.58±0.64 20.08±0.79 Aβ注射組 10 12.47±0.58 21.56±0.88
表4 海馬注射Aβ1-42對大鼠θ節律振蕩的影響(±s)Tab.4 Effect of intrahippocampal injection of Aβ1-42on θ rhythm in rats(±s)

表4 海馬注射Aβ1-42對大鼠θ節律振蕩的影響(±s)Tab.4 Effect of intrahippocampal injection of Aβ1-42on θ rhythm in rats(±s)
注:與對照組相比,aP<0.05。
組別 動物數 θ節律振蕩功率峰值 θ節律振蕩頻率對照組 10 29.92±1.11 3.26±0.04 Aβ注射組 10 21.97±0.67a 3.18±0.06
2.3對照組(生理組)大鼠海馬膽堿能θ節律振蕩功率與逃避潛伏期及目標象限游泳時間百分比的相關性分析首先,對正常對照組大鼠海馬膽堿能θ節律振蕩的功率峰值Ppeak與其在定位航行實驗中的逃避潛伏期(第5天)進行了相關性分析。如圖1A所示,Ppeak與大鼠逃避潛伏期存在明顯的負相關性,Pearson相關系數r=-0.803(P<0.05)。繼而對正常對照組大鼠海馬θ節律振蕩的功率峰值Ppeak與其在空間探索實驗中目標象限游泳實驗百分比進行了相關性分析,如圖1B所示,Ppeak與大鼠在目標象限的游泳實驗百分比呈明顯的正相關性,Pearson相關系數r=0.762(P<0.05)。
2.4Aβ海馬注射組(病理組)大鼠海馬膽堿能θ節律振蕩功率與逃避潛伏期及目標象限游泳時間百分比的相關性分析與對照組相對應,對Aβ海馬注射組大鼠海馬θ節律振蕩的功率峰值Ppeak與其在定位航行實驗中的逃避潛伏期(第5天)進行的相關性分析(圖2A)顯示,Ppeak與大鼠逃避潛伏期存在明顯的負相關性,Pearson相關系數r=-0.764(P<0.05)。對Aβ海馬注射組大鼠海馬θ節律振蕩的功率峰值Ppeak與其在空間探索實驗中目標象限游泳實驗百分比進行的相關性分析(圖2B)顯示,Ppeak與大鼠在目標象限的游泳實驗百分比呈明顯的正相關性,Pearson相關系數r=0.771(P<0.01)。
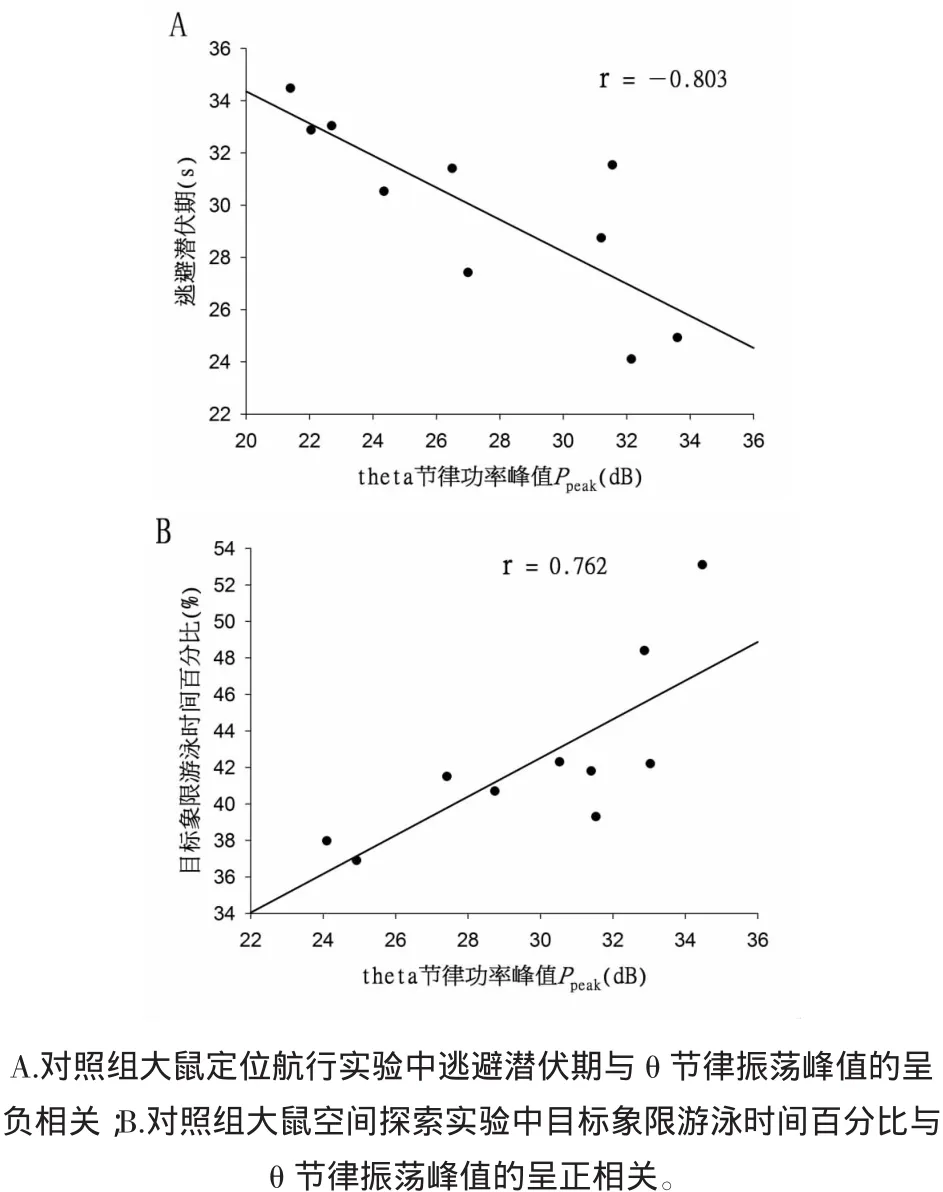
圖1 對照組大鼠逃避潛伏期、目標象限游泳時間百分比與θ節律振蕩峰值的相關性Fig.1 The correlation between the Ppeakof hippocampal cholinergic θ rhythm and escape latency and swimming time percentage in rats of control group
2.5兩組大鼠海馬膽堿能θ節律振蕩功率與逃避潛伏期及目標象限游泳時間百分比的相關性分析通過對合并后的兩組數據進行相關分析發現,在θ節律振蕩的功率峰值Ppeak和定位航行實驗逃避潛伏期相關分析圖(圖3A)中,大鼠的Ppeak幅度與逃避潛伏期、目標象限游泳時間百分比存在更明顯的相關性,Pearson相關系數分別為r=-0.896(P<0.01)和r=0.888(P<0.01)。
3 討論
海馬θ節律振蕩作為海馬結構的主導性神經網絡同步化活動,在情緒、動機、學習記憶等多種高級認知功能中起著決定性作用[10-11]。大量研究表明,非膽堿能θ節律振蕩在海馬位置細胞編碼空間地圖的過程中起著重要作用。位置細胞(place cells)在其位置野內的動作電位發放時刻相對于θ節律振蕩的相位具有進動特性—θ相移,θ相移可將大鼠單次經歷的一系列位置場按順序進行壓縮后,在每個θ周期中重復一次,這樣在這一運動過程中,代表每個位置場的神經元動作電位發放便可多次重復出現,形成間隔約為10 ms(頻率約100 Hz)的序列,而10 ms的間隔正處于最適合增加突觸強度的時間尺度上,而突觸強度的改變正是學習記憶行為的電生理學基礎[12]。因此,非膽堿能θ節律振蕩能夠通過增強突觸強度從而促進空間記憶的形成。Vincent Villette等也通過實驗證實,海馬注射Aβ壓抑了非膽堿能θ節律振蕩并損傷了自發性視覺空間識別測試中的學習記憶行為[13]。相對于非膽堿能θ節律振蕩,海馬膽堿能θ節律振蕩由于出現在動物警覺不動、異相睡眠[14]或是烏拉坦麻醉狀態下,而非存在于主觀性的自發性神經活動中,因此,對海馬膽堿能θ節律振蕩與學習記憶的相關性尚缺乏足夠的研究。
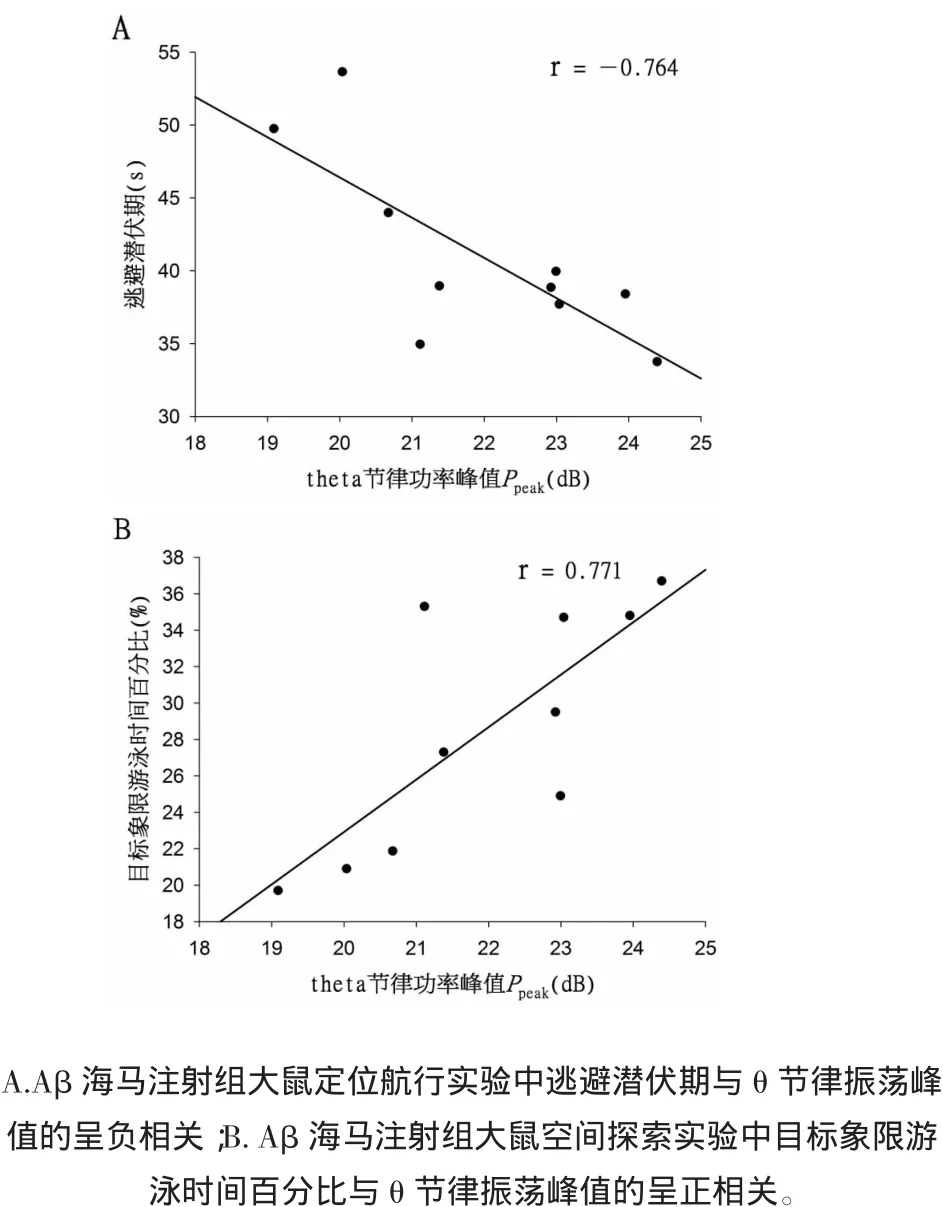
圖2 Aβ海馬注射組大鼠逃避潛伏期、目標象限游泳時間百分比與θ節律振蕩峰值的相關性Fig.2 The correlation between the Ppeakof hippocampal cholinergic θ rhythm and escape latency and swimming time percentage in rats in the intrahippocampal injection of Aβ group
本研究通過自身相關比較實驗發現海馬局部注射Aβ1-42寡聚體造成大鼠Morris水迷宮空間學習記憶行為障礙和海馬膽堿能θ節律振蕩功率壓抑,更重要的是我們還證實了無論是在正常大鼠還是在海馬損傷的大鼠中,其空間學習能力及記憶能力均與海馬膽堿能θ節律振蕩呈良好的相關性。
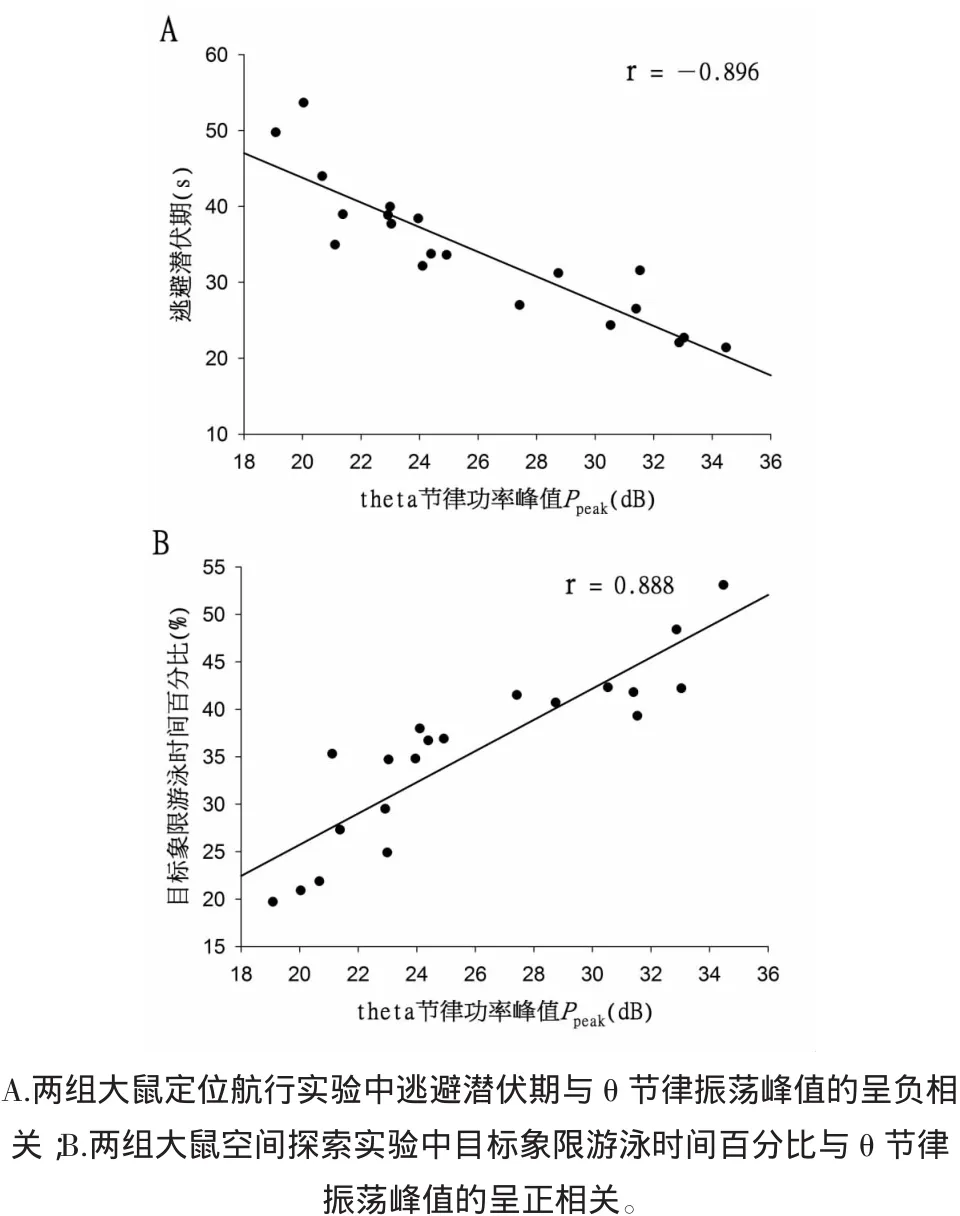
圖3 兩組大鼠逃避潛伏期、目標象限游泳時間百分比與θ節律振蕩峰值相關性的整合分析Fig.3 The integrated analysis of correlation between the Ppeakof hippocampal cholinergic θ rhythm and escape latency and swimming time percentage in rats in two groups
膽堿能θ節律振蕩多出現在實驗動物警覺不動及異相睡眠過程中,而異相睡眠對記憶的鞏固起著重要的作用,許多AD轉基因動物模型的學習記憶功能障礙可能與其異相睡眠減少[15]及θ節律振蕩減低有關[2,16]。在異相睡眠階段,包括膽堿能θ節律振蕩在內的海馬θ節律振蕩活動可能對新近記憶的再加工及鞏固(off-line reprocessing of recently acquired memories)起著一定的作用[17-18]。本研究提示:膽堿能θ節律振蕩功率較高的大鼠其對記憶的加工鞏固較好,故在空間學習記憶能力測試中有更為突出的表現;相反,海馬注射Aβ1-42導致海馬膽堿能θ節律振蕩的壓抑,故在異相睡眠階段不能有效的鞏固行為測試中形成的空間記憶,而在后續的學習記憶能力測試中表現較差。
另外,本研究還為海馬膽堿能θ節律振蕩活動作為評估大鼠空間學習記憶能力的電生理指標提供實驗依據。使用同一批實驗動物,在行為學測試后開展海馬膽堿能θ節律振蕩的記錄一方面可以從行為學及神經網絡電生理兩個角度闡述分析問題,另一方面也大大減少了實驗動物的使用數量,更符合實驗動物倫理學的原則。
當然,本實驗未能直接監測大鼠在警覺性靜止及異相睡眠狀態下的海馬膽堿能θ節律振蕩,而是在烏拉坦麻醉的狀態下借助感覺刺激誘導膽堿能θ節律振蕩來評估生理狀態下大鼠產生膽堿能θ節律振蕩,尚不屬于真正意義的行為學電生理實驗。如果能夠監測Morris水迷宮行為學測試及異相睡眠過程中海馬膽堿能θ節律振蕩及非膽堿能θ節律振蕩,可能能夠更加直接的闡述兩種θ節律振蕩對空間學習記憶活動的影響。行為學電生理實驗是目前研究行為學腦機制的一個前沿的、重要的研究領域,也是本實驗室正在著手準備開展的研究方向。可以肯定的說,借助更有力的行為學電生理手段,能夠更直觀、更全面、更嚴謹地探究腦的高級神經功能的機制及諸如AD等神經系統疾病的機制;為包括使用電針等手段通過增強氧自由基清除系統的功能,提高機體抗氧化能力實現對AD患者改善性治療研究(電針治療方案可能為臨床最佳治療方案)的基礎實驗篩選提供最佳行為、認知、記憶動物模型。
[1]Ferreira ST,Klein WL.The Abeta oligomer hypothesis for synapse failure and memory loss in Alzheimer's disease[J].Neurobiol Learn Mem,2011,96(4):529-543.
[2]Scott L,Feng J,Kiss T,et al.Age-dependent disruption in hippocampal theta oscillation in amyloid-beta overproducing transgenic mice[J]. Neurobiol Aging,2012,33(7):1413-1423.
[3]Epelbaum S,Youssef I,Lacor PN,et al.Acute amnestic encephalopathy in amyloid-beta oligomer-injected mice is due to their widespread diffusion in vivo[J].Neurobiol Aging,2015,36(6):2043-2052.
[4]Mucke L,Selkoe DJ.Neurotoxicity of amyloid beta-protein:synaptic and network dysfunction[J].Cold Spring Harb Perspect Med,2012,2(7):a006338.
[5]ShinJ,GireeshG,KimSW,etal.PhospholipaseCbeta4 inthemedial septum controls cholinergic theta oscillations and anxiety behaviors [J].J Neurosci,2009,29(49):15375-15385.
[6]Yamaguchi Y.A theory of hippocampal memory based on theta phase precession[J].Biol Cybern,2003,89(1):1-9.
[7]Yue XH,Liu XJ,Wu MN,et al.[Amyloid beta protein suppresses hippocampal theta rhythm and induces behavioral disinhibition and spatial memory deficit in rats][J].Sheng Li Xue Bao,2014,66(2): 97-106.
[8]Leung LS,Shen B.Glutamatergic synaptic transmission participates in generating the hippocampal EEG[J].Hippocampus,2004,14(4):510-525.
[9]Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].J Neurosci Methods,1984,11(1):47-60.
[10]Jutras MJ,Buffalo EA.Synchronous neural activity and memory formation[J].Curr Opin Neurobiol,2010,20(2):150-155.
[11]Cornwell BR,Johnson LL,Holroyd T,et al.Human hippocampal and parahippocampal theta during goal-directed spatial navigation predicts performance on a virtual Morris water maze[J].J Neurosci,2008,28(23):5983-5990.
[12]沈恩華,王如彬,張志康.θ相移在單次學習過程中促進神經網絡對空間位置順序記憶的研究[J].動力學與控制學報,2009,7(2): 183-187.
[13]Villette V,Poindessous-Jazat F,Simon A,et al.Decreased rhythmic GABAergic septal activity and memory-associated theta oscillations after hippocampal amyloid-beta pathology in the rat[J].J Neurosci,2010,30(33):10991-11003.
[14]Robinson TE,Kramis RC,Vanderwolf CH.Two types of cerebral activation during active sleep:relations to behavior[J].Brain Res,1977, 124(3):544-549.
[15]Zhang B,Veasey SC,Wood MA,et al.Impaired rapid eye movement sleep in the Tg2576 APP murine model of Alzheimer's disease with injurytopedunculopontinecholinergicneurons[J].AmJ Pathol,2005,167(5):1361-1369.
[16]Rubio SE,Vega-Flores G,Martinez A,et al.Accelerated aging of the GABAergic septohippocampal pathway and decreased hippocampal rhythms in a mouse model of Alzheimer's disease[J]. FASEB J 2012,26(11):4458-4467.
[17]Pace-Schott EF,Spencer RM.Sleep-dependent memory consolidation in healthy aging and mild cognitive impairment[J].Curr Top Behav Neurosci,2015,25:307-330.
[18]Fogel SM,Smith CT,Beninger RJ.Evidence for 2-stage models of sleep and memory:learning-dependent changes in spindles and theta in rats[J].Brain Res Bull,2009,79(6):445-451.
(本文編輯:馬英,張震之)
The correlatation study between hippocampal cholinergic θ rhythm and spatial memory in rats under physiological and pathological conditions
LIU Xu,YUE Xing-hua,ZHENG Yan-ping
(Department of Clinical Laboratory,The First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]To investigate the correlation between hippocampal cholinergic θ rhythm and spatial learning and memory under physiological and pathological conditions,further clarify the association between the cognitive deficits and the hippocampal θ synchronization disorder.This article also wants to provide the experimental evidence evaluating the ability of spatial learning and memory in rodents by recording the hippocampal cholinergic θ rhythm.[Methods]Tail-pinch induced hippocampal cholinergic θ rhythm was recorded after Morris water maze test on the same SD rats.Main indicators including:the latencies in the hidden platform test,the percentage of swimming time in target quadrant in the probe trial test,the swimming speed and the latencies in the visible platform test,the peak power(Ppeak)and average peak frequency(Fpeak)of θ rhythm.[Results]Bilateral intrahippocampal injection of full length amyloid β peptide(Aβ1-42)significantly impaired spatial learning(P<0.05)and memory(P<0.05)of rats in Morris water maze test and reduced the Ppeakof hippocampal cholinergic θ rhythm(P<0.05).In control group,there was a significant negative correlation between the Ppeak of hippocampal cholinergic θ rhythm and the escape latency(r=-0.803,P<0.05)and a significant positive correlation between the Ppeak of hippocampal cholinergic θ rhythm and the percentage of swimming time in target quadrant(r=0.762,P<0.05).Similar correlations were found with a correlation coefficient of r=-0.764(P<0.05)and r=0.771(P<0.05)respectively in Aβ1-42injection group.Taken these as a whole,the Ppeakof hippocampal cholinergic θ rhythm was more correlated with escape latency(r=-0.896,P<0.01)and swimming time percentage(r=0.888,P<0.01).[Conclusions]There is strong correlation between the hippocampal cholinergic θ rhythm and the spatial learning and memory ability in rats,suggesting the somatosensory stimulation induced hippocampal cholinergic θ rhythm may be involved in the spatial learning and memory consolidation in rats.The power of hippocampal cholinergic θ rhythm may be an indicator to assess the ability of spatial learning and memory in rats.
hippocampal θ rhythm;spatial learning and memory;amyloid β protein;Alzheimer's disease
R749.16
A
1672-1519(2016)09-0549-06
10.11656/j.issn.1672-1519.2016.09.11
2016-03-20)
劉旭(1974-),男,碩士,副主任醫師,碩士研究生導師,主要從事檢驗醫學工作。

