不同LED光源對辣椒光合特性的影響
錢勝艷 劉世琦 劉穎穎 連海峰 陳亞霏 張現征


摘要:以棗莊薄皮辣椒為試驗材料,采用不同LED光源照射植株,研究不同光質、光強對辣椒光合參數的影響。結果表明:直角雙曲線修正模型較適宜于辣椒葉片光響應曲線擬合。在不同LED光源照射下辣椒葉片的凈光合速率(Pn)、氣孔導度(Gs)和蒸騰速率(E)均隨著光合有效輻射的增加而增加,細胞間隙CO2濃度(Ci)隨光合有效輻射的增加而降低。白光、寶藍光和紅光630 nm處理的辣椒葉片凈光合速率高于其它光質處理。白光處理的辣椒葉片CO2吸收速率和利用率較高。紅光處理的辣椒葉片氣孔導度大于其它光質處理。紅光630 nm和白光處理的辣椒葉片蒸騰速率高于其它光質處理。綜合可得,辣椒在紅光630 nm和白光LED光源下光合能力較強。
關鍵詞:辣椒;LED光源;光合作用;光質;光合有效輻射
中圖分類號:S641.3文獻標識號:A文章編號:1001-4942(2016)09-0054-06
AbstractWith Zaozhuangbopi pepper as material, the effects of different LED light qualities and light intensities on photosynthetic parameters of pepper were studied. The results showed that the modified rectangular hyperbola model could well simulate the light response curve of pepper leaves. Under different LED light source treatments, the net photosynthesis rate (Pn), stomatal conductance (Gs) and transpiration rate (E) of pepper leaves all increased with the increase of photosynthetically active radiation, however, the intercellular CO2 concentration (Ci) decreased. We also found that the net photosynthetic rate under white, sapphire blue light and red light of 630 nm was higher than that under other light qualities. The absorption rate and utilization rate of CO2 were higher under white light. The stomatal conductance under red light was higher than that under other light qualities. The transpiration rate under red light of 630 nm and white light was higher than that under other light qualities. Above all, the photosynthetic ability of pepper under white light and red light of 630 nm was relatively stronger.
KeywordsPepper; LED light source; Photosynthesis; Light quality; Photosynthetically active radiation
植物生長是通過光合作用儲存有機物來實現的,光是植物進行光合作用的必要條件之一[1],而在太陽輻射中,只有可見光對光合作用是有效的。在可見光區域,用不同波長的光照射植物葉片,測得的光合速率不同。已有研究發現,不同光質對植物光合特性均有顯著影響,如單色藍光下茄子葉片凈光合速率顯著低于白光對照和紅光處理[2],LED 紅光有利于提高青蒜苗的光合速率[3],藍紫色短波輻射能夠促進人參的光合作用[4],藍光處理能夠提高菊花的凈光合強度[5]。與傳統的人工光源高壓鈉燈、熒光燈、金屬鹵素燈、白熾燈等相比,新型LED光源具有節能環保、安全可靠、光電轉換效率高、使用壽命長、發熱低、冷卻負荷小、光譜性能好、光量與光質可調節、易于分散或組合控制等重要特點[6,7],近年來廣受關注。
辣椒(Capsicum annuum L.)為茄科植物辣椒的果實,又叫番椒、海椒、辣子、辣角、秦椒等,是一種藥食同源的蔬菜[8],主要用于菜肴調料,通常成圓錐形或長圓形,未成熟時呈綠色,成熟后變成鮮紅色、黃色或紫色,以紅色最為常見[9]。辣椒營養價值很高,含有人體需要的碳水化合物、蛋白質、維生素、色素和鈣、磷、鐵礦物質及15種氨基酸[10]。辣椒的維生素C含量在蔬菜中占首位,是番茄的7~15倍[11]。現在辣椒已成為我國栽種最普遍的蔬菜,并列入十大蔬菜的行列[12]。
本試驗采用不同LED光源照射辣椒植株,研究不同LED光質、不同照射時間下其葉片凈光合速率(Pn)、細胞間隙CO2濃度(Ci)、氣孔導度(Gs)和蒸騰速率(E)的變化,以期探明不同光質、光強對辣椒光合作用的影響,為解決辣椒生產中存在的問題提供新的方法和思路。
1材料與方法
1.1試驗材料
試驗于2015年8-11月在山東農業大學科技創新園進行。供試辣椒品種為棗莊薄皮,種植在日光溫室中,根據辣椒苗的生長情況,定期澆營養液(山崎配方),其它管理同常規。辣椒定植30天后開始進行測定。
LED光源是從深圳純英達業集團有限公司惠州分公司專門定制的生物燈架LED高光強射燈,該生物燈架整體高度為1.6 m,在人工氣候室內通過精準調控光質、溫度和濕度模擬自然環境。
1.2試驗設計
1.2.1光響應曲線擬合分別采用二項式回歸、直角雙曲線、非直角雙曲線、指數方程模型和直角雙曲線的修正模型對葉片光響應曲線進行非線性擬合。
①二項式回歸模型[13]:二項式回歸法是以凈光合速率(Pn)和光合有效輻射(PAR)的成對值進行二元回歸。
Pn=aI2+bI+c
式中: I為光合有效輻射強度,a、b和c是常數。
②直角雙曲線模型[14]:
Pn(I)=αIPnmaxαI+Pnmax-Rd
式中:Pn(I)為光強為I時的凈光合速率;I為光強;α為植物光合作用對光響應曲線在I=0時的斜率,即光響應曲線的初始斜率,也稱為初始量子效率;Pnmax為最大凈光合速率;Rd為暗呼吸速率。
③非直角雙曲線模型[15]:
Pn(I)=αI+Pnmax-(αI+Pnmax)2-4αIkPnmax2k-Rd
式中:k 為非直角雙曲線的曲角;Pn(I)、I、α、Pnmax、Rd的定義與前述相同。
④指數方程模型[16]:
Pn=Pnmax(1-e-αI/Pnmax)-Rd
式中:Pn、Pnmax、α、Rd和I的定義與前述相同。
⑤直角雙曲線的修正模型[17]:
Pn(I)=α1-βI1+γII-Rd
式中:β和γ為系數(單位為m2·s·μmol-1);Pn(I)、I、α、Rd的定義與前述相同。
1.2.2LED光源的選擇試驗設紅光630 nm、紅光660 nm、黃光、綠光、藍光、紫光、藍紫光、白光、寶藍光共9種光質處理,每種光質設0、50、100、200、400、600、800、1 000、1 200、1 400、1 600、1 800 μmol·m-2·s-1 共12個光合有效輻射梯度。
1.3測定項目及方法
選取長勢一致的葉片,采用CIRAS-3光合儀(美國漢莎科學儀器有限公司)進行光合參數測定,測定溫度為25℃,重復3次,取平均值。流速設定為200 mL·min-1,測定各處理選取葉片的凈光合速率(Pn)、細胞間隙CO2濃度(Ci)、氣孔導度(Gs)、蒸騰速率(E)。
1.4數據處理
采用DPS 7.05和Microsoft Excel 2003軟件進行數據統計分析和作圖,采用Duncans新復極差法進行顯著性檢驗(α=0.05)。
2結果與分析
2.1不同處理辣椒葉片光合-光響應曲線擬合模型
采用二項式回歸、直角雙曲線、非直角雙曲線、指數方程模型和直角雙曲線的修正模型5種擬合方法分別對實測值進行擬合,得出R2分別為0.9803~0.9987、0.9922~0.9986、0.9957~0.9994、0.9948~0.9992和0.9968~0.9992。將5種模型擬合的光響應曲線(圖2)得到的光飽和點(LSP)、光補償點(LCP)、暗呼吸速率(Rd)、最大凈光合速率(Pnmax)等指標與實測值光響應曲線進行對比,同時綜合擬合優度決定系數R2,得出最適合辣椒葉片光響應曲線的擬合模型是直角雙曲線修正模型,其模擬值與實測值之間無顯著差異。
可見,不同LED光源下,辣椒光合作用的表觀量子效率表現為黃光﹥紅光630 nm﹥紅光660 nm﹥寶藍光﹥綠光=白光﹥藍紫光﹥藍光﹥紫光,可見在弱光條件時辣椒在黃光、紅光630 nm、紅光660 nm等較長波長LED光源下的光合能力較強;最大凈光合速率表現為白光﹥寶藍光﹥紅光630 nm﹥綠光﹥藍紫光﹥紅光660 nm﹥黃光﹥藍光﹥紫光,可見辣椒在白光、寶藍光、紅光630 nm等LED光源下的最大光合能力較強;暗呼吸速率表現為寶藍光﹥藍紫光﹥黃光﹥綠光﹥白光﹥藍光﹥紫光﹥紅光660 nm﹥紅光630 nm,但差異不明顯;光補償點表現為紅光630 nm﹤紅光660 nm﹤黃光﹤白光﹤綠光﹤寶藍光﹤藍紫光﹤藍光﹤紫光,可見辣椒葉片在紅光630 nm、紅光660 nm、黃光等較長波長LED光源下能較早開始光合有效積累;光飽和點表現為藍光﹤綠光﹤紫光﹤黃光﹤寶藍光﹤藍紫光﹤紅光630 nm﹤紅光660 nm﹤白光,高光強時辣椒葉片在白光、紅光660 nm、紅光630 nm下光合能力較強,不易受到強光抑制。
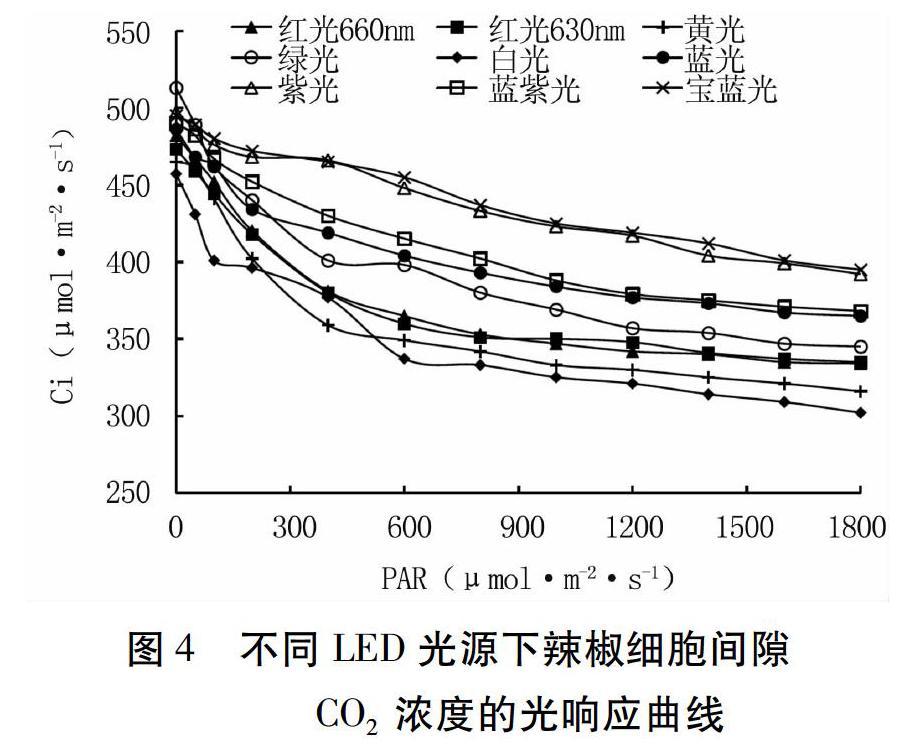
2.3不同LED光源對辣椒葉片細胞間隙CO2濃度的影響
細胞間隙CO2濃度下降越快,表明葉片對CO2的利用速率越快;細胞間隙CO2濃度越低,表明葉片對CO2的利用率越高。由圖4可見,辣椒葉片細胞間隙CO2濃度均隨光合有效輻射的增加而減少,且不同光質條件下變化趨勢基本一致。低光強時,辣椒對CO2的利用速率較快,隨著光強的增加,細胞間隙CO2濃度下降速率減慢,最終趨于平緩。白光、黃光、紅光660 nm、紅光630 nm等較長波長光質處理的辣椒葉片對CO2的吸收速率和利用率較高,而寶藍光、紫光、藍紫光等較短波長光質處理的辣椒葉片對CO2的吸收速率和利用率較低。
CO2濃度的光響應曲線
2.4不同LED光源對辣椒葉片氣孔導度的影響
氣孔導度的大小反映了葉片與外界進行氣體交換的能力。圖5表明,辣椒葉片氣孔導度隨光合有效輻射的增加逐漸增大,且不同光質下的變化趨勢基本一致。但不同光質條件下辣椒葉片的氣孔導度明顯不同,紅光630 nm和紅光660 nm處理的氣孔導度較大,氣體交換能力較強,其它光質處理的氣體交換能力較弱。
3討論與結論
光合作用是植物產量形成的基礎。光合作用的表觀量子效率反映了植物在弱光下的光合能力[18],是反映植物對光能利用效率的重要指標,同時也可作為判斷是否發生光合作用光抑制的標準[19]。本試驗結果表明,不同LED光源下辣椒光合作用的表觀量子效率不同,弱光條件時,黃光、紅光630 nm、紅光660 nm處理的辣椒葉片的光合能力較強。最大凈光合速率反映了植物葉片的最大光合能力[18],本試驗中不同LED光源下辣椒葉片的最大凈光合速率不同,白光、寶藍光、紅光630 nm處理的最大光合能力較強。暗呼吸速率是指在完全沒有光照的情況下植物呼吸的速率。因為沒有光照,光照強度為零,植物不能進行光合作用,CO2只釋放不吸收,釋放量也最大。辣椒在不同LED光源下的暗呼吸速率也不同,但差異不明顯。光補償點反映的是植物葉片光合作用過程中光合同化作用與呼吸作用消耗相當時的光強[18],本試驗中紅光630 nm、紅光660 nm、黃光處理的辣椒葉片光補償點較低,能較早地開始光合有效積累。飽和光強反映了植物利用光強的能力,其值高說明植物在受到強光時生長發育不易受到抑制[18],本試驗結果表明,強光下白光、紅光660 nm、紅光630 nm處理的辣椒葉片光合能力強,不易受到強光抑制。
本研究表明,不同LED光源對辣椒葉片的凈光合速率、細胞間隙CO2濃度、氣孔導度和蒸騰速率均有明顯的影響,隨著光合有效輻射的增加,各處理的凈光合速率、氣孔導度、蒸騰速率明顯增加,細胞間隙CO2濃度明顯降低。光合速率是影響植物同化能力和產量的關鍵因素[20]。凈光合速率的增加有利于CO2的固定,從而產生更多的有機物。藍光、紅光等其它光質處理的凈光合速率低于白光處理,這與史宏志[21]、李韶山[22]和Saile-Mark[23]等在烤煙、水稻幼苗和野生大豆與栽培大豆上的研究結果一致。但也有研究表明,藍光處理的樺樹葉片凈光合速率較高[24],綠光處理的生姜葉片凈光合速率較高[25,26],與本研究結果并不一致。這說明了植物對光質響應的復雜性,因物種的不同,其光合機構受光質調控的結果可能存在差異。
二氧化碳是光合作用的反應底物,其濃度對植物光合作用的生理生化過程起決定性作用。本研究結果表明,白光處理的辣椒葉片對CO2的吸收速率和利用率較高,其光合效率也較高。作為植物光合作用的通道,氣孔的開放保證了 H2O、CO2和 O2在植物體內的出入,同時控制植物的光合和蒸騰作用[27]。氣孔的開關與保衛細胞的水勢有關,保衛細胞水勢下降而吸水膨脹,氣孔就張開;水勢上升而失水縮小,使氣孔關閉。氣孔運動受許多外界環境因素和內在因素的調控,其中光是一個重要的調控因子,不同的光質對氣孔的開閉具有重要影響。已有研究表明不同光質對作物葉綠素形成、葉氣交換等生理過程均具有調控作用[28,29],認為葉片中保衛細胞的葉綠體、隱花色素和光敏色素可感應不同光質成分以調節葉片氣孔大小和數量[30-35]。已有研究表明,藍光處理的萵苣[34,36]和青蒜苗[3]的氣孔導度較大,而本研究結果表明,紅光處理的辣椒葉片氣孔導度大于其他光質處理。蒸騰作用有利于營養物質的吸收和運輸,對于植物吸水和降低葉片溫度也有重要作用,蔬菜作物蒸騰速率的大小反映了植物蒸騰散失水分的多少,直接影響作物的水分利用效率[37,38]。蒸騰作用是反映植物水分代謝的重要生理指標,側面反映光合作用的強弱。本試驗結果表明,紅光630 nm和白光處理的辣椒葉片蒸騰速率高于其它光質處理,光合能力較強。
參考文獻:
[1]韋峰,祁娟霞,李佳梅,等.不同光質對辣椒種子萌發、幼苗生長及抗寒性的影響[J].浙江農業學報,2015,27(11):1932-1938.
[2]杜爽,高志奎,薛占軍,等.紅藍單色光質下茄子葉片的光吸收與光合響應特性[J].河北農業大學學報,2009,32(1):19-22.
[3]楊曉建,劉世琦,張自坤,等.不同LED光源對青蒜苗生長及葉綠素熒光特性的影響[J].中國蔬菜,2011(6): 62-67.
[4]洪佳華,王鐵生.光強、光質對人參光合的影響[J].中國農業氣象,1995,16(1): 19-22.
[5]魏勝林.藍光和紅光對菊花生長和開花的影響[J].園藝學報,1998,25(2): 203-204.
[6]劉立功,徐志剛,崔瑾,等.光環境調控及LED在蔬菜設施栽培中的應用和前景[J].中國蔬菜,2009(14):1-5.
[7]崔瑾,徐志剛,邸秀茹.LED在植物設施栽培中的應用和前景[J].農業工程學報,2008,24(8):249-253.
[8]Minger M I, Jaren G M, Garrido F J. Color quality in paprika[J].J.Agric.Food Chem.,1992,40:2384-2388.
[9]江蘇新醫學院.中藥大辭典[M].上海:上海科學技術出版社,1997.
[10]高翔.辣椒的保健功能及其產品的開發研究[J].食品研究與開發,2004,25(3):115-116.
[11]陳世化,夏延斌,聶乾忠.辣椒綜合利用新進展[J].中國食物與營養, 2007(7):15-16.
[12]賴曉英,賀稚非,吳麗紅.辣椒的研究及開發現狀[J].中國調味品, 2006(3):4-9.
[13]郭水良,方芳,黃華,等.外來入侵植物北美車前繁殖及光合生理生態學研究[J].植物生態學報,2004,28(6): 787-793.
[14]Baly E C. The kinetics of photosynthesis[J]. Proceedings of the Royal Society of London, 1935,117:218-239.
[15]Thornley J H M. Mathematical models in plant physiology[M]. London: Academic Press,1976:86-110.
[16]Bassman J H, Zwier J C. Gas exchange characteristics of Populus trichocarpa, Populus deltoids and Populus trichocarpa × P. deltoids clone[J]. Tree Physiology, 1991, 8:145-159.
[17]Ye Z P. A new model for relationship between light intensity and the rate of photosynthesis in Oryza sativa[J]. Photosynthetica, 2007,45(4):637-640.
[18]葉子飄.光合作用對光和CO2響應模型的研究進展[J]. 植物生態學報,2016,34(6):727-740.
[19]冷寒冰,秦俊,葉康,等.不同光照環境下荷花葉片光合光響應模型比較[J].應用生態學報,2014,25(10):2855-2860.
[20]李偉,眭曉蕾,王紹輝,等.黃瓜幼苗不同葉位葉片光合特性對弱光的響應[J].中國農業科學,2008, 41(11): 3698-3707.
[21]史宏志,韓錦峰,張國顯,等.單色藍光和紅光對煙苗葉片生長和碳氮代謝的影響[J].河南農業大學學報,1998,32(3):358-362.
[22]李韶山,潘瑞熾.藍光對水稻幼苗生長效應的研究[J].中國水稻科學,1994,8(2):115-118.
[23]Saile-Mark M, Tevini M. Effects of solar UV-B radiation on growth, flowering and yield of Central and Southern European bush bean cultivars[J]. Photochem Photobiol,1996,64:457-462 .
[24]Sharkey T D, Ogawa T, Zeiger E, et al. Stomatal responses to light[J]. Stomatal Function,1987:195-208.
[25]張瑞華,徐坤,董燦興.光質對生姜葉片光合特性的影響[J].中國農業科學,2008,41(11):3722-3727.
[26]Ball J T. A model predicting stomatal conductance and its contribution to the control of photosynthesis under different environmental conditions[C]//Progress in Photosynthesis Research, Boston:Kluwer, 1987: 221-224.
[27]Ball J T, Woodrow I E, Berry J A. A model predicting stomatal conductance and its contribution to the control of photosynthesis under different environmental condition [G]// Biggins I. Progress in Photosynthesis Research. Dordrecht: Martinus Nijhoff Publisher,1987:221-224.
[28]DOnofrio C, Morini S, Bellocchi G. Effect of light quality on somatic embryogenesis of quince leaves[J].Plant Cell, Tissue and Organ Culture,1998,53(2): 91-98.
[29]Ramalho J C, Marques N C, Semedo J N, et al. Photosynthetic performance and pigment composition of leaves from two tropical species is determined by light quality[J].Plant Biology,2002,4(1):112-120.
[30]Sing M, Chaturvedi R, Sane P V. Diurnal and seasonal photosynthetic characteristics of Populus deltoides Marsh. leaves[J].Photosynthetic,1996,32(1):11- 21.
[31]Lin M J, Hsu B D. Photosynthetic plasticity of Phalaenopsis in response to different light environments[J].Journal of Plant Physiology,2004,161(11): 1259-1268.
[32]Qin Y H, Zhang S L, Syed A, et al. Regeneration mechanism of Toyonoka strawberry under different color plastic films[J].Plant Science,2005,168:1425-1431.
[33]Khattak A M, Pearson S. Spectral filters and temperature effects on the growth and development of chrysanthemums under low light integral[J]. Plant Growth Regulation,2006,49(1):61-68.
[34]許莉,劉世琦,齊連東,等.不同光質對葉用萵苣光合作用及葉綠素熒光的影響[J].中國農學通報,2007,23(1):96-100.
[35]鄭潔,胡美君,郭延平.光質對植物光合作用的調控及其機理[J].應用生態學報,2008,19(7):1619-1624.
[36]李雯琳,郁繼華,張國斌,等. LED光源不同光質對葉用萵苣幼苗葉片氣體參數和葉綠素熒光參數的影響[J].甘肅農業大學學報,2010,45(1):47-51.

