鳶烏賊和杜氏槍烏賊蛋白分離及其性質初探
邱月,曾少葵,章超樺,郝記明,張靜
(廣東海洋大學 食品科技學院,廣東省水產品加工與安全重點實驗室,廣東普通高等學校水產品深加工重點實驗室,南海生物資源開發與利用協同創新中心,廣東 湛江,524088)
?
鳶烏賊和杜氏槍烏賊蛋白分離及其性質初探
邱月,曾少葵,章超樺*,郝記明,張靜
(廣東海洋大學 食品科技學院,廣東省水產品加工與安全重點實驗室,廣東普通高等學校水產品深加工重點實驗室,南海生物資源開發與利用協同創新中心,廣東 湛江,524088)
以鳶烏賊(Symplectoteuthisoualaniensis)和杜氏槍烏賊(Loligoduvauceli)頭足、胴體為原料,分離各蛋白組分,并對其性質進行研究。結果表明:鳶烏賊頭足水溶性蛋白(WSP)、鹽溶性蛋白(SSP)和不溶性蛋白(ISP)分別占總蛋白的19.01%、52.21%和13.23%,胴體中的分別為10.83%、58.68%和10.03%;杜氏槍烏賊頭足三者的比例分別為37.62%、31.79%和18.08%,胴體中的分別為24.30%、54.23%和7.65%。2種烏賊頭足、胴體均是WSP和SSP必需氨基酸占氨基酸總量的40%左右。SDS-PAGE電泳分析顯示,鳶烏賊頭足和胴體中SSP的肌球蛋白重鏈(MHC)的分子質量大于200 kDa、副肌球蛋白(PM)的在100 kDa左右、肌動蛋白(Actin)接近44 kDa;杜氏槍烏賊頭足和胴體中SSP的MHC、PM、Actin蛋白條帶顏色較淺,說明其蛋白含量較低。差示掃描量熱法(DSC)結果表明,鳶烏賊頭足WSP、SSP和ISP的變性溫度分別為64.02 ℃、58.04 ℃和68.91 ℃;胴體中的分別為81.93 ℃、62.18 ℃和68.54 ℃;杜氏槍烏賊頭足各蛋白組分的變性溫度分別為81.36、83.24和78.18 ℃;胴體的分別為80.29、76.25和68.02 ℃,杜氏槍烏賊各蛋白組分的變性溫度較鳶烏賊的高。鳶烏賊頭足、胴體和杜氏槍烏賊頭足WSP在pH 3溶解度最低,杜氏槍烏賊胴體的在pH 5最低,pH對SSP溶解度影響較大;在不同離子強度的溶液中,鳶烏賊頭足SSP溶解性最好。
鳶烏賊;杜氏槍烏賊;蛋白分離;SDS-PAGE;DSC;溶解度
鳶烏賊(Symplectoteuthisoualaniensis)在中國南海和印度洋西北部海域的數量較大[1],我國南海年可捕撈量為130~200 萬t[2]。但其表皮易發紅,肉質較硬,氨味重,不合大眾口味,其資源并未得到充分利用。杜氏槍烏賊(Loligoduvauceli)主要分布在南海,其色白,味道鮮美,是一種暢銷的水產品。研究表明鳶烏賊和杜氏槍烏賊都是高蛋白、低脂肪的水產品,是良好的蛋白資源[3-4]。ISABEL等[5]探討了從秘魯魷魚肌肉中提取功能性蛋白濃縮物的方法;JUAN等[6]用酸溶解法和等電點沉淀法從秘魯魷魚中提取蛋白,并對其相關理化指標進行測定;GUILLERMINA等[7]研究了凍藏對秘魯魷魚肌肉蛋白變性及凝膠特性的影響;楊芳等[8]對阿根廷魷魚肌原纖維蛋白凝膠的保水性進行了研究;TATSUYA等[9]對鳶烏賊發光蛋白進行了提取及分析。對魷魚肌肉蛋白的提取方法、保水性、凝膠特性等進行了研究,但關于形成凝膠相關蛋白的特性的研究鮮有報道,因此本文對這2種烏賊的蛋白組成、分子質量分布、變性溫度及溶解性進行了研究。
1 材料和方法
1.1材料
鳶烏賊(100~500 g/條),由廣東海洋大學水產學院于2014年4月捕撈于南海,立即凍結后運回實驗室,杜氏槍烏賊在湛江東風市場購買。挑選100~140 g/條的鳶烏賊和35~45 g/條的杜氏槍烏賊,去除外表皮、內臟、骨、眼、口球后,分為頭足、胴體兩部分,置于-20 ℃備用,凍藏時間不超過1個月。
1.2蛋白組分分離
參照SAITO[10]等方法的基礎上稍作修改。將原料攪碎,取一定量的肉加入10倍的磷酸緩沖液(15.6 mmol/L Na2HPO4, 3.5 mmol/L NaH2PO4,pH 7.5)提取90 min,離心后沉淀S重復1次上述操作,合并2次的上清液加入1/2體積的質量分數15%的三氯乙酸,離心得到上清液為非蛋白氮溶液,沉淀即為水溶性蛋白(WSP)。沉淀S加入4倍的磷酸緩沖液(0.6 mol/L NaCl, 15.6 mmol/L Na2HPO4, 3.5 mmol/L NaH2PO4,pH 7.5),于4 ℃抽提18 h后離心,重復上述操作1次,合并2次上清液,脫鹽即得到鹽溶性蛋白(SSP)。分離后的沉淀用水漂洗離心得到不溶性蛋白(ISP)。將3種蛋白冷凍干燥后得到WSP、SSP和ISP,其蛋白含量用微量凱氏定氮法測定[11],其比例公式如下:
P/%=A/B×100
(1)
式中:P為蛋白含量比例,A為蛋白組分的含氮量,B為原料的含氮量。
1.3氨基酸組成分析
取WSP、SSP和ISP樣品經6mol/L HCl水解后,用氨基酸自動分析儀(S-433D 德國sykam公司)測定16種氨基酸[12];另取樣用6 mol/L NaOH水解后同機測定色氨酸[13]。
1.4SDS-PAGE電泳分析
將蛋白濃度約為2 mg/mL的水溶性、鹽溶性和不溶性蛋白溶液(5%SDS溶解)用上樣緩沖液處理。SDS-聚丙烯酰胺凝膠電泳條件:分離膠12%,濃縮膠5%,濃縮膠和分離膠的電壓分別為65 V和120 V。考馬斯亮藍R-250染色1 h,脫色液(冰醋酸∶乙醇∶蒸餾水體積比=1∶1∶8) 脫色直至凝膠板蛋白質染色條帶清晰為止,Gel Doc XR+凝膠成像系統拍照。
1.5熱穩定性分析
差示掃描量熱法(DSC):取5 mg左右的蛋白粉末置于鋁坩堝中,用封壓機密封,使試樣與鋁盒緊密接觸,用差示掃描量熱儀(TA Q2000 美國沃特斯公司)進行分析,檢測條件為N2流速50 mL/min,升溫速率0.5 ℃/min,溫度掃描范圍10~100 ℃,同時以空鋁坩堝作為空白對照。
1.6溶解度的測定
取一定量的WSP和SSP,分別加入不同pH值的0.01 mol/L磷酸鹽緩沖液和不同離子強度的磷酸鹽緩沖液(0.01 mol/L,pH 7.0),使蛋白濃度為1 mg/mL,樣品間或攪拌30 min,4 ℃冷凍離心,上清液用福林酚法測蛋白含量,總蛋白用微量凱氏定氮法測定,蛋白質的溶解度按上清液中蛋白含量與樣品中總蛋白比來表示。
1.7數據統計分析
數據用Excel 2007進行處理,并采用(平均數±標準差)來表示,用Origin6.0作圖。
2 結果與討論
2.1各蛋白組分比例
對鳶烏賊和杜氏槍烏賊頭足、胴體中的蛋白進行分離,得到非蛋白氮、水溶性蛋白、鹽溶性蛋白和不溶性蛋白4個組分,各蛋白組分占粗蛋白的比例如圖1所示。
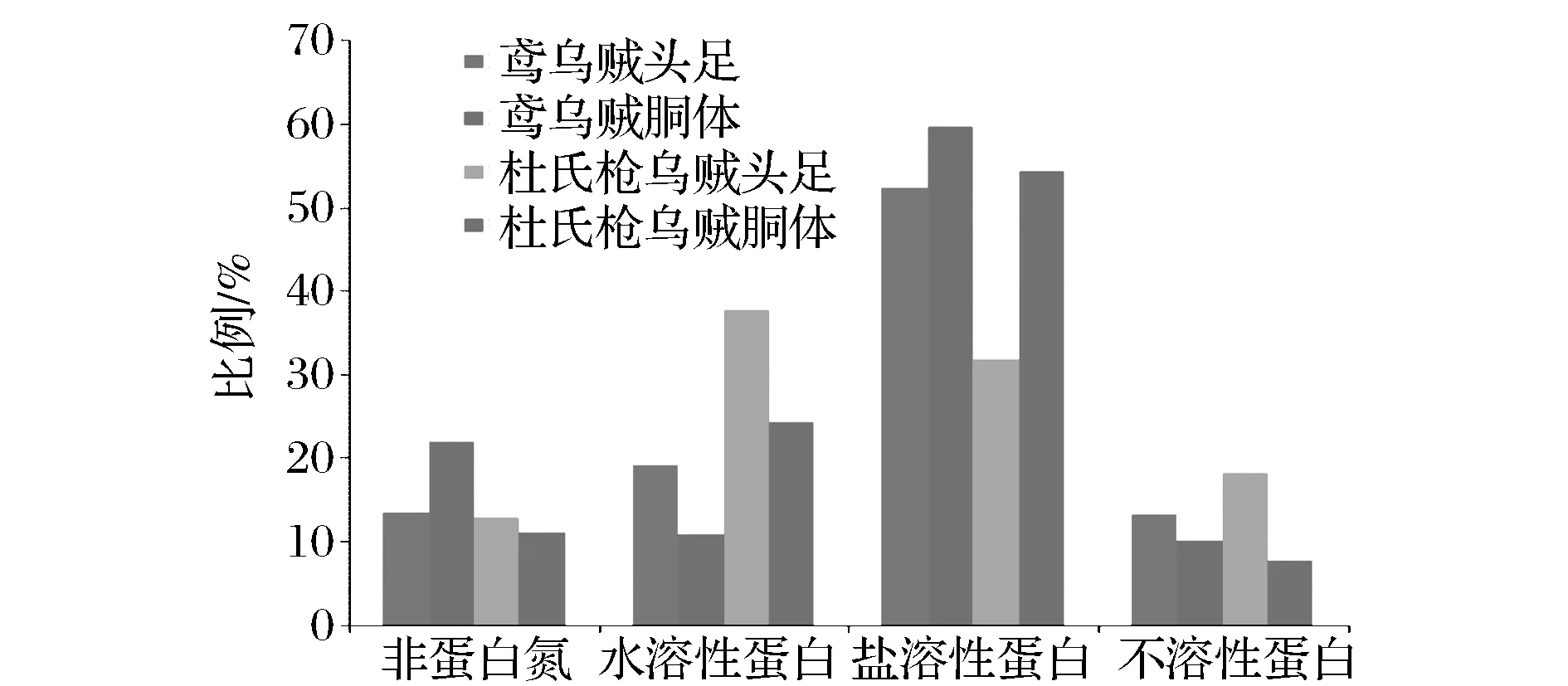
圖1 各蛋白組分占粗蛋白的比例Fig.1 The percentageof protein componentsin total protein
由圖1可知,鳶烏賊頭足、胴體和杜氏槍烏賊胴體中均是鹽溶性蛋白比例最高,且存在顯著性差異(P<0.05),均遠遠低于阿根廷魷魚的78.1%[14],而杜氏槍烏賊頭足中水溶性蛋白所占比例最高。鳶烏賊胴體鹽溶性蛋白所占比例高于頭足的,也高于杜氏槍烏賊胴體。鹽溶性蛋白又稱肌原纖維蛋白,是肉中最具生物學功能的結構蛋白群,其結構、凝膠及流變學特性對肉制品品質有重要的影響,肉糜凝膠強度主要取決于肌肉中的鹽溶性蛋白含量,因此可知,鳶烏賊的凝膠強度可能大于杜氏槍烏賊,小于阿根廷魷魚。鳶烏賊頭足、胴體和杜氏槍烏賊胴體中鹽溶性蛋白占總氮的比例分別為52.21%、58.68%和54.23%,與鰱魚、鳙魚、草魚、鯽魚、羅非魚的50%~57%[15-16]持平。
2.2氨基酸組成
對從鳶烏賊和杜氏槍烏賊頭足、胴體分離的各蛋白組分的氨基酸組成進行測定,結果見表1、表2。
由表1、表2可知,鳶烏賊和杜氏槍烏賊頭足、胴體中WSP和SSP的必需氨基酸含量相差不大,但均大于ISP。鳶烏賊頭足中3種蛋白各自的必需氨基酸含量均低于杜氏槍烏賊頭足蛋白中的含量,但胴體中的含量高于杜氏槍烏賊胴體中的含量。根據FAO/WHO的理想模式,質量較好的蛋白質其氨基酸組成為必需氨基酸占總氨基酸的比在40%左右,因此可看出,鳶烏賊和杜氏槍烏賊頭足、胴體的WSP和SSP的氨基酸比例恰當,營養齊全,是一種優質蛋白,可添加到食品中以提高其營養價值。據報道疏水性氨基酸含量高的蛋白質能形成強度高凝膠體系[17],Arg、Lys等堿性氨基酸有彈性增加效果[18]。鳶烏賊和杜氏槍烏賊頭足、胴體鹽溶性蛋白中堿性氨基酸比例分別18.99%、19.18%和18.44%、18.065%,疏水性氨基酸比例分別是34.74%、36.39%和37.54%、36.58%,與羅非魚3種蛋白組分的持平[16],因此這2種烏賊形成凝膠能力可能與羅非魚相似。
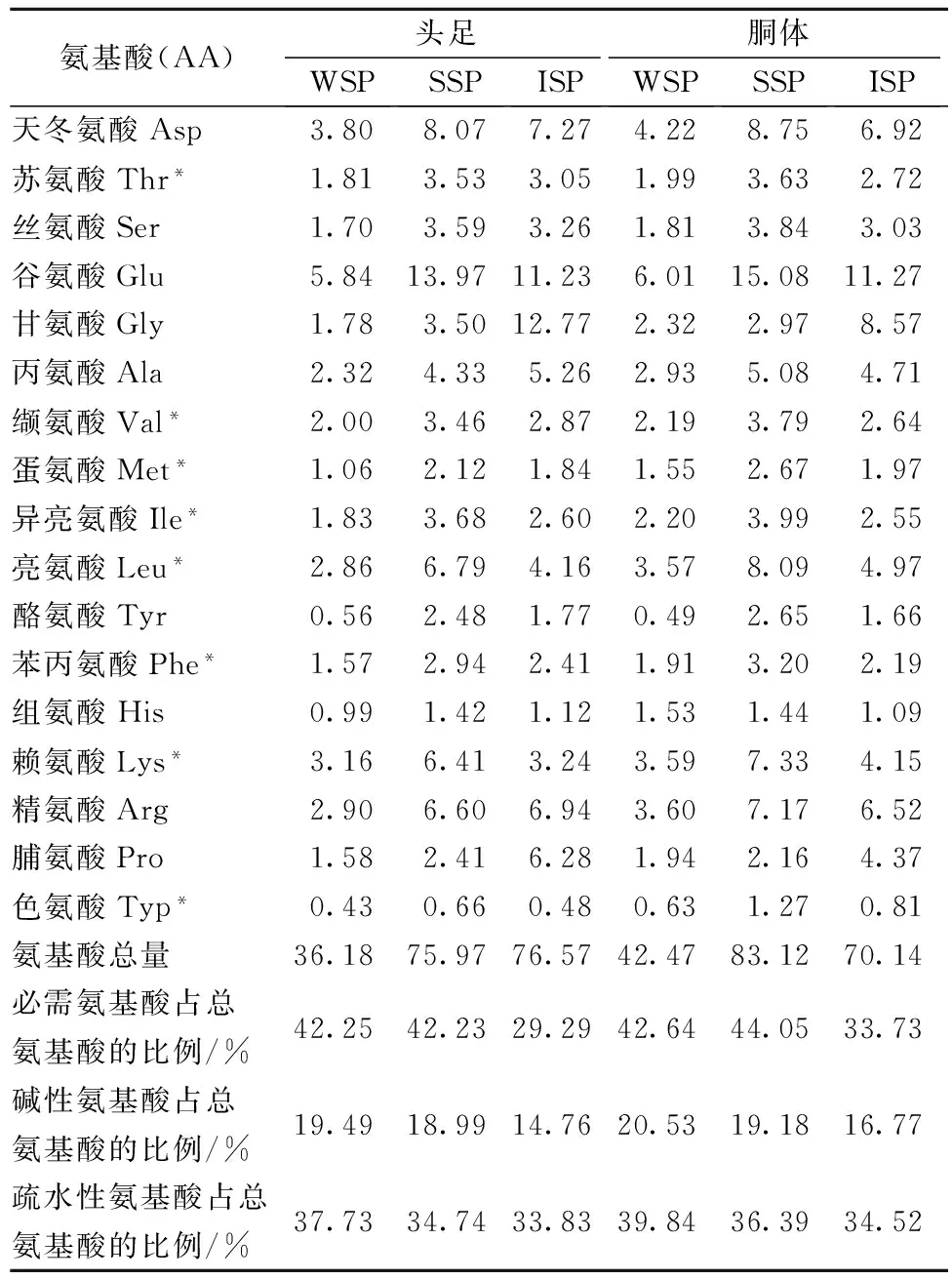
表1 鳶烏賊WSP、SSP和ISP的氨基酸組成 單位:g/100g
注:*表示必需氨基酸;堿性氨基酸:精氨酸、組氨酸、賴氨酸;疏水性氨基酸:蛋氨酸、色氨酸、苯丙氨酸、纈氨酸、異亮氨酸、亮氨酸、脯氨酸、丙氨酸。表2同。
2.4蛋白分子質量分布
對鳶烏賊和杜氏槍烏賊頭足、胴體分離的各蛋白組分進行SDS-PAGE電泳分析,結果見圖2。
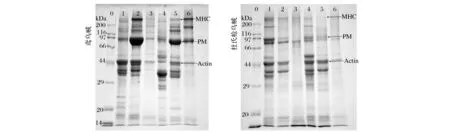
0-Mark;1-頭足的水溶性蛋白;2-鹽溶性蛋白;3-不溶性蛋白;4-胴體的水溶性蛋白;5-鹽溶性蛋白;6-不溶性蛋白圖2 蛋白組分SDS-PAGE電泳圖譜Fig.2 SDS-PAGE profile of protein components
由圖2可知,鳶烏賊頭足和胴體中蛋白組分分子質量的分布均存在一定的差異性,頭足和胴體的水溶性蛋白在SDS-PAGE電泳中的條帶較多、分子質量分布比較廣泛,部分成連續帶狀,可能是水溶性蛋白中含有相近分子質量蛋白較多,在電泳中無法分開,出現模糊的蛋白條帶只是在此分子質量范圍相對含量比較集中。鹽溶性蛋白主要是肌原纖維蛋白,由肌球蛋白重鏈(MHC)、輕鏈、肌動蛋白(Actin)和軟體動物所特有的副肌球蛋白(PM)以及相對分子質量更小的原肌球蛋白等構成[19]。鳶烏賊頭足和胴體鹽溶性蛋白中MHC分子質量大于200 kDa、PM的分子質量在100 kDa左右、Actin分子質量接近44 kDa,與馬靜蓉等[20]報道的結果基本一致。PM、MHC和Actin條帶較寬、顏色較深,說明其蛋白含量較高。
圖2中杜氏槍烏賊頭足和胴體中鹽溶性蛋白的MHC、PM、Actin蛋白條帶顏色較淺,表明其蛋白含量較低,特別是胴體中的MHC蛋白條帶幾乎完全消失,可能是因為肌原纖維蛋白在內源酶和細菌蛋白酶的共同作用下發生了降解。杜氏槍烏賊頭足和胴體水溶性蛋白均集中分布在低分子質量范圍29~97 kDa之間,不溶性蛋白的蛋白條帶相似。
2.5變性溫度
DSC是在一定的溫度范圍內,以一定的速度對試樣加熱,并記錄試樣在升溫過程中所產生的細微熱量變化,從而得到熱流對溫度的DSC掃描曲線。蛋白質結構的變化,將會導致自身熱穩定性的變化,從而引起DSC掃描曲線形狀的變化。所以,分析DSC掃描曲線形狀的變化可知試樣的熱穩定性[21]。圖3、圖4分別為鳶烏賊和杜氏槍烏賊各蛋白組分的DSC掃描圖譜,表3為各蛋白組分的變性溫度。
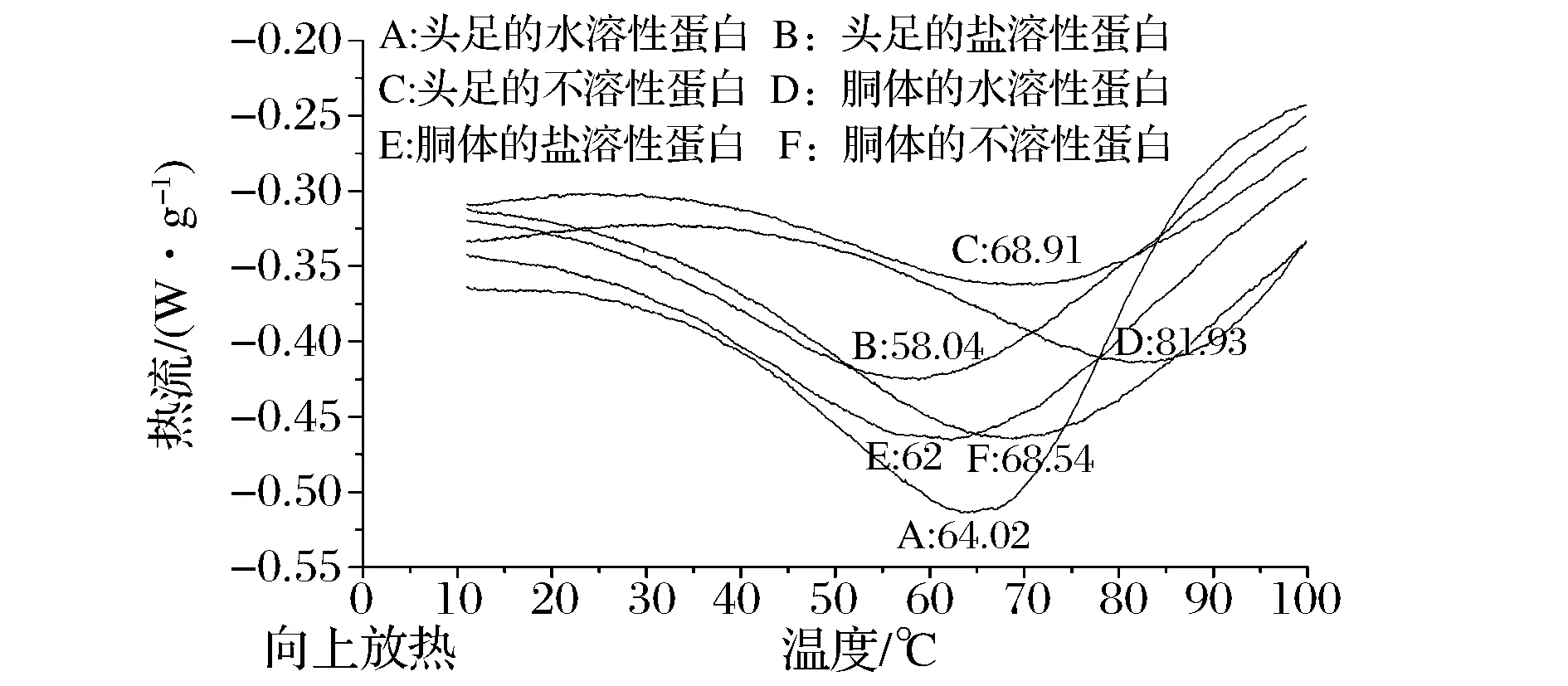
圖3 鳶烏賊蛋白組分DSC圖Fig.3 DSC thermo gram for proteincomponents from Symplectoteuthis oualaniensi
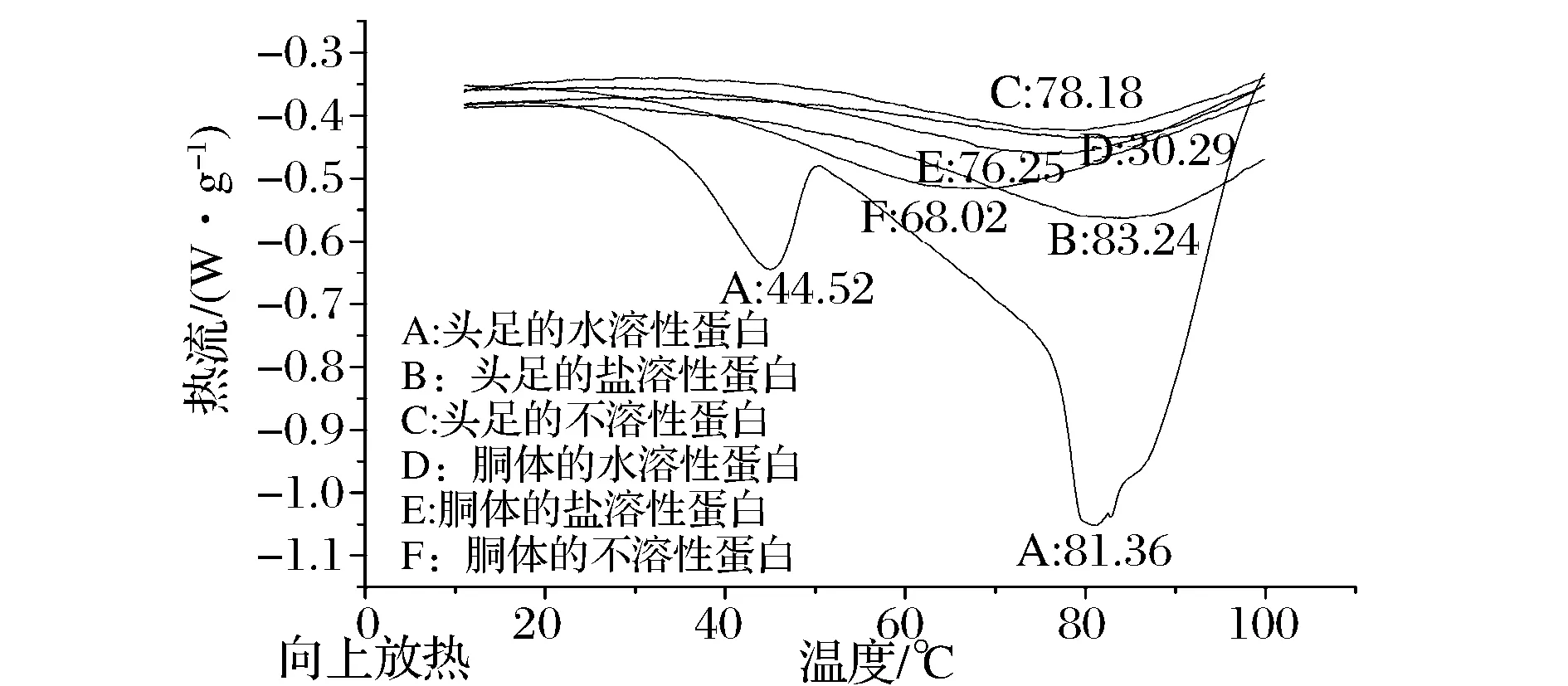
圖4 杜氏槍烏賊蛋白組分DSC圖Fig.4 DSC thermo gram for protein components from Loligo duvaucel
大部分肌漿蛋白在40~60 ℃聚集變性,肌球蛋白的變性溫度大約在40~45 ℃左右,肌動蛋白在70~75 ℃左右,膠原蛋白通常在53~63 ℃左右開始發生變性[22]。鳶烏賊頭足和胴體的SSP變性溫度分別為58.04 ℃和62.18 ℃,均低于杜氏槍烏賊頭足的83.24 ℃和胴體的76.25 ℃,且本實驗中2種烏賊SSP的DSC圖譜中均只得到一個很寬的峰,可能是因為其肌球蛋白和肌動蛋白的變性溫度很接近。2種烏賊蛋白組分變性溫度的差異可能與物種、生存環境、蛋白的氨基酸組成等有關。
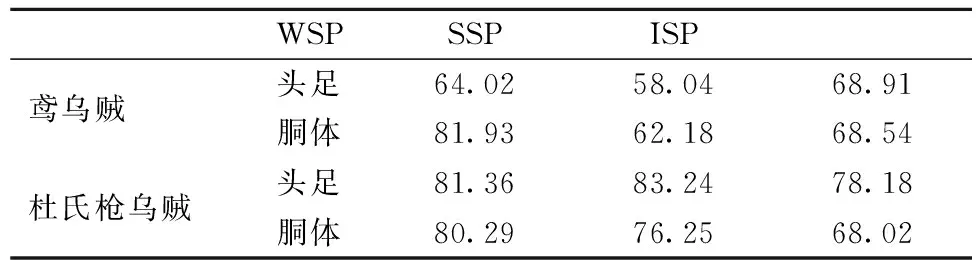
表3 各蛋白組分的變性溫度 單位:℃
2.6pH值對WSP和SSP溶解度的影響
pH值對鳶烏賊和杜氏槍烏賊頭足、胴體WSP和SSP的影響如圖5、圖6。
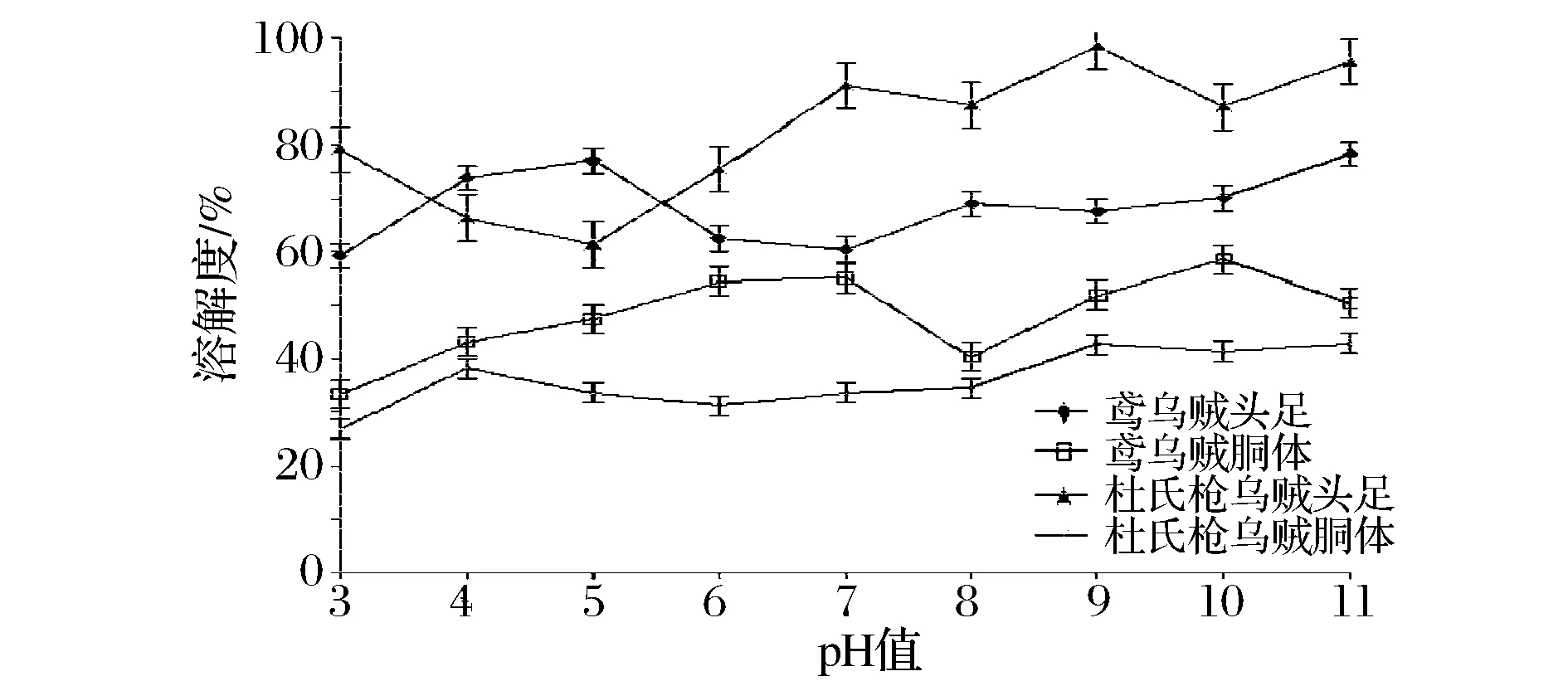
圖5 pH值對WSP溶解度的影響Fig.5 Effect of pH on the solubility of WSP
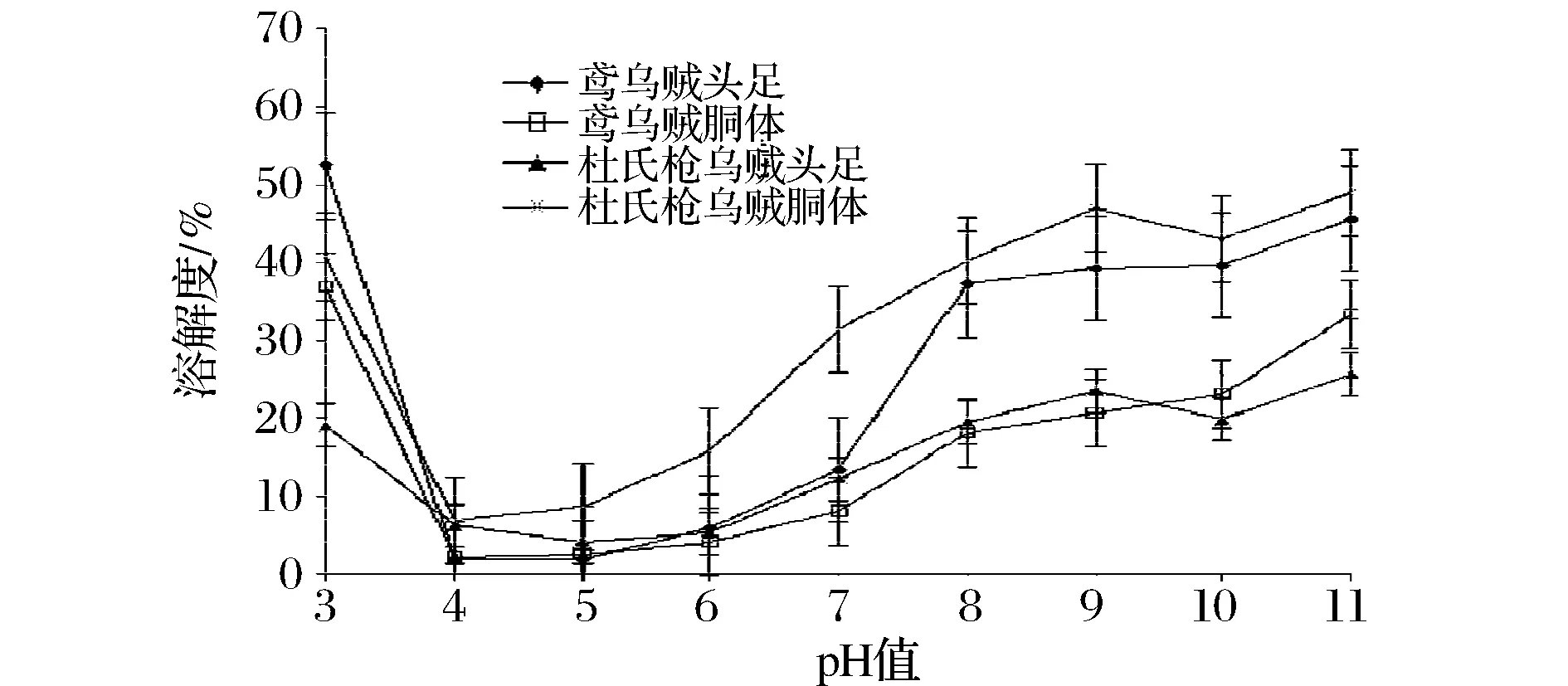
圖6 pH值對SSP溶解度的影響Fig.6 Effect of pH on the solubility of SSP
由圖5可知,2種烏賊WSP溶解度的高低為杜氏槍烏賊頭足>鳶烏賊頭足>鳶烏賊胴體>杜氏槍烏賊胴體。蛋白質屬于兩性分子,當環境pH值高于(低于)其等電點時,蛋白質帶負(正)電荷,水分子同這些電荷相互作用并起穩定作用,從而增加了蛋白質的溶解性;當pH值接近等電點時,蛋白質分子同水的作用比較弱,使得肽鍵相互靠攏,有時形成聚集體而導致蛋白質沉淀。由圖5可知,鳶烏賊頭足、胴體和杜氏槍烏賊頭足WSP的等電點可能在pH 3,杜氏槍烏賊胴體的可能在pH 5。由圖6可知,pH對SSP溶解度影響較大,在pH 4~11范圍內,中性或堿性條件下SSP的溶解度高于酸性條件的,且2種烏賊頭足SSP在pH 5條件下溶解度最低,胴體的在pH 4條件下最低。
2.7離子強度對SSP溶解度的影響
WSP是用離子強度很低的磷酸鹽緩沖液提取的,SSP用鹽溶液提取的,故未考慮離子強度對WSP溶解度的影響。NaCl濃度對SSP溶解度的影響如圖7所示。
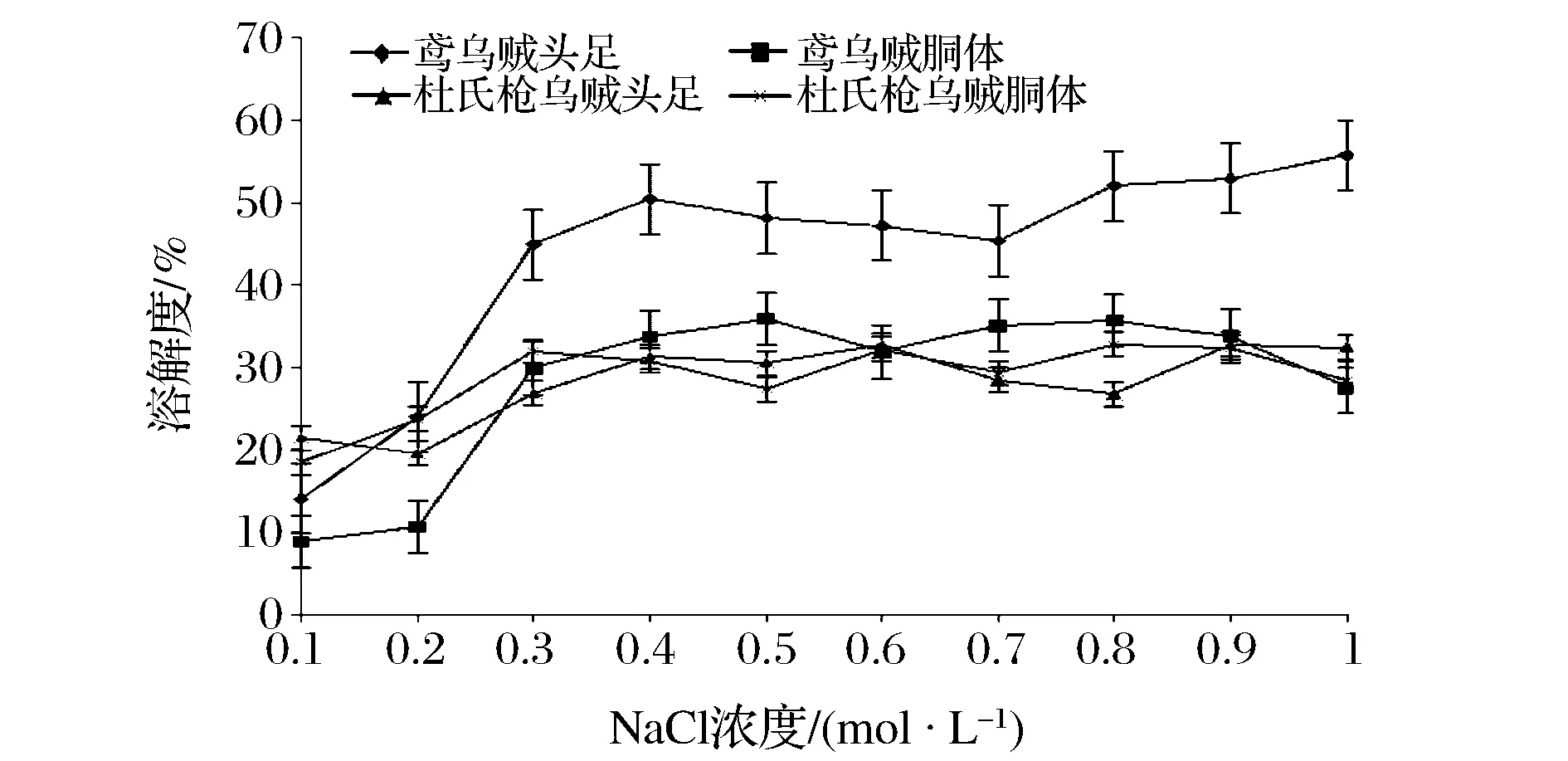
圖7 NaCl濃度對SSP溶解度的影響Fig.7 Effect of NaCl concentration on the solubility of SSP
由圖7可知,鳶烏賊頭足SSP溶解性最好,其胴體與杜氏槍烏賊頭足、胴體SSP溶解性相差不大。離子強度從0.1 mol/L增大到0.4 mol/L的過程中,2種烏賊的SSP溶解度顯著增大,當離子強度大于0.4 mol/L時,溶解度變化不明顯。這可能是因為在低離子強度下,鹽離子與蛋白質份子的帶電基團微弱結合,提高蛋白質與水的結合能力,增強蛋白水化,從而提高蛋白的溶解度;在高離子強度下,水鹽相互作用大于水和蛋白質間的作用,蛋白質的溶解度降低。
3 結論
鳶烏賊頭足和胴體及杜氏槍烏賊胴體中均是鹽溶性蛋白占粗蛋白的比例高,可能具有良好的凝膠形成能力。2種烏賊頭足、胴體均是WSP和SSP必需氨基酸比例在40%左右,是理想的優質蛋白,可添加到食品中提高其營養價值。鳶烏賊頭足和胴體鹽溶性蛋白中肌球蛋白重鏈、肌動蛋白和副肌球蛋白的含量比杜氏槍烏賊高,其變性溫度較槍烏賊低。pH對WSP溶解度的影響不顯著,SSP的溶解度受pH影響較大,在不同離子強度溶液中,鳶烏賊頭足SSP溶解度較其胴體和杜氏槍烏賊頭足、胴體的SSP溶解度高。對鳶烏賊蛋白特性的探討為其凝膠性的研究提供理論依據。
[1]陳新軍,劉必林,王堯耕.世界頭足類[M].北京:海洋出版社,2009:312-313.
[2]張鵬,楊吝,張旭豐,等.南海金槍魚和鳶烏賊資源開發現狀及前景[J].南方水產,2010(1):68-74.
[3]于剛,張洪杰,楊少玲,等.南海鳶烏賊營養成分分析與評價[J].食品工業科技,2014(18):358-361.
[4]RAMAN M, MATHEW S. Study of chemical properties and evaluation of collagen in mantle, epidermal connective tissue and tentacle of Indian Squid,LoligoduvauceliOrbigny[J].Food Science and Technology, 2014, 51(8):1 509-1 516.
[6]CORTéS-RUIZ J A, PACHECO-AGUILAR R, LUGO-SNCHEZ M E,et al. Production and functional evaluation of a protein concentrate from giant squid (Dosidicusgigas) by acid dissolution and isoelectric precipitation[J].Food Chemistry, 2008, 110:486-492
[8]楊芳,吳永沛,陳梅香,等.阿根廷魷魚肌原纖維蛋白及肌肉組織凝膠保水性研究[J].水產科學,2008,27(8):386-389.
[9]FUJII T, JUNG-YOUB A, MORI H, et al. A novel photoprotein from oceanic squid (Symplectoteuthisoualaniensis) with sequence similarity to mammalian carbon-nitrogen hydrolase domains [J].Biochemical and Biophysical Research Communications, 2002, 293(2): 874-879.
[10]SAITO T. Effect of thermal on extraction of proteins form meats[J].Bulletin of the Japan Society of Scientific Fisheries, 1983, 49(10):1 569-1 572.
[11]GB/T5009.5―2010.食品中蛋白質的測定[S].北京:中國標準出版社,2010.
[12]GB/T5009.124―2003.食品中氨基酸的測定[S].北京:中國標準出版社,2003.
[13]GB/T 18246―2000.飼料中氨基酸的測定[S].北京:中國標準出版社,2000.
[14]李桂芬.阿根廷魷魚生化成分的分析研究[J].現代食品科技,2005,1(12):120-121.
[15]劉海梅,嚴菁,熊善柏,等.淡水魚肉蛋白質組成及其在魚糜制品加工中的變化[J].食品科學,2007,28(2):40-44.
[16]唐小丹,周春霞,洪鵬志,等.羅非魚肉蛋白的分離及其性質研究[J].食品科技,2011,36(6):156-159.
[17]李維平,吳道澄,袁靜,等.蛋白質工程學[M].科學出版社,2013:39.
[18]章超樺,薛長湖.水產食品學[M].北京:中國農業出版社,2010:240.
[19]BLANCO-PASCUAL N, FERNNDEZ-MARTN F, Montero P. Jumbo squid(Dosidicusgigas) myofibrillar protein concentrate for edible packaging films and storage stability[J]. LWT-Food Science and Technology, 2014,55(2): 543-550.
[20]馬靜蓉,楊賢慶,馬海霞,等.南海鳶烏賊肌原纖維蛋白熱穩定性研究[J].食品與發酵工業, 2015,41(5):80-84.
[21]劉大松.草魚肉在微凍和冰藏保鮮中的品質變化及其機理[D].無錫:江南大學,2012.
[22]姜啟興.鳙魚肉熱加工特性及其機理研究[D].無錫:江南大學,2015.
Proteins isolation fromSymplectoteuthisoualaniensisandandLoligoduvauceliand their characteristics
QIU Yue, ZENG Shao-kui, ZHANG Chao-hua*,HAO Ji-ming, ZHANG Jing
(College of Food Science and Technology, Guangdong Ocean University, Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, Key Laboratory of Advanced Processing of Aquatic Product of Guangdong Higher Education Institution, South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center,Zhanjiang 524088, China)
According to the solubility, water soluble protein (WSP), salt soluble protein (SSP) and insoluble protein (ISP) were isolated from the cephalopodium and mantles muscle ofSymplectoteuthisoualaniensisandLoligoduvauceli. The results showed that inSymplectoteuthisoualaniensis, WSP, SSP and ISP component was 19.01%,52.21% and 13.23% in cephalopodium and 10.83%,58.68% and 10.03% in mantles muscle. InLoligoduvauceli, WSP, SSP and ISP percentage in cephalopodium and mantles muscle were 37.62%, 31.79%, 18.08% and 24.30%, 54.23%, 7.65%, respectively. In cephalopodium and mantles muscle ofSymplectoteuthisoualaniensisandLoligoduvauceli, the essential amino acids content in WSP and SSP was 40% of total amino acid. SDS-PAGE pattern showed that in cephalopodium and mantles muscle ofSymplectoteuthisoualaniensis, the molecular weight of MHC was more than 200 kDa, PM was about 100 kDa and Actin was close to 44 kDa. In cephalopodium and mantles muscle ofLoligoduvauceli, the MHC, PM and Actin protein bands of the SSP were lighter, indicating that the contents of the proteins were lower. As demonstrated by DSC, the denaturation temperature of WSP, SSP and ISP in cephalopodium ofSymplectoteuthisoualaniensiswere 64.02℃,58.04℃ and 68.91℃, and 81.93℃,62.18℃ and 68.54℃ in mantles muscle; forLoligoduvauceli,the denaturation temperature of WSP, SSP and ISP was 81.36℃,83.24℃ and 78.18℃ in cephalopodium and 80.29℃,76.25℃ and 68.02℃ in mantles muscle. The denaturation temperature of proteins fromLoligoduvauceliwere higher than that ofSymplectoteuthisoualaniensis. The solubility of WSP in cephalopodium and mantles muscle ofSymplectoteuthisoualaniensisand cephalopodium ofLoligoduvauceliwere at the minimum at pH 3; at pH 5, WSP solution in mantles muscle ofLoligoduvauceliwas the lowest. In different ionic strength solution, the solubility of SSP was better in cephalopodium ofSymplectoteuthisoualaniensis.
Symplectoteuthisoualaniensis;Loligoduvauceli; protein separation; SDS-PAGE; DSC; solubility
10.13995/j.cnki.11-1802/ts.201609014
碩士研究生(章超樺教授為通訊作者,E-mail: chz2382@126.com)。
廣東省教育廳創新強校工程項目(2014GKXM047)
2015-11-30,改回日期:2016-02-14

