解脂耶氏酵母脂肪酶Lip2與疏水蛋白SC3融合表達及催化性質
邱玉龍,鄧冬梅,潘淑蘭,孫宇飛
(廣西科技大學 生物與化學工程學院,廣西糖資源綠色加工重點實驗室,廣西 柳州,545006)
?
解脂耶氏酵母脂肪酶Lip2與疏水蛋白SC3融合表達及催化性質
邱玉龍,鄧冬梅,潘淑蘭,孫宇飛*
(廣西科技大學 生物與化學工程學院,廣西糖資源綠色加工重點實驗室,廣西 柳州,545006)
為研究疏水蛋白融合表達對脂肪酶的催化性質影響,分別構建分泌表達解脂耶氏酵母脂肪酶Lip2,帶His標簽Lip2及Lip2與疏水蛋白SC3融合蛋白的重組質粒PKL、PKHL和PKHLS并分別轉化到畢赤酵母 GS115 菌株中,通過篩選,獲得表達活性較高的工程菌株(KL、KHL、KHLS)。對3株重組菌株的培養(yǎng)與重組蛋白催化性質研究表明蛋白相對分子質量為36 kDa、36 kDa、46 kDa,發(fā)酵液對底物對硝基苯酚辛酸酯(p-NPC) 水解酶活分別達到 5.35、4.69、2.4 U/mL。最適溫度均是45 ℃,最適pH均是7.5,另外KHLS菌株的酶活力受表面活性劑的影響比KL和KHL小。
解脂耶氏酵母脂肪酶;裂褶菌疏水蛋白SC3;畢赤酵母;表面活性劑;催化性質
脂肪酶(Triacylglycerol acylhydrolase,EC 3.1.1.3)是一類能夠催化天然油脂底物水解,產生脂肪酸、甘油二酯、甘油單酯和甘油的水解酶[1]。作為一種重要的工業(yè)用酶,脂肪酶在食品工業(yè)、油脂工業(yè)[2]、飼料工業(yè)[3]、醫(yī)藥工業(yè)、洗滌工業(yè)及生物能源等行業(yè)具有廣泛的應用[4]。解脂耶氏酵母(Yarrowialipolytica)是一種可以分泌多種代謝產物的非常規(guī)酵母[5],其脂肪酶 Lip2 是一種優(yōu)良的脂肪酶,具備很高的酯化、水解、轉酯活性,已被應用到對映體拆分、酯合成、生物柴油合成等領域[6-9],真菌疏水蛋白(Fungal hydrophobin)是子囊菌和擔子菌等高等真菌細胞表面的一類小分子量蛋白。疏水蛋白與其它蛋白質相比具有一些獨特性質如親水-疏水兩面性,當疏水蛋白單體遇到親水-疏水界面時會自發(fā)組裝有序排列形成一層性質穩(wěn)定的厚約10 nm的兩親性(amphipathic)蛋白薄膜,使疏水蛋白具有自組裝的性質。疏水蛋白的獨特性質使其在食品、醫(yī)藥、化妝品、工業(yè)催化[10-12]等方面具有廣闊的應用前景。
畢赤酵母(Pichiapastoris)是一種被廣泛用作異源表達重組蛋白的酵母。和細菌一樣,畢赤酵母也是一種單細胞微生物,它們生長速度快,培養(yǎng)成本低。 然而和細菌不同的是,酵母是真核生物,有著復雜的翻譯后修飾體系,因此,畢赤酵母很適合表達真核生物的蛋白。解耶氏酵母與畢赤酵母之間的親緣關系很近,它們有著相同或相似的蛋白質表達后修飾體系。將解耶氏酵母的脂肪酶 Lip2 基因在畢赤酵母 GS115 菌株中表達是一種獲得高活力脂肪酶 Lip2 的切實可行的策略。目前,已有研究報道了在畢赤酵母體系高效表達Lip2 脂肪酶的前例[13-15]。本研究將解脂耶氏酵母脂肪酶 Lip2基因與疏水蛋白基因連接在畢赤酵母中融合表達,探索疏水蛋白對Lip的表達及催化性質的影響。
1 材料與方法
1.1材料
1.1.1菌株與質粒
畢赤酵母PichiapastorisGS115 菌株,購自美國Invitrogen公司,大腸桿菌EscherichiacoliTop10 F`為本實驗室保存。pPIC9K購自美國Invitrogen公司,經過本實驗室改造在其上面添加了MluI酶切位點。根據(jù)NCBI數(shù)據(jù)庫中解脂耶氏酵母脂肪酶 Lip2基因和裂褶菌Schizophyllumcommune疏水蛋白SC3外顯子拼接序列,設計其畢赤酵母密碼子偏好的DNA序列,分別委托南京金瑞思生物科技有限公司進行全基因合成。合成的基因克隆在質粒pUL中。
1.1.2試劑及儀器
限制性內切酶EcoRI、ApaI、SalI、MluI、Taq酶和T4DNA 連接酶等購自加拿大Fermentas公司。DNA 凝膠回收試劑盒和質粒小量提取試劑盒購自北京鼎國昌盛生物技術有限責任公司,其他試劑均為國產分析純。GenePulser Xcell 電擊轉化儀,Bio-Rad 公司;PCR 儀,德國Biometra 公司;紫外顯影儀北京市六一儀器廠;DNA電泳儀,北京君意東方電泳設備有限公司。
1.1.3培養(yǎng)基
培養(yǎng)基 YPD、MD、BMGY 和 BMMY 等參照 Invitrogen 公司的畢赤酵母表達手冊配制。
1.1.4引物
用于擴增去自身信號肽Lip2基因的引物對為:MatL1(5’-CGCGACGCGTGTTTATACTTCCACAGAG-3’)和MatL2(5’- CGCGGAATTCTTAAATACCGCAAACTCCCTC-3’),其中下劃線部分為引入的限制性內切酶MluI和EcoRI 的酶切位點。用于擴增去自身的信號肽且N端帶 6*His 標簽的 Lip2基因的引物對為:MatL3(5’-CGCGACGCGTCACCACCACCACCACCACGTTTATACTTCCACAGAG-3’)和MatL4(5’-CGCGGGGCCCAATACCGCAAACTCCCTC-3’)其中斜體為 6*His標簽編碼序列,下劃線部分為引入的限制性內切酶MluI和ApaI 的酶切位點。用于擴增SC3基因的引物對為:MatL5(5’-CGCGGGGCCCTTGCCAGGTGGTCACC-3’)和MatL6(5’-CGCGGAATTCCAAGATGTTGATTGGAGTA-3’)其中下劃線部分為引入的限制性內切酶ApaI和EcoRI 的酶切位點。
1.2實驗方法
1.2.1酵母表達載體 PL、PHL和PHLS 的構建
以提取的質粒pUL為模板,用引物MatL1/MatL2進行PCR,擴增PCR 產物和載體 pPIC9K 分別用MluI和EcoRI 酶切, 經凝膠回收試劑盒純化后用 T4DNA 連接酶連接,獲得連接好的pPIC9K-Lip2(以下簡稱PKL)載體。以提取的質粒pUL為模板,引物MatL3/MatL4進行PCR,擴增PCR 產物和載體 pPIC9K 分別用MluI和ApaI酶切, 經凝膠回收試劑盒純化后用 T4DNA 連接酶連接,獲得連接好的PHL載體。將上面兩種連接產物轉化至大腸桿菌Top10中,經含氨芐青霉素的 LB 平板的篩選,挑取單菌落抽提質粒,經 PCR 和酶切進行鑒定后,將陽性克隆送至上海立菲生物技術有限公司測序, 以確定其閱讀框的正確性。獲得載體 PL、PHL。以提取的質粒pUL為模板,用引物MatL5/MatL6進行PCR,擴增PCR 產物和載體 pPIC9K-6*His-Lip2(以下簡稱PKHL)分別用ApaI和EcoRI 酶切,經凝膠回收試劑盒純化后用 T4DNA 連接酶連接,獲得連接好的PHLS載體。將連接產物轉化至大腸桿菌Top10中,經含氨芐青霉素的 LB 平板的篩選,挑取單菌落抽提質粒, 經 PCR 和酶切進行鑒定后,將陽性克隆送至上海立菲生物技術有限公司測序,保證其閱讀框的正確性。獲得載體pPIC9K-6*His-Lip2-SC3(以下簡稱PKHLS)。
1.2.2酵母轉化及篩選
將表達載體PKL、PKHL和PKHLS用限制性內切酶SalI線性化后,電擊轉化畢赤酵母GS115感受態(tài)細胞,電擊轉化后,將細胞涂布在MD平板上,28 ℃培養(yǎng)2.5 d。長出菌落后將菌落轉移到乳化Tributyrin固體平板上,28 ℃培養(yǎng)2~3 d。挑取有明顯水解圈并且水解圈比較大的克隆子進行 PCR驗證和酶活力篩選,獲得的重組酵母菌體分別命名為KL、KHL和KHLS。
1.2.3脂肪酶酶活的定量測定
脂肪酶活性測定采用調整后的硝基苯酚法[16]:菌株經過發(fā)酵后發(fā)酵液用于酶活測定。將20.9 mg 對硝基苯酚辛酸酯(p-NPC) 溶解于10 mL乙腈中,形成 10 mmol/L的p-NPC 溶液。向試管中加入2.8 mL Tris-HCl 緩沖液(pH 7.5)、50 μL 10 mmol/Lp-NPC 溶液和150 μL 無水乙醇,混勻,形成3mL底物溶液。試放管置于45℃ 水浴鍋中預熱 5 min。向試管中加入 50 μL 菌懸液,在 45 ℃ 下反應10 min,加入10 μL 0.5 mol/L 的EDTA, 利用分光光度計測 OD410值。脂肪酶每分鐘水解p-NPC產生 1 μmol的對硝基苯酚(pNP)所需的酶量定義為1個活力單位(U)。
1.3脂肪酶酶學性質研究
1.3.1最適溫度及最適 pH
通過對不同菌種測定不同溫度(30、35、40、45 、50、50 ℃)下的p-NPC水解酶活以確定各個脂肪酶的最適溫度。通過測定不同的 pH(6.5~9.5)下對p-NPC酶活力,以確定各個脂肪酶的最適pH。每個溫度和pH測定3次取平均值。
1.3.2底物特異性
在 pH7.5、45 ℃條件下測定不同菌種發(fā)酵液對不同的底物水解特異性。底物分別為:4-硝基苯基丁酸酯(C4)、對硝基苯酚辛酸酯(C8)、對硝基苯酚月桂酸酯(C12)、對硝基苯酚棕櫚酸酯(C16)。
1.3.3表面活性劑對酶活力的影響
將發(fā)酵液中分別加入不同表面活性劑(SDS、Tween 20、Tween 80、Triton X-100),使其質量分數(shù)為1%。在4 ℃冰箱保存1 h。之后,取樣測定其在 pH7.5、45 ℃條件下對p-NPC 的水解活力。另外分別取空白酵母GS115與3種重組酵母發(fā)酵液10 mL于樣品瓶中,用力搖勻樣品瓶,使4組發(fā)酵液泡沫豐富程度基本保持一致,靜置12 h后觀察4組發(fā)酵液泡沫維持情況。
2 結果與討論
2.1酵母表達載體 PKL、PKHL和PKHLS 的構建
將連接好的載體PKL、PKHL和PKHLS(圖1和圖2)轉入大腸桿菌TOP10中,挑單菌落提質粒,用對應的引物進行PCR驗證。結果均符合預期,脂肪酶Lip2的目的片段大小為950 bp,SC3疏水蛋白目的基因片段大小為350 bp。測序檢測結果顯示并無突變。
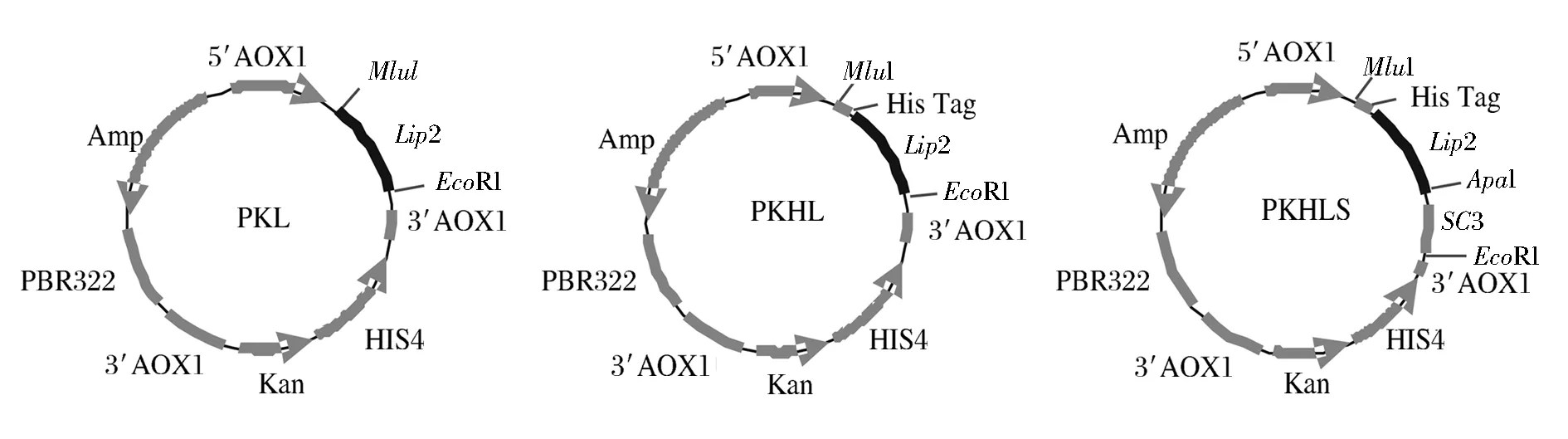
圖1 質粒圖譜Fig.1 Plasmids construction map
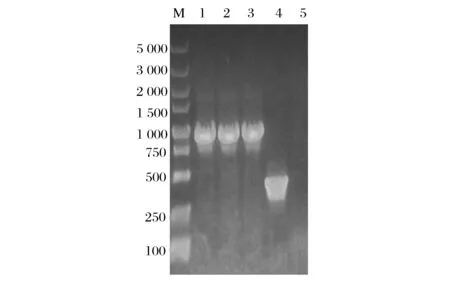
M-Marker;1-PKL plasmid;2-PKHL plasmid;3-Lip2 fragment in PKHLS plasmid;4-SC3 fragment in PKHLS plasmid;5-Blank control圖2 轉化菌體提質粒PCR驗證Fig.2 Transforming bacterial plasmid PCR validation mention
2.2酵母的轉化與篩選
在三丁酸甘油酯平板上可以觀察到 KL、KHL和KHLS重組子周圍有水解透明圈,而對照則無明顯水解圈,說明表面展示的 Lip2 具備水解三丁酸甘油脂的能力(圖3)。對重組菌株發(fā)酵液進行SDS-PAGE電泳分析,結果如圖4所示。KL、KHL重組子在 36.0 kDa 附近各有一條帶,這一條帶與解耶氏酵母脂肪酶 Lip2 大小一致。KHLS 重組子在46 kDa 附近有一條帶,這一條帶與解耶氏酵母脂肪酶 Lip2 與疏水蛋白SC3加和大小基本相符。另外由SDS-PAGE電泳圖譜可知,KHLS的表達量遠遠低于KL、KHL兩種菌株。原因可能是疏水蛋白與畢赤酵母自身蛋白的性質差異太大,在肽鏈翻譯及修飾過程中被白內蛋白降解體系識別為非正常肽鏈而大部分降解了,以畢赤酵母表達純疏水蛋白時此現(xiàn)象更明顯[10,17]。
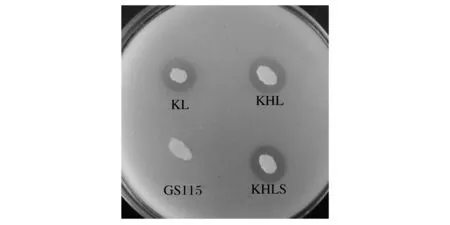
圖3 重組菌株三丁酸甘油酯平板篩選Fig.3 Lipase activity detection
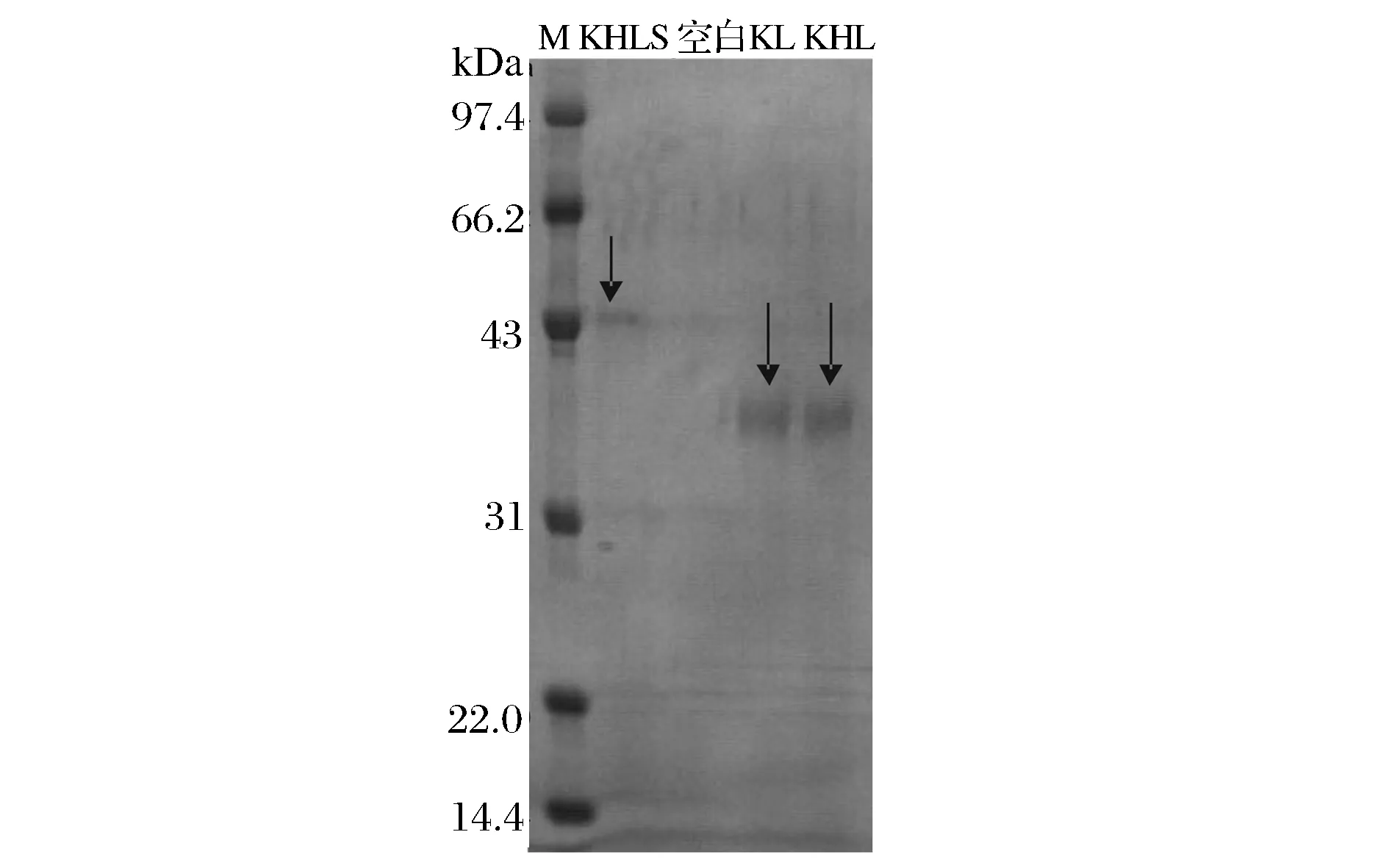
圖4 KL、KHL和KHLS 重組子搖瓶發(fā)酵表達脂肪酶的SDS-PAGE分析Fig.4 SDS-PAGE analysis of KL, KHL and KHLS recombinant shake flask for the expression of lipase
2.3最適溫度及最適pH值
通過對不同菌種測定不同溫度不同pH下的p-NPC水解酶活以確定各個脂肪酶的最適溫度與最適pH。由圖5可知,KL、KHL和KHLS表達的3種脂肪酶在低于 40 ℃ 時隨著溫度升高酶活快速上升,40~45 ℃時酶活緩慢上升,至45 ℃時酶活達到最大。高于 45 ℃之后KL和KHLS酶活緩慢下降,KHL酶則快速下降。由圖6可知,在小于 pH 7.5 之前,KL、KHL和KHLS三種脂肪酶酶活隨 pH 值增加迅速上升,而在 pH 7.5之后則隨著 pH 值的增加而快速下降,因此三者的最適溫度和最適pH值相同,均為45 ℃和pH 7.5。說明與SC3融合后Lip2的最適溫度、最適pH等催化性質沒有受到影響。由于酶的活力表現(xiàn)受表達體系[18]及酶活檢測所用底物和反應體系差異影響,本研究表達的Lip2最適作用條件與YU等[19]在P.pastorisX-33菌株表達的Lip2最適條件(40 ℃,pH 8.0)以及KUMARI等[20]在E.coliHB101系統(tǒng)表達的Lip2最適條件(40 ℃,pH 7.0)相比都略有差異。
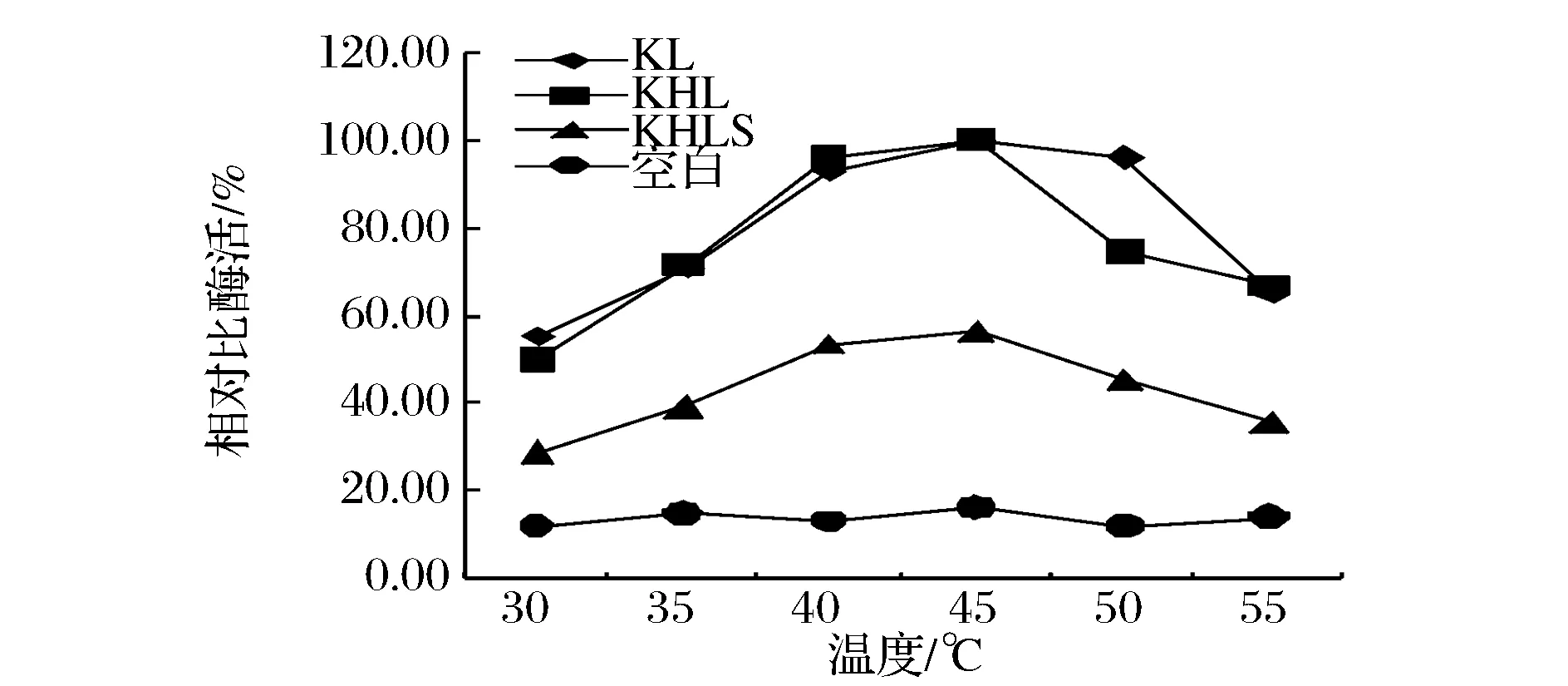
圖5 重組酶最適溫度Fig.5 Recombinase optimum temperature
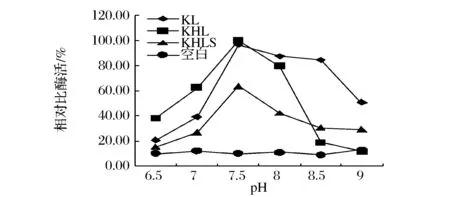
圖6 重組酶最適pHFig.6 Recombinase optimum pH
從總酶活力分析,KL和KHL總體酶活力基本相當, KHLS酶活力達到前兩者的60%左右,由SDS-PAGE電泳結果可知KHLS的表達量遠遠低于KL、KHL兩種菌株,說明Lip2與SC3融合表達量比Lip2及His-Lip2顯著降低,但酶活力并未成比例減少,甚至可以預計在蛋白含量相當?shù)那闆r下His-Lip2-SC3的酶活力要比Lip2及His-Lip2更高,此結果提示SC3對Lip2的催化活力有促進作用。
2.4底物特異性
分別用不同碳鏈長度的對硝基苯酚酯為底物檢測了KL、KHL和KHLS三種脂肪酶的酶活,由圖7可以看出,KL與KHLS脂肪酶對C8(對硝基苯酚丁酸酯)的酶活力最高分別達到5.35 U/mL和2.4 U/mL, 而KHL脂肪酶對C12(對硝基苯酚月桂酸酯)的酶活最高達到4.69 U/ml。總體而言,這3種脂肪酶對于中等長度碳鏈底物(C8-C12)具有較高的催化活力,與YU等[19-21]報道的游離態(tài)脂肪酶 Lip2 對中長鏈底物特異性強的情況基本一致。SC3融合后Lip2的底物特異性沒有發(fā)生明顯改變,說明融合的SC3并未顯著影響Lip2的底物結合位點的構象。有研究將Lip2脂肪酶與Aga2,Cwp2等釀酒酵母胞壁蛋白融合構建表面展示Lip2酶[22-23],結果都顯示其對中等長度碳鏈底物(C8-C12)的底物特異性強,也提示與Lip2端部融合的蛋白質可能不易影響Lip2對底物的選擇。
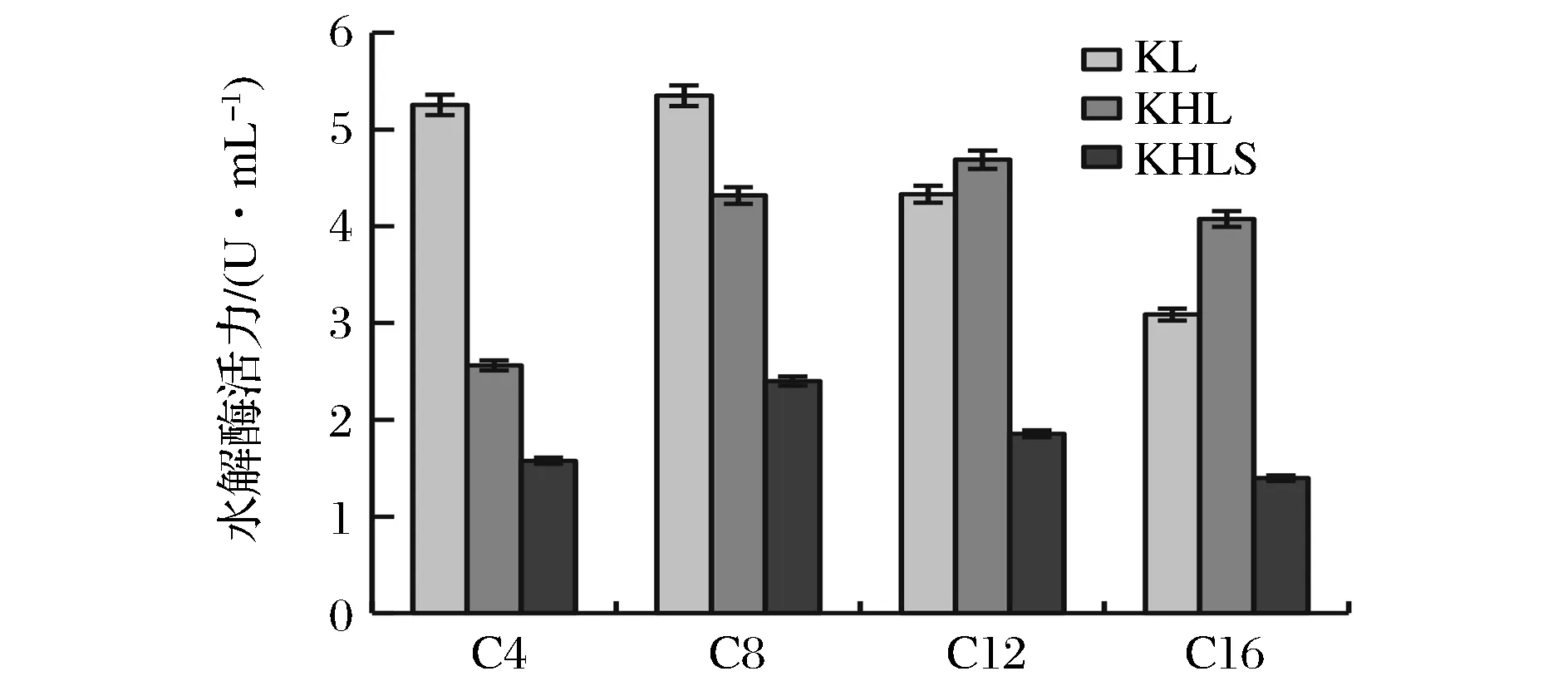
圖7 重組酶底物特異性Fig.7 Recombinant enzyme substrate specificity
2.5表面活性劑對酶活力的影響
表面活性劑是脂肪酶催化應用的常用助劑,可以幫助油脂底物在水相中分散,擴大接觸表面積,疏水蛋白的兩親性使其與Lip2酶蛋白融合后可改善分子的表面活性。由圖8可知12 h后GS115與KL、KHL發(fā)酵液泡沫基本消失,而KHLS發(fā)酵液仍有一些泡沫存在,說明脂肪酶Lip2與SC3融合后蛋白質分子自身表面活性有所提高,使得水-空氣兩相界面的接觸面積增大。融合酶的這個性質有助于反應體系中水相中的酶與油脂底物接觸,從而更好地發(fā)揮催化活力。

圖8 發(fā)酵液泡沫維持時間比較Fig.8 Comparison of fermentation broth foam maintaining time
然而表面活性劑對酶活性有一定影響,這里用HLB(Hydrophile-Lipophile Balance Number)值不同的4種表面活性劑對酶進行處理。一般用HLB值來表示表面活性劑的極性。表面活性劑極性越強,HLB 值越大,親水性越強[24]。 KL、KHL和KHLS三種酶經1%的非離子表面活性劑SDS(HLB-40)、Tween20(HLB-16.7)、Tween80(HLB-15.0)、TritonX-10(HLB-13.0)分別處理 1 h后酶活力如圖9所示,3種酶的活力隨著所加入的非離子表面活性劑(Tween20、Tween80、TritonX-100) HLB 值的降低而降低,說明非離子表面活性劑的親水性越弱,越容易影響Lip2的酶活力。值得注意的是,3種酶經非離子表面活性劑處理后與未經處理的酶活力相比KL與KHL的酶活力急劇下降,而KHLS酶活力下降相對較小,說明在非離子表面活性劑存在的環(huán)境下SC3疏水蛋白有利于脂肪酶結構保持穩(wěn)定并維持酶的催化活力。另外經陰離子表面活性劑SDS處理后的3種酶,酶活力降低均比較小,說明3種酶對SDS的耐受能力均比較強。一般認為離子型表面活性劑因其帶電基團與酶分子間的強烈靜電作用易使脂肪酶失活,而非離子型表面活性劑與酶分子間僅存在氫鍵和疏水作用,對酶的抑制性較弱[25-26]。然而酶和表面活性劑種類、結構差異,表面活性劑濃度差異等因素都會影響表面活性劑對酶的實際作用效果。有研究報導在反應體系中添加適當Tween-80有利于皺褶假絲酵母脂肪酶Lipase OF[25]及南極假絲酵母脂肪酶B(CALB)[27]合成活力發(fā)揮,原因可能是表面活性劑有助于誘導脂肪酶“蓋子”結構打開使活性中心暴露而提高催化效率,但高濃度表面活性劑也會占據(jù)脂質界面,抑制脂肪酶的吸附從而導致酶活下降[28]。本研究所用表面活性劑終濃度高達1%,因此普通Lip2酶分子受表面活性劑分子抑制使活性明顯降低,而具有自身表面活性的KHLS產融合酶分子可參與脂質界面的爭搶,表現(xiàn)出耐受高濃度表面活性劑的能力。
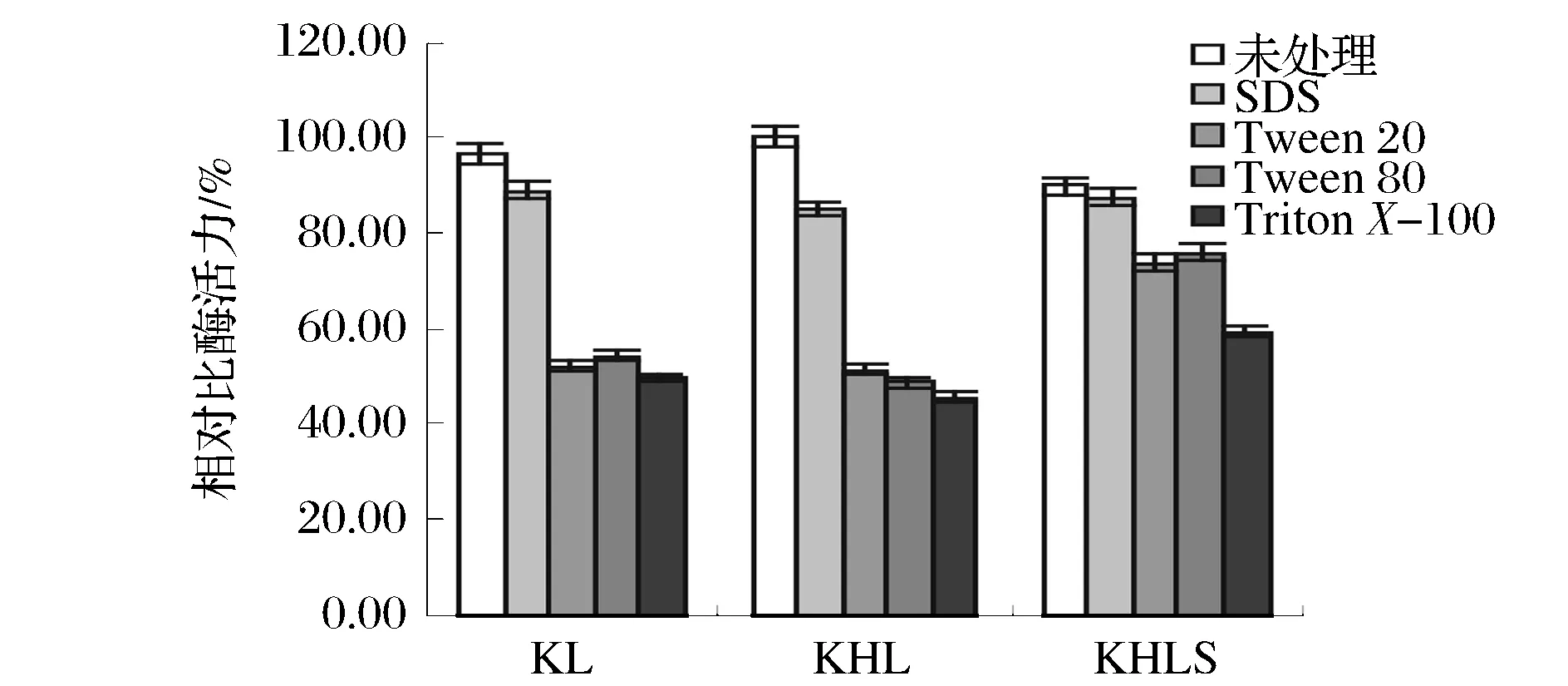
圖9 不同表面活性劑對酶活力的影響Fig.9 Effect of different surfactants on the activity of the enzyme
為了賦予脂肪酶兩親性從而提高酶的表/界面活性,翁永珍在脂肪酶表面的氨基基團上共價連接長鏈硬脂酸[29],所獲修飾酶具有一定表面活性,其溶液表/界面張力提高,有機相中酯化活力和在油/水界面催化活性明顯提高。KHLS的融合酶與此修飾酶有相似結構和表現(xiàn),提示其可能也具有較佳的非水相催化能力。
3 結論
本研究首次將SC3疏水蛋白與脂肪酶Lip2在畢赤酵母中融合表達,融合酶相對分子大小為46 kDa,具有水解三丁酸甘油酯活力。經與Lip2酶比較,融合酶的最適pH為7.5,最適溫度為45 ℃,最適底物為C8(對硝基苯酚辛酸酯),與未融合脂肪酶 Lip2 基本一致。 Lip2酶活力受表面活性劑的影響較大,而融合酶酶活力受表面活性劑的影響較小,說明SC3對與其融合表達的脂肪酶的結構及酶活力具有一定的保護作用。
[1]ANGKAWIDJAJA C,KANAYA S.Family I.3 lipase: bacterial lipases secreted by the type I secretion system [J]. Cellular and Molecular Life Sciences,2006,63(23):2 804-2 817.
[2]韋 偉,馮鳳琴.sn-1,3 位專一性脂肪酶在食品中的應用[J].中國糧油學報,2012,27(2): 122-128.
[3]劉德海,解復紅,賈彬,等.脂肪酶及其在飼料工業(yè)中的應用研究進展 [J].河南科學,2012, 30(7): 878-881.
[4]鄧利,譚天偉,王芳.脂肪酶催化合成生物柴油的研究[J].生物工程學報,2003, 19(1): 97-101.
[5]NICAUD J M.Yarrowialipolytica[J]. Yeast, 2012,29(10):409-418.
[6]FICKERS P, BENETTI P H,WACHE Y,et al.Hydrophobic substrate utilisation by the yeastYarrowialipolytica, and its potential applications [J].Fems Yeast Research,2005,5(6/7): 527-543.
[7]DENG L,TAN T W,WANG F,et al.Enzymatic production of fatty acid alkyl esters with a lipase preparation fromCandidasp.[J].European Journal of Lipid Science and Technology,2003, 105(12): 727-734.
[8]GUIEYSSE D,SANDOVAL G,FAURE L,et al.New efficient lipase fromYarrowialipolyticafor the resolution of 2-bromo-arylacetic acid esters[J]. Tetrahedron:Asymmetry,2004,15(22): 3 539-3 543.
[9]HE X L,CHEN B Q,TAN T W.Enzymatic synthesis of 2-ethylhexyl esters of fatty acids by immobilized lipase fromCandidasp. 99-125[J].Journal of Molecular Catalysis B-Enzymatic, 2002,18(4/6):333-339.
[10]NIU B L,WANG D D,YANG Y Y,et al.Heterologous expression and characterization of the hydrophobin HFBI inPichiapastorisand evaluation of its contribution to the food industry[J].Amino Acids,2012,43(2):763-771.
[11]WANG Z L,YING S H,FENG M G,et al.Recognition of a core fragment ofBeauveriabassianahydrophobin gene promoter (Phyd1) and its special use in improving fungal biocontrol potential [J]. Microbial Biotechnology,2013,6(1):27-35.
[12]WANG Z,LIENEMANN M,QIAU M,et al.Mechanisms of protein adhesion on surface films of hydrophobin[J].Langmuir,2010,26(11):8 491-8 496.
[13]YU M,WEN S,TAN T.Enhancing production ofYarrowialipolyticalipase Lip2 inPichiapastoris[J].Engineering in Life Sciences,2010,10(5): 458-464.
[14]YU M,LANGE S,RICHTER S,et al.High-level expression of extracellular lipase Lip2 fromYarrowialipolyticainPichiapastorisand its purification and characterization[J].Protein Expression and Purification,2007,53(2):255-263.
[15]汪小鋒,申旭光,趙鶴云,等.帶 His-tag 的解脂耶氏酵母脂肪酶 Lip2 在畢赤酵母中的表達及純化[J].中國生物工程雜志,2011,31(4):53-59.
[16]邱玉龍,鄧冬梅,韋揚輝,等.殼聚糖微球固定化脂肪酶催化性質研究[J].廣西科技大學學報, 2016,27(1):93-98.
[17]WANG Z F,FENG SR,HUANG Y J,et al.Expression and characterization of aGrifolafrondosahydrophobin inPichapastoris[J]. Protein Expression and Purification,2010,72: 19-25
[18]NARS G,SAUREL O,BORDES F,et al.Production of stable isotope labelled lipase Lip2 fromYarrowialipolyticafor NMR: investigation of several expression systems [J]. Protein Expression and Purification, 2014,101:14-20.
[19]YU M G,QIN S W,TAN T W.Purification and characterization of the extracellular lipase Lip2 fromYarrowialipolytica[J].Process Biochemistry,2007,42(3):384-391.
[20]KUMARI A,VERMA VV,GUPTA R.Comparative biochemical characterization and in silico analysis of novel lipases Lip11 and Lip12 with Lip2 fromYarrowialipolytica[J]. World Journal of Microbiology and Biotechnology,2012,28(11):3 103-3 111.
[21]張曉焰.解脂耶氏酵母脂肪酶Lip2的固定化工藝及其富集魚油DHA的研究[D]. 武漢: 華中科技大學,2012:31-36.
[22]劉文山,徐莉,趙鶴云,等.利用a凝集素在釀酒酵母表面展示解脂耶氏酵母脂肪酶Lip2 [J]. 微生物學報,2008,48(11):1543-1548.
[23]劉文山, 趙鶴云,賈彬,等.解脂耶氏酵母脂肪酶Lip2的表面展示及其酶學性質[J].微生物學通報,2010,37(2):174-178.
[24]KUMAR S,KIKON K,UPADHYAY A.et al.Production, purifcation, and characterization of lipase from thermophilic and alkaliphilicBacilluscoagulansBTS-3 [J].Protein Expression and Purification,2005,41:38-44
[25]劉幽燕,許建和,胡英.表面活性劑對脂肪酶活性和選擇性的影響[J].化學學報,2000,58(2): 149-152.
[26]周曉云,包廣糧,鐘衛(wèi)鴻,等.脂肪酶在表面活性劑介質中的催化反應動力學研究[J].浙江工業(yè)大學學報, 2000,28(1):18-23.
[27]金子.畢赤酵母細胞展示的CALB脂肪酶的表征及非水相催化特性研究[D].廣州:華南理工大學,2013:79-90.
[28]韓祝平.基于脂肪酶界面活化特性的固定化技術[D].杭州:浙江理工大學,2013:35-43.
[29]翁永珍.脂肪酶的化學修飾及其界面催化性能研究[D].無錫:江南大學, 2007:14-27.
The fusion expression and catalytic properties of theYarrowialipolyticalipase Lip2 and hydrophobin SC3
QIU Yu-long, DENG Dong-mei, PAN Shu-lan, SUN Yu-fei*
(Guangxi University of Science and Technology,School of Biological and Chemical Engineering,Guangxi Key Laboratory of Green Processing of Sugar Resources, Liuzhou 545006,China)
In order to investigate hydrophobin fusion expression effects on lipase catalytic properties, recombinant plasmid PKL secreted greaseYersinialipolyticalipase Lip2, PKHL with His tag Lip2 and PKHLS carrying fusion protein of Lip2 and hydrophobin SC3 were constructed and respectively transformed intoPichiapastorisGS115 strain. After screening, the engineering strains with high expression were obtained. Fermentation broth of these 3 recombinant strains respectively with a relative molecular weight of 36 kDa, 36 kDa, 46 kDa showed hydrolase activity of 5.35U/mL, 4.69U/mL, 2.4U/mL with 4-nitrophenyl caprylate (p-NPC) as substrate at optimum temperature of 45 ℃ and the optimum pH of 7.5. The enzyme activities of KL and KHL strains were much higher than that of KHLS.
Yarrowialipolyticalipase;Schizophyllumcommunehydrophobin SC3;Pichiapastoris;surfactant;catalytic activity
10.13995/j.cnki.11-1802/ts.201609004
碩士研究生(孫宇飛為通訊作者,E-mail:3893@163.com)。
廣西自然科學基金項目(2014GXNSFBA118249);廣西高校科學技術研究項目(YB2014201);廣西科技大學大學生創(chuàng)新創(chuàng)業(yè)訓練計劃項目(201510594035)
2016-02-01,改回日期:2016-03-15

