谷氨酸合成途徑基因缺失對大腸桿菌發酵L-色氨酸的影響
趙春光,魏洪波,徐慶陽,張成林,陳寧
(天津科技大學 生物工程學院,天津,300457)
?
谷氨酸合成途徑基因缺失對大腸桿菌發酵L-色氨酸的影響
趙春光,魏洪波,徐慶陽,張成林,陳寧*
(天津科技大學 生物工程學院,天津,300457)
降低谷氨酸的積累可提高L-色氨酸產量及糖酸轉化率。敲除EscherichiacoliTRTH中的谷氨酸脫氫酶及谷氨酸合成酶編碼基因gdhA、gltB,構建TRTHA(TRTH,ΔgdhA)、TRTHB(TRTH,ΔgltB),考察gdhA、gltB缺失對L-色氨酸發酵的影響。結果表明,gdhA及gltB缺失能有效降低谷氨酸的積累,但會降低細胞生長及色氨酸合成;培養基中谷氨酸的添加可恢復TRTHA及TRTHB的生長及色氨酸合成能力。在含1 g/L谷氨酸培養基中,利用TRTHB發酵L-色氨酸,L-色氨酸產量(41.23 g/L)及糖酸轉化率(15.45%)最高,較TRTH分別提高了10.92%和7.89%;谷氨酸生成量(5.72 g/L)及乙酸積累量(1.73 g/L)分別較TRTH降低了25.23 %及提高了10.19%。TRTH和TRTHB代謝流分析結果表明,gltB缺失會降低谷氨酸合成代謝流并提高乙酸合成代謝流;TRTHB的色氨酸合成代謝流(11.4%)較TRTH提高了40.74%。
大腸桿菌;L-色氨酸;谷氨酸;gdhA;gltB;代謝流分析
L-色氨酸作為人與動物的必需氨基酸,在食品、醫藥及飼料等行業得到廣泛應用[1]。目前,科研人員已對Escherichiacoli發酵生產L-色氨酸進行了深入研究[1-2]。研究表明,谷氨酸是L-色氨酸發酵中的重要代謝副產物,且降低L-色氨酸發酵中的谷氨酸積累量可提高L-色氨酸產量及糖酸轉化率[3]。通過代謝流分析表明,還原力不平衡是導致谷氨酸積累的主要原因[4]。在細胞生長階段,細胞生長可消耗大量的NADPH;而當細胞生長速率降低或者停止生長時對NADPH需求下降,則過剩的NADPH導致谷氨酸的積累[5]。
在E.coli中,谷氨酸的合成途徑主要有兩條。一條是由gdhA基因編碼的谷氨酸脫氫酶(glutamate dehydrogenase, GDH)催化的由α-酮戊二酸(α-Ketoglutaric acid, α-KG)與游離氨發生還原氨基化形成谷氨酸;另一條途徑是通過glnA基因編碼的谷氨酰胺合成酶(glutamine synthetase, GS)和由gltB/gltD基因編碼的谷氨酸合酶(glutamate synthase, GOGAT)合成[6]。通過敲除或弱化GDH、GOGAT編碼基因可以減少谷氨酸的積累。在利用谷氨酸棒狀桿菌生產α-KG時,通過敲除谷氨酸脫氫酶基因gdh及谷氨酸合成酶基因gltB可降低谷氨酸積累,提高α-KG產量[7]。在L-色氨酸發酵中,通過優化葡萄糖補料策略,使谷氨酸的積累量由83 g/L降至3 g/L以下,L-色氨酸對葡萄糖的得率從10.5%提升至18.5%,達到了理論得率的78%[3]。
在本研究中,利用Red重組技術敲除基因gdhA、gltB,構建缺失菌株TRTHA(TRTH,ΔgdhA)及TRTHB(TRTH,ΔgltB),考察gdhA及gltB缺失對L-色氨酸發酵及代謝流分布的影響,以降低L-色氨酸發酵中的谷氨酸積累,提高L-色氨酸產量及糖酸轉化率。
1 材料與方法
1.1材料與試劑
1.1.1菌株、質粒及引物
本研究所用菌株、質粒及引物參見表1,其中菌株E.coliTRTH(trpEDCBA+TetR, Δtna)由天津科技大學工業微生物菌種保藏室提供(保藏號:TCCC 27003)。
1.1.2培養基
LB培養基、2- YT培養基及SOC培養基,參見參考文獻[2]。
種子培養基(g/L):葡萄糖 20,酵母粉 7.5,KH2PO41.5,KCl 1.9,(NH4)2SO44,MgSO4·7H2O 3.15,FeSO4·7H2O 75.6 mg/L。
發酵培養基(g/L):葡萄糖 10,酵母浸粉 1,KH2PO41.5,KCl 1.9,(NH4)2SO44,MgSO4·7H2O 3.15,FeSO4·7H2O 75.6 mg/L。
1.1.3主要試劑
TaqDNA聚合酶、限制性內切酶(大連寶生物工程有限公司);PCR引物(北京博邁德科技有限公司);1 kb Marker(Fermentas);DNA片段回收試劑盒、基因組DNA提取試劑盒、質粒小樣快速提取試劑盒(北京天恩澤基因科技有限公司);IPTG、X-gal、溶菌酶、氨芐青霉素、氯霉素、四環素(北京索萊寶公司)。
1.2主要儀器
PCR儀、電轉化儀、核酸分析儀,BIO-RAD;10 L、50 L發酵罐,上海保興生物設備工程有限公司;pH、溶氧電極,METTLER TOLEDO;生物傳感分析儀(SBA-40C),山東省科學院生物研究所;高效液相色譜系統(Agilent 1200),Agilent Technologies;BioProfile 300A Nova,美國Nova Biomedical。
1.3方法
1.3.1培養方法
基因gdhA及gltB敲除過程中,細菌培養方法參見文獻[2]。
一級種子培養:用接種環挑取L-色氨酸菌落接種于裝有50 mL一級種子培養基的三角瓶中,置于搖床,36 ℃、200 r/min,培養時間8 h。
二級種子培養:采用壓差法按照10%(v/v)的接種量將一級種子液接種于裝有二級種子培養基的發酵罐中,培養溫度為35 ℃,通過添加氨水將pH維持在7.0,調節通風量及攪拌轉速將溶氧水平維持在20%,培養12 h,作為二級種子。
發酵培養:發酵罐接種量10%,培養溫度為36 ℃,pH通過流加氨水維持在7.0,通過調節通風量及攪拌轉速將溶氧水平維持在20%。當初始葡萄糖耗盡時,采用溶氧反饋控制補料策略流加葡萄糖溶液,培養40 h。
1.3.2Red技術敲除gdhA及gltB基因
利用Red重組系統敲除E.coliTRTH中的gdhA及gltB基因,具體操作步驟參見文獻[2]。
1.3.3谷氨酸脫氫酶及谷氨酸合酶活性測定
將菌株TRTH、TRTHA和TRTHB于50 mL LB液體培養基培養至對數期后,4 ℃ 8 000 r/min離心10 min。菌體經Tris-HCl 緩沖液(100 mmol/L,pH 7.2)洗滌并用1 mL相同緩沖液重懸后利用超聲破碎儀裂解細胞(功率 350 W,工作時間 5 s,間隔時間 10 s, 100個循環,于冰上操作)。將上述細胞破碎液于4℃ 10 000 r/min離心30 min后取上清液并定容至10 mL,即為粗酶液。采用BCA蛋白定量試劑盒測定總蛋白濃度。
谷氨酸脫氫酶及谷氨酸合酶反應體系見表2和表3,反應180 s后加入10μL 10%(v/v)乙酸終止反應,利用NADP/NADPH定量分析試劑盒測定NADPH濃度。單位酶活定義為在標準酶活性測定條件下(34 ℃,pH 7.2),單位體積的反應體系中單位蛋白質量(mg)每分鐘所消耗的NADPH量(mmol)。
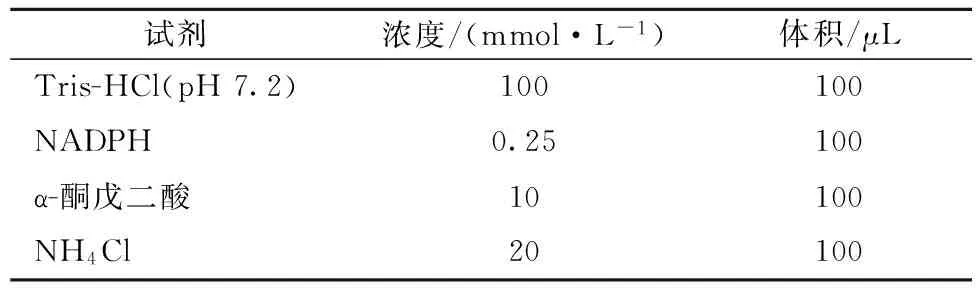
表2 谷氨酸脫氫酶酶促反應體系

表3 谷氨酸合酶酶促反應體系
1.3.4分析方法
生物量及L-色氨酸含量測定參見文獻[1];葡萄糖及谷氨酸濃度采用生物傳感分析儀測定;乙酸、乳酸及丙氨酸濃度采用BioProfile 300A分析儀測定;建立代謝網絡及代謝流平衡模型[2],利用MATLAB軟件linprog 函數計算代謝流分布。
1.4動力學參數分析
1.4.1菌體生長速率
通過測定菌體的生物量,計算菌體每小時的生長速率,單位為g/(L·h)。
1.4.2產物合成速率
通過測定產物濃度,計算產物每小時的合成速率,單位為g/(L·h)。
1.4.3顯著性分析
每個試驗重復3次,且求其數據的平均值,并用±表示數據的標準誤差。利用Origin 8.0對數據進行顯著性分析,顯著性誤差為P<0.05。
2 結果與分析
2.1缺失菌株TRTHA及TRTHB的鑒定及其谷氨酸脫氫酶和谷氨酸合酶活性分析
根據參考文獻[2]敲除TRTH基因gdhA及gltB,得到缺失菌株TRTHA、TRTHB;分別利用鑒定引物gdhA-P3-gdhA-P4、gltB-P3-gltB-P4進行PCR鑒定,將擴增片段純化后測序并利用DNAMAN軟件進行序列比對,結果與預測值相符,表明gdhA和gltB被成功敲除。分別測定菌株TRTHA和TRTHB的谷氨酸脫氫酶及谷氨酸合酶活性,出發菌株TRTH的谷氨酸脫氫酶及谷氨酸合酶活性分別為1.22 mmol/(min·mg)和1.78 mmol/(min·mg)而TRTHA和TRTHB未檢測到相應敲除基因的酶活性(表4),表明敲除gdhA和gltB基因能夠使得其編碼產物失活。
2.2TRTHA及TRTHB發酵L-色氨酸的過程分析
谷氨酸為細胞生長及色氨酸合成的必需物質,gdhA、gltB基因缺失會影響菌株生長與色氨酸合成。因此,在利用TRTHA及TRTHB發酵L-色氨酸發酵時,在發酵培養基中添加1 g/L谷氨酸(以不含谷氨酸的發酵培養基為對照)。

表4 菌株TRTH、TRTHA和TRTHB谷氨酸脫氫酶及谷氨酸合酶活性
注:*:未檢測到;**:未檢測。
2.2.1生物量及細胞生長速率
分別利用gdhA缺失菌TRTHA、gltB缺失菌TRTHB在不含及含有谷氨酸的培養基中發酵生產L-色氨酸,生物量及細胞生長速率如圖1所示。
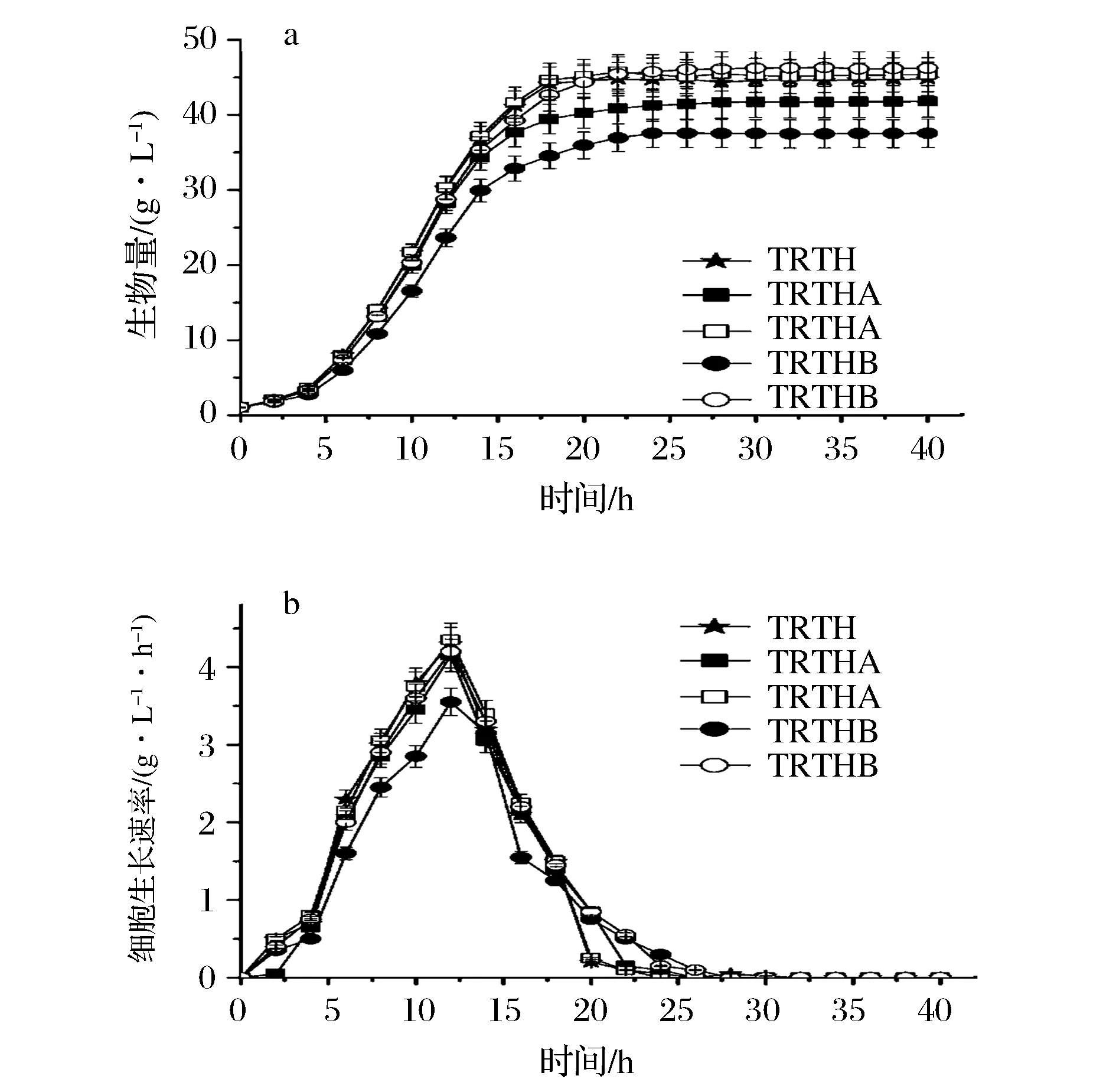
圖1 基因缺失對生物量及細胞生長速率的影響Fig.1 Effect of gene deletion on biomass and cell growth rate(注:實心圖標表示在不含谷氨酸培養基;空心圖標表示在含1g/L谷氨酸培養基)
由圖1可知,在不含谷氨酸的培養基發酵L-色氨酸時,TRTHA及TRTHB的細胞生長速率及生物量較低,二者生物量分別為41.78 g/L和37.56 g/L,均低于TRTH(44.78 g/L)。而在含有谷氨酸的培養基中,TRTHA及TRTHB的生長速率及生物量均得到提高,其生物量分別為45.32 g/L和46.23 g/L,與TRTH的生物量無顯著性差異。
2.2.2L-色氨酸產量及其合成速率
在TRTHA、TRTHB在不含或者含有谷氨酸培養基中發酵L-色氨酸時,L-色氨酸產量及其合成速率如圖2所示。
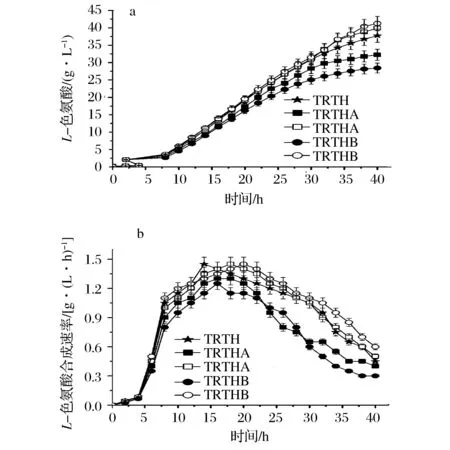
圖2 基因缺失對L-色氨酸產量及其合成速率的影響Fig.2 Effect of gene deletion on production and production rate of L-tryptophan(注:實心圖標表示在不含谷氨酸培養基;空心圖標表示在含1 g/L谷氨酸培養基)
由圖2可知,TRTHA及TRTHB在不含谷氨酸培養基中的L-色氨酸產量及其合成速率均低于含有谷氨酸培養基的;TRTHA及TRTHB的L-色氨酸產量分別為32.23 g/L和28.43 g/L。在含谷氨酸培養基中,TRTHA及TRTHB的L-色氨酸合成速率較高,其L-色氨酸產量分別為39.89 g/L和41.23 g/L,較TRTH(37.74 g/L)分別提高了5.69%、10.92%。
2.2.3谷氨酸及乙酸積累量
菌株TRTHA、TRTHB發酵L-色氨酸時,發酵過程中谷氨酸及乙酸濃度如圖3所示。
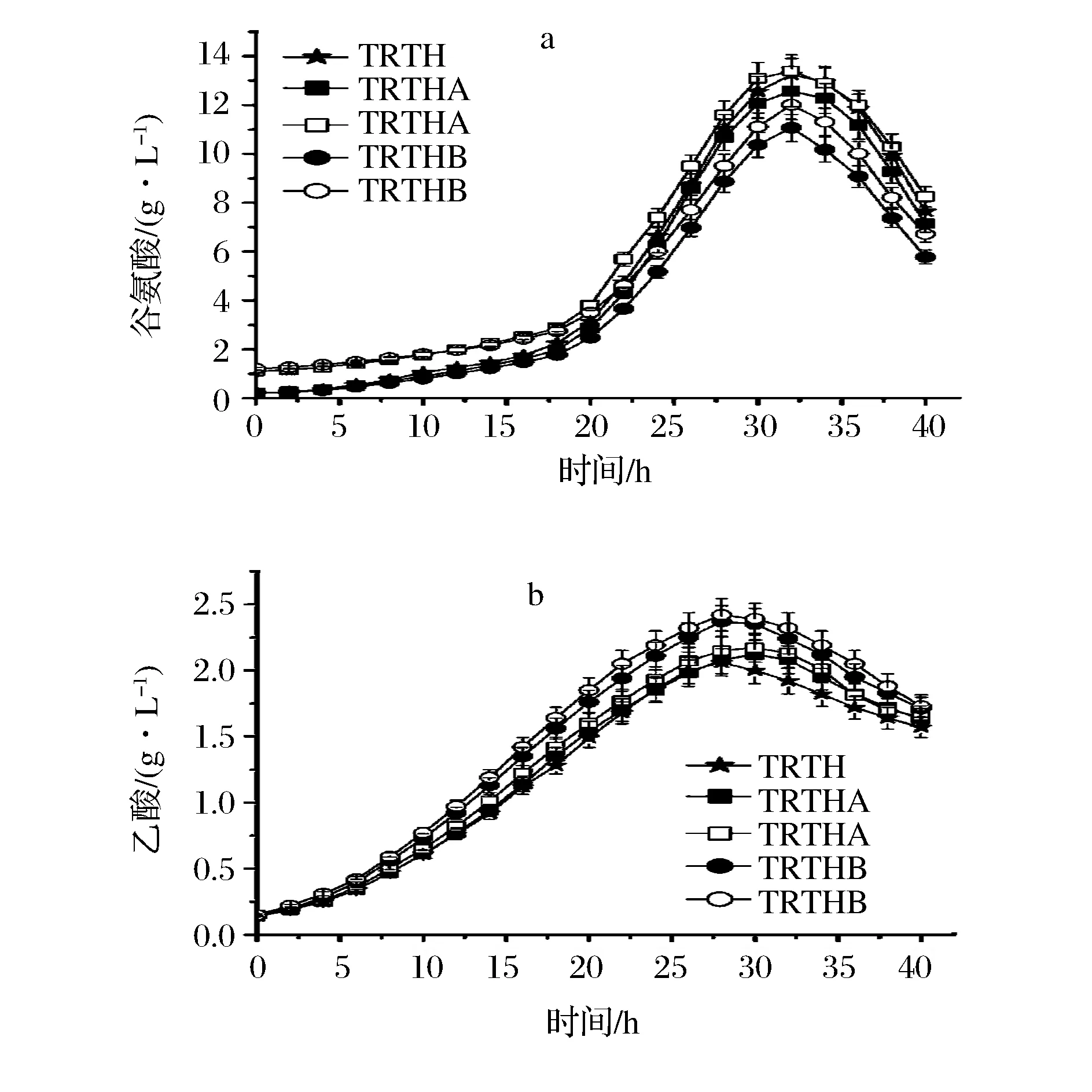
圖3 基因缺失對谷氨酸及乙酸積累量的影響Fig.3 Effect of gene deletion on accumulation of glutamate and acetate(注:實心圖標表示在不含谷氨酸的培養基;空心圖標表示在含1 g/L谷氨酸培養基)
基因gdhA及gltB缺失降低發酵過程中谷氨酸的積累,且TRTHB的谷氨酸生成量低于TRTHA;TRTHA、TRTHB在不含或者含谷氨酸培養基中的谷氨酸生成量分別為7.15 g/L、7.25 g/L、5.78 g/L及5.72 g/L(表5),均低于TRTH(7.56 g/L)。TRTHA及TRTHB的乙酸積累量均高于TRTH(1.57 g/L),且其在含谷氨酸培養基的乙酸積累量高于不含谷氨酸培養基的(無顯著差異)。TRTHA、TRTHB在不含或者含谷氨酸培養基中的乙酸積累量分別為1.63、1.65、1.71及1.73 g/L(表5)。此外,于發酵結束后測定了L-色氨酸發酵過程中常見副產物丙氨酸和乳酸的生成量,結果表明在添加谷氨酸條件下敲除gdhA和gltB均能顯著降低丙氨酸積累,3菌株發酵液中均未檢測到乳酸(表5)。
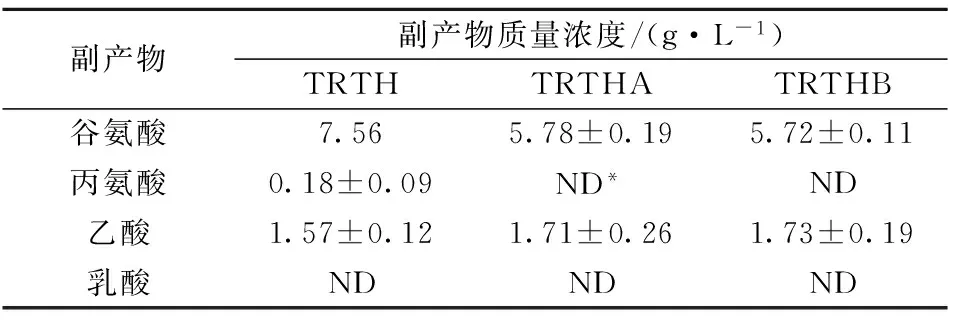
表5 菌株TRTH、TRTHA和TRTHB副產物生成量
注:*未檢測到。
2.2.4葡萄糖消耗速率及糖酸轉化率
在L-色氨酸發酵中,葡萄糖消耗速率及糖酸轉化率如圖4所示。
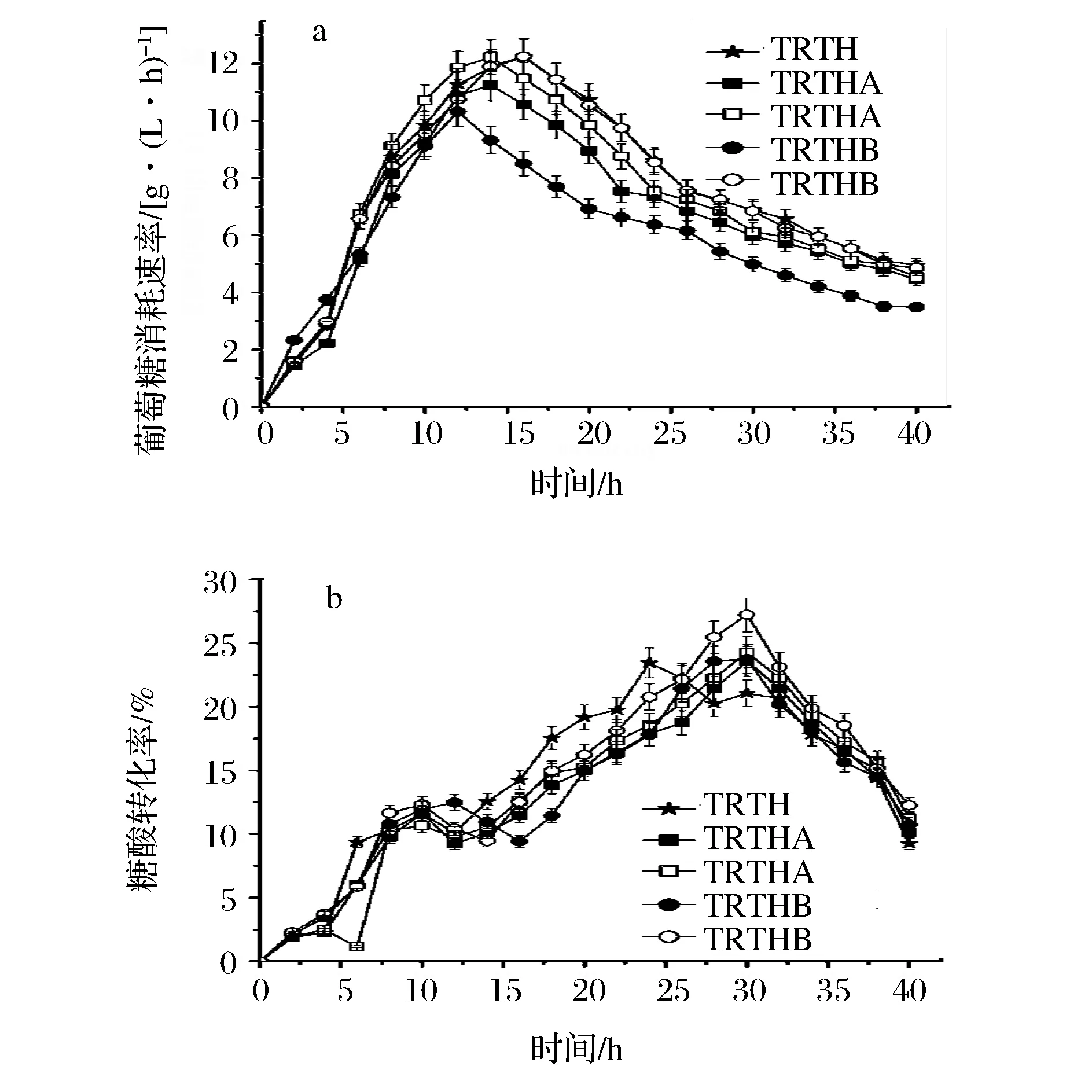
圖4 基因缺失對葡萄糖消耗速率及糖酸轉化率的影響Fig.4 Effect of gene deletion on glucose consumption and conversion rate(注:實心圖標表示在不含谷氨酸的培養基;空心圖標表示在含1 g/L谷氨酸培養基)
由圖4可知,菌株TRTHA及TRTHB在不含谷氨酸培養基中葡萄糖消耗速率均低于TRTH;而其在含谷氨酸培養基中的葡萄糖消耗速率高于TRTH,這表明在含谷氨酸培養基中細胞具有較高的生長能力。從整個發酵過程來看,TRTHA及TRTHB在含谷氨酸培養基的糖酸轉化率均高于不含谷氨酸培養基的;TRTHA及TRTHB在含谷氨酸的總體糖酸轉化率分別為15.05%和7.89%,較TRTH(14.32%)分別提高了5.01%和7.89%;TRTHA及TRTHB在不含谷氨酸的總體糖酸轉化率分別14.45%和14.02%。
2.2.5TRTH及TRTHB的L-色氨酸合成途徑代謝流分布
利用TRTH及TRTHB(含1 g/L谷氨酸的培養基)生產L-色氨酸的發酵過程可知,在28 h后菌體生物量無明顯變化,則假設此階段細胞處于擬穩態。測定發酵后期(28~40 h)的葡萄糖、色氨酸、乙酸、乳酸、丙氨酸及谷氨酸的胞外濃度,并計算其消耗或積累速率。利用MATLAB軟件計算利用TRTH及TRTHB發酵L-色氨酸時,發酵中后期L-色氨酸生物合成途徑的代謝流分布情況,如圖5所示。
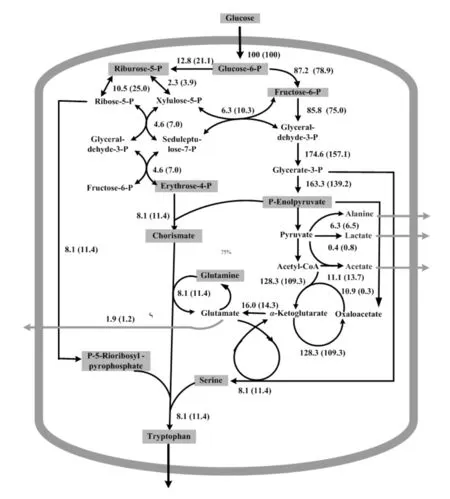
圖5 菌株TRTH及TRTHB的L-色氨酸發酵后期的代謝流分布情況Fig.5 The metabolic flux distribution of TRTH and TRTHB during the later fermentation period of L-tryptophan production(括號內數值表示TRTHB的代謝流)
由圖5可知,基因gltB缺失會影響整個代謝流的分布情況,碳代謝流由糖酵解途徑向磷酸戊糖途徑發生遷移;gltB缺失使進入糖酵解途徑的碳代謝流由87.2%降至78.9%,而進入磷酸戊糖途徑的代謝流由12.8%提高至21.1%。TRTHB中的谷氨酸合成及排除細胞的代謝流均低于TRTH,其中TRTHB中排除細胞的谷氨酸代謝流為1.2%,較TRTH降低了36.84%。gltB缺失引起乙酸及乳酸合成代謝流的提高,其中乙酸合成代謝流為13.7%,較TRTH提高了23.42%。TRTHB中色氨酸合成的代謝流為14.4%,較TRTH提高了40.74%。
3 討論
基因gdhA、gltB在E.coli的谷氨酸合成途徑中起著重要作用,且gdhA及gltB基因缺失會降低菌株的谷氨酸積累量[8]。與TRTH相比,TRTHA及TRTHB的谷氨酸生成量分別降低了6.54%和25.23%。在E.coli的谷氨酸合成途徑中,gltB對谷氨酸合成的作用大于gdhA,這可能是由于gdhA編碼的谷氨酸脫氫酶在高濃度的NH4+環境下才具有較高活性造成的[9]。谷氨酸是細胞生長過程中所需的前體物,則谷氨酸合成量不足會影響菌體的生長及生物量[10]。TRTHA及TRTHB在不含谷氨酸培養基中的生長速率及生物量均低于其在含谷氨酸的培養基中。gdhA及gltB基因缺失會降低谷氨酸的積累,但會提高其他代謝副產物合成的代謝流(如:丙酮酸、乳酸、乙酸等),從而會提高其它代謝副產物的積累量[11]。TRTHA及TRTHB的乙酸積累量均高于菌株TRTH。TRTHA及TRTHB在含谷氨酸培養基發酵L-色氨酸,其L-色氨酸產量及糖酸轉化率均高于TRTH。這表明基因gdhA、gltB的缺失降低了谷氨酸的積累,使L-色氨酸產量及糖酸轉化率得到了提高[3]。對于L-色氨酸生產菌株而言,gltB缺失菌株的L-色氨酸產量及糖酸轉化率均高于gdhA缺失菌株,則表明缺失gltB基因更有利于L-色氨酸發酵。
由TRTH及TRTHB的代謝流分布可知,TRTHB中進入磷酸戊糖途徑的代謝流提高,這會增加色氨酸合成前體物4-磷酸赤蘚糖及NADPH的供給,從而促進L-色氨酸合成[12]。TRTHB中谷氨酸合成代謝流的降低,會引起乙酸及乳酸等其它代謝副產物的合成代謝流的提高[13]。因此,應進一步研究TRTHB中的乙酸合成機制,降低其乙酸積累,以提高L-色氨酸產量。谷氨酸合成途徑基因的缺失在一定程度上降低了谷氨酸合成,但從谷氨酸合成的原因分析,其主要是由于能量代謝和還原力代謝不平衡造成的,因此針對與能量和還原力代謝有關的ATP和NADPH等輔因子的調控可作為降低谷氨酸積累更有效的手段[14],如克隆由NADPH到NADP的脫氫酶;增加從NADPH到NADP凈轉化的無效循環的代謝流[3];通過改變磷酸烯醇式丙酮酸代謝,限制通過異檸檬酸脫氫酶生產NADPH以增加色氨酸合成的代謝流;通過改變異檸檬酸脫氫酶對NADP的特異性也能解決此問題[7]。
[1]WANG Jian, CHENG Li-kun, WANG Jing, et al. Genetic engineering ofEscherichiacolito enhance production ofL-tryptophan[J]. Applied Microbiology and Biotechnology, 2013, 97(17):7 587-7 596.
[2]黃靜, 史建明, 劉倩, 等.pta基因敲除對L-色氨酸發酵的影響[J]. 微生物學報, 2011, 51(4):480-487.
[3]DODGE TC, GERSTNER JM. Optimization of the glucose feed rate prole for the production of tryptophan from recombinantE.coli[J]. Journal of Chemical Technology & Biotechnology, 2002, 77(11):1 238-1 245.
[4]王鏡巖, 朱圣庚, 徐長法. 生物化學第三版下冊[M]. 北京: 高等教育出版社, 2002:153.
[5]張偉國, 徐建中.L-賴氨酸合成代謝中NADPH代謝的研究進展[J]. 食品與生物技術學報, 2012, 31(10):1 009-1 017.
[6]李文濱, 周失, 李永光. 大腸桿菌谷氨酸脫氫酶基因的克隆及功能分析[J]. 東北農業大學學報, 2014, 45(1):53-58.
[7]LEE YB, JO JH, KIM MH, et al. Enhanced production of α-ketoglutarate by fed-batch culture in the metabolically engineered strains ofCorynebacteriumglutamicum[J]. Biotechnology and Bioprocess Engineering, 2013, 18(4):770-777.
[8]SSHAFER A, KALINOWSKI J, SIMON R, et al. High frequency conjugal plasmid transfer from gram-negativeEscherichiacolito various gram-positive coryneform bacteria[J]. Journal of Bacteriology, 1990, 172(3):1 663-1 666.
[9]GUTIERREZ-MENDEZ N, VALLJO-CORDOBA B, GONZALEZ-CORDOVA A F, et al. Evaluation of aroma generation ofLactococcuslactiswith an electronic nose and sensory analysis[J]. Journal of Dairy Science, 2008, 91(1):49-57.
[10]SILBERBACH M, SCHAFER M, HUSER A T, et al. Adaptation ofCorynebacteriumglutamicumto ammonium limitation: a global analysis using transcriptome and proteome techniques[J]. Applied & Environmental Microbiology, 2005, 71(5):2 391-2 402.
[11]MARIENHAGEN J, KENNERKNECHT N, SAHM H, et al. Functional analysis of all aminotransferases inferred from the genomic sequence ofCorynebacteriumglutamicum[J]. Journal of Bacteriology, 2005, 187(22):7 639-7 646.
[12]BAEZ-VIVEROS JL, FLORES N, JUAREZ K, et al. Metabolic transcription analysis of engineeredEscherichiacolistrains that overproduceL-phenylalanine[J]. Microb Cell Factories, 2007, doi:10.1186/1475-2859-6-30
[13]ZHAO Chun-guang, CHENG Li-kun, WANG Jian, et al. Impact of deletion of the genes encoding acetate kinase on production ofL-tryptophan byEscherichiacoli[J]. Annals of Microbiology, 2016, 66(1):261-269
[14]TJENER K, STAHNKE LH, ANDERSEN L, et al. Addition of α-ketoglutarate enhances formation of volatiles byStaphylococcuscarnosusduring sausage fermentation[J]. Meat Science, 2004, 67(4):711-719.
Effect of deletion of genes in glutamate biosynthesis pathway onL-tryptophan fermentation byEscherichiacoli
ZHAO Chun-guang, WEI Hong-bo, XU Qing-yang,ZHANG Cheng-lin, CHEN Ning*
(College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457,China)
The production ofL-tryptophan and glucose conversion rate was increased by decreasing the accumulation of glutamate.gdhA encoding glutamate dehydrogenase andgltB encoding glutamate decarboxylase inE.coliTRTH were deleted to construct TRTHA (TRTH, ΔgdhA) and TRTHB (TRTH, ΔgltB). The effect of deletion ofgdhA andgltB onL-tryptophan fermentation was subsequently investigated. The results indicated that the disruption ofgdhA orgltB decreased the excretion of glutamate as well as the cell growth andL-tryptophan biosynthesis. While the cell growth rate andL-tryptophan biosynthesis of TRTHA and TRTHB were recovered by adding glutamate in media. WithL-tryptophan fermentation using TRTHB, the highest production ofL-tryptophan (41.23 g/L) and glucose conversion rate (15.45%) were increased by 10.92% and 7.89%, glutamate production (5.72 g/L) was decreased by 25.23% and acetate accumulation was increased by 10.19% compared with TRTH. Analysis on metabolic flux distribution of TRTH and TRTHB showed that the flux of glutamate was decreased and the flux of acetate was increased with deletion ofgltB, and the flux of tryptophan of TRTHB (11.4%) was increased by 40.74%.
Escherichiacoli;L-tryptophan; glutamate;gdhA;gltB; analysis of metabolic flux
10.13995/j.cnki.11-1802/ts.201609002
在讀博士(陳寧教授為通訊作者,E-mail: ningch@tust.edu.cn)。
國家高技術研究發展計劃(863計劃):2015AA021003
2016-04-22,改回日期:2016-06-07

