Prss37 基因轉錄起始位點的確定及其轉錄調控的初步探討
王津津, 匡昉哲, 莊 華, 陸翠杰, 匡 穎(. 上海南方模式生物科技發展有限公司, 上海00;. 上海南方模式生物研究中心, 上海00;. 同濟大學 生命科學與技術學院, 上海 0009)
Prss37 基因轉錄起始位點的確定及其轉錄調控的初步探討
王津津1, 匡昉哲2, 莊華1, 陸翠杰3, 匡穎2
(1. 上海南方模式生物科技發展有限公司, 上海201203;2. 上海南方模式生物研究中心, 上海201203;3. 同濟大學 生命科學與技術學院, 上海 200092)
目的確定Prss37基因的轉錄起始位點,并利用轉基因技術在整體水平驗證該啟動子的組織特異性。方法運用cDNA 5’末端快速擴增法(5’RACE)對C57BL/6J小鼠睪丸mRNA進行分析,確定Prss37的轉錄起始位點; 構建Prss37內源啟動子區域轉錄起始位點上游不同長度DNA片段(1 kb、2 kb、4 kb)驅動的熒光素酶基因表達的質粒;通過受精卵雄原核顯微注射技術獲得上述三種啟動子驅動熒光素酶基因表達的轉基因小鼠;利用活體成像技術觀察熒光素酶基因的表達,明確啟動子的組織特異性。結果Prss37基因的轉錄起始位點位于NCBI GeneBankTM (NM_026317.2)報道序列上游的40 bp處; 成功獲得三種轉基因小鼠,其中1 kb啟動子驅動的轉基因小鼠檢測到熒光素酶基因的表達,且在腦、睪丸和附睪組織中的表達較強。結論明確Prss37的轉錄起始位點,成功獲得了睪丸和附睪表達熒光素酶基因的轉基因小鼠,為進一步的Prss37基因轉錄調控研究奠定了基礎。
Prss37基因; 轉錄; 轉基因小鼠; 熒光素酶基因
哺乳動物的受精是一個連續的、多步驟的過程,射出的精子需要在雌性生殖道內獲能,并完成從子宮到輸卵管的遷移,與位于輸卵管壺腹部的卵子相遇,實現精卵結合,進而通過頂體反應、皮層反應等過程完成精卵融合[1,2]。
絲氨酸蛋白酶超家族是發現最早,也是最大、最多樣的酶家族之一,其在生物有機體中起著重要而廣泛的生理作用[3],已有證據表明,絲氨酸蛋白酶在受精過程中發揮了重要作用,參與精子獲能、精卵結合等生理過程[4-7]。Prss37是一種胰酶樣絲氨酸蛋白酶,其基因特異性地表達在小鼠的睪丸組織。課題組的研究已證實,Prss37基因純合缺失的精子無法完成從雌鼠子宮向輸卵管壺腹部的遷移,且精子與卵子的識別、結合能力也顯著下降,致使小鼠雄性不育[8]。Prss37蛋白在進化上相對保守, 人和小鼠的同源度高達91%,Prss37基因為人類男性不育診斷和治療方面提供新的方向,也為相關避孕藥物研發提供了新的靶點,通過抑制該蛋白或促進該蛋白的表達,在不影響睪丸發育和精子的情況下達到正常避孕或提高受孕率的效果。
活體動物體內光學成像技術是近年來一種新興的生物發光成像技術[9-11]。利用該技術, 研究人員將報告基因[如熒光素酶(luciferase)或者綠色熒光蛋白等]克隆在特定基因的啟動子序列下游, 利用轉基因小鼠技術導入到小鼠基因組中, 獲得可遺傳的轉基因小鼠品系, 這些小鼠被稱之為報告小鼠(reporter mice),利用體內光學成像技術在不傷害小鼠的情況下,可實時定量地檢測小鼠體內熒光素酶的表達,反映活體中被研究基因轉錄的實時變化和表達位置。Prss37基因的轉錄調控研究至今未見報道, 作者通過cDNA5’末端快速擴增(5’RACE)技術成功明確該基因的轉錄起始位點,構建了不同長度啟動子片段驅動熒光素酶表達的轉基因小鼠,成功獲得了在睪丸和附睪組織中表達熒光素酶基因的小鼠,為進一步的Prss37轉錄調控機制研究提供理論和技術支持。
1 材料與方法
1.1實驗動物
SPF級C57BL/6J、基因工程小鼠等由上海南方模式生物科技發展有限公司繁育生產[SCXK(滬)2014-002]和研發,所有小鼠均飼養于上海南方模式生物研究中心SPF級動物設施[SYXK(滬)2013-0035],實驗動物的使用與管理嚴格遵從國際實驗動物評估與認可管理委員會(AAALAC)的規定,實驗方案得到中心實驗動物使用管理委員會的批準。
1.2質粒和菌株
D-H5α為天根公司產品,pMD18-T載體購自TaKaRa公司, pGL3-basic vector購自Promega公司。
1.3試劑
各種限制性內切酶、T4 DNA連接酶、Taq酶、PCR及RT-PCR相關試劑等均購自Takara公司,蛋白酶K購自Amresco公司。常規化學試劑主要購自Sigma-Aldrich公司、上海國藥集團和生工生物工程(上海)有限公司, 熒光素鉀鹽(Potassium Lucifein)購自Gold Biotechnology公司,Luciferase Assay System購自Promega公司,Trizol試劑購自nvitrogen或Takara公司,SYBR Premix Ex TaqTM試劑盒為Takara公司。
1.4引物
所有引物均采用PrimerSelect 軟件包根據序列資料自行設計,由上海生工生物技術公司合成,引物終濃度均為10 μmol/mL,引物序列如下。
5’RACE引物:
ower1: GGGGGATGTCTACCGGAGCCAGCA;
ower5: CAGCAGAGGCCGGAATCTTCTGCTCAC
載體構建引物:
P1: ACC CTCGAG CTGTCACTGTTTCATCACTCAGATATCATCAC
P2: AAT ACGCGT GACCCAGAAATGAACCCAC-
ACACC
P3: TAG ACGCGT ACCGTTGCTGTGCTTCC-TCTA
P4: CTG ACGCGT GCAGTAAATGGGAGCAAAGAACTTCAC
小鼠基因型鑒定引物:
Pre40: GTGATGATATCTGAGTGATGAAACAGTG;Plower: GTCACATCTCATCTACCTCCCGG;
小鼠Luciferase表達檢測引物:
Luciferase-F: GCCAAAAGCACTCTGATTGAC
Luciferase-R: CCATATCCTTGCCTGATACCTG
RT-PCR所用引物:
Actb F: TACCCAGGCATTGCTG-ACAGG
Actb R:ACTTGCGGTGCACGATGGA
Prss37 R: CCTGCCACCTTCAA-CCACAA-3
Prss37 R: GGCTGCTTCCTTGTT-GAGT-3
1.55’ cDNA末端快速克隆(5’RACE)
小鼠睪丸組織總RNA用Trizol法抽提,利用紫外分光光度計測定并計算A260/A280比值。根據已知小鼠Prss37的基因組序列采用PrimerSelect軟件設計2條用于5’RACE的基因特異性引物(lower1和lower5),這種方法能最大程度保證完整的釣取Prss37基因的5’端序列及其可能的剪接變異體。實驗采用Clontech公司的SMARTer RACE cDNA Amplification試劑盒進行,之后用膠回收試劑盒回收5’RACE擴增產物,與pMD18-T載體連接,用DH5α感受態進行轉化,涂板,之后挑取克隆并將篩選為陽性的克隆進行測序。運用DNA測序和生物信息學分析等方法,將小鼠Prss37基因轉錄起始位點與Ensembl數據庫(http://www.ensembl.org/ index.html)中已公布數據的進行比較。
1.6小鼠Prss37啟動子不同長度片段載體的構建
運用生物信息學分析,在經實驗確認的轉錄起始位點之后第一個ATG之前,分別用引物P2和P1、P3和P1以及P4和P1,以C57BL/6J成年雄鼠睪丸組織的cDNA為模板,用PrimeSTAR高保真酶進行PCR擴增,分別獲得長度約4 kb、2 kb 和1 kb的PCR產物,這些產物通過T4連接酶分別連接到pMD18-T的載體上,之后將連接產物轉化DH5α感受態,挑取克隆,抽質粒,并將所得到的質粒進行序列分析,將序列結果正確的質粒經Mlu I及Xho I雙酶切,定向克隆到pGL3-Basic載體上,構建含有Prss37啟動子序列和熒光素酶報告基因的重組質粒。
1.7轉基因小鼠的制備
通過Not I和Sal I雙酶切以獲得線性化的轉基因質粒,質量分數1%瓊脂糖凝膠電泳,凝膠回收純化包含Prss37啟動子驅動的熒光素酶表達所需原件的片段,受精卵雄原核顯微注射建立了轉基因小鼠,受精卵供體為C57BL/6J小鼠。
1.8轉基因小鼠的繁育及基因型鑒定
各轉基因小鼠品系的繁殖始終維持在C57BL/6J背景。小鼠出生后,剪鼠尾進行裂解及基因型鑒定,在轉基因小鼠的基因組上分別設計5’端啟動子區域的Pre40及3’端熒光素酶基因區域的plower引物以進行PCR鑒定。其反應條件為:95 ℃變性4 min, 95 ℃ 30 s變性、60 ℃ 30 s退火以及72 ℃30 s延伸,擴增34個循環后,72 ℃ 10 min。對PCR產物進行瓊脂糖凝膠電泳,陽性小鼠應能擴增出612 bp大小條帶,對照小鼠應沒有條帶出現。
1.9轉基因小鼠RNA水平表達分析
不同組織的總RNA采用Trizol法(Invitrogen, Carlsbad, CA)抽提,步驟按說明書操作。所有RNA均用DNA酶處理。mRNA表達水平利用半定量和熒光定量PCR進行研究。β-actin用作內參。熒光定量PCR使用SYBR Premix Ex TaqTM試劑盒(Takara, 大連, 中國), 在Eppendorf的Mastercycler系統上操作。反應條件設置為: 94 ℃ 30 s,60 ℃20 s,72 ℃ 20 s,運行40 個循環,每個樣品做三個復孔。目標產物與非特異擴增產物的區分通過熔解曲線分析實現。熒光素酶基因的表達水平根據β-actin的含量進行標準化處理。
1.10熒光素酶蛋白水平表達的檢測
1.10.1活體熒光素酶的化學發光檢測分析采用IVIS(In Vivo Imaging Systems)成像系統(Xenogen),每只待測小鼠腹部剃毛并且腹腔注射150 μL的熒光素鈉鹽(15 mg/mL,以PBS為溶劑)。小鼠用異氟烷/氧氣系統麻醉,熒光素鈉鹽注射12 min后,小鼠被置于成像系統的觀測設備中成像,小鼠在暗盒中成像3 min。圖像的熒光強度使用Living Image software (Xenogen)進行分析。
1.10.2體外熒光素酶活性的檢測小鼠斷頸處死后,取50~100 mg各待檢測組織,加入500 mL的裂解液(Promega)勻漿,4 ℃,12 000 r/min,離心15 min, 取上清即為蛋白樣品。使用 Luciferase Assay System試劑盒(Promega),用化學發光檢測儀Luminometer TD-20/20(Lumat LB9507)檢測熒光強度。組織蛋白濃度采用BCA法測定(Pierce),定量后將測得的熒光數值用蛋白濃度來標準化,得到每毫克蛋白的熒光值。
1.11統計學分析
定量結果(平均值±標準誤差)以圖形方式呈現。觀察到的統計學差異使用One-way ANOVA(方差分析)檢驗。P<0.05為差異有統計學意義。
2 結果
2.15’RACE分析Prss37基因的轉錄起始位點
采用5’RACE技術,成功鑒定了Prss37基因的轉錄起始位點。5’RACE結果顯示Prss37基因轉錄本的起始位點比現有N C B I數據庫中(NM_026317.2)公布的位置向前推移了40 bp, 即現已公布的轉錄起始位點位于實際的+40的位置(圖1)。新發現的轉錄起始位點被設定為新的+1,在以下的研究中涉及到的位置信息均在此基礎上編號。
2.2Prss37啟動子驅動熒光素酶基因表達的小鼠的構建
本實驗室前期研究結果[8]表明,Prss37基因在小鼠睪丸中的精子塑形過程中特異性表達,在其它組織和其它時相均未見其表達。由于沒能找到內源性表達該基因的細胞系,及該基因為精子塑形過程中表達的特點,因此在睪丸原代培養的情況下,不論是表達該基因的精子細胞數目還是轉染效率,均無法在體外篩選該基因啟動子的序列。基于上述情況,并結合以往對啟動子結構的認知,作者分別選取了不同長度的啟動子序列擬構建帶有熒光素酶報告基因的載體,以期獲得轉基因小鼠,并通過所能觀察到的轉基因陽性小鼠體內熒光素酶的時空特異性表達情況來分析Prss37啟動子的具體長度及其可能的機制
PCR結合測序技術獲得大約1 kb、2 kb、4 kb 的Prss37啟動子序列,并將其克隆到pGL3-Basic vector上,構建由Prss37啟動子驅動的熒光素酶(Luciferase)報告基因載體,三種啟動子的轉基因質粒結構圖見圖2。酶切鑒定及DNA測序正確后,用Not I和Sal I進行線性化,將所獲得的DNA片段用于外源基因的受精卵(C57BL/6J背景)雄原核顯微注射,所獲得的小鼠進行PCR檢測,陽性小鼠即為首建鼠。
三種啟動子序列均獲得轉基因陽性鼠(表1)。三種啟動子的轉基因首建鼠的基因型鑒定結果詳見圖3。

圖1 Prss37基因的啟動子序列
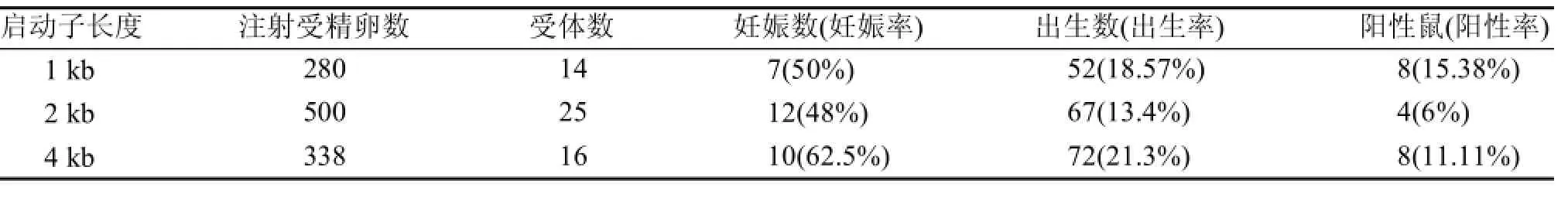
表1 三種轉基因小鼠顯微注射結果
2.3轉基因小鼠的繁育及活體熒光素酶基因表達的檢測
三種轉基因首建鼠與C57BL/6J小鼠交配,經繁育1 kb 啟動子的轉基因小鼠有6只首建鼠成功建系, 后代小鼠經活體成像分析僅49#首建鼠的后代觀察到熒光素酶的表達(圖4A),后續僅對49系小鼠進行繁殖;2 kb 和4 kb 啟動子的轉基因小鼠分別有4只和7只首建鼠成功建系,后代均未檢測到熒光素酶的表達。
在49系首建鼠的傳代過程中,發現16只F1代小鼠中有11只為陽性鼠,明顯高于后代中應有50%陽性鼠的理論值(8只),此現象可能歸因于普通轉基因技術的多位點、多拷貝插入的特點。
取1 kb-49系F2代的小鼠通過小動物活體成像系統進行活體熒光的采集,結果顯示由不同的F1代小鼠繁育出的F2代陽性雄鼠的發光情況并不相同,推測與插入片段的整合位點有關。
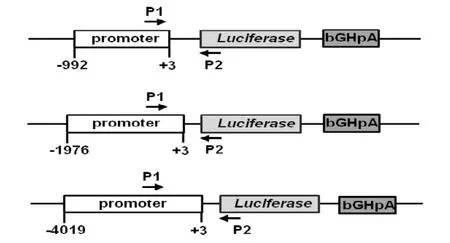
圖2 三種啟動子-熒光素酶轉基因質粒結構圖
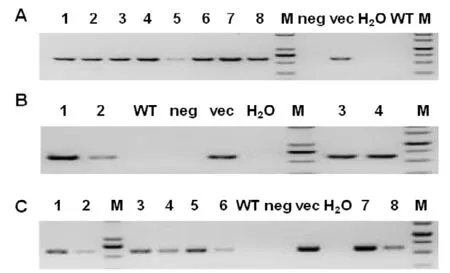
圖3 三種轉基因首建鼠的PCR
2.4轉基因小鼠熒光素酶基因表達的組織特異性為了確定熒光素酶基因的組織表達譜, 取轉基因雄鼠的10個不同組織[腦(Briain)、唾腺(Salivary gland)、胸腺(Thymus)]、心臟(Heart)、肺(Lung)、肝臟(Liver)、脾臟(Spleen)、腎(Kidney)、睪丸(Testis)、附睪(Epididymis)進行RNA的抽提及反轉錄,并通過RT-PCR檢測,結果顯示熒光素酶基因在各檢測組織中皆有一定量的表達, 其中, 腦, 睪丸和附睪組織中高表達(圖4 B)。
同時抽提上述10種組織的蛋白,通過化學發光檢測儀Luminometer TD-20/20 (Lumat LB9507)檢測,顯示熒光素酶基因在轉基因小鼠中的表達譜與RNA水平的相同(圖4 C)。
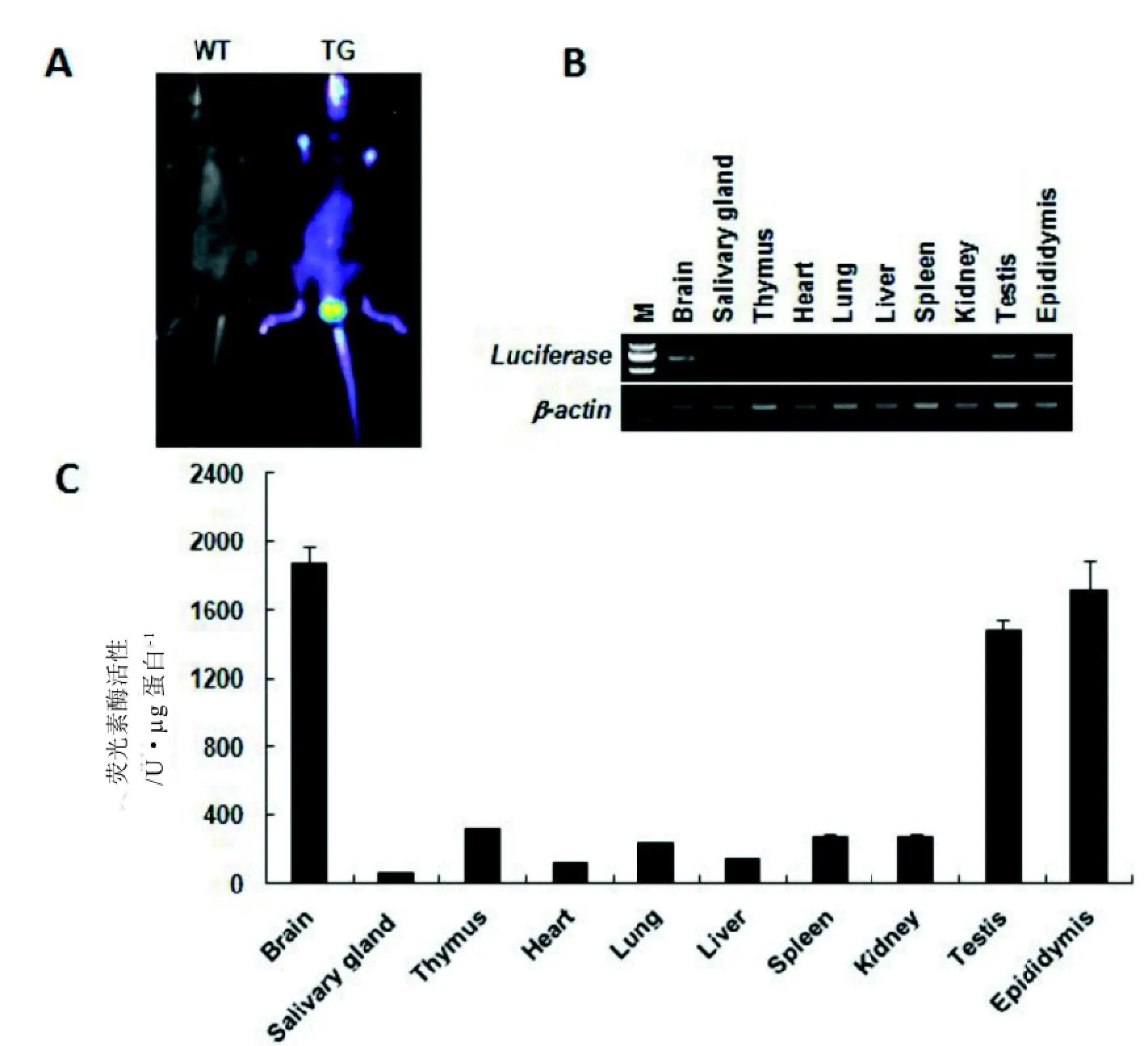
圖4 啟動子-1 kb轉基因鼠熒光素酶基因表達檢測
2.5轉基因小鼠熒光素酶基因表達時空特異性
通過對轉基因鼠睪丸及附睪組織蛋白的體內、體外熒光素酶活性的檢測,表明睪丸組織中熒光素酶從第一周就開始有表達,到第二周之后表達量趨于穩定。而在附睪中則從第二周開始有表達,并逐漸升高, 到第6周最高, 到第八周開始又有所下降圖5)。以上結果提示, 1 kb啟動子可能不是決定Prss37基因組織特異性和時空特異性的關鍵區域。
3 討論
課題組以往的研究證實了Prss37基因的缺失會導致雄性不育,且與精子在輸卵管中的遷移和精卵結合密切相關,并在不明原因男性不育病人的精子中發現了該基因的表達下降(相關內容將在另一篇文章中發表),表明該基因的表達與人類男性不育相關,有臨床應用價值。
小鼠Prss37基因特異性地表達于睪丸組織中,且在小鼠出生后23 d開始轉錄,28 日齡開始可檢測到的蛋白的表達[8],提示Prss37基因的轉錄受到嚴格的調控。課題組通過5’RACE技術確定了該基因的轉錄起始位點,為尋找體外研究該基因的轉錄調控的細胞系, 對兩個小鼠生精細胞系GC-1 spg 和GC-2 spd中該基因的內源性表達進行檢測,均未發現該基因的表達,該基因表達的特殊性致使無法在體外開展啟動子活性的研究。為此,課題組分別選取不同長度(1 kb、2 kb、4 kb)的啟動子序列構建帶有熒光素酶基因的載體,并通過受精卵雄原核顯微注射構建轉基因小鼠,然而在轉基因小鼠的后續繁育及表達檢測過程中僅1 kb啟動子的轉基因小鼠(49系)檢測到熒光素酶基因的表達,但未能實現睪丸特異性表達; 同時在49系小鼠傳代過程中,發現16只F1代小鼠中有11只為轉基因陽性鼠, 明顯高于后代中應有50%陽性鼠的理論值(8只), 且在F2代轉基因陽性小鼠中也有熒光素酶基因不表達的情況,推測該系小鼠的轉基因片段存在多位點插入的可能, 詳細的分子機制有待進一步研究。現有的研究結果[12]已經證明, 雄原核顯微注射獲得的轉基因小鼠存在外源片段隨機整合、多拷貝串聯、多位點整合的可能性,位置效應直接影響外源基因的表達,故上述實驗結果并不能說明所獲得的啟動子序列不能實現外源基因表達的組織和時空特異性,課題組將通過同源重組技術將上述轉基因片段敲入小鼠rosa26基因位點, 進一步驗證啟動子片段的活性。
該研究獲得的轉基因小鼠模型中熒光素酶基因的表達未能完全模擬體內Prss37基因的表達,為此課題組將通過同源重組技術將熒光素酶基因定點插入小鼠Prss37基因啟動子下游,以期獲得治療男性不育藥物和節育藥物篩選的理想動物模型。
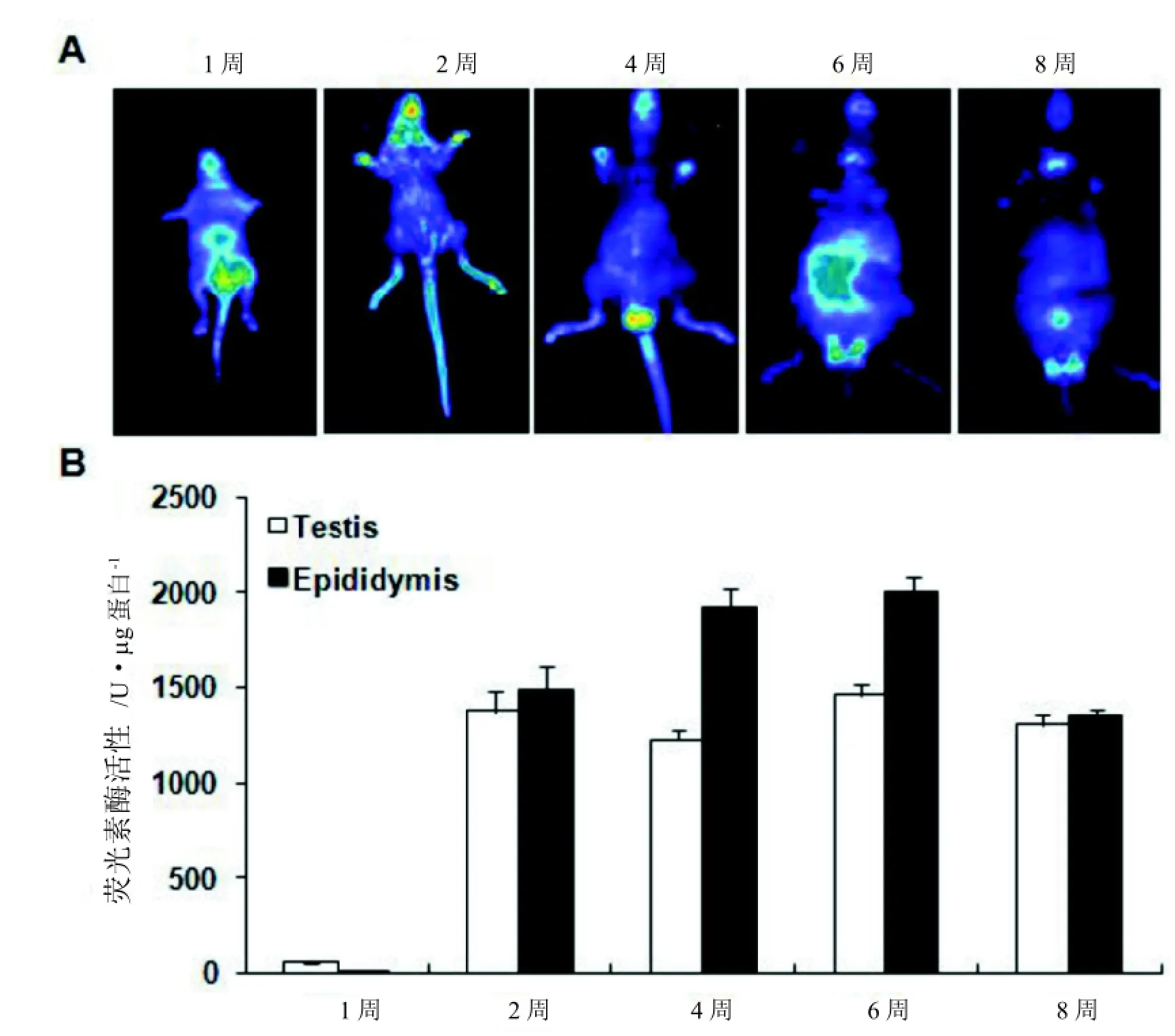
圖5 熒光素酶基因表達時空特異性分析
[1] Ikawa M, Inoue N, Benham AM, et al. Fertilization: A sperm’s journey to and interaction with the oocyte[J]. J Clin Investigat, 2010, 120(4):984-994.
[2] Muro Y, Okabe M.Mechanisms of fertilization-a view from the study of gene-manipulated mice[J]. J Androl, 2011, 32(3):218-225.
[3] Rawlings ND, Barrett AJ.Evolutionary families of peptidases[J]. Biochem, J, 1993, 290(Pt1):205-218.
[4] Kawano N, Kang W, Yamashita M,et al. Mice lacking twosperm serine proteases,ACR and PRSS21,are subfertile,but the mutant sperm are infertile in vitro[J]. Biol Reprod, 2010, 83(3):359-369.
[5] Honda A, Yamagata K, Sugiura S, et al. A mouse serine protease TESP5 is selectively included into lipid rafts of sperm membrane presumably as glycosylphosphatidylinositol-anchored protein[J].J Biol Chem, 2002, 277(19):16976-16984.
[6] Gyamera-Acheampong, C, Tantibhedhyangkul J, Weerachatyanukul W.et al,Sperm from mice genetically deficient for the PCSK4 proteinase exhibit accelerated capacitation, precocious acrosome reaction,reduced binding to egg zona pellucida,and impaired fertilizing ability[J].Biol Reprod, 2006, 74(4):666-673.
[7] Gyamera-Acheampong C, Mbikay M. Proprotein convertase subtilisin/kexin type 4 in mammalian fertility: a review[J]. Hum Reprod Update, 2009, 15(2):237-247.
[8] Shen C, Kuang Y, Liu J, et al. Prss37 is required for male fertility in the mouse[J].Biol Reprod, 2013, 88(5):1-11.
[9] Contag PR, Olomu IN, Stevenson DK, et al.Bioluminescent indicators in living mammals[J]. Nat Med, 1998, 4(2):245-247.
[10] Zhang W, Contag PR, Madan A, et al.Bioluminescence for biological sensing in living mammals[J].Adv Exp Med Biol, 1999, 471:775-784.
[11] Li L, Fei Z, Ren J, et al. Functional imaging of interleukin 1 beta expression in inflammatory process using bioluminescence imaging in transgenic mice[J]. BMC Immunol, 2008, 9:49.
[12] Michalova K, Bucchini D, Ripoche MA, et al.Chromosome localization of the human insulin gene in transgenic mouse lines[J]. Hum Genet, 1988, 80(3):247-252.
Identification of Mouse Prss37 Transcription Initiation Site and Preliminary Analysis of Its Transcription Regulation
WANG Jin-jin1, KUANG Fang-zhe1, ZHUANG Hua1, LU Cui-jie3, KUANG Ying2
(1. Shanghai Biomodel Organism Science & Technology Development Company, Shanghai 201203, China;2. Shanghai Research Center for Biomodel Organisms, Shanghai 201203, China;3. School of Life Science and Technology, Tongji University, Shanghai 200092, China)
ObjectiveTo determine the transcription initiation site of mouse Prss37 gene, and verify the tissue specificity of the promoter in vivo using transgenic technology. MethodsThe transcription initiation site was identified by 5' rapid amplification of cDNA ends (5' RACE ) used to analyze the mRNA of testis from C57BL/6J mice . The plasmids including different lengths of promoter (1kb, 4kb, and 6kb)and luciferase gene were constructed. Then, these plasmids were injected into male pronucleus by microinjection technique to obtain luciferase positive transgenic mice. ResultsThe transcription start site of Prss37 gene was located at the 40bp site upstream of the predicted site reported in GeneBankTM (NM_026317.2). Moreover, three kinds of transgenic mice were successfully established, but the expression of luciferase gene was only detectable in transgenic mice driven by 1kb promoter. The higher expression level of luciferase was found in brain, testis and epididymis tissues. ConclusionThe transgenic mice expressing luciferase in testis and epididymis tissues were successfully established, which laid a foundation for further research on the transcriptional regulation of Prss37 gene.
Prss37 gene; Transcription; Transgenic mice; Luciferase gene
Q95-33
A
1674-5817(2016)02-0093-08
10.3969/j.issn.1674-5817.2016.02.003
2015-12-08
上海市科委項目資助(13140901400, 14140900400, 13DZ2280600)
王津津(1983-), 博士, 女, 助理研究員。E-mail: jinjin.wang@shmo.com.cn
匡穎(1965-), 女, 碩士, 研究員。E-mail: ying.kuang@shmo.com.cn

