Ca2+對酸橙幼苗低溫脅迫下抗逆生理指標的影響△
梁永富,王康才,隋利,薛啟,葉軍,陳興忠
(1.南京農業大學 園藝學院,江蘇 南京 210095;2.泰州市林業技術指導站,江蘇 泰州 225300)
Ca2+對酸橙幼苗低溫脅迫下抗逆生理指標的影響△
梁永富1,王康才,隋利1,薛啟1,葉軍2,陳興忠2
(1.南京農業大學 園藝學院,江蘇 南京 210095;2.泰州市林業技術指導站,江蘇 泰州 225300)
分析Ca(NO3)2對低溫脅迫下酸橙幼苗抗逆生理指標的影響,探討Ca(NO3)2對酸橙幼苗低溫脅迫調控的可行性。該實驗以盆栽酸橙幼苗為材料,葉面噴施5、10、15、20、25mmol·L-1的Ca(NO3)2溶液,置于4℃/0℃(晝/夜),光照為600 μmol·m-2·s-1的人工氣候箱內,以常溫25℃噴施蒸餾水和低溫脅迫下噴施蒸餾水為對照,處理3d后,測定酸橙幼苗POD、SOD和CAT酶活性、可溶性蛋白含量、脯氨酸含量、MDA含量、相對電導率和葉綠素含量。結果表明,低溫脅迫下葉面噴施Ca(NO3)2溶液可提高酸橙幼苗葉片POD、SOD和CAT酶活性,顯著提高可溶性蛋白和脯氨酸等滲透調節物質的含量,降低細胞MDA含量和相對電導率,減緩葉綠素下降的趨勢,提高了葉片光合效率。葉面噴施一定濃度Ca(NO3)2溶液可減輕低溫脅迫對酸橙幼苗葉片的傷害。
Ca(NO3)2;酸橙;低溫脅迫
蕓香科植物酸橙CitrusaurantiumL.是中藥材枳殼的基原植物,也是一種經濟及觀賞價值較高的果樹。枳殼類藥材以枳實之名始載于《神農本草經》[1],具有理氣寬中、行滯消脹的功效,為常用理氣藥。現代醫學研究表明,枳殼粗提物具有抗腫瘤[2]、降血脂[3]等作用。酸橙主要分布于浙江、貴州、江西、四川、江蘇等長江以南各省[4],現市場上流通的酸橙類枳殼主產于江西、浙江和四川等地。枳殼依產地分為川枳殼、湘枳殼、江枳殼、蘇枳殼、溫枳殼五類[5]。蘇枳殼主產于江蘇,曾經有一定產量,現在在市場上基本消失。為了讓蘇枳殼重新形成產量,江蘇泰州對酸橙進行引種,但在引種的過程中發現,酸橙葉片受冬季低溫的影響,會出現枯黃掉落的現象,低溫還影響了初春時節酸橙的花芽分化,導致枳殼類藥材產量下降。因此,如何減輕低溫對酸橙造成的傷害,增強酸橙對低溫脅迫的抗逆性,對提高枳殼類藥材產量具有重要意義。
Ca2+作為細胞信號傳導過程中的第二信使,在植物細胞膜感受到寒冷脅迫信號后,能夠將信號快速傳遞到胞內,并引起胞內相應的生理化學反應,減輕低溫對植物的傷害[6-8]。研究表明,噴施外源Ca2+可以提高植物的抗逆性,增強植物對低溫環境的適應性[9-11]。CaCl2作為Ca2+的常用鈣鹽,其在低溫環境下對植物抗寒性的提高已得到了證實[12],但酸橙是中度耐鹽植物,Cl-對其會造成陰離子傷害[13-15]。Ca(NO3)2可以代替CaCl2處理柑橘類植物,提高其抗寒性[16-17]。本文根據酸橙栽培過程中遇到的實際問題,研究低溫脅迫下,葉面噴施不同濃度Ca(NO3)2對酸橙幼苗葉片生理生化特性的影響,包括細胞膜透性、膜脂過氧化產物丙二醛含量和滲透物質含量等,以探討Ca(NO3)2與酸橙幼苗抗寒能力的關系,以期為酸橙栽培技術的改進提供依據。
1 材料
供試材料由湖南程錦農業科技開發有限公司提供,經南京農業大學中藥材科學系王康才教授鑒定為蕓香科植物酸橙CitrusaurantiumL.
2 方法
2.1 實驗設計
試驗于2015年9月至11月在南京農業大學溫室內進行。于2015年9月1日選取生長基本一致、無病蟲害、高10 cm左右的酸橙幼苗進行盆栽,盆高16 cm×直徑14 cm的塑膠盆中。栽培基質是蛭石:營養土為2∶1的混合物,基質體積約為花盆體積的80%,每盆4株。常規水肥管理,每5 d澆水一次,每次澆水量為150 mL,緩苗1個月后進行外源Ca2+和低溫脅迫處理。選用Ca(NO3)2代替Ca2+處理酸橙幼苗,Ca(NO3)2設計5,10,15,20,25 mmol·L-15個濃度。于2015年10月1日至3日18∶00對酸橙進行葉面噴施,以葉面的正反面浸潤、向下滴液為度,每處理4盆。連續噴施3 d,第3 d噴施生長調節劑2h后,將幼苗連同塑膠盆放入人工氣候箱(QHX-800L人工氣候箱,金壇市良友儀器有限公司)中進行低溫脅迫處理,溫度為4 ℃/0 ℃(晝/夜),光照為600 μmol·m-2·s-1,同時設置2組對照,對照CK1為置于溫度為25 ℃/23 ℃(晝/夜),噴施蒸餾水;CK2為低溫脅迫,噴施蒸餾水。低溫處理3 d后,于2015年10月3日取出苗木在室溫下恢復24 h后進行相關生理指標測定。
2.2 相關生理指標
測定可溶性蛋白含量測定采用Bradford考馬斯亮藍G-250染色法;脯氨酸含量測定采用茚三酮法;丙二醛(MDA)含量測定采用硫代巴比妥酸(TBA)法;超氧化物歧化酶(SOD)和過氧化氫酶(CAT)活性測定分別采用氮藍四唑(NBT)法和高錳酸鉀滴定法;過氧化物酶(POD)活性測定采用愈創木酚法;葉綠素含量采用乙醇提取分光光度法;相對電導率采用電導儀法[18]。
2.3 數據統計與分析
采用Excel 2010和統計軟件SPSS 20.0進行統計分析,LSD法檢驗差異顯著性。
3 結果與分析
3.1 Ca(NO3)2對低溫脅迫下酸橙幼苗葉片MDA含量和相對電導率的影響
由圖1可知,與常溫對照CK1相比,低溫脅迫下,酸橙幼苗葉片的MDA含量均顯著升高,說明細胞膜遭到不同程度低溫傷害。而與低溫脅迫對照CK2相比,葉面噴施濃度為5,10,15,20和25 mmol·L-1的Ca(NO3)2溶液均顯著降低了葉片MDA含量,分別降低了11.35%、16.47%、28.38%、62.43%、35.41%。其中,以濃度為20 mmol·L-1的Ca(NO3)2噴施效果最好,與CK2相比,差異極顯著。
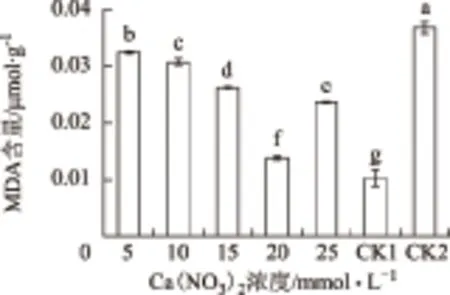
圖1-1 Ca(NO3)2對低溫脅迫下酸橙幼苗MDA含量的影響

圖1-2 Ca(NO3)2對低溫脅迫下酸橙幼苗相對電導率的影響
從表1可以看出,與常溫對照CK1相比,CK2的相對電導率顯著升高了124.23%,說明低溫脅迫破壞了酸橙幼苗葉片細胞膜系統的結構與功能,致使相對電導率急劇上升。葉面噴施不同濃度的Ca(NO3)2后,與CK2相比,均出現不同程度的降低了相對電導率,且相對電導率隨著Ca(NO3)2濃度的升高而出現呈先升高后降低的趨勢。在Ca(NO3)2濃度為20 mmol·L-1時,噴施效果最好,相對電導率較CK2降低45.02%。
3.2 Ca(NO3)2對低溫脅迫下酸橙幼苗葉片SOD、POD、CAT活性的影響
由表1可知,經低溫脅迫處理后,CK2酸橙幼苗葉片的POD、SOD酶活性較CK1明顯降低,分別降低33.17%和13.51%,說明低溫脅迫顯著抑制了酸橙幼苗葉片的抗氧化酶活性。與CK2相比,葉面噴施不同濃度的Ca(NO3)2溶液,均能顯著提高酸橙幼苗葉片POD、SOD、CAT的酶活性。其中以20mmol·L-1的Ca(NO3)2溶液葉面噴施的效果最好,POD、SOD、CAT的酶活性增加率最大,與CK2相比,分別增加了76.95%,16.65%,30.00%。
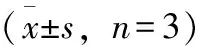
表1 生長調節劑對低溫脅迫下酸橙幼苗葉片抗氧化酶活性的影響
注:同一列不同小寫字母表示顯著差異,P<0.05(表2同)
3.3 Ca(NO3)2對低溫脅迫下酸橙幼苗葉片脯氨酸和可溶性蛋白含量的影響
可溶性蛋白是植物體內重要的滲透調節物質,參與植物的滲透調節過程,低溫脅迫下其含量的多少反映了植物對逆境的適應能力。由圖2-1可知,低溫脅迫下,CK2可溶性蛋白含量明顯高于CK1,較CK1提高15.98%,說明低溫脅迫下,酸橙可以自發產生某種機制,積累可溶性蛋白,以適應低溫環境。與CK2相比,葉面噴施Ca(NO3)2溶液可以進一步提高酸橙幼苗葉片可溶性蛋白含量,且可溶性蛋白含量隨著Ca(NO3)2濃度的升高而呈現先升高后降低的趨勢。相對于低溫處理CK2來說,葉面噴施20 mmol·L-1的Ca(NO3)2效果最好,可溶性蛋白含量增加了68.86%。
脯氨酸也是植物體內重要的調節物質之一,當植物受到環境脅迫時,植物體內的脯氨酸含量就會迅速增加,以減輕環境脅迫對植物造成的傷害,所以脯氨酸的含量在一定程度上反映了植物的抗逆性。由圖2-2可以看出,經過低溫脅迫處理后,CK2脯氨酸含量較CK1增加了16.11%,說明酸橙幼苗對低溫傷害有一定的抵抗力。與CK2相比,葉面噴施10,15,20,25 mmol·L-1的Ca(NO3)2溶液均顯著顯著提高植物體內脯氨酸含量,分別提高9.90%、15.93%、39.45%、27.07%。其中,以20 mmol·L-1的Ca(NO3)2的噴施效果最好。
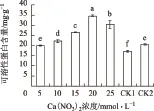
圖2-1 Ca(NO3)2對低溫脅迫下酸橙幼苗可溶性蛋白含量的影響

圖2-2 Ca(NO3)2對低溫脅迫下酸橙幼苗脯氨酸含量的影響
3.4 Ca(NO3)2對低溫脅迫下酸橙幼苗葉片葉綠素含量的影響
由表2可知,經低溫處理后,CK2酸橙幼苗光合色素均明顯下降,葉片中葉綠素a、葉綠素b、類胡蘿卜素和葉綠素總量較CK1分別下降了18.39%、18.78%、26.46%、18.46%,均達顯著水平。經不同濃度的Ca(NO3)2處理的酸橙幼苗葉片,相對于低溫處理CK2來說,光合色素含量均明顯提高,其中以20 mmol·L-1的Ca(NO3)2的處理效果最好,顯著減緩了酸橙幼苗光合色素下降的趨勢。葉片中葉綠素a,葉綠素b,類胡蘿卜素和葉綠素總量較CK2分別提高了22.39%、21.54%、36.30%、27.47%。
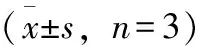
表2 生長調節劑對低溫脅迫下酸橙幼苗葉片葉綠素含量的影響
4 討論
4.1 Ca2+對酸橙幼苗滲透調節物質的調節作用
低溫傷害是環境脅迫之一,限制了植物的生長。農林業生產中常因低溫傷害而導致農作物大幅減產,使生產者蒙受巨大損失。在受到低溫脅迫時,植物感受外界環境的低溫信號后,通過自身的低溫信號轉導系統調控植物的生理生化代謝途徑,合成有關物質,以減輕低溫傷害[19]。脯氨酸和可溶性蛋白是植物體內重要的滲透調節物質,可以增加植物細胞質濃度,降低細胞滲透勢和冰點,防止細胞脫水和胞內結冰,從而減輕植物的低溫傷害[20]。本研究發現,經過3 d的低溫脅迫處理,與CK1相比,CK2酸橙幼苗葉片中可溶性蛋白和脯氨酸含量均顯著提高,說明低溫對酸橙幼苗造成了傷害,觸發了酸橙幼苗的抗冷機制,促使酸橙主動積累可溶性蛋白和脯氨酸,降低細胞滲透勢,緩減了酸橙幼苗因低溫而導致的細胞失水,一定程度上解輕了酸橙幼苗的低溫傷害[19-20]。本實驗研究表明,低溫脅迫下,與CK2相比,葉面噴施一定濃度的Ca2+溶液,可進一步提高酸橙幼苗葉片可溶性蛋白和脯氨酸含量,有效減輕了低溫傷害。這可能是因為Ca2+是第二信使,能夠傳導低溫信息而促進植物抗寒基因的表達[21-24],進而促進植物合成可溶性蛋白和脯氨酸,增加植物抵御低溫的能力,這與李國新[25],耿廣東[26]等的研究相一致。
4.2 Ca2+對酸橙幼苗抗氧化酶和細胞膜的調節作用
SOP、SOD和CAT是植物體內抗氧化酶,能夠快速清除植物體內活性氧(ROS)。正常生長條件下植物體內ROS的產生與其清除系統會保持動態平衡,體內ROS水平低,不會引起細胞膜系統的氧化傷害[27]。本研究發現,在低溫脅迫下,與CK1相比,CK2酸橙幼苗葉片中MDA含量和相對電導率顯著上升,可能的原因是低溫抑制了POD和SOD抗氧化酶活性,致使細胞內ROS的清除機制遭到破壞,導致細胞內ROS含量上升,當ROS的積累超過一定閾值時,就會發生膜脂過氧化,細胞膜的完整性遭到破壞,細胞膜系統的半透性逐步喪失,依賴于膜系統的代謝系統發生紊亂[27],致使細胞內電解質外流,MDA含量和相對電導率顯著上升。與CK2相比,葉面噴施濃度為20 mmol·L-1的Ca(NO3)2溶液可以提高POD、SOD和CAT抗氧化酶活性,降低MDA含量和相對電導率。一方面可能是因為Ca2+能夠穩定細胞壁、細胞膜和膜蛋白,使細胞膜的代謝系統趨于正常[11],另一方面Ca2+是低溫信號轉導重要的第二信使,通過與細胞內鈣調素(CaM)等鈣離子感應器結合,改變不同蛋白質的磷酸化狀態,引發各種細胞反應,如合成各種抗氧化酶等生物大分子,從而提高了抗氧化酶活性,加快了細胞內活性氧的清除,增強了植物適應低溫環境的能力[21-24]。
4.3 Ca2+對酸橙幼苗葉綠素的調節作用
光合色素是綠色植物進行光合作用的物質基礎,光合色素含量的多少一定程度上決定了綠色植物對光的轉化效率能的高低。本研究發現,低溫脅迫下,與常溫對照CK1相比,CK2酸橙幼苗葉片中葉綠素和類胡蘿卜素含量顯著下降,一方面可能是低溫抑制了光合色素合成酶的活性,致使光合色素的合成受阻;另一方面,低溫導致光抑制現象的發生,產生的活性氧破壞了葉綠體雙層膜和內囊體結構,導致光合色素的分解[28-29]。此外,低溫引起的植物代謝緩慢可能會導致合成光合色素的原料減少,造成葉綠素含量的減少[30]。與CK2相比,葉面噴施Ca(NO3)2溶液可提高葉片中光合色素的含量。究其原因,可能是因為Ca2+能夠穩定葉綠體雙層膜及內囊體結構,同時誘導了光合色素合成酶和抗寒基因的表達,從而使光合色素含量提高。這與邵怡若[31]等的研究相一致。
綜上所述,葉面噴施一定濃度的Ca(NO3)2溶液能夠提高酸橙幼苗葉片POD、SOD和CAT酶活性,顯著提高可溶性蛋白和脯氨酸等滲透調節物質的含量,降低細胞中MDA含量和相對電導率,減緩葉綠素下降的趨勢,并最終提高低溫脅迫下酸橙幼苗的抗逆性。用Ca(NO3)2溶液處理酸橙幼苗適宜的適宜濃度為20 mmol·L-1。
[1] 中國科學院藥物研究所.中藥志:第三冊[M].北京:人民衛生出版社,1984:42,48.
[2] Sato T,Koike L,Miyata Y,et al.Inhibition of activatorprotein-1 binding activity and phosphatidylinositol 3-Kinase pathway by nobiletin,apolymethoxy flavonoid,results in augmentation of tissue inhibitor ofmetalloproteinases-1 production and suppression ofproduction of matrixmetalloproteinases-1 and-9 in humanfibrosarcoma HT-1080 Cells[J].Cancer Res,2002,62(4):1025-1029.
[3] 周燕文,時雪峰.柚皮苷對實驗性2 型糖尿病大鼠的作用研究[J].中國藥師,2012,15(4):471-474.
[4] 宋立人,洪恂,丁緒亮,等.現代中藥學大辭典[M].北京:人民衛生出版社,2001.
[5] 蔡逸平,陳有根,范崔生.中藥枳殼、枳實類原植物調查及商品藥材的鑒定[J].中國中藥雜志,1999,24(5):259-262.
[6] 陳立松,劉星輝.果樹逆境生理[M].北京:中國農業出版社,2003.
[7] 利容千,王建波.植物逆境細胞及生物學[M].武漢:武漢大學出版社,2002.
[8] Medvedev S S.Calcium signaling system in plants[J].Russian Journal of Plant Physiology,2005,52:249-270.
[9] Gao H B,Chen G L,Han L H,et al.Calcium influence on chilling resistance of grafting eggplant seedlings[J].Journal of Plant Nutrition,2004,27:1327-1339.
[10] 蔣廷惠,占新華,徐陽春,等.鈣對植物抗逆能力的影響及其生態學意義[J].西北植物學報,2005,16(5):971-976.
[11] 康國章,陶均,孫谷濤,等.H2O2和Ca2+對低溫脅迫香蕉幼苗抗冷性的影響[J].園藝學報,2002,29(2):119-122.
[12] Lin S Z,Zhang Z Y,Lin Y Z,et al.The role of calcium and calmodulin in freezing-induced freezing resistance of Populustomentosa cuttings[J].Journal of Plant Physiology and Molecular Biology,2004,38:59-68.
[13] Mass E V.Salinity and citriculture[J].Tree Physiology,1993,12(2):195-216.
[14] 陳竹生,聶華堂,計玉,等.柑桔種質的耐鹽性鑒定[J].園藝學報,1992,19(4):289-295.
[15] Storey R,Walker R R.Citrus and salinity[J].ScientiaHorticulturae,1999,78(4):39-81.
[16] Lin S Z,Zhang Z Y.Role of CaCl2in cold acclimation-induced freezing resistance of Populustomentosa cuttings[J].Forestry Studies in China,2002,4:38-42.
[17] Bar Y,Apelbaum A,Kafkafi U,et al.Ethylene association with chloride stress in citrus plants[J].Scientia Horticulturae,1998,73:99-109.
[18] 李合生.植物生理生化實驗原理和技術[M].北京:高等教育出版社,2000:134-263.
[19] 吳鳳章,王賀新,徐國輝,等.木本植物低溫脅迫生理及分子機制研究進展[J].林業科學,2015,51(7):116-128.
[20] 劉文英.植物逆境與基因[M].北京理工大學出版社,2015:41-76.
[21] Kingston-Smith A H,Foyer C H.Bundle-sheath proteins are more sensitive to oxidative damage than those of the mesophyll in maizeleaves exposed to paraquat or low temperatures[J].Journal of Experimental Botany,2000,51(342):123-130.
[22] Reddy V S,Reddy A S.Proteomics of calcium-signaling components in plants[J].Phytochemistry,2004,65(12):1745-1776.
[23] Sathyanarayanan P V,Poovaiah B W.Decoding Ca2+signals inplants[J].Critical Reviews in Plant Sciences,2004,23(1):1-11.
[24] Yang T,Poovaiah B W.Calcium/calmodulin-mediated signal network in plants[J].Trends in Plant Science,2003,8(10):505-512.
[25] 李國新,曾斌,楊曉紅,等.不同鈣鹽對溫州蜜柑抗凍性的影響[J].應用生態學報,2008,19(8):1665-1669.
[26] 耿廣東,程智慧,張素勤.外源Ca2+對茄子幼苗抗寒性的影響[J].西南農業大學學報:自然科學版2006,28(3):432-435
[27] Liu W Y,Yu K M,He T F,et al.The low-temperature induced physiological responses ofAvenanudaL.,a cold tolerant plant species[J].The Scientific World Journal,2013,658-793.
[28] Wang Y,Yang H F,Li S D.Studies on chilling injury and cold hardiness of horticultural crops:a literature review[J].Acta Horticulturae Sinica,1994,21(3):239-244.
[29] Liang L H,Mei X,Lin F,et al.Effect of low temperature stress on tissue structure and physiological index of cashew young leaves[J].Ecology and Environmental Sciences,2009,18(l):317-320.
[30] Wang C G,Wang X,Cang J,et al.Effect of low temperature stress on cold resistance ability of rice seedlings[J].Journal of Northeast Agricultural University,2004,35(2):205-207.
[31] 邵怡若,徐建新,薛立,等.低溫脅迫時間對4種幼苗生理生化及光合特性的影響[J].生態學報,2013,33(14):4237-4247.
EffectsofExogenousCa(NO3)2onPhysiologicalofCitrusaurantiumunderLowTemperatureStress
LIANG Yongfu1,WANGKangcai1*,SUILi1,XUEQi1,YEJun2,CHENXinzhong2
(1.CollegeofHorticulture,NanjingAgriculturalUniversity,Nanjing210095,China;2.ForestrytechnicalguidanceStationofTaizhou,Taizhou225300,China)
In order to reveal feasibility of the regulation of Ca(NO3)2onCitrusaurantiumunder low temperaturestress,the effects of Ca(NO3)2on physiological index were studied.Pot culturedCitrusaurantiumleaves under the same outdoor conditions were sprayed with 5,10,15,20,25mmol·L-1Ca(NO3)2separately,and then placed in the low incubator[0℃/4℃(day/night),light intensity 600 μmol·m-2·s-1],and sprayed with distilled water at 25 ℃ and under low temperature stress were set as the control.The related relative conductivity,contents of proline,malondialdehyde,soluble protein,chlorophyll,activities of SOD,POD and CAT,were measured.The results showed that the exogenous Ca(NO3)2enhanced the activities of SOD and POD,the contentsofproline and soluble protein,and effectively reduces the damage of heat stress on cell membrane.At the sametime,the exogenous Ca(NO3)2increases the contents of chlorophyll,the efficiency of leaf photosynthesis.In conclusion,the foliage spraying Ca(NO3)2could reduce the damage of low temperature stress onCitrusaurantiumleaves.
Ca(NO3)2;Citrusaurantiumseedlings;low temperature stress
2016-03-25)
江蘇省林業三新工程項目(LYSX[2014]48)
*
王康才,教授,研究方向:藥用植物栽培與生理;E-mail:wangkc@njau.edu.cn
10.13313/j.issn.1673-4890.2016.12.022

