人參化學(xué)成分的藥物代謝動(dòng)力學(xué)研究△
楊秀偉
(北京大學(xué) 天然藥物及仿生藥物國(guó)家重點(diǎn)實(shí)驗(yàn)室,北京大學(xué) 藥學(xué)院 天然藥物學(xué)系,北京 100191)
人參化學(xué)成分的藥物代謝動(dòng)力學(xué)研究△
楊秀偉*
(北京大學(xué) 天然藥物及仿生藥物國(guó)家重點(diǎn)實(shí)驗(yàn)室,北京大學(xué) 藥學(xué)院 天然藥物學(xué)系,北京100191)
人參廣泛的治療和保健作用已有許多研究,其主要有效成分人參皂苷調(diào)節(jié)多種生理活動(dòng)。生物和環(huán)境因素可能影響人參皂苷的功效。人參皂苷的藥代動(dòng)力學(xué)和代謝研究結(jié)果證明:①人參皂苷在胃腸道的吸收性隨分子結(jié)構(gòu)中糖基化程度不同而不同;②在人源腸Caco-2細(xì)胞單層模型,多糖基化原形人參皂苷的膜滲透性差是限制其口服吸收不良的主要原因;③人參皂苷在被吸收進(jìn)入循環(huán)系統(tǒng)之前,主要被代謝為相應(yīng)的次皂苷和/或皂苷元;④某些人參皂苷在腸道內(nèi)由腸內(nèi)細(xì)菌所致生物轉(zhuǎn)化產(chǎn)生的生物活性中間體和/或終末產(chǎn)物,能夠反映它們的生物活化作用,提示人參皂苷很可能是前藥;⑤原形人參皂苷及其脫糖基代謝產(chǎn)物從體內(nèi)清除。本文概述了人參皂苷生物轉(zhuǎn)化和/或代謝以及藥代動(dòng)力學(xué)的最新研究進(jìn)展,為明確人參的藥效物質(zhì)基礎(chǔ)提供了循證科學(xué)依據(jù)。
人參;人參皂苷;藥物代謝動(dòng)力學(xué)
傳統(tǒng)中藥人參PanaxginsengC.A.Meyer系馳名中外的大補(bǔ)要藥,除“獨(dú)參湯”、人參皂苷-Rg3(商品名如“參百益Ginsenbesty”)外,以根和根莖、莖葉、果實(shí)等為原料的中成藥或保健品均有問世,用于各種目的的應(yīng)用。由于人參含有多樣性的化學(xué)成分[1-3],決定了其具有多樣性的生物學(xué)活性和藥理學(xué)作用[4],后者又與人參化學(xué)成分的藥物代謝動(dòng)力學(xué)(pharmacokinetics,簡(jiǎn)稱為藥動(dòng)學(xué);PK),即其體內(nèi)過程,包括吸收(absorption)、分布(distribution)、代謝(metabolism)、排泄(excretion)、毒性(toxicity)(簡(jiǎn)稱為ADMET)等密切相關(guān),研究人參化學(xué)成分的ADMET性質(zhì)成為現(xiàn)代科學(xué)“循證”人參價(jià)值的策略之一,其能夠在分子水平上提供人參生物學(xué)活性和藥理學(xué)作用的信息。伴隨人參化學(xué)成分研究的不斷深入及其動(dòng)物、人體內(nèi)人參化學(xué)分子及生物轉(zhuǎn)化和/或代謝產(chǎn)物分析技術(shù)的不斷進(jìn)步,人參PK研究取得了許多進(jìn)展,及時(shí)總結(jié)這些成果或信息,有利于人參研究的集約化健康發(fā)展。本文不但總結(jié)直接來源于人參的化學(xué)成分的PK,而且包括那些來源于三七Panaxnotoginseng(Burk.)F.H.Chen和西洋參PanaxquinquefoliumL.、且在人參中含有的化學(xué)物質(zhì)的PK。
1 腸內(nèi)生物轉(zhuǎn)化
人參皂苷(G)-Rb1是人參皂苷中的主要成分之一,亦是20(S)-原人參二醇[20(S)-protopanaxadiol;20(S)-PPD]型皂苷的典型代表,因此,不但研究的比較早,而且研究的比較深入。給無菌大鼠(germfree rat)灌胃G-Rb1[5],在腸道和盲腸中檢測(cè)不到人參皂苷化合物K(G-CK)。給藥后7h,G-Rb1在腸道和糞便中的累積回收率為90%以上;給藥后15h的累積回收率為70%以上;給小鼠和普通大鼠灌胃G-Rb1或人口服G-Rb1,血漿中檢測(cè)不到G-Rb1。但是,如果給無菌大鼠在腸道內(nèi)定植真桿菌(Eubacterium)sp.A-44獲得悉生大鼠(gnotobiotic rat)再灌胃給予G-Rb1,給藥后7h在腸道和累積糞便中可檢測(cè)到大量的G-Rb1和G-CK;給藥后15h僅檢出相當(dāng)量的轉(zhuǎn)化產(chǎn)物G-CK和少量的轉(zhuǎn)化產(chǎn)物G-Rd,而無原形G-Rb1。同時(shí),在悉生大鼠血漿中可檢測(cè)到G-CK。此證明腸內(nèi)細(xì)菌具有轉(zhuǎn)化G-Rb1的能力。將大鼠分為林可霉素(lincomycin)按4.8、0.12g·kg-1兩個(gè)劑量處理組和無處理對(duì)照組[6],取處理組大鼠0、6、12、24、48h的糞便懸浮液與G-Rb1共溫孵培養(yǎng),在0.12g·kg-1劑量處理組檢測(cè)到G-Rd和G-F2,但在4.8g·kg-1劑量處理組僅檢測(cè)到G-Rd,提示林可霉素改變了大鼠腸內(nèi)菌叢構(gòu)成,對(duì)G-Rb1的轉(zhuǎn)化程度不同。將G-Rb1與青年人的新鮮糞便共溫孵培養(yǎng)[7],G-Rb1迅速被轉(zhuǎn)化,至培養(yǎng)的8h內(nèi)已完全轉(zhuǎn)化,轉(zhuǎn)化產(chǎn)物有G-Rd、G-CK和G-F2;至24h內(nèi),G-Rd消失,可檢出20(S)-PPD;至48h后,僅能檢出G-CK和20(S)-PPD,兩者的摩爾比為1∶1,由此總結(jié)G-Rb1的轉(zhuǎn)化過程為G-Rb1→G-Rd→G-F2→G-CK→20(S)-PPD。以1~60歲年齡段的58人的糞便為腸內(nèi)細(xì)菌來源進(jìn)行G-Rb1的轉(zhuǎn)化研究,發(fā)現(xiàn)男性和女性的腸內(nèi)細(xì)菌轉(zhuǎn)化產(chǎn)生G-CK的能力基本相同,而以30~39歲的轉(zhuǎn)化率最高。Shen等[8]分析了健康志愿受試者腸道轉(zhuǎn)化G-Rb1的途徑。將G-Rb1與腸內(nèi)菌叢共溫孵培養(yǎng),轉(zhuǎn)化產(chǎn)生G-Rd、F2、CK和絞股藍(lán)皂苷(GY)XVII、LXXV等5個(gè)轉(zhuǎn)化產(chǎn)物,G-Rb1→GY-XVII→GY-LXXV→G-CK轉(zhuǎn)化途徑迅速,為中間體過程,產(chǎn)物量少;G-Rb1經(jīng)過GY-XVII→G-F2(主要產(chǎn)物)→GY-LXXV(微量產(chǎn)物)過程產(chǎn)生G-CK,G-Rd和GY途徑存在年齡、性別上的個(gè)體差異。G-Rb1表現(xiàn)為在強(qiáng)酸條件下不穩(wěn)定,在模擬胃液條件下迅速轉(zhuǎn)化為G-F2、Rg3、Rh2和CK,但沒有產(chǎn)生GY-XVII和LXXV,提示G-Rb1轉(zhuǎn)化為GY-XVII和LXXV有賴于消化道細(xì)菌介導(dǎo)的酶促反應(yīng)。文獻(xiàn)[5-6]報(bào)道了β-D-葡萄糖苷酶在腸內(nèi)菌轉(zhuǎn)化G-Rb1上的作用。Bae等[9]報(bào)道真桿菌(Eubacteriumsp.)、鏈球菌(Streptococcussp.)和雙歧桿菌(Bifidobacteriumsp.)水解龍膽二糖(gentiobiose)的能力比水解槐糖(sophorose)的能力強(qiáng),經(jīng)過G-Rd中間體轉(zhuǎn)化G-Rb1為G-CK;梭桿菌(Fusobacterium)K-60水解槐糖的能力比水解龍膽二糖的能力強(qiáng),經(jīng)過GY-XVII中間體轉(zhuǎn)化G-Rb1為G-CK。將G-Rb1與大鼠盲腸內(nèi)容物共溫孵培養(yǎng)[10],至培養(yǎng)的0.5h可檢測(cè)到轉(zhuǎn)化產(chǎn)物GY-XVII,G-Rd、F2和CK,主要轉(zhuǎn)化產(chǎn)物為G-Rd,至培養(yǎng)6h的主要轉(zhuǎn)化產(chǎn)物為G-CK;在大鼠大腸,亦能檢測(cè)到這4個(gè)轉(zhuǎn)化產(chǎn)物。Akao等篩選了29種人腸內(nèi)細(xì)菌對(duì)G-Rb1的轉(zhuǎn)化,其中僅有真桿菌sp.A-44有轉(zhuǎn)化G-Rb1的能力,G-Rd和CK的產(chǎn)率分別為16.8%和70.3%;亦有報(bào)道口腔普菌(Prevotellaoris)是轉(zhuǎn)化G-Rb1的腸內(nèi)活性菌之一[11-12]。G-Rb1的腸內(nèi)菌生物轉(zhuǎn)化途徑如圖1。
將G-Rb2與大鼠盲腸內(nèi)容物一起溫孵培養(yǎng),亦可檢測(cè)到轉(zhuǎn)化產(chǎn)物G-Rd、F2和CK等,至共溫孵培養(yǎng)6h的主要轉(zhuǎn)化產(chǎn)物為G-CK[10]。真桿菌、鏈球菌和雙歧桿菌經(jīng)過G-Rd中間體轉(zhuǎn)化G-Rb2為G-CK[9]。G-Rb1與G-Rb2在大鼠腸內(nèi)容物中亦可轉(zhuǎn)化產(chǎn)生少量的C-25過氧化物[10]。
人腸內(nèi)細(xì)菌可轉(zhuǎn)化G-Rc為20-O-[α-L-呋喃阿拉伯糖基-(1→6)-β-D-吡喃葡萄糖基]-20(S)-原人參二醇和G-CK[13]。Bae等報(bào)道[14],人腸內(nèi)細(xì)菌可轉(zhuǎn)化G-Rc產(chǎn)生G-Rd、F2、CK、Mb、Mc和20(S)-PPD,所有受試人糞便菌叢皆能轉(zhuǎn)化G-Rc為G-CK和20(S)-PPD,后者為主要轉(zhuǎn)化產(chǎn)物。人糞便中的擬桿菌(Bacteroidessp.)、真桿菌和雙歧桿菌轉(zhuǎn)化能力較強(qiáng),雙歧桿菌K-103和真桿菌A-44經(jīng)過G-Rd中間過程轉(zhuǎn)化G-Rc為G-CK;擬桿菌HJ-15和雙歧桿菌K-506經(jīng)過G-Mb中間過程轉(zhuǎn)化G-Rc為G-CK。
人腸內(nèi)細(xì)菌口腔普菌可將G-Rd轉(zhuǎn)化為3個(gè)產(chǎn)物,其中之一為G-CK[11-12]。從上述G-Rb1和Rb2的腸內(nèi)菌轉(zhuǎn)化產(chǎn)物中間體G-Rd亦可繼續(xù)轉(zhuǎn)化為相應(yīng)的轉(zhuǎn)化產(chǎn)物。
人腸內(nèi)菌叢可將20(S)-G-Rg3轉(zhuǎn)化為20(S)-G-Rh2[15-16]和20(S)-PPD[16],主要轉(zhuǎn)化產(chǎn)物為20(S)-G-Rh2[16]。20(S)-G-Rg3迅速轉(zhuǎn)化為20(S)-G-Rh2和20(S)-PPD,其轉(zhuǎn)化速率是20(R)-G-Rg3轉(zhuǎn)化為20(R)-G-Rh2和20(R)-PPD的19倍。從腸內(nèi)菌叢中分離出的擬桿菌、真桿菌和雙歧桿菌經(jīng)過G-Rh2中間體轉(zhuǎn)化G-Rg3為PPD,但梭桿菌僅能將G-Rg3轉(zhuǎn)化為G-Rh2。生曬參和水參中不含G-Rg3,原人參二醇型皂苷轉(zhuǎn)化為G-Rg3,在較大程度上依賴于環(huán)境條件。在60℃酸性條件下,原人參二醇型皂苷轉(zhuǎn)化為G-Rg3和Δ20-G-Rg3;在中性條件下,G-Rb1、Rb2、Rc不能轉(zhuǎn)化為這些產(chǎn)物;在酸性條件下的轉(zhuǎn)化隨著溫孵時(shí)間和溫度的增加而增加,最適轉(zhuǎn)化溫度為60℃、溫孵5h。人腸內(nèi)菌叢可轉(zhuǎn)化G-Rg3和Δ20-G-Rg3為G-Rh2和Δ20-G-Rh2,其中的擬桿菌、雙歧桿菌和梭桿菌轉(zhuǎn)化G-Rg3為G-Rh2的能力較強(qiáng)[17]。
G-Rb1、Rb2、Rc、Rd、Rg3皆為原人參二醇型皂苷,其在腸內(nèi)的轉(zhuǎn)化程度依賴于酶的有無和活力[6]。因此,有研究者[18]對(duì)轉(zhuǎn)化酶進(jìn)行了篩選,以期獲得高產(chǎn)率的轉(zhuǎn)化產(chǎn)物。從米曲霉(Aspergillusoryzae)獲得的粗乳糖酶(lactase)、β-半乳糖苷酶(β-galactosidase)、從綠色木霉(Trichodermaviride)獲得的纖維素酶(cellulase)等能分別水解原人參二醇型皂苷高產(chǎn)G-F2、CK和Rd;從青霉(Penicilliumsp.)獲得的乳糖酶能水解原人參二醇型皂苷產(chǎn)生主要產(chǎn)物G-Rd和G-Rg3、CK。
從已有的研究結(jié)果,判斷腸內(nèi)細(xì)菌所致上述原人參二醇型皂苷的轉(zhuǎn)化是一個(gè)對(duì)原形化合物的“激活”過程,如對(duì)腫瘤細(xì)胞的細(xì)胞毒活性,G-CK>20(S)-G-Rh2≥20(S)-G-Rg3>G-Rb1>Rb2[15];對(duì)腫瘤L1210、P388、A549、Me180細(xì)胞株的細(xì)胞毒活性,20(S)-PPD>20(S)-G-Rh2>20(S)-G-Rg3>G-Rb1,在同樣的條件下,20(R)-PPD、20(R)-G-Rh2、20(R)-G-Rg3和G-Rb1沒有顯示出細(xì)胞毒活性;對(duì)大鼠胃H+/K+ATPase活性,20(S)-G-Rh2和20(S)-G-Rg3都顯示出抑制作用,而原形化合物G-Rb1沒有顯示出抑制作用[16];對(duì)于幽門螺桿菌(Helicobacterpylori)生長(zhǎng),無論是20(R)-PPD還是20(S)-PPD都顯示出生長(zhǎng)抑制活性[16-17]。G-Rc的轉(zhuǎn)化產(chǎn)物G-CK、Mc和20(S)-PPD對(duì)腫瘤L1210和P388細(xì)胞株皆有明顯的細(xì)胞毒活性,G-CK和Mc還有抗過敏和抗炎活性,原形化合物G-Rc沒有顯示活性[14]。G-Rh2亦顯示出抗過敏活性[19]。
G-Re是人參皂苷中的主要成分之一,亦是20(S)-原人參三醇[20(S)-protopanaxatriol;20(S)-PPT]型皂苷的典型代表,不但研究的比較早,而且研究的比較深入。人腸內(nèi)細(xì)菌可轉(zhuǎn)化G-Re產(chǎn)生G-Rg1、Rg2、Rh1、F1和20(S)-PPT[20]。將G-Re與人腸內(nèi)菌叢溫孵培養(yǎng)3h,仍以原形狀態(tài)存在;至培養(yǎng)6、9、12h,出現(xiàn)轉(zhuǎn)化產(chǎn)物G-Rg1;至培養(yǎng)24h,G-Re和G-Rg1消失佚盡,僅能檢出轉(zhuǎn)化產(chǎn)物20(S)-PPT[13]。當(dāng)將G-Re與從人腸內(nèi)細(xì)菌叢中分離得到的一株菌株口腔普菌共溫孵培養(yǎng)時(shí),產(chǎn)生3個(gè)轉(zhuǎn)化產(chǎn)物,推測(cè)其中的2個(gè)轉(zhuǎn)化產(chǎn)物是G-Re的氧化轉(zhuǎn)化產(chǎn)物。轉(zhuǎn)化產(chǎn)物中未發(fā)現(xiàn)20(S)-PPT,但可檢出G-Rg1[11]。此外,人腸內(nèi)細(xì)菌叢中的雙歧桿菌K-103轉(zhuǎn)化G-Re為G-Rg1;雙歧桿菌K-525和擬桿菌HJ15轉(zhuǎn)化G-Re為G-Rg1和Rh1;擬桿菌JY6轉(zhuǎn)化G-Re為G-Rg1、Rh1、F1和20(S)-PPT;梭桿菌K-60轉(zhuǎn)化G-Re為G-Rg1、Rh1和F1[20]。雙歧桿菌Int57和SJ32經(jīng)過G-Rg2中間體將G-Re轉(zhuǎn)化為G-Rh1;黑曲霉(Aspergillusniger)經(jīng)過G-Rg1中間體將G-Re轉(zhuǎn)化為G-Rh1;宇佐美曲霉(Aspergillususamii)轉(zhuǎn)化G-Re為G-Rg2[21]。
人腸內(nèi)細(xì)菌轉(zhuǎn)化G-Rg1較難,轉(zhuǎn)化反應(yīng)發(fā)生的時(shí)間較長(zhǎng),可將其轉(zhuǎn)化為G-Rh1、G-F1和20(S)-PPT。將G-Rg1與人腸內(nèi)細(xì)菌溫孵培養(yǎng),至培養(yǎng)的24h以后原形化合物顯著減少,至培養(yǎng)的48h完全消失,但24h后出現(xiàn)轉(zhuǎn)化產(chǎn)物G-Rh1,至培養(yǎng)的48h達(dá)最大,以后緩慢下降。至培養(yǎng)的48h,20(S)-PPT開始出現(xiàn)并逐漸增加。大約有20%的G-Rg1轉(zhuǎn)化為20(S)-PPT。另有研究證明,當(dāng)將G-Rg1與人腸內(nèi)細(xì)菌溫孵培養(yǎng)3h,即有少量的G-Rh1和20(S)-PPT產(chǎn)生,絕大部分的G-Rg1沒有被轉(zhuǎn)化;溫孵培養(yǎng)6h,已檢測(cè)不出原形化合物和G-Rg1,有少量的G-F1,絕大部分是20(S)-PPT;而在12、24h,僅能檢出20(S)-PPT[7,11,13,22]。腸內(nèi)菌中的口腔普菌不能水解G-Rg1[12]。這些轉(zhuǎn)化上的差異是由于不同來源的人腸內(nèi)細(xì)菌組成不同造成的還是由于代謝條件不同造成的,有待深入研究,闡明其緣由是十分有意義的。如果是腸內(nèi)細(xì)菌組成不同,以轉(zhuǎn)化結(jié)果為先導(dǎo),可能尋找到轉(zhuǎn)化活性特異或轉(zhuǎn)化活性更高的人腸內(nèi)細(xì)菌。
將20(S)-G-Rg2與大鼠胃液溫孵,可檢出轉(zhuǎn)化產(chǎn)物20(S)-G-Rh1、20(S)-PPT和24H-25-羥基-20(S)-G-Rg2。將它們?cè)倥c大鼠腸液溫孵培養(yǎng),每個(gè)又可產(chǎn)生兩個(gè)轉(zhuǎn)化產(chǎn)物[23]。20(S)-G-Rh1在人腸內(nèi)菌叢溫孵培養(yǎng)體系中可轉(zhuǎn)化為20(S)-PPT[20]。
絕大部分的人參皂苷的生物轉(zhuǎn)化研究主要圍繞單體化合物進(jìn)行,Wang等[24]報(bào)道了紅參提取物的人腸內(nèi)菌叢轉(zhuǎn)化,鑒定出30個(gè)轉(zhuǎn)化產(chǎn)物,主要是脫糖基產(chǎn)物,并首次發(fā)現(xiàn)了人參皂苷的乳酸酯轉(zhuǎn)化產(chǎn)物。
2 腸吸收、生物利用度
2.1人源腸Caco-2細(xì)胞單層及其他模型
人源腸Caco-2細(xì)胞單層模型,已用來評(píng)價(jià)藥物的吸收特性。G-Ra3在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的表觀滲透系數(shù)(Papp)值在10-7~10-8數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收不良[25]。
G-Rb1在Caco-2模型中,攝取和轉(zhuǎn)運(yùn)沒有發(fā)生飽和現(xiàn)象,從頂端(AP)到底端(BL)的轉(zhuǎn)運(yùn)隨濃度增加而呈線性增加,提示其過膜轉(zhuǎn)運(yùn)為被動(dòng)擴(kuò)散;轉(zhuǎn)運(yùn)的Papp值為(5.90±1.02)×10-8cm·s-1(C0=1 mg·mL-1),吸收過程不受細(xì)胞膜內(nèi)P-糖蛋白(P-gp)和多藥耐藥相關(guān)蛋白(MRP)外排載體的調(diào)控,在Caco-2細(xì)胞的細(xì)胞攝取量為(0.77±0.03)μg·mg-1蛋白(C0=1 mg·mL-1),提示其經(jīng)腸道吸收較差;胃液的酸性環(huán)境、大腸菌叢產(chǎn)生的酶及肝臟的首過作用皆對(duì)其口服吸收產(chǎn)生影響,但腸道黏膜的透過性低是其口服吸收差的主要影響因素[26-27]。總皂苷中的G-Rb1與單體G-Rb1給藥相比,在Caco-2細(xì)胞模型中的吸收特性無明顯差異,提示其他成分對(duì)G-Rb1的吸收特性無明顯影響[27]。用糖尿病大鼠血清溫孵Caco-2細(xì)胞單層,可促進(jìn)細(xì)胞間通透性,導(dǎo)致G-Rb1吸收性增加[28]。
G-Rb2在Caco-2細(xì)胞單層模型中,雙向轉(zhuǎn)運(yùn)的Papp值在10-6~10-7數(shù)量級(jí),表明其經(jīng)腸道吸收較差;Papp(BL→AP)/Papp(AP→BL)為9.63,表明外排大于吸收,提示可能有外排轉(zhuǎn)運(yùn)蛋白參與G-Rb2的轉(zhuǎn)運(yùn)過程[29]。
G-Rb3在Caco-2細(xì)胞單層模型中,雙向轉(zhuǎn)運(yùn)的Papp值在10-6數(shù)量級(jí),表明其在腸道具有中等程度的吸收;Papp(BL→AP)/Papp(AP→BL)為1.86,表明外排大于吸收,提示可能有外排轉(zhuǎn)運(yùn)蛋白參與G-Rb3的轉(zhuǎn)運(yùn)過程[30]。受這兩個(gè)因素影響,G-Rb3可能表現(xiàn)為吸收性不良。
G-Rc和G-Rd在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-6~10-7數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收中等或不良[25]。
G-Rg3在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-7~10-8數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收不良[25]。G-Rg3的攝取是時(shí)間及濃度依賴性的,其被動(dòng)轉(zhuǎn)運(yùn)系數(shù)Kd為0.07 nmol·h-1·mg-1·port-1,最大攝取速率Vmax為3.32 nmol·h-1·mg-1·port-1,Km為16.31 μmol·L-1;在加入代謝抑制劑疊氮化鈉及2,4-二硝基苯酚時(shí)攝取速率明顯降低[31]。提示其攝取轉(zhuǎn)運(yùn)可能消耗能量。
G-Rh2在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-6~10-7數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收中等或不良[25];其吸收具有時(shí)間、pH值和濃度依賴性,在4 ℃時(shí)符合一級(jí)速率方程,在37 ℃、pH 7.4時(shí)符合二級(jí)速率方程,代謝抑制劑和低溫會(huì)使其吸收速率降低,當(dāng)細(xì)胞外pH 7.0時(shí)G-Rh2達(dá)到最大吸收,動(dòng)力學(xué)分析表明它可能是P-gp的1個(gè)底物[32]。Gu等[33]探討了G-Rh2吸收不良的原因。Caco-2細(xì)胞單層模型中,在4 ℃,G-Rh2在1~50 μmol·L-1的吸收轉(zhuǎn)運(yùn)是線性的,但在37 ℃、濃度超過10 μmol·L-1出現(xiàn)飽和現(xiàn)象;在37 ℃、濃度為10 μmol·L-1時(shí),前60 min的吸收轉(zhuǎn)運(yùn)是線性的;240 min,20(S)-G-Rh2和20(R)-G-Rh2分別為2 173.70和979.38 ng·min·μg-1;轉(zhuǎn)運(yùn)的Papp值在10-7~10-8數(shù)量級(jí),外流率在1.5以上。在腸灌流模型,至灌注的3 h,20(S)-G-Rh2和20(R)-G-Rh2的吸收分?jǐn)?shù)分別為15.7%和9.1%。載體轉(zhuǎn)運(yùn)是G-Rh2的主要吸收機(jī)制,它是ABC轉(zhuǎn)運(yùn)體(ATP Binding cassettee transporters)的基質(zhì)。ABC轉(zhuǎn)運(yùn)體介導(dǎo)的外流和難過膜性,是G-Rh2吸收不良的主要原因。在立體異構(gòu)體上,20(R)-G-Rh2的吸收性低于20(S)-G-Rh2差向異構(gòu)體[33]。顧軼等[34]研究了20(R)-G-Rh2的大鼠腸吸收動(dòng)力學(xué),給藥后的十二指腸、空腸、回腸和結(jié)腸腸袢的曲線下面積(AUC)0→6h分別為(207±88)、(301±49)、(157±93)、(172±68)ng·mL-1·h-1,吸收速率常數(shù)Ka分別為(3.9±0.4)、(1.6±0.4)、(1.9±0.8)、(1.1±0.9)·h-1,達(dá)峰時(shí)間tmax分別為(0.44±0.13)、(1.75±0.50)、(1.13±0.63)和(2.00±1.41)h,達(dá)峰濃度分別為(82±17)、(110±11)、(36±8)和(43±7)ng·mL-1,說明20(R)-G-Rh2腸道吸收困難,十二指腸和空腸是它吸收的主要部位。
G-F2在Caco-2細(xì)胞單層模型,從AP→BL轉(zhuǎn)運(yùn)的Papp值在10-6~10-7數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收中等或不良;從BL→AP轉(zhuǎn)運(yùn)的Papp值在10-5~10-6數(shù)量級(jí)[25]。
以上是原人參二醇型皂苷的吸收研究,某些該類型皂苷在腸內(nèi)轉(zhuǎn)化為G-CK和PPD。G-CK和PPD在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-5~10-6數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收良好[25],G-CK的吸收轉(zhuǎn)運(yùn)呈線性濃度依賴性,其機(jī)制為被動(dòng)擴(kuò)散[35]。值得注意的是如G-Rb1、Rb2本身對(duì)P-gp無抑制作用,但其腸內(nèi)菌轉(zhuǎn)化產(chǎn)物G-CK[36-37]和PPD[36]是P-gp的抑制劑,與P-gp基質(zhì)藥物聯(lián)合口服用藥可能存在藥物相互作用的風(fēng)險(xiǎn),需慎重。另一方面,與P-gp抑制劑合用,能增加人參皂苷的吸收。如在L-MDR1細(xì)胞模型,G-Rb1、Rb2、Rc、Rd、Rg3的外流率大于3.5,與P-gp抑制劑五味子木脂素合用,能明顯降低它們的外流率和提高它們的攝取率[38]。
G-Re是人參中原人參三醇型皂苷的代表性成分之一,在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-6~10-7數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收中等或不良[25]。
G-Rf和20-葡萄糖基-G-Rf在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-7~10-8數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收不良,但G-Rf要好于20-葡萄糖基-G-Rf[25]。
G-Rg1、G-Rg2和三七皂苷R1(NG-R1)在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-6~10-7數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收中等或不良[25]。另有報(bào)道[27],G-Rg1在胃液酸性環(huán)境下易被破壞,在近中性環(huán)境內(nèi)基本保持穩(wěn)定,大腸內(nèi)容物中易降解,在小腸內(nèi)容物中相對(duì)穩(wěn)定。在Caco-2細(xì)胞單層的攝取受溫度的影響,但pH的變化及環(huán)孢菌素A的加入對(duì)其攝取均無顯著性影響;攝取和轉(zhuǎn)運(yùn)沒有發(fā)生飽和現(xiàn)象,從AP到BL的轉(zhuǎn)運(yùn)隨濃度增加而呈線性增加,提示其過膜轉(zhuǎn)運(yùn)為被動(dòng)擴(kuò)散;轉(zhuǎn)運(yùn)的Papp值為(2.59±0.17)×10-7cm·s-1(C0=1 mg·mL-1),吸收過程不受細(xì)胞膜內(nèi)P-gp和MRP外排載體的調(diào)控,在Caco-2細(xì)胞的細(xì)胞攝取量為(1.07±0.16)μg·mg-1蛋白(C0=1 mg·mL-1),提示其經(jīng)腸道吸收較差;胃液的酸性環(huán)境、大腸菌叢產(chǎn)生的酶及肝臟的首過作用皆對(duì)其口服吸收產(chǎn)生影響,但腸道黏膜的透過性低是其口服吸收差的主要影響因素。總皂苷中的G-Rg1與單體G-Rg1給藥相比,在Caco-2細(xì)胞模型中的吸收特性無明顯差異,提示總皂苷中的其他成分對(duì)G-Rg1的吸收特性無明顯影響。李昊等[39]應(yīng)用不同腸段的腸管外翻囊模型亦研究了P-gp抑制劑對(duì)G-Rg1的吸收影響,發(fā)現(xiàn)在回腸和空腸中G-Rg1的吸收良好,且無明顯差異,P-gp抑制劑維拉帕米對(duì)G-Rg1的吸收沒有顯著影響,提示G-Rg1可能不是P-gp的底物。
G-Rh1在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-6~10-7數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收中等或不良[25]。G-F1在Caco-2細(xì)胞單層模型,從AP→BL轉(zhuǎn)運(yùn)的Papp值在10-6~10-7數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收中等或不良;從BL→AP轉(zhuǎn)運(yùn)的Papp值在10-5~10-6數(shù)量級(jí)[25]。
原人參三醇型皂苷的體內(nèi)生物轉(zhuǎn)化產(chǎn)物PPT在Caco-2細(xì)胞單層模型雙向轉(zhuǎn)運(yùn)的Papp值在10-5~10-6數(shù)量級(jí),預(yù)測(cè)其經(jīng)腸道吸收良好[25]。
值得注意的是,某些原人參三醇型皂苷如G-Re本身對(duì)P-gp無抑制作用,但其腸內(nèi)菌轉(zhuǎn)化產(chǎn)物PPT是P-gp的抑制劑,與P-gp基質(zhì)藥物聯(lián)合口服用藥可能存在藥物相互作用的風(fēng)險(xiǎn),需慎重[36]。另一方面,與P-gp抑制劑合用,能增加人參皂苷的吸收。如在L-MDR1細(xì)胞模型,與P-gp抑制劑五味子木脂素合用,能明顯提高G-Rg2的攝取率[38]。
2.2在體實(shí)驗(yàn)
將G-Rb1給大鼠灌胃、十二指腸和門靜脈注射相對(duì)于尾靜脈注射的絕對(duì)生物利用度分別為0.64%、2.46%、59.49%,與胃和肝消除相比,存在明顯的腸首過作用[26]。給糖尿病大鼠和正常大鼠及高脂飼喂大鼠灌胃G-Rb1,生物利用度分別為2.25%、0.90%和0.78%,此可能與G-Rb1能促進(jìn)糖尿病大鼠腸細(xì)胞間通透性有關(guān)[27]。按200mg·kg-1劑量灌胃給予大鼠G-Rb1,給藥后7h或15h,在無菌大鼠血漿中既檢測(cè)不到G-CK,亦檢測(cè)不到其他的代謝產(chǎn)物,給予的G-Rb1大部分從腸道和累積糞便,特別是從盲腸中回收,證明其吸收性差;在無菌大鼠腸道定植真桿菌sp.A-44獲得的單菌悉生大鼠,在血漿中可檢測(cè)到相當(dāng)量的G-CK,亦發(fā)現(xiàn)在盲腸和累積糞便中,給藥后7h,在盲腸內(nèi)容物中僅檢測(cè)到少量的原形化合物G-Rb1。說明盡管G-Rb1腸道吸收性差,但它的腸內(nèi)菌轉(zhuǎn)化產(chǎn)物G-CK在腸道較下部分被吸收[5]。按5、10、20mg·kg-1劑量給大鼠灌胃G-CK,24h內(nèi)在全部胃腸道中的原形G-CK回收率分別為54.3%、81.7%、77.5%,絕對(duì)生物利用度分別為1.8%、4.3%、35.0%,與低劑量相比,20mg·kg-1時(shí)的單位劑量AUC增加,絕對(duì)口服生物利用度也增加了[35]。但如果將G-CK在肝內(nèi)形成的脂肪酸酯化物(G-CK-EM1)[40]計(jì)算在內(nèi),其生物利用度還要高。按每小鼠2mg的劑量灌胃G-Rb1后24h,在血清中未檢測(cè)到原形化合物;給藥后8h,血清中G-CK-M1達(dá)峰值(8.5±0.4)μg·mL-1,而直接給予G-CK-M1后2h,血清中G-CK-M1達(dá)峰值(10.3±1.0)μg·mL-1[40]。志愿受試者口服人參粉12g,服用后2h在血漿中即可檢測(cè)到G-CK,其最高吸收發(fā)生在給藥后9~14h,某些受試者甚至在給藥后24h在血漿中仍可檢測(cè)到G-CK[41]。
志愿受試者口服人參提取物或給大鼠灌胃人參總皂苷,在血漿中可檢測(cè)到代謝產(chǎn)物G-CK、3-O-二去葡萄糖基G-Rb2(3-O-dideglucosylginsenoside Rb2)、G-C-Mc(ginsenoside C-Mc)和20(S)-PPT[13],提示某些人參皂苷以代謝產(chǎn)物的形式吸收入血。
給大鼠灌胃三七提取物,G-Rb1的生物利用度為4.35%[42];灌胃三七總皂苷,G-Rb1的生物利用度為1.18%[43]。G-Rd在犬的口服生物利用度為0.26%[44];給大鼠灌胃三七總皂苷,G-Rd的絕對(duì)生物利用度為2.36%[43]。G-Rg3在大鼠的口服生物利用度為2.63%[45]。G-Rh2在大鼠和犬的口服生物利用度分別為5%和16%[46]。G-Re在小鼠的口服絕對(duì)生物利用度為0.19~0.28%;在相對(duì)于純G-Re等劑量給藥,人參漿果提取物中的G-Re在小鼠的口服絕對(duì)生物利用度為0.33~0.75%[47],提示人參漿果提取物中的其他成分有促進(jìn)G-Re吸收的作用。給大鼠灌胃三七總皂苷,G-Re的絕對(duì)生物利用度為7.06%[43]。
G-Rg1在大鼠的口服生物利用度為1.33%[48]。給大鼠灌胃三七提取物,G-Rg1的生物利用度為18.40%[42];灌胃三七總皂苷,G-Rg1的絕對(duì)生物利用度為6.06%[43]。
按10mg·kg-1劑量給大鼠灌胃G-Rg2,在血漿中檢測(cè)不到原形化合物[49]。G-Rh1在大鼠的口服絕對(duì)生物利用度為(1.01±0.03)%[50],生物利用度較低。給大鼠灌胃三七總皂苷,NG-R1的絕對(duì)生物利用度為9.29%[43]。
將三七總皂苷給大鼠灌胃、十二指腸和門靜脈注射相對(duì)于尾靜脈注射的絕對(duì)生物利用度分別為3.29%、6.60%、50.56%,與胃和肝消除相比,存在明顯的腸首過作用[27]。
20(R)-達(dá)瑪烷-3β,12β,20,25-四醇[20(R)-dammarane-3β,12β,20,25-tetrol]在大鼠的絕對(duì)生物利用度為(64.8±14.3)%[51]。
PPD型人參皂苷(G-Ra3、Rb1、Rd、Rg3、Rh2)和PPT型人參皂苷(G-Rg1、Re、Rh1和NG-R1)的口服生物利用度一般小于5%,PPT型人參皂苷有稍好的生物利用度可能是因?yàn)槠浣到獗萈PD型人參皂苷慢[52]。
中藥配伍應(yīng)用可提高人參皂苷的生物利用度,如“生脈散”中的五味子木脂素能提高人參皂苷(如G-Rb1、Rb2、Rc、Rd、Rg2、Rg3等)的體內(nèi)暴露量[38]。
傳統(tǒng)上認(rèn)為人參皂苷的吸收性差,生物利用度低。但如果考慮到人參皂苷的腸內(nèi)細(xì)菌所致生物轉(zhuǎn)化產(chǎn)物的吸收,如生物活性物質(zhì)G-CK的吸收,則人參皂苷的吸收并非很差,則會(huì)得到不同的結(jié)論。
3 分布
有關(guān)人參皂苷體內(nèi)分布的研究相對(duì)較少。在大鼠或小鼠,按20、50、150mg·kg-1劑量血管內(nèi)給予G-Rd,小鼠在給藥后0.5~72h,大鼠在給藥后0.5~48h,在心、肝、脾、肺、腎、胃、腸、睪丸、子宮、腦、肌肉和脂肪組織等均可檢測(cè)到G-Rd,其中以肺中分布量最高[53]。
給小鼠靜脈注射G-CK后15min,在肝臟和小腸上部分布大量的G-CK,肺和膀胱較少,腎臟很難檢測(cè)到,說明G-CK存在腸肝循環(huán)。按25mg·kg-1劑量給小鼠靜脈注射G-CK后40min,G-CK的分布仍以肝臟和小腸為最高,血液和肺及腎臟最低,占給藥劑量的50%。按25mg·kg-1劑量給小鼠一次靜脈注射G-CK,肝臟中最高G-CK濃度出現(xiàn)在給藥后10min,占給藥劑量的65%。口服給予G-CK,依次通過胃、小腸、盲腸和結(jié)腸,其在胃腸道的分布量與G-CK的移行密切相關(guān);口服給藥后2h在肝臟中達(dá)最高,占給藥量的8%,然后緩慢降低,說明G-CK自小腸吸收,聚積在肝臟[54]。
BST204是一個(gè)純化的人參干燥提取物,含有高濃度的G-Rh2和Rg3差向異構(gòu)體混合物[20(S)-G-Rh2、20(R)-G-Rh2、20(S)-G-Rg3、20(R)-G-Rg3],已用于癌癥患者。按2g·kg-1劑量給大鼠灌胃BST204后120、240min,在脂肪組織、心、腎、肝、肺、肌肉、脾、胃、腸系膜、大腸和小腸皆可檢測(cè)到20(S)-G-Rh2和20(S)-G-Rg3,小腸中分布量最高,其次為胃、腸系膜、肝和大腸,在腦組織中沒有檢測(cè)到20(S)-G-Rh2,但可檢測(cè)到20(S)-G-Rg3;相同組織分布的20(S)-G-Rh2和20(S)-G-Rg3的量有所差異。可能由于20(R)-G-Rh2和20(R)-G-Rg3的吸收性差,在這些組織中皆沒有檢測(cè)到,此與血漿中的現(xiàn)象擬合良好[55]。
給大鼠靜脈注射20(R)-G-Rg3,其在肝中分布最高,腦中分布最低;小腸壁、胃壁、肺、腎、脾中分布較高,心、脂肪、肌肉、卵巢、睪丸中的分布較低;在大鼠體內(nèi)消除較快,其在各主要組織中的分布在給藥后8h均顯著降低[56]。
給家兔眼涂抹20(S)-G-Rg3眼膏后,房水、角膜和虹膜-睫狀體中20(S)-G-Rg3濃度達(dá)到高峰的時(shí)間分別為0.42、0.16、0.19h[57]。給大鼠按1.5mg·kg-1劑量肌注20(S)-G-Rg3,在心、肝、脾、肺、腎中可以檢測(cè)到20(S)-人參皂苷Rg3存在,而在腦、胃、腸、體脂、肌肉和生殖腺中均未檢測(cè)到[58]。
按3mg·kg-1劑量給大鼠灌胃20(R)-G-Rh2后2、6h,在心、肝、脾、肺、腎、胃(不含內(nèi)容物)、腸(不含內(nèi)容物)、脂肪組織、卵巢皆可檢測(cè)到20(R)-G-Rh2。此與血漿中的現(xiàn)象擬合良好[46]。給藥后12h,除在上述所有組織外,還在腎上腺檢測(cè)到了20(R)-G-Rh2。但在腦、皮膚、肌肉和睪丸沒有檢測(cè)到20(R)-G-Rh2。
給大鼠按50mg·kg-1劑量灌胃G-Rg1后8h,肝臟中濃度達(dá)到峰值,同時(shí)在腦核(包括皮層、海馬、紋狀體)、心、脾、肺、腎、胃、小腸、肌肉、脂肪中均有分布,24h后除肝臟外,上述其他組織中仍有G-Rg1存在,提示G-Rg1能透過血腦屏障進(jìn)入腦部,這也很好地解釋了其對(duì)中樞神經(jīng)系統(tǒng)的促進(jìn)學(xué)習(xí)記憶作用[59]。按100mg·kg-1劑量給大鼠灌胃G-Rg1,給藥后150min處死動(dòng)物,在肝、腎、心、肺、脾、胃、小腸、大腸、血清中皆可檢測(cè)到G-Rg1。大鼠組織或血清中G-Rg1的濃度低于10μg·g-1或10μg·mL-1;消化道中G-Rg1是給予劑量的(77.3±3.9)%。Feng等[60]按10mg·kg-1劑量給大鼠靜脈注射G-Rg1,給藥后5、15、30min和1.0、1.5、2.0、3.0、4.0、6.0、8.0、2.0、18.0、24.0h取組織分析了G-Rg1的組織分布動(dòng)力學(xué)特征,在心、肝、脾、肺、腎、腦、胰腺皆可檢測(cè)到G-Rg1,同時(shí)在這些組織檢測(cè)了G-Rg1的代謝產(chǎn)物G-Rh1和G-F1。除在腦中沒有檢測(cè)到G-Rh1和G-F1外,在上述組織中皆檢測(cè)到了這2個(gè)代謝產(chǎn)物,原形化合物G-Rg1及其代謝產(chǎn)物G-Rh1和G-F1在上述組織分布良好,給藥后5min,G-Rg1即可達(dá)到最高濃度,它在組織中的清除除腎外,皆比它在血中的清除快;代謝產(chǎn)物G-Rh1和G-F1在給藥后4~6h即可達(dá)到最高濃度。劉梅等[61]探討了G-Rg1經(jīng)PEG修飾后在小鼠的組織靶向分布。分別給予小鼠尾靜脈注射G-Rg1和PEG G-Rg1,于不同時(shí)間點(diǎn)取血并取各組織臟器,采用UPLC對(duì)樣品中指標(biāo)性成分G-Rg1進(jìn)行含量測(cè)定,計(jì)算G-Rg1在各組織分布的靶向系數(shù),觀察比較2組在小鼠體內(nèi)的組織靶向分布情況。結(jié)果G-Rg1組在小鼠體內(nèi)各組織分布的AUC大小順序?yàn)楦巍⒛I、肺、心、脾,肝靶向系數(shù)為2.01;PEG修飾組在小鼠體內(nèi)各組織的AUC大小順序?yàn)槟I、肝、肺、心、脾,肝靶向系數(shù)為9.21。說明PEG修飾后,G-Rg1對(duì)肝組織的靶向選擇性增強(qiáng),同時(shí)對(duì)腎、肺組織的靶向選擇性亦得到增強(qiáng)。
已有報(bào)道新人參二醇(neoginsenoside;NPD;dammar-20(22)E-ene-3β,12β,25-triol)對(duì)神經(jīng)具有保護(hù)作用。按100mg·kg-1劑量給大鼠灌胃NPD,在胃內(nèi)容物、胃壁、腸內(nèi)容物、大腸、腎、肝、胰腺、肺、小腸、肌肉、睪丸、腦、子宮、腹壁平滑肌、體脂肪、脾、卵巢、心、十二指腸皆可檢測(cè)到NPD;給藥后1.5~3.5h分布量達(dá)最高,24h已檢測(cè)不到NPD,分布量最高的是胃和腸,其次為腎和肝,說明NPD在大鼠組織分布迅速,不會(huì)長(zhǎng)期蓄積[62]。
20(R)-達(dá)瑪烷-3β,12β,20,25-四醇[20(R)-dammarane-3β,12β,20,25-tetrol]對(duì)人胰腺癌細(xì)胞系HPAC和Panc-1細(xì)胞顯示出比G-Rg3和PPD更強(qiáng)的細(xì)胞毒活性(IC50=~10μg·mL-1);按10mg·kg-1·d-1劑量、每周5d、連續(xù)腹腔給藥6周,能夠抑制無胸腺異種移植人胰腺癌小鼠腫瘤的生長(zhǎng),抑制率達(dá)52%。按10和20mg·kg-1劑量無論是靜脈注射還是灌胃給予異種移植人胰腺腫瘤裸鼠20(R)-達(dá)瑪烷-3β,12β,20,25-四醇,可分布于腫瘤部位、脾、肝和腎,肝中分布量最高[63]。
4 代謝和藥代動(dòng)力學(xué)
關(guān)于人參皂苷的代謝研究,主要圍繞的是其在腸內(nèi)的生物轉(zhuǎn)化,而在體內(nèi)的代謝研究相對(duì)比較少。在諸多的研究成果中,十分有意義的是人參二醇組皂苷,如G-Rb1、Rb2、Rc、Rd等的腸內(nèi)菌轉(zhuǎn)化產(chǎn)物G-CK。G-CK一部分隨糞便排出體外,一部分吸收進(jìn)入血液循環(huán)。如果將G-CK直接灌胃或靜脈給予小鼠,在肝臟均可檢出G-CK和它的代謝產(chǎn)物脂肪酸酯G-CK-EM1(EM1)[40,54]。而且靜脈給藥在小腸內(nèi)除檢出G-CK外,既沒有檢出EM1亦沒有檢出其他的代謝產(chǎn)物。給大鼠經(jīng)尾靜脈注射G-CK,EM1在肝臟的產(chǎn)率為給予劑量的24mol%,G-CK的回收率為給予劑量的30mol%。說明EM1在肝臟具有選擇性滯留;EM1亦可能是在肝臟中合成的。從化學(xué)的角度分析,G-CK有親脂性的功能團(tuán)—達(dá)瑪烷二醇基,這類似于膽甾醇;有親水性的功能團(tuán)—葡萄糖殘基。已有研究證明:肝細(xì)胞通過受體(除半乳糖受體)識(shí)別葡萄糖。肝細(xì)胞的這種特異性功能決定了G-CK必定選擇性在肝臟累積。G-CK通過肝臟從血液轉(zhuǎn)運(yùn)至膽汁,實(shí)際上是G-CK在肝細(xì)胞的內(nèi)流和外流反應(yīng)。EM1的產(chǎn)生,證明了G-CK的再代謝或轉(zhuǎn)化。酯化反應(yīng)可能類似于膽固醇與脂肪酸的酯化反應(yīng),由乙酰輔酶A催化完成。G-CK從肝臟被排入膽汁而進(jìn)入腸道,可能存在腸肝循環(huán)。從EM1的FAB-MS數(shù)據(jù)、酸和堿水解分析,推斷一分子EM1結(jié)合一分子脂肪酸;脂肪酸的種類主要為油酸和硬脂酸,少量為棕櫚酸;脂肪酸殘基結(jié)合的位點(diǎn)可能是C3-OH,也可能是C20-葡萄糖殘基的C6-OH。與G-CK相比,EM1在肝臟中的滯留時(shí)間大大加長(zhǎng);G-CK可通過膽汁分泌進(jìn)入小腸,而EM1則不能進(jìn)入小腸。G-CK的肝臟代謝如圖1所示。
G-CK對(duì)腫瘤細(xì)胞增殖具有抑制作用,攻擊腫瘤細(xì)胞的第一個(gè)靶點(diǎn)是細(xì)胞膜。G-CK與血漿細(xì)胞膜相互作用,引起葡萄糖流入腫瘤細(xì)胞降低,抑制藥物從腫瘤細(xì)胞外流。將G-CK與腫瘤細(xì)胞溫孵培養(yǎng),15min內(nèi),G-CK進(jìn)入胞液和細(xì)胞核,通過上調(diào)細(xì)胞周期蛋白依賴性激酶抑制劑p27Kipl、下調(diào)c-Myc和細(xì)胞周期蛋白D1、活化半胱天冬酶-3活性,最終導(dǎo)致細(xì)胞分裂周期被阻斷、細(xì)胞凋亡。G-CK及其EM1都能抑制B16-F10黑色素瘤細(xì)胞的生長(zhǎng),但EM1的毒性比G-CK低。在整體試驗(yàn)中,將EM1和G-CK分別直接注入(靜脈注射可能會(huì)導(dǎo)致血漿酯酶水解EM1)肝移植性B16-F10黑色素瘤細(xì)胞癌灶內(nèi),發(fā)現(xiàn)EM1對(duì)腫瘤細(xì)胞生長(zhǎng)的抑制作用比G-CK更強(qiáng);在抗癌細(xì)胞轉(zhuǎn)移方面,兩者的作用幾乎相同。
給大鼠按1、2、10mg·kg-1劑量靜脈注射G-CK,AUC與劑量成正比,10mg·kg-1劑量的PK參數(shù):半衰期(t1/2)=(224±115)min,AUC=(486.8±188.2)μg·min·mL-1,平均滯留時(shí)間(MRT)=(79.9±40.5)min,清除率(Cl)=(23.1±8.4)mL·min-1·kg-1;給大鼠按5、10、20mg-1劑量灌胃給予G-CK,AUC與劑量成正比,20mg-1劑量的PK參數(shù):達(dá)峰時(shí)間(tmax)=(151±122)min,達(dá)峰濃度(Cmax)=(0.726±0.386)μg·mL-1,AUC=(341.0±201.8)μg·min·mL-1[35]。志愿受試者口服人參粉12g,G-CK血漿中的平均tmax、Cmax,AUC分別為(10.76±2.07)h、(27.89±24.46)ng·mL-1、(221.98±221.42)μg·h·mL-1[41]。志愿受試者口服人參提取物,在血漿中可檢測(cè)到代謝產(chǎn)物G-CK、3-O-二去葡萄糖基G-Rb2(3-O-dideglucosylginsenoside Rb2)、G-C-Mc(ginsenoside C-Mc)和20(S)-PPT,血藥濃度為0.3~5.1μg·[13]。
按400mg·kg-1劑量給大鼠灌胃G-Rb1,從尿液中得到8個(gè)代謝產(chǎn)物,分別為G-Rd、GY-XVII、G-F2、G-CK、3-酮基-G-CK、25-羥基-20(22)E-烯-G-Rg3、20(22),24-二烯-G-Rg3、25-羥基-G-Rd[64]。根據(jù)代謝產(chǎn)物化學(xué)結(jié)構(gòu)特點(diǎn),推測(cè)其可能的代謝途徑為:G-Rb1→G-Rd→G-F2→G-CK→3-酮基-G-CK或G-Rb1→G-Rd→20(S)-G-Rg3→20(22)E,24-二烯-G-Rg3→25-羥基-20(22)E-烯-G-Rg3或G-Rb1→G-Rd→20(R)-G-Rg3(或25-羥基-G-Rd)或G-Rb1→GY-XVII→G-F2→G-CK→3-酮基-G-CK。
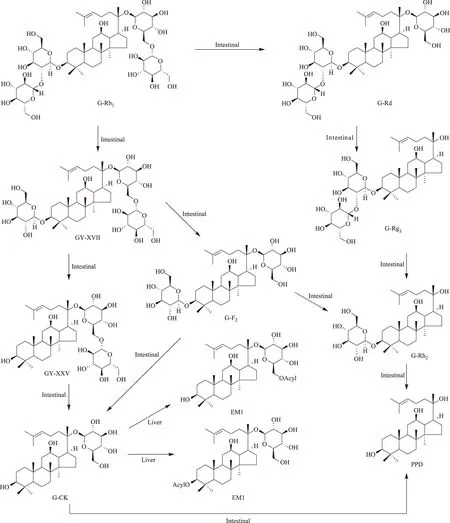
圖1 G-Rb1的生物轉(zhuǎn)化和G-CK的肝臟代謝途徑
按50、100、200mg·kg-13個(gè)劑量給大鼠灌胃G-Rb1,有其藥動(dòng)學(xué)特征,t1/2分別為30.42、19.38、31.34h,tmax分別為8、6、6h,AUC0→t分別為343.17、565.18、7439.79mg·L-1·h-1,AUC0→∞分別為506.34、706.47、12165.36mg·L-1·h-1,Vd分別為1.734、0.792、0.074L·kg-1,Cl分別為0.039、0.028、0.002L·kg-1,MRT0→t分別為17.88、17.802、20.05h,MRT0→∞分別為41.73、29.43、21.58h,ρmax分別為18.03、34.31、375.66μg·L-1[65]。說明盡管G-Rb1口服生物利用度差,但仍有吸收,并具有一定的藥動(dòng)學(xué)特征。
按0.4mg·kg-1劑量給大鼠靜脈注射G-Rc,在尿液中可檢測(cè)到原形G-Rc及其連續(xù)脫去C-3吡喃葡萄糖基的代謝產(chǎn)物G-Rc-Mb和G-Rc-Mc,而灌胃給藥,在糞便中可檢測(cè)到原形G-Rc,大部分的G-Rc代謝為G-Rc-Mc和G-CK。大鼠靜脈注射G-Rc的血藥濃度-時(shí)間PK為二房室模型,主要PK參數(shù)為:t1/2α=(7.30±1.13)min,t1/2β=(1091.67±173.18)min,k10=(0.201±0.004)·h-1,k12=(4.49±0.57)·h-1,k21=(1.12±0.32)·h-1,AUC=(1701.19±144.81)μg·min·mL-1,Vc=(23.97±2.52)mL,Cl=(4.81±0.41)mL·h-1[66]。
灌胃和靜脈給予大鼠G-Rd,利用LC-MS方法檢測(cè),比較給藥后0~24h內(nèi)收集的尿中的代謝產(chǎn)物,發(fā)現(xiàn)兩種給藥途徑下的代謝產(chǎn)物有較大差異。灌胃給藥后的代謝反應(yīng)包括糖苷鍵的水解反應(yīng)和結(jié)合反應(yīng),靜脈給藥后藥物的代謝轉(zhuǎn)化以氧化反應(yīng)和結(jié)合反應(yīng)為主。灌胃給藥后的尿液中檢測(cè)到4個(gè)代謝產(chǎn)物,靜脈給藥后的尿液中檢測(cè)到了5個(gè)代謝產(chǎn)物,它們?yōu)镚-Rd的單氧化產(chǎn)物、G-Rd、G-Rg3和G-Rh2等[67-68]。說明G-Rd在給藥24h后,大鼠體內(nèi)仍有原形存在。文中敘述代謝產(chǎn)物中還有G-Rb1存在[68],產(chǎn)生機(jī)制不明。
按50、100、200mg·kg-13個(gè)劑量組給大鼠灌胃G-Rd,有其藥動(dòng)學(xué)特征,t1/2分別為11.09、17.76、9.83h,tmax分別為8、8、8h,AUC0→t分別為223.70、1109.12、9682.74mg·L-1·h-1,AUC0→∞分別為240.56、1241.10、10108.36mg·L-1·h-1,Vd分別為0.078、0.016、0.002L·kg-1,Cl分別為1.331、0.413、0.028L·kg-1,MRT0→t分別為15.08、15.80、17.97h,MRT0→∞分別為18.51、21.95、19.92h,ρmax分別為26.45、118.31、866.35μg·L-1[44]。按20、50、150mg·kg-1單劑量給小鼠靜脈注射G-Rd,血藥濃度-時(shí)間曲線的PK特征為開放二房室模型,20mg·kg-1時(shí),分布半衰期t1/2α=(0.21±0.11)h,清除半衰期t1/2β=(14.19±2.37)h,中央隔室的表觀體積Vc=(0.375±0.101)L,Cl=(0.066±0.005)·h-1,AUC=(305.0±22.3)μg·mL-1·h-1;50mg·kg-1時(shí),t1/2α=(0.66±0.69)h,t1/2β=(12.83±2.92)h,Vc=(0.809±0.565)L,Cl=(0.280±0.172)·h-1,AUC=(293.2±279.4)μg·mL-1·h-1;150mg·kg-1時(shí),t1/2α=(0.48±0.25)h,t1/2β=(14.02±10.57)h,Vc=(1.432±0.242)L,Cl=(0.569±0.306)·h-1,AUC=(312.6±139.5)μg·mL-1·h-1[53]。3個(gè)劑量下,給藥后較早的2min,血藥濃度即達(dá)峰值,然后迅速下降;至給藥后1h,迅速下降至近70%;給藥后8~24h,降低到給藥劑量的90%以上,類似的趨勢(shì)亦呈現(xiàn)在大鼠。給予犬按0.2mg·kg-1劑量靜注和2mg·kg-1劑量灌胃G-Rd,靜注時(shí)t1/2=(39.4±12.0)h,MRT=(26.7±1.63)h,AUC0→t=(76403.4±15880.6)ng·h·mL-1,AUC0→∞=(76451.1±15874.8)ng·h·mL-1,Cl=(0.002±0.0005)L·kg-1;灌胃時(shí)t1/2=(24.2±2.85)h,MRT=(25.5±3.84)h,AUC0→t=(1890.2±668.6)ng·h·mL-1,AUC0→∞=(1930.3±647.4)ng·h·mL-1,Cl=(1.14±0.40)L·kg-1[44];按10mg劑量給志愿受試者靜脈滴注G-Rd,Cmax=(2841.18±473.03)ng·mL-1,tmax=(0.50±0.00)h,t1/2=(19.29±3.44)h,AUC0→t=(27261.63±8116.88)ng·h·mL-1,AUC0→∞=(27929.39±8615.75)ng·h·mL-1,MRT0→t=(17.52±3.73)h,MRT0→∞=(19.79±5.24)h,Vd=(10.57±2.88)L·kg-1,Cl=(0.39±0.12)L·h-1[68],靜注G-Rd,在人體內(nèi)代謝緩慢。
給大鼠按1.5mg·kg-1劑量肌注20(S)-G-Rg3,與血漿蛋白的結(jié)合率為15%~17%,且不隨濃度的變化而改變。PK行為符合一室模型,t1/2(ke)=0.75h,tmax=0.116h,ρmax=13.9mg·L-1,AUC=16.6mg·h·L-1[58]。提示肌內(nèi)注射后很快被吸收進(jìn)入血液,迅速達(dá)到血藥濃度峰值,在體內(nèi)的代謝速度亦較快。家兔涂抹20(S)-G-Rg3眼膏后,其在房水、角膜和虹膜-睫狀體中的PK行為均符合一室模型,房水、角膜和虹膜-睫狀體中tmax分別為0.42、0.16、0.19h,t1/2分別為0.71、0.69、0.78h,3h后眼組織中的藥物濃度已低于最大濃度的1/10[57]。
相對(duì)于20(S)-G-Rg3,文獻(xiàn)中對(duì)20(R)-G-Rg3的代謝和PK報(bào)道較多,是由于化學(xué)結(jié)構(gòu)畫錯(cuò),還真的就是20(R)-G-Rg3的代謝和PK結(jié)果,有待于查證。按100mg·kg-1劑量給大鼠灌胃20(R)-G-Rg3,血漿中沒有檢測(cè)到原形化合物,給藥后24h累積糞便中原形化合物的回收率僅是給予劑量的0.97%~1.15%,提示其發(fā)生了快速、廣泛的生物轉(zhuǎn)化和/或代謝,代謝產(chǎn)物包括20(R)-G-Rh2、PPT、PPT單氧化物、PPT二氧化物、20(R)-G-Rg3單氧化物和20(R)-G-Rg3二氧化物等。按5mg·kg-1劑量靜脈給藥,t1/2僅為18.5min,給藥后1.5h全部消除[69]。另有報(bào)道[56],分別以0.25、0.5、1.0mg·kg-1劑量給大鼠靜脈注射20(R)-G-Rg3,其藥動(dòng)學(xué)參數(shù)分別為:t1/2=(0.62±0.10)、(0.61±0.08)和(0.62±0.08)h,AUC0→t=(145±27.9)、(302±58.2)和(698±128)ng·mL-1·h-1,AUC0→∞=(147±28.7)、(304±57.9)和(700±128)ng·mL-1·h-1,MRT=(0.17±0.03)、(0.13±0.03)和(0.16±0.04)h,Cl=(1.43±0.32)、(1.42±0.32)和(1.31±0.22)mL·min-1·kg-1,Vss=(29.3±5.57)L·kg-1、(28.3±5.44)和(27.4±6.52)L·kg-1。AUC與劑量成正比。給beagle犬口服(2mg·kg-1)或靜脈注射(0.3mg·kg-1)20(R)-G-Rg3,在血漿中沒有檢測(cè)到代謝產(chǎn)物20(R)-G-Rh2和PPT[70];主要PK參數(shù),口服給藥Cmax=(7.30±1.67)ng·mL-1,tmax=(2.50±0.84)h,t1/2=(5.99±1.16)h,ke=(0.12±0.02)·h-1,AUC0→t=(45.9±12.8)ng·h·mL-1,AUC0→1=(50.0±13.1)ng·h·mL-1,MRT=(6.55±1.40)h,Vd=(722±257)L·kg-1,Cl=(362±91.4)mL·min-1·kg-1;靜脈給予t1/2=(1.71±0.11)h,ke=(0.42±0.05)·h-1,AUC0→t=(1458±437)ng·h·mL-1,AUC0→∞=(1466±444)ng·h·mL-1,MRT=(0.85±0.18)h,Vd=L·kg-1,Cl=(3.65±0.99)mL·min-1·kg-1。按10mg·kg-1劑量給大鼠灌胃20(R)-G-Rg3,血漿中可檢測(cè)到原形化合物及其代謝產(chǎn)物20(R)-G-Rh2和PPT;20(R)-G-Rg3的Cmax=(104.07±59.95)ng·mL-1,tmax=(4.40±1.67)h;按1mg·kg-1劑量給大鼠靜脈注射20(R)-G-Rg3,其血藥濃度-時(shí)間PK特征為二房室模型,t1/2α=(0.12±0.03)h,t1/2β=(2.09±0.50)h[45]。志愿受試者按3.2mg·kg-1單劑量口服20(R)-G-Rg3,Cmax=(15.67±6.14)ng·mL-1,tmax=(0.66±0.01)h[71]。6名健康志愿者按0.8mg·kg-1單劑量口服20(R)-GRg3,由于血藥濃度低,可測(cè)數(shù)據(jù)點(diǎn)少,未進(jìn)行模型模擬;說明口服G-Rg3后在體內(nèi)吸收快,消除也較快,但血藥濃度很低。8名健康志愿者按3.2mg·kg-1單劑量口服20(R)-G-Rg3,其藥時(shí)曲線符合口服吸收有滯后時(shí)間的二房室模型,tmax=(0.66±0.10)h,Cmax=(16±6)ng·mL-1,t1/2α=(0.46±0.12)h,t1/2β=(4.9±1.1)h,t1/2(Ka)=(0.28±0.04)h,AUC0→∞=(77±26)ng·mL-1·h-1[72]。
給大鼠按400、1000、2000mg·kg-1單劑量灌胃含有20(S)-G-Rh2、20(R)-G-Rh2、20(S)-G-Rg3、20(R)-G-Rg3的純化人參干燥提取物BST204,在血漿中僅能檢測(cè)到20(S)-G-Rh2和20(S)-G-Rg3,而檢測(cè)不到20(R)-G-Rh2和20(R)-G-Rg3[55];AUC0→t和Cmax與劑量成正比;但終末t1/2和tmax略有不同,在3個(gè)劑量下,20(S)-G-Rh2的t1/2分別為(161±88.3)、(145±131)、(140±50.3)min,tmax分別為90(60~120)、120(120~240)、90(60~120)min;20(S)-G-Rg3的t1/2分別為(147±25.8)、(304±40.0)、(406±181)min,tmax分別為270(240~600)、240(120~480)、270(120~300)min。純品20(S)-G-Rh2(31.5mg·kg-1)和20(S)-G-Rg3(68.0mg·kg-1)分別給予雄性大鼠灌胃,20(S)-G-Rh2的PK參數(shù):AUC0→t=(234±110)g·min·mL-1,終末t1/2=(172±105)min,Cmax=(1.26±0.577)g·mL-1,tmax=120(90-240)min,GI24劑量百分?jǐn)?shù)(%)=(1.08±1.57)h,Ae24劑量百分?jǐn)?shù)(%)=(1.01±1.23)h;20(S)-G-Rg3的PK參數(shù):AUC0→t=(107±66.6)g·min·mL-1,終末t1/2=(241±73.0)min,Cmax=(0.280±0.221)g·mL-1,tmax=300(240-480)min,GI24劑量百分?jǐn)?shù)(%)=(1.24±1.85)h,Ae24劑量百分?jǐn)?shù)(%)=(2.40±2.38)h。提示純品和混合物形式給藥PK行為不同。
給大鼠按0.03、0.1、0.3mg·kg-1單劑量靜脈注射20(R)-G-Rh2,PK參數(shù),Cmax分別為288、683、1069ng·mL-1,t1/2分別為1.8、4.9、4.5h,MRT分別為0.8、2.4、1.9h,Cl分別為15.2、20.9、35.4mL·min-1·kg-1,Vd分別為2.3、8.9、13.7L·kg-1,AUC0→t分別為32.1、75.0、134.5ng·h·mL-1,AUC0→∞分別為32.9、79.8、141.4ng·h·mL-1;給大鼠按1、3、9mg·kg-1單劑量灌胃20(R)-G-Rh2,tmax分別為6、6、6h,Cmax分別為3.5、8.7、65.3ng·mL-1,t1/2分別為4.0、3.9、2.6h,MRT分別為9.6、9.3、7.1h,Cl分別為20.9、20.9、20.9mL·min-1·kg-1,Vd分別為7.3、7.1、4.7L·kg-1,AUC0→t分別為35.1、93.4、457.1ng·h·mL-1,AUC0→∞分別為37.1、95.8、460.2ng·h·mL-1,F(xiàn)分別為4.7%、4.0%、6.4%;20(R)-G-Rh2與大鼠血漿蛋白的結(jié)合率為70%[46]。給Beagle犬按0.1mg·kg-1劑量單次靜脈注射20(R)-G-Rh2,Cmax=(1735.8±266.4)ng·mL-1,t1/2=(7.8±0.9)h,MRT=(4.0±0.5)h,Cl=(2.1±0.5)mL·min-1·kg-1,Vd=(1.4±0.4)L·kg-1,AUC0→t=(813.6±196.7)ng·h·mL-1,AUC0→∞=(844.6±202.3)ng·h·mL-1,F(xiàn)=100%;給Beagle犬按1mg·kg-1劑量單次口服20(R)-G-Rh2,tmax=(2.6±1.3)h,Cmax=(371.0±199.6)ng·mL-1,t1/2=(9.6±3.5)h,MRT=(6.4±2.4)h,Cl=(2.1±0.5)mL·min-1·kg-1,Vd=(1.8±1.0)L·kg-1,AUC0→t=(1190.2±610.0)ng·h·mL-1,AUC0→∞=(1243.2±622.3)ng·h·mL-1,F(xiàn)=(16.7±11.7)%[46]。Beagle犬靜脈給藥的血藥濃度-時(shí)間PK特征為三室模型,說明20(R)-G-Rh2嗣后緩慢地再分布到周邊室;多次給藥不影響其PK特征。在大鼠灌胃20(R)-G-Rh2劑量3mg·kg-1組的給藥后0~24h累積糞便中檢測(cè)到代謝產(chǎn)物PPT,膽汁中亦存在20(R)-G-Rh2的代謝產(chǎn)物,尿液中檢出20(R)-G-Rh2的硫酸酯共價(jià)結(jié)合物。
給大鼠靜脈注射G-Re,收集藥后0~72h的尿液,可發(fā)現(xiàn)原形化合物和9個(gè)代謝產(chǎn)物,包括3個(gè)G-Re的單加氧產(chǎn)物,主要代謝產(chǎn)物20(S)-G-Rg1以及20(S)-G-Rg2、20(R)-G-Rg2、G-Rh1或G-F1、PPT、去氫PPT。由于是靜脈給藥,證明這些代謝產(chǎn)物在體內(nèi)發(fā)生。給大鼠灌胃G-Re,收集藥后0~72h的尿液,可發(fā)現(xiàn)原形化合物和8個(gè)代謝產(chǎn)物,20(S)-G-Rg1、20(S)-G-Rg2、20(R)-G-Rg2、G-Rh1或G-F1、PPT、去氫PPT,以及2個(gè)未確定結(jié)構(gòu)的代謝產(chǎn)物[73]。主要代謝途徑為氧化和脫糖基。
給ICR小鼠按1mg·kg-1劑量靜脈給予G-Re,PK參數(shù),在雄性小鼠AUC0→t=(638.8±197.0)ng·h·mL-1,AUC0→∞=(639.3±196.8)ng·h·mL-1,t1/2=(0.2±0.03)h,MRT=(0.2±0.07)h,Vd=(0.3±0.2)L·kg-1,Cl=(1.7±0.7)L·h-1·kg-1;在雌性小鼠AUC0→t=(1437.6±271.2)ng·h·mL-1,AUC0→∞=(1442.0±271.0)ng·h·mL-1,t1/2=(0.5±0.08)h,MRT=(0.5±0.08)h,Vd=(0.2±0.07)L·kg-1,Cl=(0.7±0.11)L·h-1·kg-1[47],存在性別差異。單體化合物G-Re與人參漿果提取物(含等量G-Re)給藥相比,灌胃給藥,10mg·kg-1劑量組,單體化合物G-Re的PK參數(shù),tmax=(0.4±0.2)h,Cmax=(29.0±25.4)ng·mL-1,AUC0→t=(17.7±4.5)ng·h·mL-1,MRT=(0.76±0.20)h,F(xiàn)=0.28%;人參漿果提取物組tmax=(0.3±0.13)h,Cmax=(21.3±10.1)ng·mL-1,AUC0→t=(21.3±19.9)ng·h·mL-1,MRT=(1.06±0.56)h,F(xiàn)=0.33%。50mg·kg-1劑量組,單體化合物G-Re的PK參數(shù),tmax=(0.7±0.7)h,Cmax=(35.0±4.3)ng·mL-1,AUC0→t=(61.5±37.0)ng·h·mL-1,MRT=(2.0±1.2)h,F(xiàn)=0.19%;人參漿果提取物組tmax=(0.5±0.3)h,Cmax=(124.1±127.9)ng·mL-1,AUC0→t=(238.3±64.2)ng·h·mL-1,MRT=(4.0±2.0)h,F(xiàn)=0.75%。50mg·kg-1劑量組的Cmax和AUC0→t存在差異,提取物(F=0.33%~0.75%)中的G-Re更易吸收,但總體上口服吸收差F=0.19%~0.28%[47]。
按100和200mg·kg-1劑量給大鼠灌胃G-Re[65],100mg·kg-1劑量組,t1/2=2.928h,tmax=8h,AUC0→t=19.75mg·L-1·h-1,AUC0→∞=19.85mg·L-1·h-1,Vd=4.257L·kg-1,Cl=1.008L·kg-1,MRT0→t=8.89h,MRT0→∞=8.986h,ρmax=2.42μg·L-1;200mg·kg-1劑量組,t1/2=4.971h,tmax=8h,AUC0→t=90.32mg·L-1·h-1,AUC0→∞=99.66mg·L-1·h-1,Vd=1.44L·kg-1,Cl=0.201L·kg-1,MRT0→t=9.83h,MRT0→∞=11.83h,ρmax=14.32μg·L-1。血藥濃度與給予劑量成正相關(guān)。按20、30、40mg·kg-1劑量給大鼠靜脈注射G-Re,t1/2α分別為6.505、6.817、4.499min,t1/2β分別為28.96、30.49、27.57min,AUC分別為599.31、1025.65、1415.7min·mg·L-1。雄性與雌性大鼠均按1mg·kg-1靜脈注射G-Re,其t1/2分別為0.2、0.5h,口服絕對(duì)生物利用度僅為0.33%~0.75%[74]。但未見對(duì)代謝產(chǎn)物進(jìn)行分析。因此,G-Re真實(shí)的生物利用度無法判斷。
志愿受試者口服200mg G-Re片[75],G-Re代謝為G-Rg1、G-F1、G-Rh1和PPT,但沒有檢測(cè)到G-Rg2,提示G-Rg2可能在體內(nèi)迅速被代謝。即或G-Re在腸內(nèi)被轉(zhuǎn)化為G-Rg1、G-F1、G-Rh1和PPT,能夠在尿液中檢測(cè)到這些產(chǎn)物,證明它們能夠被吸收。G-Re在血液中的PK參數(shù)tmax=(1.19±0.44)h,Cmax=(0.939±0.549)μg·L-1,AUC0→t=(2.476±2.281)μg·L-1·h-1,AUC0→∞=(2.699±2.284)μg·L-1·h-1,t1/2=(1.82±0.75)h,Cl/F=(124054±84725)L·h-1。
G-Rg1在大鼠腸內(nèi)可轉(zhuǎn)化為G-Rh1、G-F1和PPT;在人腸內(nèi)可轉(zhuǎn)化為G-Rh1和PPT[60]。
按100和200mg·kg-1劑量給大鼠灌胃G-Rg1[65],100mg·kg-1劑量組,t1/2=7.725h,tmax=8h,AUC0→t=66.11mg·L-1·h-1,AUC0→∞=72.66mg·L-1·h-1,Vd=3.068L·kg-1,Cl=0.275L·kg-1,MRT0→t=13.52h,MRT0→∞=16.549h,ρmax=7.70μg·L-1;200mg·kg-1劑量組,t1/2=4.731h,tmax=8h,AUC0→t=284.73mg·L-1·h-1,AUC0→∞=288.42mg·L-1·h-1,Vd=0.473L·kg-1,Cl=0.069L·kg-1,MRT0→t=11.93h,MRT0→∞=12.321h,ρmax=38.38μg·L-1。與G-Re的藥代動(dòng)力學(xué)行為基本一致。按10mg·kg-1劑量給大鼠靜脈注射G-Rg1,血藥濃度-時(shí)間曲線PK特征為二房室模型[60],給藥后5min,G-Rg1血藥濃度最高,然后迅速下降,給藥后4h消失;代謝產(chǎn)物G-Rh1和G-F1在給藥后1h 在血中出現(xiàn),約在6h 達(dá)到最高血藥濃度,給藥后24h在血中完全消失;但沒有發(fā)現(xiàn)PPT。PK參數(shù),G-Rg1的α=(2.2±0.8)·h-1,β=(0.28±0.11)·h-1,t1/2α=(0.37±0.13)h,t1/2β=(1.82±0.64)h,Vc=(0.021±0.009)L·kg-1,Cl=(0.037±0.017)mL·h-1·kg-1,MRT0→t=(1595.7±451.6)ng·h·mL-1,MRT=(1.92±0.23)h;G-Rh1的α=(2.9±1.1)·h-1,β=(0.16±0.04)·h-1,Cmax=(55.7±17.7)ng·mL-1,tmax=(5.32±0.63)h,t1/2α=(0.30±0.14)h,t1/2β=(5.87±2.66)h,Vc=(0.028±0.011)L·kg-1,Cl=(0.009±0.005)mL·h-1·kg-1,MRT0→t=(597.5±274.4)ng·h·mL-1,MRT=(5.99±3.03)h;G-F1的α=(4.1±1.3)·h-1,β=(0.13±0.05)·h-1,Cmax=(71.4±18.0)ng·mL-1,tmax=(6.88±0.86)h,t1/2α=(0.23±0.10)h,t1/2β=(6.87±2.95)h,Vc=(0.035±0.014)L·kg-1,Cl=(0.016±0.006)mL·h-1·kg-1,MRT0→t=(805.6±233.7)ng·h·mL-1,MRT=(7.13±2.25)h。
按150mg·kg-1劑量給大鼠灌胃G-Rg1,血中可檢測(cè)到G-Rg1及其代謝產(chǎn)物G-Rh1、G-F1和PPT。血藥濃度-時(shí)間曲線PK特征為二房室模型[60],給藥后15min在血液中出現(xiàn)G-Rg1,給藥后1h達(dá)最大血藥濃度,然后迅速下降,給藥后8h消失;代謝產(chǎn)物G-Rh1和G-F1約在給藥后1h 在血中出現(xiàn),約在4h達(dá)到平均最高血藥濃度;代謝產(chǎn)物PPT約在給藥后3h 在血中出現(xiàn),約在8h達(dá)到最高血藥濃度;給藥后24h,仍可在血液中檢測(cè)到三個(gè)代謝產(chǎn)物。PK參數(shù),G-Rg1的α=(7.4±2.9)·h-1,β=(0.46±0.16)·h-1,Cmax=(1134.4±562.80)ng·mL-1,tmax=(0.92±0.12)h,t1/2α=(0.14±0.05)h,t1/2β=(2.25±0.68)h,Vc/F=(0.008±0.002)L·kg-1,Cl/F=(0.031±0.014)mL·h-1·kg-1,MRT0→t=(2363.5±914.80)ng·h·mL-1,MRT=(2.68±0.36)h。G-Rh1的α=(3.6±0.8)·h-1,β=(0.12±0.05)·h-1,Cmax=(584.6±117.3)ng·mL-1,tmax=(3.64±1.43)h,t1/2α=(0.29±0.09)h,t1/2β=(6.73±2.28)h,Vc/F=(0.015±0.040)L·kg-1,Cl/F=(0.017±0.080)mL·h-1·kg-1,MRT0→t=(4185.5±1364.2)ng·h·mL-1,MRT=(5.06±1.33)h。G-F1的α=(4.0±1.0)·h-1,β=(0.17±0.05)·h-1,Cmax=(522.2±197.5)ng·mL-1,tmax=(5.17±0.93)h,t1/2α=(0.22±0.08)h,t1/2β=(5.44±1.44)h,Vc/F=(0.020±0.007)L·kg-1,Cl/F=(0.022±0.005)mL·h-1·kg-1,MRT0→t=(3774.3±890.40)ng·h·mL-1,MRT=(6.65±2.17)h。PPT的α=(4.4±1.4)·h-1,β=(0.22±0.06)·h-1,Cmax=(38.3±23.4)ng·mL-1,tmax=(7.30±2.00)h,t1/2α=(0.20±0.04)h,t1/2β=(5.06±0.90)h,Vc/F=(0.027±0.011)L·kg-1,Cl/F=(0.011±0.006)mL·h-1·kg-1,MRT0→t=(396.2±202.6)ng·h·mL-1,MRT=(5.33±3.20)h。
人靜脈注射20(S)-G-Rg1后,體內(nèi)藥動(dòng)學(xué)參數(shù)t1/2α=(0.28±0.10)h,t1/2β=(2.09±1.89)h,VC=(0.015±0.006)L·kg-1,AUC0→t=(124.4±35.9)ng·L-1·h-1,AUC0→∞=(127.9±37.2)ng·L-1·h-1,Cl=(0.03±0.01)L·kg-1·h-1。提示20(S)-G-Rg1在人體內(nèi)的分布與消除都較快[76]。
給大鼠靜脈注射G-Rg2,血液中存在20(S)-G-Rg2和20(R)-G-Rg2。按10、20、50mg·kg-13個(gè)劑量分別單次靜脈給藥后,20(S)-G-Rg2具有代謝不穩(wěn)定性,部分轉(zhuǎn)化為20(R)-G-Rg2,兩者的PK過程符合開放一房室模型,20(R)-G-Rg2在體內(nèi)的消除半衰期較長(zhǎng),該對(duì)差向異構(gòu)體其他主要藥動(dòng)學(xué)參數(shù)的差異具有統(tǒng)計(jì)學(xué)意義,可見兩者的藥動(dòng)學(xué)是不同的[77]。
20(R)-G-Rg2的PK參數(shù):A=(5.0005±0.0648)μg·mL-1,α=(0.1740±0.0220)min-1,B=(1.6259±0.1232)μg·mL-1,β=(0.0097±0.0004)min-1,t1/2α=(4.0246±0.0087)min,t1/2β=(71.1999±3.1586)min,k21=(0.0504±0.0065)min-1,k10=(0.0336±0.0003)min-1,k12=(0.0997±0.0157)min-1,Vc=(3.8115±0.0988)L·kg-1,Vd=(7.5398±0.5373)L·kg-1,AUC=(197.7176±5.1766)μg·min·mL-1,Cl=(0.1264±0.0003)L·min-1;20(S)-G-Rg2的PK參數(shù):A=(55.3000±3.7722)μg·mL-1,α=(0.1963±0.0633)min-1,B=(14.5104±5.6855)μg·mL-1,β=(0.0181±0.0057)min-1,t1/2α=(3.7242±0.0459)min,t1/2β=(38.4414±1.1134)min,k21=(0.0562±0.0274)min-1,k10=(0.0640±0.0100)min-1,k12=(0.0942±0.0358)min-1,Vc=(0.3620±0.0459)L·kg-1,Vd=(0.6068±0.3821)L·kg-1,AUC=(1092.5109±83.9747)μg·min·mL-1,Cl=(0.0232±0.0013)L·min-1[78]。
給大鼠灌胃20(S)-G-Rh1,t1/2β=(0.43±0.08)h,tmax=(1.00±0.00)h,Cmax=(0.05±0.01)mg·L-1,AUC0→t=(0.13±0.01)mg·L-1·h-1,AUC0→∞=(0.14±0.01)mg·L-1·h,CL/F=(67.68±9.63)L·h-1;靜脈注射,t1/2α=(0.07±0.04)h,t1/2β=(0.41±0.05)h,Vd=(0.13±0.04)L,AUC0→t=(1.50±0.23)mg·L-1·h-1,AUC0→∞=(1.52±0.24)mg·L-1·h-1,Cl=(0.67±0.11)L·h-1;F=(1.01±0.03)%。由此可見20(S)-G-Rh1在體內(nèi)的清除較快,生物利用度較低[50]。
給大鼠按5mg·kg-1劑量靜脈注射20(R)-達(dá)瑪烷-3β,12β,20,25-四醇,血漿PK參數(shù)為t1/2=(3.9±2.1)h,ke=(0.2±0.1)h-1,AUC0→t=(31808±11685)ng·h·mL-1,AUC0→∞=(33487±14834)ng·h·mL-1,MRT=(4.7±2.9)h,Vd/F=(950.2±115.0)mL·kg-1,Cl/F=(166.6±52.4)mL·h-1·kg-1;按10mg·kg-1劑量灌胃給予20(R)-達(dá)瑪烷-3β,12β,20,25-四醇,血漿PK參數(shù)為Cmax=(4617.2±1571.3)ng·mL-1,tmax=(5.5±4.7)h,t1/2=(4.5±2.6)h,ke=(0.2±0.1)h-1,AUC0→t=(38954±5172)ng·h·mL-1,AUC0→∞=(40194±6666)ng·h·mL-1,MRT=(8.1±3.1)h,Vd/F=(1355.4±510.6)mL·kg-1,Cl/F=(254.1±42.7)mL·h-1·kg-1[51]。給異種移植人胰腺腫瘤裸鼠,按10mg·kg-1劑量靜脈注射20(R)-達(dá)瑪烷-3β,12β,20,25-四醇,Cmax=41.9μg·mL-1,AUC0→∞=21.3μg·h·mL-1,t1/2=2.39h,MRT=1.03h,Cl/F=0.470mL·g-1·h-1;按20mg·kg-1劑量灌胃20(R)-達(dá)瑪烷-3β,12β,20,25-四醇,Cmax=2.96μg·mL-1,AUC0→∞=5.36μg·h·mL-1,t1/2=1.52h,MRT=1.73h,Cl/F=3.73mL·g-1·h-1[63]。在大鼠的絕對(duì)生物利用度為64.8%[51];而在異種移植人胰腺腫瘤裸鼠的絕對(duì)生物利用度為19.8%[63]。在異種移植人胰腺腫瘤裸鼠,靜脈注射20(R)-達(dá)瑪烷-3β,12β,20,25-四醇在腫瘤部位的Cmax=4.36μg·g-1,AUC0→∞=128μg·h·g-1,t1/2=2.52h,MRT=2.28h;灌胃在腫瘤部位的Cmax=2.05μg·g-1,AUC0→∞=9.64μg·h·g-1,t1/2=3.21h,MRT=3.99h[63],在腫瘤部位的PK性質(zhì)良好。
G-Rb1、Rb2、Rb3、Rc、Rd為PPD型皂苷,亦為人參的主要化學(xué)成分。PPD型皂苷在體內(nèi)可代謝為PPD,PPT型皂苷在體內(nèi)可代謝為PPT,因此,研究PPD和PPT的PK意義重大。給大鼠按75mg·kg-1劑量灌胃人參皂苷元(PPD和PPT分別占16%和33%)或按30mg·kg-1劑量靜脈注射人參皂苷元,研究它們的PK特性。靜脈給予,PPD的t1/2,λz=6.25h,Cl=0.98L·h-1·kg-1,清除相對(duì)較慢;PPT的t1/2,λz=0.80h,Cl=4.27L·h-1·kg-1,清除較快。灌胃給予,PPD和PPT皆可吸收進(jìn)入體循環(huán),PPD的tmax=1.82h,Cmax=1.04μg·mL-1,吸收相對(duì)較慢;PPT的tmax=0.58h,Cmax=0.13μg·mL-1,吸收相對(duì)較快。兩者的系統(tǒng)暴露量有明顯的差別。PPD和PPT的絕對(duì)生物利用度分別為48.12%和3.69%,差異明顯[79]。這些差異性為研究PPD型皂苷和PPT型皂苷的作用,在藥代動(dòng)力學(xué)上奠定了基礎(chǔ)。
給予動(dòng)物或人單一的人參皂苷或人參皂苷混合物或人參皂苷提取物或含有人參/三七的復(fù)方,某些人參皂苷可能具有不同的PK行為。給大鼠靜脈注射單一的G-Rb1、Rb2和Rb3,t1/2分別為(12.5±1.8)、(15.4±3.7)、(24.9±12.6)h;灌胃單一的G-Rb1、Rb2和Rb3,t1/2分別為(9.8±6.9)、(23.1±3.7)、(21.1±9.8)h[80]。給大鼠灌胃三七提取物,G-Ra3、Rb1、Rc、Rd的t1/2較長(zhǎng),為7.5~19.8h;而G-Rg1、Rg2、Rg3、F1、F2、Rh1、Rh2、Re、Rf,20-葡萄糖基G-Rf的t1/2相對(duì)較短,為0.2~3.2h[25]。同樣是三七提取物,給大鼠灌胃的G-Rb1和Rg1的t1/2分別為17.96和14.13h[42]。給beagle犬灌胃三七提取物,G-Rb1、Rg1和NG-R1的t1/2分別為(18.27±2.55)、(4.55±1.22)和(3.35±0.55)h[81];給beagle犬灌胃含有三七提取物的丹參片,G-Rb1、Rg1和NG-R1的t1/2分別為(60.9±17.5)、(4.59±2.95)和(4.82±3.13)h[82];給大鼠灌胃七藿通竅片(三七提取物和淫羊藿提取物組成的復(fù)方中藥制劑),G-Rb1、Re、Rg1和NG-R1的t1/2分別為(1512.2±1461.9)、(431.4±149.5)、(418.8±68.0)和(245.6±118.5)min[83];給大鼠靜脈注射參附(紅參和附子)注射液(劑量相當(dāng)于G-Re,0.18mg·kg-1;G-Rf,0.10mg·kg-1;G-Rb1,0.66mg·kg-1;G-Rc,0.57mg·kg-1;G-Rb2,0.42mg·kg-1;G-Ro,0.08mg·kg-1;G-Rd,0.81mg·kg-1),Rb1、Rb2、Rc、Rd和G-Rf的t1/2分別為(19.29±6.36)、(35.60±30.66)、(29.54±22.91)、(8.49±5.20)和(4.21±3.68)h,AUC0→t分別為(71.37±31.17)、(44.42±20.24)、(65.30±29.10)、(2.81±2.02)、(4.38±3.30)mg·L-1·h-1,MRT0→t分別為(9.83±0.36)、(10.22±1.51)、(10.00±1.30)、(6.01±3.33)、(2.99±2.17)h[84]。在志愿受試者中[75],口服人參皂苷,G-Re的t1/2為(1.82±0.75)h;靜脈注射參麥注射液[76],G-Rg1的t1/2為(2.09±1.89)h。同一人參皂苷在不同條件下的不同PK行為直接影響其生物學(xué)活性和藥理學(xué)作用。
5 排泄
給大鼠灌胃G-Rb1,在尿液中可檢測(cè)到原形化合物及其代謝產(chǎn)物G-Rd、Rg3、Rh2,說明G-Rb1可經(jīng)尿液排泄[6]。
給大鼠靜脈或灌胃給予G-CK,給藥后24h在整個(gè)胃腸道的原形化合物的回收率分別為24.4%~26.2%和54.3%~81.7%,尿液中排泄量最少[35]。
志愿受試者口服人參提取物,在尿液中可檢測(cè)到代謝產(chǎn)物G-CK、3-O-二去葡萄糖基G-Rb2(3-O-dideglucosylginsenoside Rb2)、G-C-Mc(ginsenoside C-Mc)和20(S)-PPT,尿藥濃度為2.2~96μg·mL-1[13]。
給大鼠灌胃G-Rc,主要以一部分原形和代謝產(chǎn)物G-Rc-Mc和G-CK形式在糞便排泄;靜脈注射主要以一部分原形和代謝產(chǎn)物G-Rc-Mb和G-Rc-Mc形式經(jīng)尿液排泄[66]。
靜脈或灌胃大鼠G-Rd,以原形或其代謝產(chǎn)物形式排泄[68]。給小鼠靜脈注射G-Rd,小鼠給藥后0~6、6~24、24~48、48~72h尿中累積排泄率分別為14.9%、60.8%、62.86%、63.36%;糞便中累積排泄率分別為7.20%、18.45%、18.72%、18.85%,主要經(jīng)尿液排泄。大鼠靜脈給藥后0~12、12~24、24~48h尿中累積排泄率分別為30.5%、37.2%、39.5%;糞便中累積排泄率分別為15.6%、31.7%、36.6%,尿液和糞便皆是主要排泄途徑[53]。總的來看,給藥后24h主要經(jīng)尿液清除。
給大鼠按0.5mg·kg-1劑量靜脈注射20(R)-G-Rg3,主要以原形形式經(jīng)膽汁排泄;進(jìn)入腸道的20(R)-G-Rg3在腸道菌群的作用下降解產(chǎn)生苷元原人參二醇[56]。給大鼠按1.5mg·kg-1劑量肌注20(S)-G-Rg3,其主要經(jīng)尿液排泄,給藥8h內(nèi),累積經(jīng)尿液排出的20(S)-G-Rg3占給予總量的72.1%,經(jīng)膽汁排泄的20(S)-G-Rg3占給予總量的10.1%,大部分20(S)-G-Rg3經(jīng)尿液由腎臟排出體外,在體內(nèi)基本無蓄積[58]。
20(R)-G-Rh2在Beagle犬和大鼠的系統(tǒng)清除率分別低至約2、20mL·min-1·kg-1,實(shí)驗(yàn)中測(cè)定在Beagle犬的系統(tǒng)清除率為(1±0.5)mL·min-1·kg-1,恰好是Beagle犬一般肝血流的7%,說明20(R)-G-Rh2的體清除低。大鼠灌胃20(R)-G-Rh2在排泄物中的原形化合物的回收率僅為給予劑量的1%,靜脈注射原形化合物在膽汁中的回收率為30%,這與20(R)-G-Rh2代謝產(chǎn)物的生成密切相關(guān)。詳細(xì)的研究表明,按0.1mg·kg-1劑量給大鼠靜脈注射20(R)-G-Rh2,原形化合物在給藥后0~1、0~3、0~5、0~7、0~9、0~12h在膽汁中的累積排泄率分別為(13.00±2.46)%、(20.36±2.35)%、(23.69±2.51)%、(25.42±2.52)%、(26.73±2.67)%和(27.72±2.74)%。按3mg·kg-1劑量給大鼠灌胃20(R)-G-Rh2,原形化合物在藥后0~2、0~4、0~6、0~8、0~10、0~12h在膽汁中的累積排泄率分別為(0.05±0.04)%、(0.23±0.27)%、(0.33±0.25)%、(0.45±0.18)%、(0.49±0.24)%、(0.52±0.31)%;原形化合物在藥后0~24、0~48、0~72h在糞便中的累積排泄率分別為(0.55±0.34)%、(0.65±0.35)%、(0.80±0.31)%[46]。
給大鼠無論是靜脈注射還是灌胃給予G-Re,G-Re能以原形及其代謝產(chǎn)物形式經(jīng)尿液排泄[73]。給ICR小鼠按1mg·kg-1劑量靜脈給予G-Re,有較短的半衰期,雄性為(0.2±0.03)h,雌性為(0.5±0.08)h,迅速從體內(nèi)清除[47]。
志愿受試者口服200mg G-Re片[75],在尿液中可檢測(cè)到原形化合物及其代謝產(chǎn)物G-Rg1、G-F1、G-Rh1和PPT,說明它們皆可經(jīng)尿液排泄。
給大鼠靜脈注射G-Rg1,原形化合物及其代謝產(chǎn)物G-Rh1和G-F1的血中清除半衰期分別為1.82、5.87和6.87h;灌胃情況下,原形化合物及其代謝產(chǎn)物G-Rh1、G-F1和PPT的血中清除半衰期分別為2.25、6.73、5.44和5.06h[60]。
給大鼠靜脈注射G-Rg1,給藥后0~2h、2~4h和4~8h,原形化合物G-Rg1在膽汁中的排泄率分別為給予劑量的(36.21±8.60)%、(18.80±7.37)%和(5.76±1.99)%,總排泄率為(60.77±6.14)%;給藥后0~2h、2~4h、4~8h和8~12h,代謝產(chǎn)物G-Rh1在膽汁中的排泄率分別為給予劑量的(0.06±0.08)%、(0.55±0.46)%、(1.06±0.32)%和(0.57±0.28)%,總排泄率為(2.24±0.62)%;給藥后2~4h、4~8h和8~12h,代謝產(chǎn)物G-F1在膽汁中的排泄率分別為給予劑量的(0.43±0.24)%、(0.27±0.15)%和(1.52±0.32)%,總排泄率為(1.52±0.32)%;給藥后4~8h和8~12h,代謝產(chǎn)物PPT在膽汁中的排泄率分別為給予劑量的(0.16±0.12)%和(0.05±0.03)%,總排泄率為(0.21±0.13)%[60]。
給大鼠靜脈注射G-Rg1,給藥后0~4h、4~8h、8~12h,原形化合物G-Rg1在尿液中的排泄率分別為給予劑量的(15.74±6.08)%、(9.82±4.17)%和(2.39±0.53)%,總排泄率為(27.95±8.17)%;在糞便中的排泄率分別為給予劑量的(15.92±1.73)%、(1.31±0.21)%和(0.41±0.17)%,總排泄率為(17.64±2.42)%。0~4h、4~8h、8~12h和12~24h,代謝產(chǎn)物G-Rh1在尿液中的排泄率分別為給予劑量的(14.88±1.95)%、(3.17±1.01)%、(1.05±0.34)%、(0.16±0.06)%,總排泄率為(19.26±2.98)%;在糞便中的排泄率分別為給予劑量的(18.63±2.97)%、(5.47±1.48)%、(2.02±0.61)%、(0.11±0.36)%,總排泄率為(16.23±5.06)%;代謝產(chǎn)物G-F1在尿液中的排泄率分別為給予劑量的(15.76±2.02)%、(6.08±1.53)%、(0.63±0.15)%和(0.25±0.07)%,總排泄率為(12.72±3.75)%;在糞便中的排泄率分別為給予劑量的(17.74±1.69)%、(4.12±2.08)%、(0.96±0.24)%和(0.04±0.02)%,總排泄率為(12.86±2.79)%。在0~4h、4~8h和8~12h,代謝產(chǎn)物PPT在尿液中的排泄率分別為給予劑量的(10.18±0.11)%、(1.17±0.19)%和(0.03±0.01)%,總排泄率為(11.38±0.65)%;在0~4h、4~8h、8~12h和12~24h,代謝產(chǎn)物PPT在糞便中的排泄率分別為給予劑量的(14.19±2.02)%、(4.68±1.57)%、(1.72±0.36)%和(0.14±0.02)%,總排泄率為(10.73±4.59)%[60]。
總之,給大鼠靜脈注射G-Rg1,原形化合物G-Rg1及其代謝產(chǎn)物在大鼠尿液和糞便中的總排泄率分別為51.31%和47.46%,主要排泄途徑為膽汁[60]。
給大鼠靜脈注射G-Rg2后,5.5h內(nèi)膽汁中原形G-Rg2累積排泄率為給予劑量的27.2%,24h內(nèi)糞便中原形G-Rg2累積排泄率為給予劑量的22.6%;尿液中未檢出G-Rg2。由此可見,靜脈給予大鼠G-Rg2,原形藥物主要通過膽汁和糞便途徑排出體外[85]。
按100mg·kg-1劑量給大鼠灌胃NPD,給藥后96h,累積糞便排泄率為給予劑量的(64.56±20.32)%,尿液排泄率僅為(0.0233±0.0356)%,說明灌胃NPD的主要排泄途徑為糞便[61]。
6 結(jié)語
盡管人參的三萜主要化學(xué)成分類型局限在達(dá)瑪烷型和齊墩果酸型,但它們具有多樣性的化學(xué)結(jié)構(gòu),具有不同的PK特性,決定了人參多樣性的生物學(xué)活性和藥理學(xué)作用。為了闡明人參的生物學(xué)活性、藥理學(xué)作用、作用機(jī)制和臨床應(yīng)用,許多科學(xué)工作者專注于人參單體皂苷的研究,取得了可喜成績(jī)。一般地說,脫糖基人參皂苷的疏水性和穿過細(xì)胞壁的能力隨著脫糖基作用而增強(qiáng),最終表現(xiàn)為生物學(xué)活性和藥理學(xué)作用的增強(qiáng),或發(fā)生作用性質(zhì)的改變,人參皂苷結(jié)構(gòu)的腸內(nèi)細(xì)菌生物轉(zhuǎn)化,在某種程度上活化了其作用。因此,天然的人參皂苷似乎是一種前藥。實(shí)際上,口服給予的人參皂苷在腸道內(nèi)的水解是不完全的,如將分子結(jié)構(gòu)中具有3個(gè)糖基的G-Re口服給予健康志愿受試者,在尿液中可檢測(cè)到結(jié)合三個(gè)糖基的原形化合物G-Re、結(jié)合2個(gè)糖基的G-Rg1、結(jié)合1個(gè)糖基的G-Rh1和G-F1及它們的苷元PPT[75]。在大鼠試驗(yàn)中亦得到了類似的結(jié)果[73]。給予健康志愿受試者口服人參標(biāo)準(zhǔn)提取物GinsanaG115膠囊(主要成分為G-Re和Rg1,還含有G-Rb1、Rb2、Rc、Rd、Rf等),在給藥后0~3h累積尿液中可檢測(cè)到G-Rb2、Rc、Rd、Re和Rg1;3~6h累積尿液中可檢測(cè)到G-Rh1;6~12h累積尿液中可檢測(cè)到G-Rb1和G-CK;12~24h累積尿液中可檢測(cè)到G-Rh1/G-F1和G-CK[86]。從這個(gè)人體的試驗(yàn)結(jié)果,告誡我們要正確的理解體外人腸內(nèi)細(xì)菌轉(zhuǎn)化人參皂苷的實(shí)驗(yàn)結(jié)果,一些人參皂苷可以進(jìn)入體循環(huán)發(fā)揮其生物學(xué)作用。盡管人參皂苷的組織分布研究較少,但某些人參皂苷可以分布到達(dá)心和腦組織,此可能是人參滋養(yǎng)心肌和益智的基礎(chǔ)。此外,如果把原形人參皂苷的吸收和其代謝產(chǎn)物的吸收進(jìn)行加和計(jì)算,將會(huì)改變?nèi)藗儗?duì)人參皂苷生物利用度差的認(rèn)識(shí)。PPD和PPT型皂苷和/或皂苷元存在20R和20S差向異構(gòu)體,同一對(duì)差向異構(gòu)體有時(shí)具有差異性的PK性質(zhì),表現(xiàn)為生物學(xué)活性和藥理學(xué)作用的差異性。過去幾年人參單體皂苷結(jié)構(gòu)上的變化導(dǎo)致其生物轉(zhuǎn)化和/或代謝及PK特性變化的研究相對(duì)比較多,由于人參的應(yīng)用多為混合人參皂苷的應(yīng)用,今后應(yīng)對(duì)人參皂苷相互作用及與其他中藥成分相互作用導(dǎo)致其PK性質(zhì)的變化展開研究,其成果可擴(kuò)展到循證人參配伍復(fù)方作用機(jī)制上的應(yīng)用。人參PK和生物學(xué)活性、藥理學(xué)作用的研究進(jìn)展亦將極大地激發(fā)人們對(duì)人參有用生物轉(zhuǎn)化和/或代謝產(chǎn)物的合成[87-88]。
[1] 楊鑫寶,楊秀偉,劉建勛.人參中皂苷類化學(xué)成分的研究[J].中國(guó)現(xiàn)代中藥,2013,13(5):349-358.
[2] 李珂珂,楊秀偉.人參莖葉化學(xué)成分的研究進(jìn)展[J].中國(guó)現(xiàn)代中藥,2012,14(1):47-50.
[3] 楊秀偉.人參中三萜類化學(xué)成分的研究[J].中國(guó)現(xiàn)代中藥,2016,18(1):7-15.
[4] 楊秀偉,富力.人參中三萜類化學(xué)成分的生物學(xué)活性和藥理學(xué)作用[J].中國(guó)現(xiàn)代中藥,2016,18(1):36-55.
[5] Akao T,Kida H,Kanaoka M,et al.Intestinal bacterial hydrolysis is required for the appearance of compound K in rat plasma after oral administration of ginsenoside Rb1fromPanaxginseng[J].J Pharm Pharmacol,1998,50(10):1155-1160.
[6] Xu R J,Peng Y,Wang M Y,et al.Effects of broad-spectrum antibiotics on the metabolism and pharmacokinetics of ginsenoside Rb1:A study on rats’ gut microflora influenced by lincomycin[J].J Ethnopharmacol,2014,158(Part A):338-344.
[7] Kanaoka M,Akao T,Kobashi K.Metabolism of ginseng saponins,ginsenosides,by human intestinal flora[J].J Tradit Med,1994,11(3):241-245.
[8] Shen H,Leung W I,Ruan J Q,et al.Biotransformation of ginsenoside Rb1viathe gypenoside pathway by human gut bacteria[J].Chin Med(London,United Kingdom),2013,8:22/1-22/11.
[9] Bae E A,Park S Y,Kim D H.Constitutiveβ-glucosidases hydrolyzing ginsenoside Rb1and Rb2from human intestinal bacteria[J].Biol Pharm Bull,2000,23(12):1481-1485.
[10] Karikura M,Miyase T,Tanizawa H,et al.Studies on absorption,distribution,excretion and metabolism of ginseng saponins.VII.Comparison of the decomposition modes of ginsenoside-Rb1and-Rb2in the digestive tract of rats[J].Chem Pharm Bull,1991,39(9):2357-2361.
[11] Hasegawa H,Sung J H,Benno Y.Role of human intestinalPrevotellaorisin hydrolyzing ginseng saponins[J].Planta Med,1997,63(5):436-440.
[12] Sung J H,Hasegawa H,Ha J Y,et al.Metabolism of ginseng saponins by human intestinal bacteria(part II)[J].Saengyak Hakhoechi,1997,28(1):35-41.
[13] Hasegawa H,Sung J H,Matsumiya S,et al.Main ginseng saponin metabolites formed by intestinal bacteria[J].Planta Med,1996,62(5):453-457.
[14] Bae E A,Choo M K,Park E K,et al.Metabolism of ginsenoside Rc by human intestinal bacteria and its related antiallergic activity[J].Biol Pharm Bull,2002,25(6):743-747.
[15] Shin J E,Park E K,Kim E J,et al.Cytotoxicity of compound K(IH-901)and ginsenoside Rh2,main biotransformants of ginseng saponins bybifidobacteria,against some tumor cells[J].J Ginseng Res,2003,27(3):129-134.
[16] Bae E A,Han M J,Choo M K,et al.Metabolism of20(S)-and20(R)-ginsenoside Rg3by human intestinal bacteria and its relation toinvitrobiological activities[J].Biol Pharm Bull,2002,25(1):58-63.
[17] Bae E A,Han M J,Kim E J,et al.Transformation of ginseng saponins to ginsenoside Rh2by acids and human intestinal bacteria and biological activities of their transformants[J].Arch Pharm Res,2004,27(1):61-67.
[18] Ko S R,Suzuki Y,Suzuki K,et al.Marked production of ginsenosides Rd,F(xiàn)2,Rg3,and compound K by enzymatic method[J].Chem Pharm Bull,2007,55(10):1522-1527.
[19] Park E K,Choo M K,Kim E J,et al.Antiallergic activity of ginsenoside Rh2[J].Biol Pharm Bull,2003,26(11):1581-1584.
[20] Bae E A,Shin J E,Kim D H:Metabolism of ginsenoside Re by human intestinal microflora and its estrogenic effect[J].Biol Pharm Bull2005,28(10):1903-1908.
[21] Chi H,Ji G E:Transformation of ginsenosides Rb1and Re fromPanaxginsengby food microorganisms.Biotechnol Lett,2005,27(11):765-771.
[22] Odani T,Tanizawa H,Takino Y.Studies on the absorption,distribution,excretion and metabolism of ginseng saponins.IV.Decomposition of ginsenoside-Rg1and-Rb1in the digestive tract of rats[J].Chem Pharm Bull,1983,31(10):3691-3697.
[23] 陳英杰,荻原幸夫.20(S)-人參皂苷-Rg2的代謝產(chǎn)物研究[J].沈陽藥學(xué)院學(xué)報(bào),1987,4(3):202.
[24] Wang H Y,Hua H Y,Liu X Y,et al.Invitrobiotransformation of red ginseng extract by human intestinal microflora:Metabolites identification and metabolic profile elucidation using LC-Q-TOF/MS[J].J Pharm Biomed Anal,2014,98:296-306.
[25] Liu H F,Yang J L,Du F F,et al.Absorption and disposition of ginsenosides after oral administration ofPanaxnotoginsengextract to rats[J].Drug Metabo Dispos,2009,37(12):2290-2298.
[26] Han M,Sha X Y,Wu Y J,et al.Oral absorption of ginsenoside Rb1usinginvitroandinvivomodels[J].Planta Med,2006,72(5):398-404.
[27] 韓旻,韓麗妹,王青松,等.三七皂苷的口服吸收機(jī)制[J].藥學(xué)學(xué)報(bào),2006,41(6):498-505.
[28] Liu C,Hu M Y,Guo H F,et al.Combined contribution of increased intestinal permeability and inhibited deglycosylation of ginsenoside Rb1in the intestinal tract to the enhancement of ginsenoside Rb1exposure in diabetic rats after oral administration[J].Drug metabolism and disposition:the biological fate of chemicals,2015,43(11):1702-1710.
[29] 趙潔,楊彩華,胡明,等.人參皂苷Rb2透過Caco-2單細(xì)胞層的吸收特征研究[J].南方醫(yī)科大學(xué)學(xué)報(bào),2009,29(12):2387-2390.
[30] 趙潔,楊彩華,胡明,等.人參皂苷Rb3透過Caco-2單細(xì)胞層模型上的吸收特征研究[J].中國(guó)藥房,2010,21(3):196-198.
[31] 謝海棠,王廣基,趙小辰,等.Caco-2細(xì)胞對(duì)人參皂苷Rg3的攝取及代謝研究[J].中國(guó)臨床藥理學(xué)與治療學(xué),2004,9(3):257-260.
[32] Xie H T,Wang G J,Chen M,et al.Uptake and metabolism of ginsenoside Rh2and its aglycon protopanaxadiol by Caco-2cells[J].Biol Pharm Bull,2005,28(2):383-386.
[33] Gu Y,Wang G J,Wu X L,et al.Intestinal absorption mechanisms of ginsenoside Rh2:stereoselectivity and involvement of ABC transporters[J].Xenobiotica,2010,40(9):602-612.
[34] 顧軼,王廣基,張經(jīng)緯,等.20(R)-人參皂苷Rh2的大鼠腸吸收動(dòng)力學(xué)[J].中國(guó)臨床藥理學(xué)與治療學(xué),2009,14(4):368-373.
[35] Paek I B,Moon Y,Kim J,et al.Pharmacokinetics of a ginseng saponin metabolite compound K in rats[J].Biopharm Drug Dispos,2006,27(1):39-45.
[36] Li N,Wang D D.Ge G B,et al.Ginsenoside metabolites inhibitP-glycoproteininvitroandinsituusing three absorption models[J].Planta Med,2014,80(4):290-296.
[37] Yang Z,Wang J R,Niu T,et al.Inhibition ofP-glycoprotein leads to improved oral bioavailability of compound K,an anticancer metabolite of red ginseng extract produced by gut microflora[J].Drug Metabo Dispos,2012,40(8):1538-1544.
[38] Liang Y,Zhou Y Y,Zhang J W,et al.Pharmacokinetic compatibility of ginsenosides andSchisandralignans in Shengmai-san:from the perspective ofP-glycoprotein[J].PLoS One,2014,9(6):e98717/1-e98717/12.
[39] 李昊,孫建國(guó),謝海棠,等.大鼠腸管外翻模型對(duì)人參皂苷Rg1吸收機(jī)制的研究[J].中國(guó)臨床藥理學(xué)與治療學(xué),2004,9(5):510-513.
[40] Wakabayashi C,Hasegawa H,Murata J,et al.Invivoantimetastatic action of ginseng protopanaxadiol saponins is based on their intestinal bacterial metabolites after oral administration[J].Oncol Res,1997,9(8):411-417.
[41] Leea J,Leea E,Kim D,et al.Studies on absorption,distribution and metabolism of ginseng in humans after oral administration[J].J Ethnopharmacol,2009,122(1):143-148.
[42] Xu Q F,F(xiàn)ang X L,Chen D F.Pharmacokinetics and bioavailability of ginsenoside Rb1and Rg1fromPanaxnotoginsengin rats[J].J Ethnopharmacol,2003,84(2-3):187-192.
[43] Li X Y,Wang G J,Sun J G,et al.Pharmacokinetic and absolute bioavailability study of total panax notoginsenoside,a typical multiple constituent traditional chinese medicine(TCM)in rats[J].Biol Pharm Bull2007,30(5):847-851.
[44] Wang W,Wang G J,Xie H T,et al.Determination of ginsenoside Rd in dog plasma by liquid Chromatography-mass spectrometry after solid-phase extraction and its application in dog pharmacokinetics studies[J].J Chromatogr B,2007,852(1-2):8-14.
[45] Xie H T,Wang G J,Sun J G,High performance liquid chromatographic-mass spectrometric determination of ginsenoside Rg3and its metabolites in rat plasma using solid-phase extraction for pharmacokinetic studies[J].J Chromatogr B,2005,818(2):167-173.
[46] Gu Y,Wang G J,Sun J G,et al.Pharmacokinetic characterization of ginsenoside Rh2,an anticancer nutrient from ginseng,in rats and dogs[J].Food Chem Toxicol,2009,47(9):2257-2268.
[47] Joo K M,Lee J H,Jeon H Y,et al.Pharmacokinetic study of ginsenoside Re with pure ginsenoside Re and ginseng berry extracts in mouse using ultra performance liquid chromatography/mass spectrometric method[J].J Pharm Biomed Anal2010,51(1):278-283.
[48] Sun J G,Wang G J,Xie H T,Simultaneous rapid quantification of ginsenoside Rg1and its secondary glycoside Rh1and aglycone protopanaxatriol in rat plasma by liquid chromatography-mass spectrometry after solid-phase extraction[J].J Pharm Biomed Anal,2005,38(1):126-132.
[49] Xu M J,Wang G J,Xie H T,et al.Determination of ginsenoside Rg2in rat plasma by high-performance liquid chromatography-mass spectrometry after solid-phase extraction[J].Analytical Letters,2006,39(1):113-126.
[50] Lai L,Hao H P,Liu Y T,et al.Characterization of pharmacokinetic profiles and metabolic pathways of20(S)-ginsenoside Rh1invivoandinvitro[J].Planta Med,2009,75(8):797-802.
[51] Zhang X R,Zhang D,Xu J H,et al.Determination of25-OH-PPD in rat plasma by high-performance liquid chromatography-mass spectrometry and its application in rat pharmacokinetic studies[J].J Chromatogr B,2007,858(1-2):65-70.
[52] Qi L W,Wang C Z,Yuan C S:Isolation and analysis if ginseng:advances and challenges[J].Nat Prod Rep,2011,28(3):467-495.
[53] Sun D,Wang B,Shi M,et al.Pharmacokinetic,tissue distribution and excretion of ginsenoside-Rd in rodents[J].Phytomedicine,2012,19(3-4):369-373.
[54] 楊秀偉.中藥成分的吸收、分布、代謝、排泄、毒性與藥效(ADME/Tox./Act):上冊(cè)[M].北京:中國(guó)醫(yī)藥科技出版社,2006:978-1052.
[55] Bae S H,Park J B,Zheng Y F,et al.Pharmacokinetics and tissue distribution of ginsenoside Rh2and Rg3epimers after oral administration of BST204,a purified ginseng dry extract,in rats[J].Xenobiotica,2014,44(12):1099-1107.
[56] 李柯.薯蕷皂苷和人參皂苷Rg3動(dòng)物體內(nèi)藥物動(dòng)力學(xué)研究[D].沈陽:沈陽藥科大學(xué),2005.
[57] 劉繼華,盧丹,劉金平,等.20(S)-人參皂苷Rg3眼膏在兔眼組織分布及其藥代動(dòng)力學(xué)[J].藥學(xué)學(xué)報(bào),2005,40(3):258-261.
[58] 劉繼華,盧丹,劉金平,等.大鼠肌內(nèi)注射20(S)-人參皂苷Rg3的藥動(dòng)學(xué)研究[J].中國(guó)藥學(xué)雜志,2007,42(14):1087-1090.
[59] 張均田.人參冠百草—人參化學(xué)、生物活性和藥代動(dòng)力學(xué)研究進(jìn)展[M].北京:化學(xué)工業(yè)出版社,2008,72-78.
[60] Feng L,Wang L,Hu C J,et al.Pharmacokinetics,tissue distribution,metabolism,and excretion of ginsenoside Rg1in rats[J].Arch Pharm Res,2010,33(12):1975-1984.
[61] 劉梅,王莉,胡凱莉,等.人參皂苷Rg1經(jīng)PEG修飾前后的組織分布研究[J].中國(guó)中藥雜志,2012,37(12):1747-1750.
[62] Geng C,Yin J Y,Yu X H,et al.Tissue distribution and excretion study of neopanaxadiol in rats by ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry[J].Biomed Chromatogr,2015,29(3):333-340.
[63] Hao M,Wang W,Zhao Y Q,et al.Pharmacokinetics and tissue distribution of25-hydroxyprotopanaxadiol,an anti-cancer compound isolated fromPanaxginseng,in athymic mice bearing xenografts of human pancreatic tumors[J].Eur J Drug Metabo Pharmacokinet,2011,35(3-4):109-113.
[64] Chen GT,Yang M,Song Y,et al.Comparative analysis on microbial and rat metabolism of ginsenoside Rb1by high-performance liquid chromatography coupled with tandem mass spectrometry[J].Biomed Chromatogr,2008,22(7):779-785.
[65] 林力,劉建勛,張穎,等.LC-MS/MS法測(cè)定大鼠口服人參皂苷Rg1,Re,Rb1和Rd 的藥動(dòng)學(xué)[J].中國(guó)藥學(xué)雜志,2009,44(5):373-377.
[66] Sun J H,Wu W,Guo Y Y,et al.Pharmacokinetic study of ginsenoside Rc and simultaneous determination of its metabolites in rats using RRLC-Q-TOF-MS[J].J Pharm Biomed Anal,2014,88:16-21.
[67] 楊柳,許舜軍,曾星,等.大鼠尿中人參皂苷Rd及其代謝物的LC-MS研究[J].藥學(xué)學(xué)報(bào),2006,41(8):742-746.
[68] Yang L,Deng Y H,Xu S J,et al.Invivopharmacokinetic and metabolism studies of ginsenoside Rd[J].J Chromatogr B,2007,854(1-2):77-84.
[69] Qian TX,Cai ZW,Wong RNS,et al.Invivorat metabolism and pharmacokinetic studies of ginsenoside Rg3[J].J Chromatogr B,2005,816(1-2):223-232.
[70] Li K,Chen X Y,Xu J H,Li X,et al.Liquid chromatography/tandem mass spectrometry for pharmacokinetic studies of20(R)-ginsenoside Rg3in dog[J].Rapid Commun Mass Spectrom,2005,19(6):813-817.
[71] Wang H L,Zou H F,Kong L,et al.Determination of ginsenoside Rg3in plasma by solid-phase extraction and high-performance liquid chromatography for pharmacokinetic study[J].J Chromatogr B,1999,731(2):403-409.
[72] 龐煥,汪海林,富力,等.20(R)-人參皂苷Rg3人體藥代動(dòng)力學(xué)研究[J].藥學(xué)學(xué)報(bào),2001,36(3):170-173.
[73] Yang L,Xu S J,Liu C J,et al:Invivometabolism study of ginsenoside Re in rat using high-performance liquid chromatography coupled with tandem mass spectrometry[J].Anal Bioanal Chem2009,395(5):1441-1453.
[74] 彭纓,王淑君,潘衛(wèi)三,等.人參皂苷Re大鼠體內(nèi)藥物動(dòng)力學(xué)研究[J].沈陽藥科大學(xué)學(xué)報(bào),2006,23(4):197-200.
[75] Liu L,Huang J Q,Hu X,et al.Simultaneous determination of ginsenoside(G-Re,G-Rg1,G-Rg2,G-F1,G-Rh1)and protopanaxatriol in human plasma and urine by LC-MS/MS and its application in a pharmacokinetics study of G-Re in volunteers[J].J Chromatogr B,2011,879(22):2011-2017.
[76] Yang L,Xu S J,Wu Z F,et al.Determination of ginsenoside-Rg1in human plasma and its application to pharmacokinetic studies following intravenous administration of ‘Shenmai’ injection[J].Phytother Res,2009,23(1):65-71.
[77] 楊秀偉,桂方晉,田建明,等.人參皂苷-Rg2在大鼠體內(nèi)的藥代動(dòng)力學(xué)[J].中國(guó)藥理學(xué)通報(bào),2009,25(7):967-970.
[78] Gui FJ,Yang XW,Li LY,et al.Simultaneous enantiomer determination of20(R)-and20(S)-ginsenoside-Rg2in rat plasma after intravenous administration using HPLC method[J].J Chromatogr B,2007,850(1-2):1-6.
[79] Kong L T,Wang Q,Xiao B X,et al.Different pharmacokinetics of the two structurally similar dammarane sapogenins,protopanaxatriol and protopanaxadiol,in rats[J].Fitoterapia,2013,86:48-53.
[80] Zhao J,Su C,Yang C P,et al.Determination of ginsenosides Rb1,Rb2,and Rb3in rat plasma by a rapid and sensitive liquid chromatography tandem mass spectrometry method:Application in a pharmacokinetic study[J].J Pharm Biomed Anal,2012,64-65:94-97.
[81] Chen W,Dang Y J,Zhu C Y.Simultaneous determination of three major bioactive saponins ofPanaxnotoginsengusing liquid chromatography-tandem mass spectrometry and a pharmacokinetic study[J].Chin Med,2010,5:12-17.
[82] Song M,Zhang S Y,Xu X Y,et al.Simultaneous determination of threePanaxnotoginsengsaponins at sub-nanograms by LC-MS/MS in dog plasma for pharmacokinetics of compound Danshen tablets[J].J Chromatogr B,2010,878(32):3331-3337.
[83] Deng G F,Wang D L,Meng M X,et al.Simultaneous determination of notoginsenoside R1,ginsenoside Rg1,Re,Rb1and icariin in rat plasma by ultra-performance liquid chromatography-tandem mass spectrometry[J].J Chromatogr B,2009,877(22):2113-2122.
[84] Li Z G,Zhang R,Wang X P,et al.Simultaneous determination of seven ginsenosides in rat plasma by high-performance liquid chromatography coupled to time-of-flight mass spectrometry:application to pharmacokinetics of Shenfu injection[J].Biomed Chromatogr,2015,29(2):167-175.
[85] 楊秀偉,桂方晉,宋燕,等.人參皂苷-Rg2的排泄實(shí)驗(yàn)研究[J].中國(guó)中藥雜志,2009,34(10):1281-1284.
[86] Tawab M A,Bahr U,Karas M,et al.Degradation of ginsenosides in humans after oral administration[J].Drug Metab.Dispos.2003,31(8):1065-1071.
[87] 呂靜,李珂珂,李爭(zhēng)寧,等.人參皂苷化合物K乙酰化衍生物的合成及分析[J].中國(guó)現(xiàn)代中藥,2015,17(5):431-439.
[88] Li W F,Chen L R,Gong X J,et al.Synthesis of esters of ginsenoside metabolite M1and their cytotoxicity on MGC80-3cells[J].Molecules,2013,18(4):3689-3702.
PharmacokineticStudiesofChemicalConstituentsofGinseng
YANGXiuwei*
(StateKeyLaboratoryofNaturalandBiomimeticDrugs,DepartmentofNaturalMedicines,SchoolofPharmaceuticalSciences,PekingUniversity,Beijing100191,China)
The wide range of therapeutic and health care potential of ginseng has been studied extensively,and ginsenosides,the principal active ingredients of ginseng,are shown to be involved in modulating multiple physiological activities.Biological and environmental factors may affect the efficacy of ginsenosides.Evidence from pharmacokinetic and metabolic studies of ginsenosides demonstrated that (1) the absorption of many ginsenosides from gastrointestinal tract is different along with their different degrees of glycosylation in the molecular structure;(2) the poor membrane permeability of polyglycosylated prototypic ginsenoside predicted from the human Caco-2cell monolayer model restricted their oral absorption badly;(3) ginsenoside may be metabolized mainly to their prosaponins and/or aglycones by intestinal microflora before absorption into circulatory system;(4) the intestinal microflora-dependent biotransformation of some ginsenosides in the gastrointestinal tract could reflect a pathway of bioactivation resulting in the formation of bioactive intermediates and/or end-products,suggesting that ginsenoside is likely to be a prodrug;and (5) intact and some deglycosylated products are cleared from the body.This review provides an overview of the recent advances in biotransformation and/or metabolism as well as pharmacokinetics of ginsenosides,which might greatly contribute to supply the scientific basis for Evidence-Based Medicine in clarifying the effective substance basis of ginseng.
Panaxginseng;ginsenoside;pharmacokinetic
10.13313/j.issn.1673-4890.2016.1.004
2015-10-30)
國(guó)家自然科學(xué)基金重點(diǎn)項(xiàng)目(81530097);“十二五”國(guó)家科技支撐專項(xiàng)(2011BAI03B01;2011BAI07B08)
*
楊秀偉,教授,博士生導(dǎo)師,研究方向:天然產(chǎn)物化學(xué)與藥物代謝;E-mail:xwyang@bjmu.edu.cn

