加味小柴胡湯抗幽門螺桿菌的有效物質部位群研究
胡麗娟,劉蔚,吳歡歡,李力,周愛軍,劉焱文*
(1.湖北中醫藥大學,湖北 武漢 430065;2.武漢市中醫醫院,湖北 武漢 430050;3.東莞市中醫院,廣東 東莞 523000)
加味小柴胡湯抗幽門螺桿菌的有效物質部位群研究
胡麗娟1,劉蔚1,吳歡歡1,李力2,周愛軍3,劉焱文1*
(1.湖北中醫藥大學,湖北 武漢 430065;2.武漢市中醫醫院,湖北 武漢 430050;3.東莞市中醫院,廣東 東莞 523000)
目的:對加味小柴胡湯抗幽門螺桿菌(Helicobacter pylori,H.pylori)的有效物質部位群進行篩選研究,以期闡述其藥效物質基礎,為該經典方劑治療胃潰瘍的臨床療效提供現代藥理學依據。方法:在中醫藥理論指導下,將加味小柴胡湯復方視為整體,采用系統溶劑法提取分離為揮發油、生物堿類、酚酸類、皂苷類、多糖類等化學物質部位;采用瓊脂擴散法和液體稀釋法,考察該方劑及其各化學物質部位對H.pylori 的抑菌圈直徑和最低抑菌濃度(minimal inhibitory concentration,MIC)。結果:全方水煎液組抑菌圈直徑(6.90±0.63)mm,MIC為0.125 g生藥·mL-1;揮發油物質部位組(7.46±0.47)mm,MIC為0.500 g生藥·mL-1;生物堿物質部位組(7.28±0.21)mm,MIC為0.130 g生藥·mL-1;酚酸類物質部位組(7.46±0.10)mm,MIC為0.506 g生藥·mL-1;皂苷類物質部位組(7.29±0.10)mm,MIC為0.246 g生藥·mL-1;總多糖物質部位組沒有產生抑菌圈。結論:確定了加味小柴胡湯方中揮發油、生物堿類、酚酸類和皂苷類等物質部位為抗H.pylori的有效物質部位群。
加味小柴胡湯;幽門螺桿菌;有效物質部位群;抑菌圈;MIC
幽門螺桿菌(H.pylori)是胃潰瘍和慢性胃炎疾患的病原體,也是導致胃癌和淋巴癌的重要病因。人類是H.pylori唯一天然宿主,因而胃潰瘍和慢性胃炎為常見病、多發病。我國是H.pylori感染高發地區,感染人群約占56.22%,其中西藏地區高達84.62%[1],嚴重危害我國人民健康。因此,尋找抗H.pylori的藥物是醫藥科學工作者的重要研究課題。
加味小柴胡湯以張仲景所著《傷寒論》中小柴胡湯為基本方,加味干姜、黃連、白術、茯苓組成。東莞市中醫院周愛軍主任醫師長期臨床運用加味小柴胡湯治療胃潰瘍和慢性胃炎,療效顯著。本實驗在臨床療效基礎上,將加味小柴胡湯復方視為整體,采用系統溶劑法將其提取分離為揮發油、生物堿類、酚酸類、皂苷類、多糖類等部位;以抑菌圈直徑和最低抑菌濃度作為考察指標,對各物質部位進行抗H.pylori篩選研究,確定了該方劑的有效物質部位群。因此,本實驗為加味小柴胡湯用于治療胃潰瘍和慢性胃炎的臨床療效提供了科學實驗依據。
1 儀器與材料
1.1 儀器
數顯電熱培養箱303A-3型(上海浦東榮豐科學儀器有限公司);SW-CJ-1FD潔凈工作臺(蘇州安泰空氣技術有限公司);立式滅菌器LMQ.C型(寧波甬安醫療器械制造有限公司);超純水機QYYS-20A型(重慶前沿水處理設備有限公司);光學顯微鏡BX41型(奧林巴斯);-80 ℃立式超低溫保存箱DW-86L288型(Haier)等。
1.2 材料
微需氧產氣袋(三菱瓦斯化學株式會社);哥倫比亞培養基、哥倫比亞血瓊脂基礎、2.5 L圓底立式厭氧培養袋、HB四連式牛津杯(青島海博生物技術有限公司);無菌脫纖維綿羊血(平睿生物科技有限公司)。
1.3 質控菌
幽門螺桿菌標準菌種ATCC43504(上海北諾生物科技有限公司)。
1.4 供試藥物的制備
加味小柴胡湯全方水煎液的制備:按處方比例稱取一定量各味中藥,水煎煮提取,濃縮,干燥,研磨成藥粉。稱取藥粉適量,用雙蒸水溶解,定容至10 mL,配制成相當于2 g生藥·mL-1的藥液,備用。
揮發油物質部位藥液的制備:取處方量中藥,采用水蒸氣蒸餾法提取揮發油。取揮發油適量,加100 μL聚山梨酯-80,繼加入雙蒸水定容至10 mL,配制成相當于4 g生藥·mL-1的藥液,備用。
總多糖物質部位藥液的制備:取加味小柴胡湯除黃連外組方的水煎液的濃縮液,少量多次加入95%乙醇,攪拌,使藥液中乙醇濃度達70%,靜置過夜,減壓抽濾,將醇沉物干燥,得總多糖物質部位。取總多糖干浸膏粉適量,用雙蒸水定容至10 mL,配制成相當于4 g生藥·mL-1的藥液,備用。
生物堿物質部位藥液的制備:取上述抽濾后濾液適量,揮至無醇味,用1 mol·L-1NaOH溶液調pH至10~11,用等體積的三氯甲烷萃取8次,合并三氯甲烷萃取液,減壓回收三氯甲烷,得三氯甲烷物質部位;另按處方比例稱取黃連,用甲醇-鹽酸(100∶1)混合溶液超聲處理3次,每次30 min,合并黃連提取液,減壓回收溶劑,得黃連提取物;按處方比例稱取三氯甲烷萃取物和黃連提取物適量,混合,得生物堿物質部位。取生物堿物質部位干浸膏粉適量,加100 μL聚山梨酯-80,繼加入雙蒸水定容至10 mL,配制成相當于4 g生藥·mL-1的藥液,備用。
酚酸類物質部位藥液的制備:將上述三氯甲烷萃取后的水相用1mol·L-1HCL溶液調pH至3~4,用等體積乙酸乙酯萃取8次,合并乙酸乙酯萃取液,減壓回收乙酸乙酯,得酚酸物質部位。取酚酸物質部位干浸膏粉適量,加100 μL聚山梨酯-80,繼加入雙蒸水定容至10 mL,配制成相當于4 g生藥·mL-1的藥液,備用。
皂苷類物質部位藥液的制備:將上述乙酸乙酯萃取后的水相用1 mol·L-1NaOH溶液調pH至中性,用等體積水飽和正丁醇萃取8次,合并正丁醇層,減壓回收正丁醇,得皂苷物質部位。取皂苷物質部位干浸膏粉適量,用雙蒸水溶解定容至10 mL,配制成相當于4 g生藥·mL-1的藥液,備用。
1.5 陽性對照藥物的制備
稱取克拉霉素膠囊(江蘇亞邦愛普森藥業,批號:20140302)內容物0.25 g,用雙蒸水溶解并定容至15 mL,備用。
2 方法[2-4]
2.1 選擇性培養基的配制
2.1.1 哥倫比亞液體培養基 稱取本品29.0 g,加熱溶解于1000 mL雙蒸水中,121 ℃高壓滅菌15 min,備用。
2.1.2 哥倫比亞血瓊脂固體培養基 稱取本品39.0 g,加熱溶解于1000 mL雙蒸水中,121 ℃高壓滅菌15 min,冷至50 ℃左右時,加入5%無菌脫纖維綿羊血,混勻,趁熱傾入無菌平皿。
2.2 菌種的復蘇與培養
將H.pylori標準菌株從-80 ℃冰箱取出,室溫放冷;取標準菌種100 μL置固體培養基中,用L型玻璃棒平鋪,再將培養皿裝入培養袋中,放入微需氧產氣袋,迅速密封后置于恒溫培養箱中,37 ℃培養72 h。
2.3 菌液的制備及其濃度確定
刮除固體培養基上的菌苔,將其轉移至50 mL無菌的液體培養基中,作為原菌液,37 ℃培養24 h,用0.9%氯化鈉溶液將菌液稀釋成10倍、100倍、103倍、104倍、105倍的菌懸液,搖勻,分別取稀釋的菌懸液各10 μL置固體培養皿中,用接種針劃“豐”字,再將培養皿裝入培養袋中,放入微需氧產氣袋,迅速密封后置于恒溫培養箱中,37 ℃培養72 h;每個濃度平行試驗2次。采用菌落計數的方法,確定稀釋后的菌液的濃度,再選取合適的菌液濃度進行體外抗菌試驗。
2.4 瓊脂擴散法測定抑菌環直徑
取直徑90 mm、高度為16 mm的培養皿,傾注約15 mL熱融的哥倫比亞血瓊脂培養基,待冷凝后,作底層;另取適量熱融的血瓊脂培養基,冷至50 ℃左右,加入適量菌懸液(約1 mL/皿,濃度為1×105CFU·mL-1),搖勻后傾入培養皿中,約6 mL/皿,作為菌層;冷凝后,用無菌鑷夾取HB四連式牛津杯置于培養皿上,每孔加各物質部位藥液100 μL,每個物質部位重復3次;最后將培養皿裝入培養袋中,放入微需氧產氣袋,迅速密封后置于恒溫培養箱中,37 ℃培養72 h;觀察并測量各部位藥液的抑菌圈大小。
2.5 液體稀釋法測定最低抑菌濃度(MIC)
取各試驗組藥液,用液體培養基稀釋至1∶4、1∶8、1∶16、1∶32、1∶64、1∶128等濃度,其中全方水煎液組從1∶1、1∶2開始稀釋;取各組稀釋后的藥液各1 mL,置于2 mL試管中,分別加入50 μL菌懸液(濃度為1×107CFU·mL-1),每稀釋級重復2次。陽性對照管:1 mL液體培養基中加入50 μL菌懸液,使渾濁或有菌層;陰性對照管:2 mL液體培養基,應澄清。最后將試管裝入培養袋中,放入微需氧產氣袋,迅速密封后置于恒溫培養箱中,37 ℃培養72 h;觀察藥液的渾濁情況,藥液渾濁說明有菌生長,藥液澄清且搖勻后仍澄清說明無菌生長,無菌生長的供試藥液最低濃度為該供試藥液的MIC。
3 結果
3.1 H.pylori 的菌落形態
光學顯微鏡觀察菌落形態特征,呈“海鷗”狀或者彎曲的“S”,見圖1~2。
圖1 幽門螺桿菌培養菌落形態

圖2 幽門螺桿菌鏡檢圖
3.2 抑菌圈試驗測定結果
全方水煎液組、揮發油物質部位組、生物堿物質部位組、酚酸類物質部位組、皂苷類物質部位組都顯示出明顯抑菌效果,與陽性藥物克拉霉素比較無顯著差異;而總多糖物質部位組沒有產生抑菌圈,顯示無抗幽門螺桿菌活性。提示加味小柴胡湯抗幽門螺桿菌的有效物質部位群為揮發油類、生物堿類、酚酸類和皂苷類,結果見表1、圖3。

組別藥物濃度/g生藥·mL-1抑菌圈直徑/mm陽性對照組 0 0167g·mL-17 60±0 13全方水煎液組 2 006 90±0 63揮發油物質部位組4 007 46±0 47生物堿物質部位組4 157 28±0 21酚酸物質部位組 4 057 46±0 10皂苷物質部位組 3 947 29±0 10多糖物質部位組 4 00—

注:1.全方水煎液組;2.揮發油組;3.生物堿組;4.酚酸組;5.皂苷組;6.多糖組;7.陽性對照組。圖3 加味小柴胡湯及其各物質部位抑菌效果圖
3.3 MIC測定結果
采用倍比稀釋法對加味小柴胡湯及各物質部位進行最低抑菌濃度的測定,測定結果見表2。結果顯示,全方水煎液組的MIC為0.125 g生藥·mL-1,生物堿物質部位的MIC為0.130 g生藥·mL-1,皂苷物質部位的MIC為0.246 g生藥·mL-1,揮發油部位的MIC為0.500 g生藥·mL-1,酚酸部位的MIC為0.506 g生藥·mL-1。
4 討論
目前臨床治療H.pylori感染疾患主要采用三聯治療方案,雖然取得了較好的治療效果,但隨著抗菌藥的耐藥性、不良反應及復發率高等問題的出現,其對H.pylori感染疾患的效果已受到了明顯影響。因此,近年來很多學者開始關注中醫藥治療H.pylori感染疾患,體現了中醫藥治療胃潰瘍和慢性胃炎疾患過程中有效物質系統配伍協同作用的優勢。據文獻報道,黃連、黃芩、茯苓、黨參、甘草等中藥具有抗H.pylori的藥效作用,小柴胡湯、半夏瀉心湯、四君子湯、黃連解毒湯等中藥復方治療H.pylori感染疾患具有較好的療效[5]。中醫臨床實踐證實,H.pylori感染所致胃潰瘍和慢性胃炎以濕熱型病例居多,其次為肝胃不和型[6]。加味小柴胡湯以柴胡為君藥引領和解表里、疏肝升陽之功效,配伍黃連、黃芩發揮清熱解毒功能,半夏、生姜、白術、茯苓的功效為燥濕化痰、解表散寒、補脾補氣,人參、大棗則加強補脾益氣,甘草調和方中諸藥。因此,加味小柴胡湯臨床用于治療胃潰瘍和慢性胃炎疾患符合中醫辨證的普遍規律。
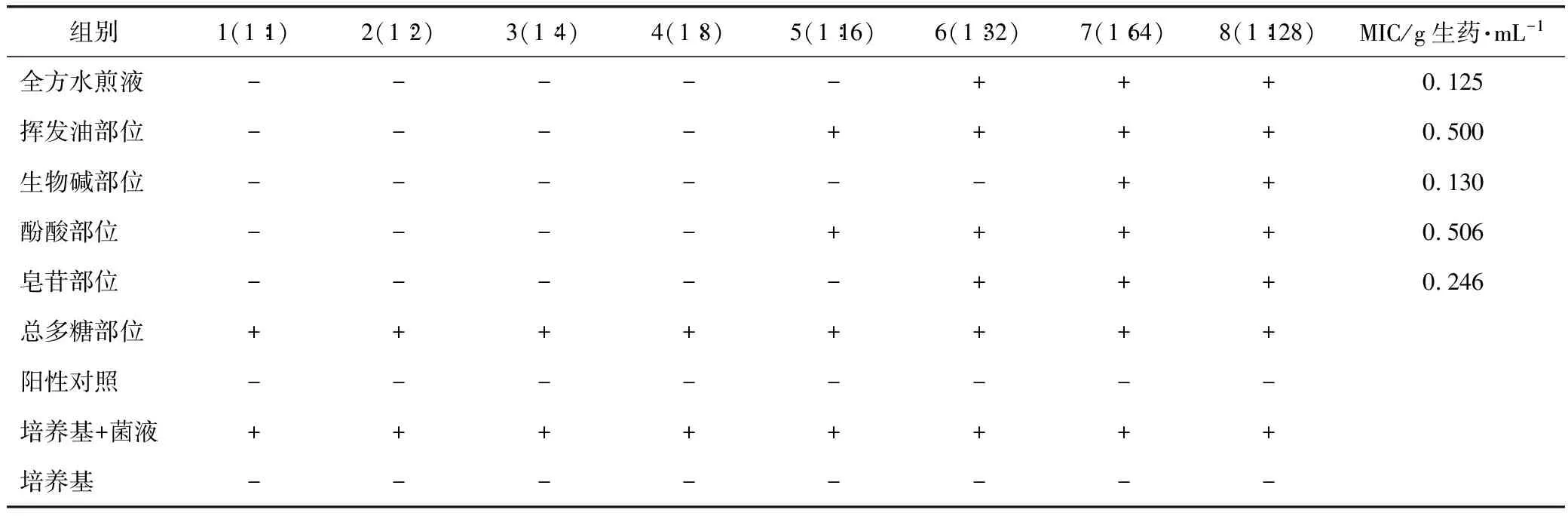
表2 加味小柴胡湯及其各物質部位的MIC實驗結果
注:+表示“渾濁”;-表示“澄清”。
本實驗在綜合分析加味小柴胡湯方中各藥化學成分的基礎上,將該經典方視為整體,根據各類化學成分理化性質的特點,采用系統溶劑法將其提取分離為不同化學物質部位。制備供試品溶液過程中,發現全方、皂苷和多糖部位的水溶性較好,但其他物質部位水溶性較差,故考慮對水溶性較差的物質部位,在供試品溶液制備過程中加入1%聚山梨酯-80助溶。通過查閱相關文獻發現,70%以上濃度的聚山梨酯-80具有一定抑菌作用[7]。本實驗的供試品藥液制備過程中僅加入1%聚山梨酯-80助溶,因此推測對實驗結果影響甚微。由于培養H.pylori的固體培養基呈鮮紅色,進行抑菌圈直徑測量時有背景干擾,故在測量抑菌圈直徑時,將培養皿放在菌落計數器的白光板上,打開白光燈,在白光板上用游標卡尺測量抑菌圈直徑。在較強白光照射下,背景干擾降低,可觀察到抑菌圈,抑菌圈直徑大小也可準確測量。
通過抗H.pylori的篩選研究,確定了揮發油、生物堿、酚酸類、皂苷類等為有效部位群物質系統。實驗結果表明,加味小柴胡湯及其有效物質部位群與目前臨床用于治療胃潰瘍和慢性胃炎疾患的純陽正氣膠囊、清胃沖劑、雙黃連口服液等中成藥比較[8-9],其抗H.pylori的作用類似;與陽性藥物比較,亦顯示良好抑菌效果,這對于闡釋該經典方劑的物質基礎具有重要意義。加味小柴胡湯全方提取物與其有效物質部位比較,前者抗H.pylori的效果優于多數有效物質部位,從而體現了中藥復方的配伍協同作用。因此,本實驗研究為加味小柴胡湯治療胃潰瘍和慢性胃炎的臨床療效提供了科學實驗依據,其有效物質的作用機理和配伍協同作用有待進一步深入研究。
[1] 張萬岱,胡伏蓮,蕭樹東,等.中國自然人群幽門螺桿菌感染的流行病學調查[J].現代消化及介入診療,2010,15(5):265-270.
[2] 喻鋼,田萬紅,王斌,等.體外抗幽門螺旋桿菌抑菌方法的研究[J].藥物分析雜志,2014,34(10):1897-1901.
[3] 陳智龍,呂永慧,王玎,等.清熱化濕舒胃方及其寒熱配伍對幽門螺旋桿菌的體外抑菌實驗[J].世界華人消化雜志,2015,23(6):949-953.
[4] 許藝飛,江偉雯,鄺兆進,等.胃瘍寧丸體內外抗幽門螺桿菌的實驗研究[J].中藥新藥與臨床藥理,2014,25(5):572-576.
[5] 甘英輝,嚴歡,程正,等.中藥治療幽門螺桿菌感染的研究進展[J].湖南中醫雜志,2014,30(2):141-143.
[6] 王清暉,黃雅慧.中醫藥治療消化性潰瘍的方法選擇[J].陜西中醫,1998,19(3):118-119.
[7] 胡君茹,姜華,李喜香.三種非水溶性供試品溶劑對抑菌試驗效果的影響[J].西部中藥,2013,26(11):30-31.
[8] 馮青,劉偉,蘇楠,等.純陽正氣膠囊抑制幽門螺桿菌作用研究[J].醫藥導報,2014,33(3):322-324.
[9] 蔣振明,徐國纓,張存鈞,等.中藥復方對幽門螺桿菌抑菌作用的體外實驗[J].中國中西醫結合消化雜志,2001,9(2):101-102.
StudyonAnti-HelicobacterpyloriEffectiveFractionsofModifiedXiaoChaihuDecoction
HU Lijuan1,LIUWei1,WUHuanhuan1,LILi2,ZHOUAijun3,LIUYanwen1*
(1.HubeiUniversityofChineseMedicine,Wuhan430065,China;2.WuhanHospitalofTraditionalChineseMedicine,Wuhan430050,China;3.DongguanHospitalofTraditionalChineseMedicine,Dongguan523000,China)
Objective:To investigate the anti-helicobacter pylori effect of the Modified Xiao Chaihu Decoction and their isolated componentsinvitro.Methods:The means of systematic solvent extraction was used to separate volatile oils,alkaloids,phenolic acids,saponins and polysaccharides from the decoction.The inhibition zones of the decoction and their isolated components were surveyed through agar diffusion method,and the minimal inhibitory concentrations(MICs)were also determined by using fluid dilution method.Results:The bacterial inhibition diameter and MIC of the decoction were(6.90±0.63)mm and 0.125 g·mL-1of the crude drug,the bacterial inhibition diameter and MIC of the volatile oils were(7.46±0.47)mm and 0.500 g·mL-1of the crude drug,the bacterial inhibition diameter and MIC of the alkaloids were(7.28±0.21)mm and 0.130 g·mL-1of the crude drug,the bacterial inhibition diameter and MIC of the phenolic acids were(7.46±0.10)mm and 0.506 g·mL-1of the crude drug,the bacterial inhibition diameter and MIC of the saponins were(7.29±0.10)mm and 0.246 g·mL-1of the crude drug,the bacterial inhibition diameters of the polysaccharides was zero.Conclusion:The volatile oils,alkaloids,phenolic acids and saponins of the Modified Xiao Chaihu Decoction are anti-helicobacter pylor active fractions.
Modified Xiao Chaihu Decoction;Helicobacter pylori;effective fractions;bacterial inhibition diameter;MIC
2015-06-03)
*
劉焱文,教授,博士生導師,研究方向:中藥及其制劑的物質基礎;Tel:(027)88920834,E-mail: ywliu2008@163.com
10.13313/j.issn.1673-4890.2016.3.011

