siRNA干擾USP7表達對喉癌細胞生物學特性的影響
周 芨,鄧世山,嚴達忠,劉 海△
(1.川北醫學院附屬醫院耳鼻喉科,四川南充 637007;2.川北醫學院基礎醫學院,四川南充 637007)
?
siRNA干擾USP7表達對喉癌細胞生物學特性的影響
周芨1,鄧世山2,嚴達忠1,劉海1△
(1.川北醫學院附屬醫院耳鼻喉科,四川南充 637007;2.川北醫學院基礎醫學院,四川南充 637007)
目的通過小干擾RNAs(siRNA)干擾泛素特異性蛋白酶7(USP7)在喉癌細胞中的表達,來探討USP7對喉癌細胞生物學特性的影響。方法自行設計并使用高效siRNA 在喉癌HEP2細胞株特異性干擾USP7表達,然后利用CCK-8法、Transwell小室遷移實驗和流式細胞術觀察USP7干擾后對喉癌細胞增殖、遷移能力和凋亡的影響。結果自行設計的siRNA可高效抑制喉癌HEP2細胞USP7 mRNA及蛋白表達,顯著抑制喉癌細胞的增殖、遷移能力,促進喉癌細胞的凋亡。結論siRNA-USP7可以顯著抑制喉癌細胞增殖和遷移能力,并促進凋亡,提示USP7可能是晚期喉癌治療的一個重要靶標。
喉腫瘤;泛素特異性蛋白酶7;HEP2細胞;RNA,小分子干擾;細胞凋亡
喉癌(laryngeal carcinoma)在頭頸部腫瘤中比較常見,手術是其主要治療手段[1]。對于晚期患者,手術范圍廣,術后容易并發聲音嘶啞甚至失聲,給患者本身帶來極大社會心理壓力[2]。因此,探索新的治療方法及如何改善晚期喉癌患者的預后并提高其生活質量具有重要的臨床價值。泛素蛋白酶系統(ubiquitin-proteasome system,UPS)在腫瘤的發生發展中扮有重要作用,通過抑制其活性顯示出好的抑瘤效應[3]。作者前期研究發現,泛素特異性蛋白酶7(USP7)蛋白在喉癌組織中高表達,癌旁組織中低表達;并發現USP7陽性表達與腫瘤分化程度呈負相關,分化越低,USP7蛋白陽性表達率越高[4]。因此深入研究USP7在喉癌中的作用是非常必要的。
雙鏈小干擾RNA(small interfering RNA,siRNA)由21~25個核苷酸組成,能引起RNA沉寂和抑制靶蛋白的表達[5-6]。為了進一步明確USP7在喉癌中的作用,本研究擬使用siRNA干擾USP7的表達,觀察其對喉癌細胞株HEP2細胞增殖、遷移和凋亡的影響,從而進一步探討USP7在喉癌發生發展中的作用。
1 材料與方法
1.1細胞株人喉癌HEP2細胞株購自中國科學院上海生物科學研究院細胞資源中心,在含10%小牛血清的RPMI-1640培養基,5%CO2、37 ℃恒溫孵箱內培養。
1.2USP7 siRNA設計使用siDirect Version2.0軟件設計出針對USP7基因的特異性siRNA片段3對及無關序列的siRNA片段(negative control siRNA,NC siRNA)1對,見表1,由廣州銳博生物科技有限公司合成。

表1 USP7 siRNA設計序列
1.3細胞轉染將喉癌HEP2細胞以3×105/孔的密度接種于6孔板后24 h,細胞覆蓋達50%~60%后進行轉染。根據脂質體Lipofectamine2000說明書進行操作。實驗分實驗組(轉染有siRNA)、陰性對照組(轉染NC siRNA)、空白組(不轉染),實驗組中又包括siRNA 1組、siRNA 2組、siRNA 3組。
1.4半定量逆轉錄PCR(RT-PCR)在 GeneBank 中檢索出人USP7和β-action全長序列,用 Oligo6 軟件分別設計引物(表2)。以逆轉錄所得cDNA為模板,進行PCR擴增反應。反應條件:94 ℃,5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 45 s,共30個循環。用2%瓊脂糖凝膠,電壓100 V、時間40 min進行電泳,結果在凝膠成像系統觀察擴增的條帶,采集圖片,用Image Lab 3.0 軟件分析,測量灰度值,計算mRNA的相對表達值。
1.5Western blot提取總蛋白等量蛋白加入到10%的十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)進行電泳,并轉至聚偏氟乙烯(PVDF)膜。10%的牛奶封閉60 min,然后敷一抗,4 ℃過夜。抗體及工作濃度如下:兔抗人USP多克隆抗體(1∶200,北京博奧森生物技術有限公司),鼠抗人β-actin抗體(1∶5 000,Santa Cruz公司)。復溫60 min。敷二抗60 min。最后膠片顯影。

表2 RT-PCR引物序列及產物大小
1.6CCK-8檢測細胞活力CCK-8實驗操作步驟按照說明書進行:將細胞以5×103密度接種于96孔板,每組設8個復孔,常規轉染;分別在轉染后24、48、72 h,每孔加入10 μL CCK-8試劑;放入CO2培養箱繼續孵育1 h;用酶標儀測定450 nm波長處的吸光度(A)值,并根據A值分析細胞活力情況。
1.7Transwell 小室遷移模型檢測細胞遷移能力Transwell小室遷移模型實驗根據文獻[6]所述方法進行。簡述如下,常規接種6孔板,分空白組、陰性對照組和siRNA實驗組,轉染72 h后。消化細胞,離心棄培養液,用無血清RPMI 1640培養基重懸。調整細胞密度至5×104。Transwell小室放入24孔培養板中,在小室外加入600 μL含10%小牛血清的RPMI 1640培養基,將各組細胞分別按1×104個/孔加入到小室上室,使每孔內外室液面高度基本保持一致。培養18 h后,取出Transwell小室,用棉簽小心拭去上室膜上細胞;4%多聚甲醛固定30 min,結晶紫染色20 min。倒置顯微鏡200倍光鏡下取上、下、左、右和中心5個視野照相,并計數遷移到膜背面的細胞數,計算其平均值。
1.8細胞凋亡檢測將細胞以1×105密度接種于6孔板,轉染72 h后收集細胞大約1×105個;加入150 μL 1×Binding Buffer(含有1∶1比例的Annexin V-FITC和PI雙染混合液) 懸浮細胞;室溫,避光,孵育15 min;加入100 μL的1×Binding Buffer,1 h內用流式細胞儀檢測。數據的統計與分析軟件為WinMDI 2.9。
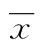
2 結 果
2.1各組喉癌HEP2細胞中USP7 mRNA的表達比較RT-PCR結果表明,轉染72 h后,實驗組siRNA1、siRNA2、siRNA3 3亞組細胞中USP7 mRNA表達水平分別為0.150 5±0.001 2、0.102 6±0.001 9、0.147 3±0.000 8;而陰性對照組USP7 mRNA表達水平為0.456 7±0.000 9,空白組USP7 mRNA表達水平為0.312 9±0.001 0。統計分析發現,USP7 mRNA表達水平在陰性對照組和空白組兩組間差異無統計學意義(P=0.155 6)。實驗組各亞組較陰性對照組及空白組的USP7 mRNA水平均明顯降低,差異有統計學意義(P<0.01)。siRNA2組中USP7 mRNA下降最為顯著。
2.2siRNA轉染喉癌HEP2細胞后對USP7蛋白表達情況轉染72 h后,細胞中USP7蛋白表達水平與陰性對照組比較差異有統計學意義(P<0.01);而陰性對照組及空白組USP7蛋白表達差異無統計學意義(P>0.05),見圖1。表明siRNA顯著抑制了USP7蛋白在HEP7細胞內的表達。
2.3SiRNA干擾USP7蛋白后對喉癌HEP2細胞活力的影響在轉染后不同時間點,陰性對照組和空白組兩組之間細胞活力差異無統計學意義(P>0.05)。但在實驗組中,分別在轉染24、48、72 h后,細胞活力呈時間依賴方式較陰性對照組有顯著下降,差異有統計學意義(P<0.05),見圖2。

圖1 Western blot檢測USP7在各組HEP2細胞中的表達情況

a:P>0.05;b:P<0.05。
圖2CCK-8檢測各組HEP2細胞活力變化情況

a:P=0.196 8;b:P<0.01。
圖3Transwell小室遷移實驗檢測各組細胞的遷移能力
2.4siRNA干擾USP7蛋白后對喉癌HEP2細胞遷移能力的影響倒置顯微鏡下計數穿移到微孔膜下層的細胞。實驗組較陰性對照組明顯降低,差異有統計學意義(P<0.01)。陰性對照組和空白組細胞數量差異無統計學意義(P=0.196 8),見圖3。
2.5siRNA干擾USP7蛋白后對喉癌HEP2細胞凋亡能力的影響轉染72 h后,實驗組細胞的凋亡率為(33.67±4.00)%,空白組和陰性對照組細胞凋亡率分別為(5.21±0.56)%和(6.08±0.43)%,實驗組細胞凋亡率較陰性對照組顯著增加,差異有統計學意義(P=0.000 3)。而空白組和陰性對照組間細胞凋亡率差異無統計學意義(P=0.099 5)。見圖4。

a:P=0.099 5;b:P=0.000 3。
圖4流式細胞術檢測細胞的凋亡情況
3 討 論
喉癌是頭頸部最常見的惡性腫瘤之一,占到了頭頸部腫瘤的20%左右[7]。治療方法包括全喉切除、單獨或者加頸部淋巴結清掃、放射治療、全喉切除加放射治療、以及放射治療聯合化學治療等[8]。病期較晚的患者,除了臨床療效差之外,患者治療后的生活質量受到不同程度的影響,其中尤以手術導致的聲音嘶啞甚至失聲和吞咽困難影響最大,給患者及社會造成極大的負擔[9-10]。因此,深入探討如何提高喉癌療效的同時并改善患者的生活質量具有重要臨床價值。
本研究在喉癌樣本組織中發現,USP7蛋白在喉癌組織高表達,在癌旁組織低表達。USP7蛋白陽性表達與腫瘤分化程度顯著相關,分化程度愈低,陽性表達率則越高[4]。靶向治療已經運用于臨床,并顯示出卓越的治療前景[11]。這為喉癌研究提供了一個著眼點。抑制USP7蛋白功能是否影響喉癌細胞的生物學特性成為本次研究目的。
siRNA由21~25個核苷酸組成,能引起RNA沉寞和抑制靶蛋白的表達。因此,siRNA對諸多疾病(包括基因疾病、病毒性感染和癌)極具治療前景[5]。本研究結果顯示,自行設計的siRNA在mRNA水平顯著抑制了USP7的表達,具有高效性和專一性。進而,利用效率最高的siRNA作為研究,進行細胞轉染,觀察對細胞遷移、增殖和凋亡的影響。結果表明siRNA顯著干擾USP7蛋白表達,抑制喉癌HEP2細胞株的增殖和遷移能力,促進腫瘤細胞凋亡。提示USP7在喉癌中可能作為一個癌基因[12],在癌組織中高表達,具有促進腫瘤細胞增殖和遷移的能力,并有抗癌細胞凋亡的作用。這為喉癌的臨床治療提供了新思路,即通過靶向治療來抑制USP7蛋白高表達類晚期腫瘤的生長,從而達到控制腫瘤的作用。目前,關于泛素類蛋白酶抑制劑的研究已經成為腫瘤治療領域的熱點。Chauhan等[13]研究發現USP7在多發性骨髓瘤患者的骨髓和腫瘤細胞中高表達。回顧性分析發現USP7蛋白表達與總生存時間呈負相關,且USP7蛋白表達水平越低患者復發的時間間隔越長。進而使用USP7的選擇性抑制劑P5091作用于多發性骨髓瘤的耐藥細胞株,發現可以逆轉耐藥促進凋亡;在體內實驗研究中,P5091能顯著抑制腫瘤生長并延長生存時間,且耐受性好。其機制為P5091通過抑制USP7蛋白表達,導致HDM2多聚泛素化,加速HDM2的降解,結果增加了p53和p21蛋白的穩定性。Altun等[14]研究發現P22077作為P5091的類似物,除了具有降低HDM2水平,穩定p53、p21蛋白狀態的作用外,還有降低DNA損傷蛋白DDB1、RBX1、DCAF7和DCAF11的作用,提示P22077可能參與了USP7蛋白和DNA修復酶之間某種未知的功能聯系。Fan等[15]在兒童神經母細胞瘤的研究中,發現USP7高表達可以用于預測患者的不良預后,亦發現其小分子抑制劑P22077在p53野生狀態下通過USP7-HDM2-p53軸高效促進神經母細胞瘤細胞的凋亡,并能逆轉神經母細胞瘤耐藥細胞株LA-N-6耐藥,體內實驗證明P22077能顯著抑制移植瘤生長。而新鑒別出的USP7選擇性抑制劑HBX19818[16],其IC50為28.1 μmol/L,HBX19818通過催化位點的親核攻擊不可逆地綁定到USP7蛋白,引起氯釋放,從而與位于USP7活性位點的Cys223形成共價結合。
去泛素化酶(deubiquitinating enzymes,DUBs)家族負責負性調控泛素信號系統,對癌基因和抑癌基因都有影響,涉及細胞周期、DNA損傷反應、凋亡、信號通路及抑癌基因相關通路。USP7蛋白作為DUBs家族的一員,主要表達于細胞核,少量表達于細胞質[4,12]。除了一個DUB結構域外,USP7還有一個C-末端結構域(至少包含5個泛素樣結構域)和一個N-末端TRAF樣MATH結構域。通過其去泛素化作用,USP7調控多個多聚泛素化亞類蛋白的穩定狀態,如通過改變Mdm2和Bmi1/Mel18的穩定性來分別調控p53和p16INK4a的水平[17-18]。TSPYL5通過和p53競爭綁定到USP7相同區域來調控USP7與p53的綁定結合[19]。USP7還可以通過去泛素化作用調控幾個單聚泛素化的亞類物在細胞內的分布。在氧化應激狀態下,USP7通過和FOXO蛋白相互作用和去泛素化作用,抑制FOXO4的核定位和轉錄活性[20]。同樣,USP7去泛素化作用于PTEN抑癌基因,從而調控它的核排斥[21]。綜上表明,USP7運用p53依賴的和不依賴的方式作用于細胞生理生化功能。本研究的缺陷在于未對USP7通過何種機制來調控喉癌細胞的增殖、遷移和凋亡等生物學行為進行深入探討。通過文獻閱讀,作者猜測USP7通過p53依賴的方式對細胞凋亡、細胞周期產生作用,并擬通過移植瘤模型驗證的體外實驗結果,為siRNA-USP7的臨床轉化研究打下基礎。這是作者下一步研究的目標和方向。
總之,本研究設計出了高效專一的能夠抑制USP7蛋白功能的siRNA,并利用其中效率最高的siRNA2作用于喉癌細胞,在抑制USP7蛋白表達的同時,抑制腫瘤細胞的增殖、遷移能力,促進腫瘤細胞凋亡。這為USP7作為喉癌治療靶點提供了理論基礎。
[1]符曉,李贊,王大海,等.綜合治療9例喉癌術后咽瘺的療效分析[J].中國耳鼻咽喉顱底外科雜志,2012,18(4):305-306.
[2]Li L,Zhang Z,Wang C,et al.Quantitative proteomics approach to screening of potential diagnostic and therapeutic targets for laryngeal carcinoma[J].PLoS One,2014,9(2):e90181.
[3]Kar G,Keskin O,Fraternali F,et al.Emerging role of the ubiquitin-proteasome system as drug targets[J].Curr Pharm Des,2013,19(18):3175-3189.
[4]周芨,鄧世山,劉海.USP7在喉癌組織中的表達及其臨床意義[J].中國耳鼻咽喉顱底外科雜志,2015,21(1):27-30.
[5]Higuchi Y,Kawakami S,Hashida M.Strategies for in vivo delivery of siRNAs:recent progress[J].Bio Drugs,2010,24(3):195-205.
[6]Ren T,Qing Y,Dai N,et al.Apurinic/apyrimidinic endonuclease 1 induced upregulation of fibroblast growth factor 2 and its receptor 3 induces angiogenesis in human osteosarcoma cells[J].Cancer Sci,2014,105(2):186-194.
[7]Karatzanis AD,Psychogios G,Waldfahrer F,et al.Management of locally advanced laryngeal cancer[J].J Otolaryngol Head Neck Surg,2014,43(1):4.
[8]Spector GJ,Sessions DG,Lenox J,et al.Management of stage Ⅳ glottic carcinoma:therapeutic outcomes[J].Laryngoscope,2004,114(8):1438-1446.
[9]Keszte J,Danker H,Dietz A,et al.Mental disorders and psychosocial support during the first year after total laryngectomy[J].Clin Otolaryngol,2013,38(6):494-501.
[10]Starmer HM,Tippett DC,Webster KT.Effects of laryngeal cancer on voice and swallowing[J].Otolaryngol Clin North Am,2008,41(4):793-818,vii.
[11]Shen M,Schmitt S,Buac D,et al.Targeting the ubiquitin-proteasome system for cancer therapy[J].Expert Opin Ther Targets,2013,17(9):1091-1108.
[12]Cheng C,Niu C,Yang Y,et al.Expression of HAUSP in gliomas correlates with disease progression and survival of patients[J].Oncol Rep,2013,29(5):1730-1736.
[13]Chauhan D,Tian Z,Nicholson B,et al.A small molecule inhibitor of ubiquitin-specific protease-7 induces apoptosis in multiple myeloma cells and overcomes bortezomib resistance[J].Cancer Cell,2012,22(3):345-358.
[14]Altun M,Kramer HB,Willems LI,et al.Activity-based chemical proteomics accelerates inhibitor development for deubiquitylating enzymes[J].Chem Biol,2011,18(11):1401-1412.
[15]Fan YH,Cheng J,Vasudevan S,et al.USP7 inhibitor P22077 inhibits neuroblastoma growth via inducing p53-mediated apoptosis[J].Cell Death Dis,2013,4:e867.
[16]Reverdy C,Conrath S,Lopez R,et al.Discovery of specific inhibitors of human USP7/HAUSP deubiquitinating enzyme[J].Chem Biol,2012,19(4):467-477.
[17]Cummins JM,Rago C,Kohli M,et al.Tumour suppression:disruption of HAUSP gene stabilizes p53[J].Nature,2004,428(6982):1 p following 486.
[18]Maertens GN.El Messaoudi-Aubert S,Elderkin S,et al.Ubiquitin-specific proteases 7 and 11 modulate Polycomb regulation of the INK4a tumour suppressor[J].EMBO J,2010,29(15):2553-2565.
[19]Epping MT,Meijer LA,Krijgsman O,et al.TSPYL5 suppresses p53 levels and function by physical interaction with USP7[J].Nat Cell Biol,2011,13(1):102-108.
[20]Van Der Horst A,De Vries-Smits AM,Brenkman AB,et al.FOXO4 transcriptional activity is regulated by monoubiquitination and USP7/HAUSP[J].Nat Cell Biol,2006,8(10):1064-1073.
[21]Song MS,Salmena L,Carracedo A,et al.The deubiquitinylation and localization of PTEN are regulated by a HAUSP-PML network[J].Nature,2008,455(7214):813-817.
Influence of siRNA interfering USP7 expression on cytobiological characteristics of laryngeal cancer cells
ZhouJi1,DengShishan2,YanDazhong1,LiuHai1△
(1.DepartmentofOtolaryngology,AffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong,Sichuan637007,China;2.SchoolofBasicMedicine,NorthSichuanMedicalCollegeofNanchong,Sichuan637007,China)
ObjectiveThis study is to investigate the influences of USP7 on the cytobiological characteristics of laryngeal cancer cells by small interfering RNA (siRNA) interfering the USP7 expression in the laryngeal cancer cells.MethodsThe self-designed highly efficient siRNA was used to conduct the specific interference on USP7 expression in laryngeal cancer HEP2 cells.Then the influence on the capacity of cell proliferation and migration,as well as apoptosise after USP7 interference were observed by using the CCK-8 method,Transwell chamber migration test and flow cytometry.ResultsThe self-designed siRNA could efficiently inhibit the expression of USP7 mRNA in laryngeal cancer cells,furthermore markedly suppressed the proliferation and migration of laryngeal cancer cells,enhanced the cell apoptosis in laryngeal cancer HEP2 cells in vitro.ConclusionThe siRNA interfering USP7 can inhibit the proliferation and migration capacity of laryngeal cancer cells,and promoted their apoptosis.
laryngeal neoplasms;ubiquitin-specific protease 7;HEP2 cell line;RNA,small interfering;apoptosis
周芨(1979-),主治醫師,碩士,主要從事耳鼻咽喉頭頸外科研究。△
,E-mail:41800451@qq.com。
論著·基礎研究
10.3969/j.issn.1671-8348.2016.12.010
R739.6
A
1671-8348(2016)12-1616-04
2015-10-18
2015-12-20)

