治療真性紅細胞增多癥的新藥研究進展
李曉菲,馬滿玲
?
治療真性紅細胞增多癥的新藥研究進展
李曉菲,馬滿玲*
真性紅細胞增多癥是以紅細胞克隆性增殖為主的一種骨髓增殖性腫瘤,其病程常伴發出血和動靜脈血栓,可進展為骨髓纖維化和轉歸為急性白血病。常用的治療方法是靜脈放血、羥基脲和干擾素等。目前部分患者不能從傳統治療方法中獲益,臨床亟待探索新的治療方案。近年來隨著JAK2V617F基因突變的發現,對其發病機制和治療策略的研究日益深入,研究者對真性紅細胞增多癥的研究也轉向了分子生物層面。本文綜述了JAK抑制劑、PEG-α-干擾素、HDACs抑制劑等新藥的臨床試驗研究,為后續研究和臨床應用提供參考。
真性紅細胞增多癥;JAK抑制劑;Ruxolitinib;PEG- α-干擾素;HDACs抑制劑
0 引言
2008年WHO骨髓增殖性腫瘤分類標準將真性紅細胞增多癥(Polycythemia vera,PV)作為骨髓增殖性腫瘤(Myeloproliferative neoplasm,MPN)的一種,并將JAK2V617F基因突變作為一項主要條件列入診斷標準,定義為造血干細胞克隆性增生導致的紅細胞增多,并可能伴隨白細胞和血小板增多[1]。其全球性群體發病率為0.84/100 000[2]。PV在臨床上常伴發出血和血栓形成風險,后期還會進展為骨髓纖維化[3]和轉歸為急性白血病[4],因此,其治療的目的在于預防急性并發癥。但由于該病罕見,目前的治療方案局限于靜脈放血[5]、低劑量阿司匹林[6]為主的基礎治療和包括羥基脲、干擾素在內的細胞減少療法[7-8]。2005年,隨著JAK2V617F基因突變的發現,研究者對PV病理生理學,包括JAK/STAT通路活化異常等有了深入了解[9],一些新藥的臨床前和臨床試驗也正在進行,如JAK抑制劑、PEG-α-干擾素、HDACs抑制劑等。本文旨在討論現有治療方案的利弊,并對新藥臨床試驗的研究進展進行綜述。
1 傳統治療方案
根據歐洲白血病研究組(European Leukemia Net,ELN)PV患者治療推薦意見[10],對于低危PV患者(年齡<60歲,無血栓事件病史),給予小劑量阿司匹林和靜脈放血療法,紅細胞壓積(Hematocrit,HCT)應該控制在<45%;對于高危PV患者(年齡>60歲,有血栓事件病史),目前常用的治療方案為降細胞療法,如給予羥基脲,以減少血栓形成風險,控制血細胞計數,減小脾腫大。另外,干擾素(IFN-α)作為一種抗病毒、抗腫瘤、抗血管生成、抗增殖的免疫調節劑,具有減少造血干細胞的增殖和對靜脈放血的需求的作用。白潔等[11]對816例最長發病45年的PV患者進行的生存預后回顧性分析顯示,IFN-α可能通過降低JAK2V617F基因負荷,減低PV后骨髓纖維化的發生風險。
2 新的治療藥物
2.1JAK抑制劑
2.1.1RuxolitinibRuxolitinib是一種口服JAK1/JAK2抑制劑[12],在2014年被FDA批準用于對羥基脲耐藥或不耐受的PV患者[13],國內沒有上市。Ⅱ期臨床試驗顯示,大部分患者臨床血液學有效率達到了2009年ELN的修訂標準[14]。34例使用Ruxolitinib的患者,97%達到了臨床血液學有效,其中完全有效率達59%(見表1)。其在降低基線白細胞、血小板計數及PV相關的癥狀負荷方面也有良好的效果。3年隨訪數據表明,有近1/4的患者JAK2V617F基因負荷降低了50%以上。Ⅲ期臨床試驗RESPONE[15](見表2)評估了其在對羥基脲無效或不耐受并伴有脾腫大的PV患者中的有效性和安全性。共有222例PV患者參加了試驗,初期結果顯示,Ruxolitinib在無放血情況下控制紅細胞壓積、減輕脾腫大和改善疾病相關癥狀方面優于最佳支持療法(Best Available Therapy,BAT)。主要結局指標達標率(21% vs.1%,P<0.000 1)、無放血紅細胞壓積受控(60% vs.20%)、脾臟減小35%以上(38% vs.1%)、完全血液學有效率(24% vs.9%,P=0.003)方面均優于BAT組。癥狀負擔用骨髓增殖性腫瘤癥狀評分表(Myeloproliferative Neoplasm Symptom Assessment Form,MPN-SAF)[16]評估,Ruxolitinib組患者MPN-SAF癥狀評分改善超過50%的比例高于BAT組(49% vs.5%)。其嚴重不良反應包括貧血(1.8%)和血小板增多癥(5.5%)。RELIEF試驗[17]主要對比評估使用Ruxolitinib和羥基脲的患者PV相關癥狀的改善情況。Ruxolitinib組的主要結局指標-第16周MPN-SAF評分達到50%以上的患者占43.4%,羥基脲組為29.6% (P=0.139,OR:1.82,95%CI0.82~4.04),盡管差異無統計學意義,但在部分癥狀改善方面有顯著差異。如Ruxolitinib組有40%的患者疲勞程度改善≥50%,而羥基脲組為26.4%,兩組瘙癢癥狀改善≥50%百分比分別為54.2%和32%。
2.1.2LestaurtinibLestaurtinib是強效的JAK2抑制劑,在PV患者中進行的Ⅱ期臨床試驗顯示,其療效有限,在18例患者中,只有2例(11%)達到首要結局指標(JAK2V617基因負荷降低15%以上),仍有75%的患者有放血需求,10例(56%)患者脾臟減小,11例(41%)患者在18周后由于惡心、嘔吐、食欲增加、肌痙攣等不良反應而中斷治療[18]。
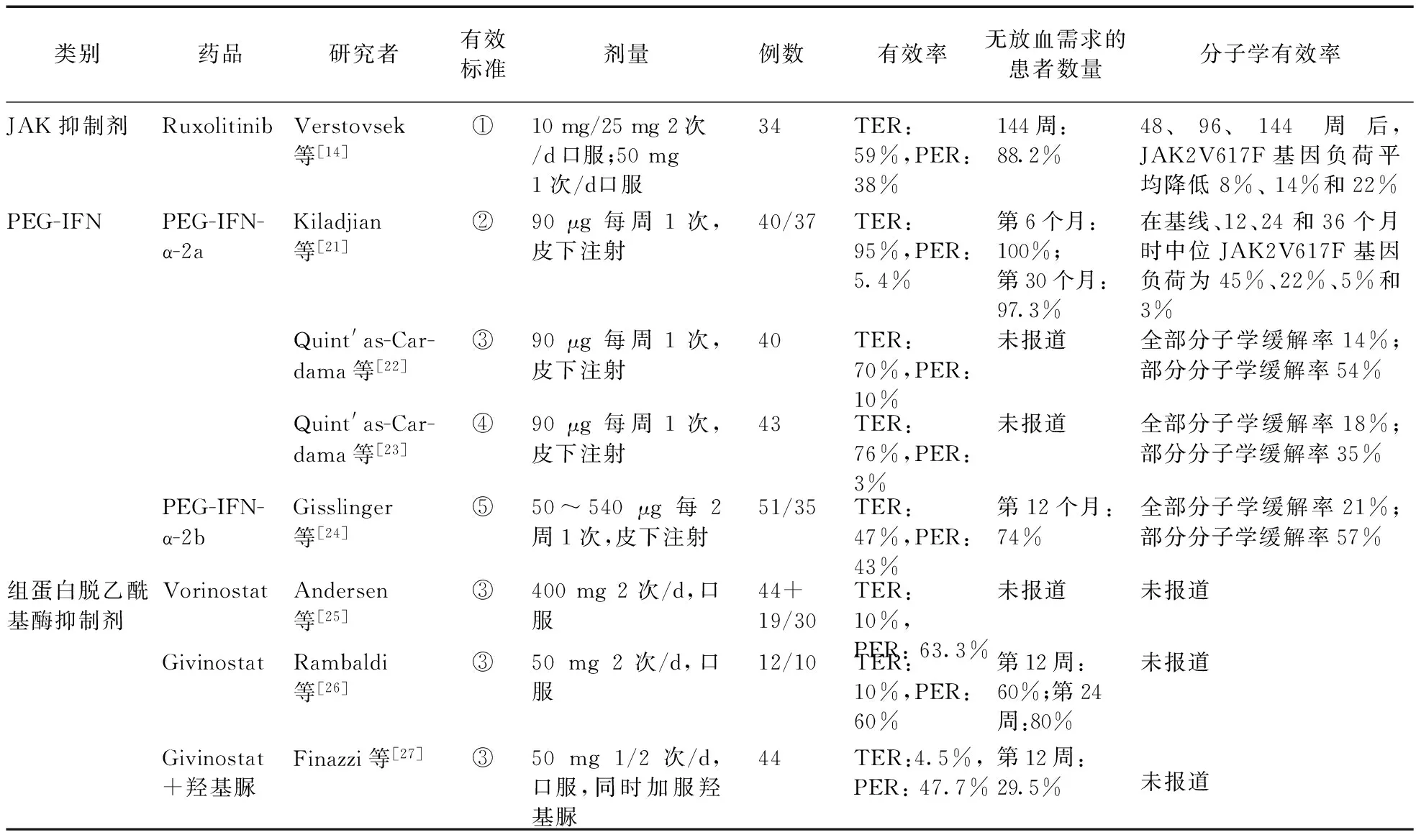
表1 各類新藥Ⅱ期臨床試驗
注:TER:完全有效率;PER:部分有效率。①部分有效:4周無放血治療后紅細胞壓積<45%;完全有效:無放血治療紅細胞壓積<45%,白細胞計數≤10×109/L,血小板計數≤400×109/L,觸診脾臟正常大小,瘙癢癥狀緩解超過1周。②部分有效:無放血治療下男性HCT<45%,女性HCT<42%或血小板計數<400×109/L,或放血需求降低超過50%;完全有效:無放血治療下男性HCT<45%,女性HCT<42%,無脾腫大,白細胞計數<10×109/L,血小板計數<400×109/L。③依據2009年歐洲白血病協會標準。④部分有效:放血需求降低或脾臟減小超過50%;完全有效:男性HCT<45%,女性HCT<42%且無血栓事件,白細胞計數≤10×109/L,血小板計數≤400×109/L,脾臟大小正常無放血、羥基脲治療。⑤部分有效:無放血治療紅細胞壓積<45%或放血需求降低超過50%;完全有效:無放血治療紅細胞壓積<45%,血小板計數≤400×109,白細胞計數≤10×109/L,脾臟大小正常,無血栓事件
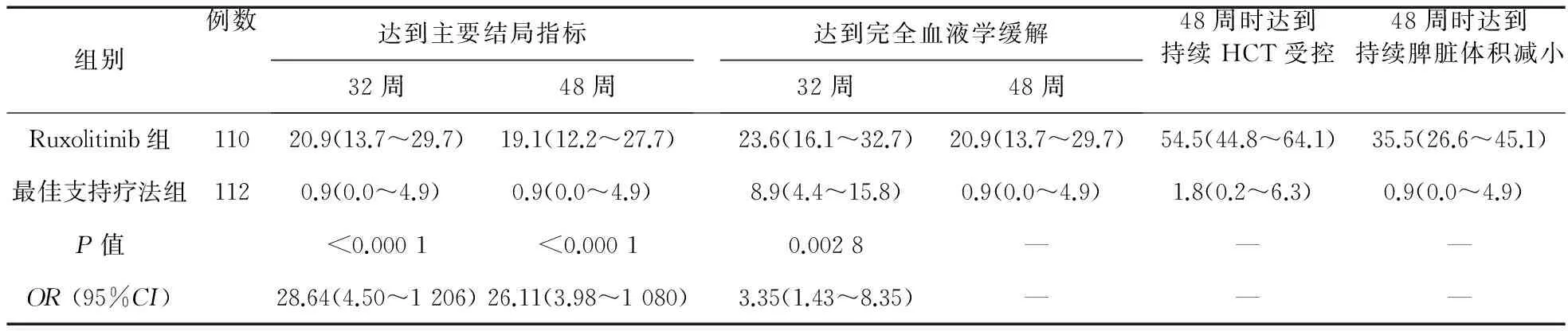
表2 RuxolitinibⅢ期臨床試驗數據(%)
注:數據來自www.clinicaltrails.gov
2.1.3LY2784544LY2784544是用于MPN患者的口服JAK2抑制劑,臨床前研究顯示,其能在體內和體外選擇性抑制野生型JAK2基因和JAK2V617F信號,在MPN鼠模型中,本品能減輕脾腫大,降低JAKV617F基因負荷[19]。在MPN患者中進行的Ⅰ期臨床試驗確定了120 mg/d的劑量,其嚴重不良反應主要有肌酐升高、急性腎功不全、高尿酸血癥、高鉀血癥、貧血等。LY2784544Ⅱ期臨床試驗主要評估其在對Ruxolitinib不耐受的PV患者中的有效性[20]。
2.2聚乙二醇干擾素(PEG-IFN-α)
2.2.1PEG-IFN-αPEG-IFN-α是將聚乙二醇接合到重組干擾素而制成的新劑型,其半衰期更長,穩定性更好,免疫原反應更少,因此耐受性更高。PEG-IFN-α-2a最早被FDA批準用于治療丙型、乙型肝炎患者。但PV患者的Ⅱ期臨床試驗顯示,其臨床血液學有效率達79%~100%,完全有效率(定義為在無放血治療下,男性HCT<45%,女性HCT<42%或45%;白細胞計數≤10×109/L,血小板計數≤400×109/L,且無脾腫大)達到54%~95%[21-23]。Kiladjian等[21]報道,PEG-IFN-α-2a作用于PV患者具有高效、毒性可耐受的特點。Quint′as-Cardama等[22-23]分別于2009年和2013年報道了2個Ⅱ期試驗,研究顯示,給予PV患者PEG-IFN-α-2a 90 μg每周1次治療后,完全血液學緩解率達70%,完全分子學緩解率(檢測不到JAK2V617F)達14%。另1項試驗的中位隨訪期限為42個月,PEG-IFN-α-2a在PV患者中的完全血液學緩解率達76%,完全分子學緩解率(檢測不到JAK2V617F)達18%。Gowin等回顧性分析了美國歐盟8個臨床中心118例MPN(包括44例PV)患者用PEG-IFN-α-2a治療的情況,根據ELN標準,PV患者的總緩解率達87%,完全緩解率為54%。89%~96%的患者報告了不良反應,大部分為輕中度,嚴重不良反應主要為中性粒細胞減少癥和肝毒性。10%~24%的患者因毒性而在24~96個月時中斷治療。
2.2.2聚乙二醇干擾素α-2b (PEG-IFN-α-2b)IFN-α-2b與IFN-α-2a的氨基酸序列不同,前者是“外來的蛋白質”,而后者由IFN-α-2b基因產生,是人類本來就有的“天然干擾素”。PEG-IFN-α-2b 是長效劑型。Gisslinger等[24]通過前瞻性、開放標簽、多中心的Ⅰ/Ⅱ期劑量擴增試驗(n=51),確定PEG-IFN-α-2b的最大耐受劑量,并評估其有效性和安全性。確定了PEG-IFN-α-2b可以2周給藥1次,治療總有效率達90% (完全有效47%,部分有效43%),分子學緩解率在第50周、第144周時分別為33%(完全緩解12%,部分緩解21%)和78%(完全緩解21%,部分緩解57%)。治療第12個月時,有74%的患者無需靜脈放血。88%(45例)的患者報告了不良反應,20%的患者因不良反應而終止治療。
2.3組蛋白脫乙酰酶抑制劑
2.3.1Vorinostat(MK-0683)Vorinostat是一種組蛋白脫乙酰酶(Histone deacetylases,HDAC)抑制劑,能通過誘導細胞分化、阻斷細胞周期、誘導細胞調控而發揮作用,是皮膚T細胞淋巴瘤患者的三線藥物。Ⅱ期臨床試驗顯示,Vorinostat對MPN有一定效果,但因毒性反應而中斷用藥的發生率增加[25]。24周結束時,63例MPN患者(包括44例PV患者)中35%達到臨床血液學有效,46%的脾腫大患者得到緩解。在48%完成試驗的患者中,最常見的不良反應事件是疲乏和胃腸道毒性。24周Vorinostat治療結束后,28例(44%)患者因毒性(腹瀉、疲乏、腎損傷、掉發和惡心等)中斷治療。
2.3.2GivinostatGivinostat是HDAC抑制劑,抑制JAK2V617F基因突變細胞增殖,在MPN患者中具有良好的活性和耐受性。Ⅱ期臨床試驗顯示,口服Givinostat對PV患者有效。先導試驗顯示(時間為4周),7例(70%)患者達到ELN標準的血液學緩解,1例(10%)患者達到完全緩解[26]。8例基線脾腫大的患者中,5例得到緩解。Finazzi等[27]在Ⅱ期試驗中將44例PV患者隨機分配到羥基脲+Givinostat 50/100 mg組,根據ELN標準,52.3%的患者在12周后達到血液學緩解,4.5%完全有效。Givinostat治療可減輕瘙癢癥狀(62.5%),但對緩解脾腫大無效(91.9%)。研究顯示,由不良反應事件(中度:血小板減少癥、高鉀血癥、心律不齊;重度:精神癥狀、肺栓塞、貧血)而中斷治療的比例分別為16.7%和18.2%。
3 總結與展望
PV患者易發生血栓事件和脾腫大的風險,同時由于出現一系列癥狀,會嚴重影響生活質量。低劑量阿司匹林和靜脈放血可以用于新診斷的低危患者的治療,高危患者還需要額外的降細胞療法;羥基脲是目前此類人群中常用的標準方案;干擾素可作為PV患者的一線療法。但這些指南推薦大多沒有臨床證據。如:尚無評估羥基脲在降低血栓形成風險和控制PV相關癥狀的前瞻性隨機對照試驗。另外,目前的治療方案并不是對所有患者群體都有效,一部分對羥基脲無效或不耐受的高危患者不能從現有方案中獲益。新的治療方案應該滿足這類患者的需求,其關鍵在于設計隨機臨床試驗來評估血栓風險和PV相關癥狀負擔,以確保未來的治療指南有可靠的臨床證據。臨床試驗數據顯示,JAK抑制劑有望補充當前的治療空缺,而PEG-IFN-α-2a目前雖然是有爭議的二線藥物,但有望成為一線治療藥,而HDACs抑制劑的毒性較大,還需要更多的研究來評估其有效性和安全性。
[1]Tefferi A,Vardiman JW.Classification and diagnosis of myeloproliferative neoplasms:the 2008 World Health Organization criteria and point-of-care diagnostic algorithms[J].Leukemia,2008,22(1):14-22.
[2]Titmarsh GJ,Duncombe AS,McMullin MF,et al.How common are myeloproliferative neoplasms? A systematic review and meta-analysis[J].Am J Hematol,2014,89(6):581-587.
[3]Tefferi A.Essential thrombocythemia,polycythemia vera,and myelofibrosis:current management and the prospect of targeted therapy[J].Am J Hematol,2008,83(6):491-497.
[4]Finazzi G,Caruso V,Marchioli R,et al.Acute leukemia in polycythemia vera:an analysis of 1638 patients enrolled in a prospective observational study[J].Blood,2005,105(7):2664-2670.
[5]Marchioli R,Finazzi G,Specchia G,et al.Cardiovascular events and intensity of treatment in polycythemia vera[J].N Engl J Med,2013,368(1):22-33.
[6]Landolfi R,Marchioli R,Kutti J,et al.Efficacy and safety of low-dose aspirin in polycythemia vera[J].N Engl J Med,2004,350(2):114-124.
[7]Alvarez-Larran A,Pereira A,Cervantes F,et al.Assessment and prognostic value of the European LeukemiaNet criteria for clinicohematologic response,resistance,and intolerance to hydroxyurea in polycythemia vera[J].Blood,2012,119(6):1363-1369.
[8]Tefferi A,Barbui T.Polycythemia vera and essential thrombocythemia:2015 update on diagnosis,risk-stratification and management[J].Am J Hematol,2015,90(2):162-173.
[9]James C,Ugo V,Le CJP,et al.A unique clonal JAK2 mutation leading to constitutive signalling causes polycythaemia vera[J].Nature,2005,434(7037):1144-1148.
[10]Barosi G,Birgegard G,Finazzi G,et al.Response criteria for essential thrombocythemia and polycythemia vera:result of a European LeukemiaNet consensus conference[J].Blood,2009,113(20):4829-4833.
[11]白潔,石慧,艾麗梅,等.單中心真性紅細胞增多癥816例生存現狀及預后分析[J].中華醫學雜志,2015,95(18):1364-1368.
[12]Shilling AD,Nedza FM,Emm T,et al.Metabolism,excretion,and pharmacokinetics of [14C] INCB018424,a selective Janus tyrosine kinase 1/2 inhibitor,in humans[J].Drug Metab Dispos,2010,38(11):2023-2031.
[13]Raedler LA.Jakafi (Ruxolitinib):First FDA-approved medication for the treatment of patients with polycythemia vera[J].Am Health Drug Benefits,2015,8(Spec Feature):75-79.
[14]Verstovsek S,Passamonti F,Rambaldi A,et al.A phase 2 study of ruxolitinib,an oral JAK1 and JAK2 inhibitor,in patients with advanced polycythemia vera who are refractory or intolerant to hydroxyurea[J].Cancer,2014,120(4):513-520.
[15]Vannucchi AM.Ruxolitinib versus standard therapy for the treatment of polycythemia vera[J].N Engl J Med,2015,372(5):426-435.
[16]Scherber R,Dueck AC,Johansson P,et al.The myeloproliferative neoplasm symptom assessment form (MPN-SAF):international prospective validation and reliability trial in 402 patients[J].Blood,2011,118(2):401-408.
[17]Randomized switch study from hydroxyurea to ruxolitinib for RELIEF of polycythemia vera symptoms:the relief study.https://clinicaltrials.gov/ct2/show/NCT01632904.(2015-5-6).
[18]Hexner E,Roboz G,Hoffman R,et al.Open-label study of oral CEP-701 (lestaurtinib) in patients with polycythaemia vera or essential thrombocythaemia with JAK2-V617F mutation[J].Br J Haematol,2014,164(1):83-93.
[19]Ma L,Clayton JR,Walgren RA,et al.Discovery and characterization of LY2784544,a small-molecule tyrosine kinase inhibitor of JAK2V617F[J].Blood Cancer J,2013,3:e109.
[20]A study of LY2784544 in participants with myeloproliferative neoplasms.http://clinicaltrials.gov/show/NCT01594723.(2015-5-7).
[21]Kiladjian JJ,Cassinat B,Chevret S,et al.Pegylated interferon-alfa-2a induces complete hematologic and molecular responses with low toxicity in polycythemia vera[J].Blood,2008,112(8):3065-3072.
[22]Quintas-Cardama A,Kantarjian H,Manshouri T,et al.Pegylated interferon alfa-2a yields high rates of hematologic and molecular response in patients with advanced essential thrombocythemia and polycythemia vera[J].J Clin Oncol,2009,27(32):5418-5424.
[23]Quintas-Cardama A,Abdel-Wahab O,Manshouri T,et al.Molecular analysis of patients with polycythemia vera or essential thrombocythemia receiving pegylated interferon alpha-2a[J].Blood,2013,122(6):893-901.
[24]Gisslinger H,Zagrijtschuk O,Buxhofer-Ausch V,et al.Ropeginterferon alfa-2b,a novel IFN-alpha-2b,induces high response rates with low toxicity in patients with polycythemia vera[J].Blood,2015,126(15):1762-1769.
[25]Andersen CL,McMullin MF,Ejerblad E,et al.A phase II study of vorinostat (MK-0683) in patients with polycythaemia vera and essential thrombocythaemia[J].Br J Haematol,2013,162(4):498-508.
[26]Rambaldi A,Dellacasa CM,Finazzi G,et al.A pilot study of the histone-deacetylase inhibitor givinostat in patients with JAK2V617F positive chronic myeloproliferative neoplasms[J].Br J Haematol,2010,150(4):446-455.
[27]Finazzi G,Vannucchi AM,Martinelli V,et al.A phase II study of givinostat in combination with hydroxycarbamide in patients with polycythaemia vera unresponsive to hydroxycarbamide monotherapy[J].Br J Haematol,2013,161(5):688-694.
Research progress of drug therapies for the treatment of polycythemia vera
LI Xiao-fei,MA Man-ling*
(First Affiliated Hospital of Harbin Medical University,Harbin 150020,China)
Polycythemia vera (PV) is a myeloproliferative neoplasm characterized by an elevated red blood cell mass.Clinically,its course can be complicated by arterial and venous vascular incidents,evoluting to myelofibrosis,or leukemic transformation.Current treatment options,including the use of phlebotomy,low-dose aspirin,IFN-α and hydroxyurea,can effectively manage PV in many patients.New therapies should be explored because some patients cannot benefit from traditional treatment.The discovery of a mutation in the Janus kinase (JAK) 2 gene (V617F) in almost all cases of PV has prompted the development of molecularly targeted agents as the treatment.In this review,we reviewed the research achievements of new agents such as JAK inhibitors,PEG-IFN-α and HDACs inhibitors,in order to provide a reference for subsequent researches and clinical applications.
Polycythemia vera;JAK inhibitor;Ruxolitinib;PEG-IFN-α;HDACs inhibitor
2015-12-02
哈爾濱醫科大學附屬第一醫院,哈爾濱 150020
10.14053/j.cnki.ppcr.201608033

