miR-139對骨肉瘤細胞增殖和凋亡的影響
李志全, 馬 龍, 董 暉, 黎 璞, 吳堯平*
(1第四軍醫大學西京醫院骨科,西安 710032; 2解放軍第513醫院心內科; 3解放軍第474醫院骨科; 4第四軍醫大學唐都醫院麻醉科; *通訊作者,E-mail:fmmuxj_wuyp@sina.com)
?
miR-139對骨肉瘤細胞增殖和凋亡的影響
李志全1, 馬龍2, 董暉3, 黎璞4, 吳堯平1*
(1第四軍醫大學西京醫院骨科,西安710032;2解放軍第513醫院心內科;3解放軍第474醫院骨科;4第四軍醫大學唐都醫院麻醉科;*通訊作者,E-mail:fmmuxj_wuyp@sina.com)
目的闡明miR-139在骨肉瘤細胞中的表達水平及其對骨肉瘤細胞增殖和凋亡的影響。 方法采用qRT-PCR檢測miR-139在永生化成骨細胞系hFOB 1.19及骨肉瘤細胞系SOSP-9607、MG-63中的表達情況;采用5-氮雜-2′-脫氧胞苷(5-Aza-CdR)和曲古抑菌素A(TSA)處理骨肉瘤細胞,通過qRT-PCR檢測miR-139的表達變化;將miR-139模擬物轉染入骨肉瘤細胞中,通過MTT實驗檢測細胞增殖能力的變化,通過流式細胞術分析細胞凋亡的變化,通過Western blot檢測Cyclin D1表達和Caspase-3活化的變化。 結果與永生化成骨細胞系hFOB 1.19相比,miR-139在SOSP-9607和MG-63骨肉瘤細胞中的表達水平顯著降低(P<0.01);5-Aza-CdR對SOSP-9607和MG-63骨肉瘤細胞中miR-139的表達沒有影響,而TSA能夠促進miR-139的表達(P<0.01);miR-139模擬物能夠抑制骨肉瘤細胞的增殖能力,誘導骨肉瘤細胞凋亡,并抑制Cyclin D1的表達、促進Caspase-3的激活(P<0.05或P<0.01)。 結論miR-139在骨肉瘤細胞中低表達,而過表達miR-139能夠抑制骨肉瘤細胞的增殖并誘導其凋亡。
骨肉瘤;miR-139;增殖;凋亡
骨肉瘤(osteosarcoma)是最常見的惡性骨腫瘤,起源于間質細胞,好發于兒童及青少年,腫瘤早期即可發生遠處轉移。20世紀70年代以前,骨肉瘤的標準治療方案是截肢術,患者5年生存率不足20%。隨著化療方案和技術的不斷進步,化療聯合保肢手術已成為骨肉瘤的標準治療方案,非轉移性骨肉瘤患者的5年生存率已提高至65%-70%。但是,對于惡性程度較高或者已經發生遠處轉移的骨肉瘤患者,近幾十年來其生存率并沒有顯著提高,中位生存期僅為23個月,其主要原因是骨肉瘤細胞容易對化療藥物產生多藥耐藥性(multidrug resistance,MDR),從而導致化療效果不明顯[1]。
微小RNA(microRNA,miRNA)是由18-25個堿基組成的非編碼小分子RNA,能夠通過種子序列(seed sequence)識別靶基因mRNA的3′端非翻譯區(3′-untranslated region,3′-UTR),與之發生完全或不完全的堿基配對結合,進而導致靶基因mRNA的降解或抑制其翻譯,因此,miRNA能夠從轉錄后水平調控基因的表達。迄今為止,通過生物信息學及實驗研究已在人體組織細胞中鑒定出了1 000多個miRNA分子,每個miRNA分子能夠調控多個基因的表達,而每個基因也可能受到多個miRNA分子的調控。目前的研究表明,大約50%的人類基因表達受到miRNA的調控。miRNA的堿基序列在種間具有高度保守性,其在細胞分化、代謝、增殖和凋亡等生命活動過程中扮演重要角色,廣泛參與了多種生理及病理過程[2]。
高杰等[3]最先研究了骨肉瘤的miRNA表達譜,從SOSP-9607骨肉瘤細胞中鑒定得到了182個miRNA分子。迄今已有大量研究證實,骨肉瘤組織細胞中存在多種miRNA分子的異常表達,其與骨肉瘤細胞的增殖、凋亡、侵襲及耐藥性等多種惡性表型相關[4]。miR-139是近幾年新發現的一種具有抑癌作用的miRNA分子,其在多種腫瘤細胞中表達降低,而過表達miR-139能夠抑制腫瘤細胞的惡性表型,但目前有關miR-139與骨肉瘤的相關性尚未見報道[5]。因此,本研究將檢測miR-139在骨肉瘤細胞中的表達情況,觀察其對骨肉瘤細胞增殖和凋亡的影響,初步探索miR-139在骨肉瘤形成及發展過程中的作用,為骨肉瘤的臨床診斷及治療提供實驗參考。
1 材料和方法
1.1主要儀器
CO2細胞培養箱(Thermo Fisher Scientific,美國);NanoDrop ND-000分光光度計(NanoDrop Tech,美國);ABI7500 Fast實時定量PCR儀(Applied Biosystems,美國);蛋白電泳儀、iMark酶標儀(Bio-Rad,美國);FACSCalibur 流式細胞儀(BD Biosciences,美國);FluorChem FC2凝膠成像系統(Alpha Innotech,美國)。
1.2主要試劑
RPMI1640培養基(Gibco,美國);胎牛血清(HyClone,美國);青-鏈霉素溶液(100×)、胰酶細胞消化液(上海碧云天生物技術有限公司);總RNA提取試劑盒miRNeasy Mini Kit、miRNA反轉錄與實時定量PCR試劑盒miScript PCR Starter Kit(Qiagen,德國);組蛋白去乙酰化酶(histone deacetylase,HDAC)抑制劑曲古抑菌素A(trichostatin A,TSA)、DNA甲基轉移酶抑制劑5-氮雜-2′-脫氧胞苷(5-Aza-2′-deoxycytidine,5-Aza-CdR)、二甲基亞砜(dimethyl sulfoxide,DMSO)(Sigma,美國);MTT細胞增殖及細胞毒性檢測試劑盒、Annexin Ⅴ-FITC細胞凋亡檢測試劑盒(上海碧云天生物技術有限公司);siRNA-Mate轉染試劑(上海吉瑪制藥技術有限公司);抗Cyclin D1、活化Caspase-3及β-actin抗體(Abcam,英國);BCA蛋白定量試劑盒、ECL化學發光試劑盒(Pierce,美國)。
1.3細胞培養
永生化成骨細胞系hFOB 1.19、骨肉瘤細胞系SOSP-9607及MG-63由本室保存。細胞接種于培養皿中,加入適量含10%胎牛血清、1%青-鏈霉素的RPMI1640培養基,置于37 ℃、5% CO2細胞培養箱中培養,常規胰酶消化傳代。
1.4實時定量PCR(quantitative real-time PCR,qRT-PCR)
采用miRNeasy Mini Kit提取細胞總RNA,定量后采用miScript PCR Starter Kit進行qRT-PCR,以U6為內參。miR-139的上游引物序列為:5′-TCT ACA GTG CAC GTG TCT-3′,下游引物為試劑盒中的通用引物。U6的上游引物序列為:5′-CTC GCT TCG GCA GCA CA-3′,下游引物序列為:5′-AAC GCT TCA CGA ATT TGC GT-3′。引物由上海生工生物有限公司合成。
1.5細胞轉染實驗
miR-139模擬物(mimics)及陰性對照(negative control)由上海吉瑪制藥技術有限公司合成。細胞轉染步驟參考siRNA-Mate說明書,簡要步驟如下:轉染前一天接種細胞至6孔板,待第2天細胞生長至約30%匯合度時進行轉染。采用無血清RPMI1640培養基分別稀釋siRNA-Mate和miRNA(二者比例為1 μl siRNA-Mate對應10 pmol miRNA),靜置5 min后將二者混勻,室溫孵育20 min后加入培養孔中,miRNA終濃度為40 nmol/L。
1.6MTT實驗檢測細胞增殖能力
胰酶消化、離心收集骨肉瘤細胞,血球計數板計數后調整細胞密度至2×104/ml。隨后將細胞接種于96孔培養板中,每孔100 μl(即2×103/孔)。待細胞貼壁后(接種后12 h)開始計時,分別于0,1,2,3,4,5 d向每孔中加入10 μl MTT溶液(5 mg/ml),繼續孵育4 h,每孔中再加入100 μl Formanzan溶解液并繼續孵育,直至普通光學顯微鏡下顯示Formanzan結晶全部溶解為止(約4 h),于570 nm波長處測定OD值。1.7流式細胞術(FCM)檢測細胞凋亡
分別收集處理后的SOSP-9607及MG-63骨肉瘤細胞(包括培養液中的細胞),PBS重懸細胞并計數。取1×105個重懸細胞,1 000×g離心5 min后棄上清,加入195 μl Annexin Ⅴ-FITC結合液輕輕重懸細胞,然后加入5 μl Annexin Ⅴ-FITC,輕輕混勻,再加入10 μl碘化丙啶(PI)染色液,輕輕混勻。室溫避光孵育20 min,進行流式細胞術檢測細胞凋亡狀況。
1.8Western blot實驗檢測蛋白表達
收集處理后的SOSP-9607及MG-63骨肉瘤細胞,提取總蛋白,采用BCA蛋白定量試劑盒定量。制備蛋白電泳樣品,SDS-PAGE電泳后轉膜。5%脫脂奶粉室溫封閉1 h,加入TBST稀釋的抗Cyclin D1、活化Caspase-3或β-actin抗體,4 ℃孵育過夜。次日洗滌一抗后加入相應的二抗,室溫孵育2 h,洗滌后采用ECL試劑盒進行化學發光,利用FluorChem FC2系統成像并進行灰度分析。
1.9統計學分析
2 結果
2.1miR-139在骨肉瘤細胞中的表達變化
miR-139在多種腫瘤細胞中的表達降低,但在骨肉瘤細胞中的表達變化未見研究報道。為此,首先采用qRT-PCR檢測了miR-139在永生化成骨細胞系hFOB 1.19及骨肉瘤細胞系SOSP-9607、MG-63中的表達情況。結果發現:與永生化成骨細胞系hFOB 1.19相比,miR-139在SOSP-9607和MG-63骨肉瘤細胞中的表達水平顯著降低,分別為hFOB 1.19細胞的42%±11%(P<0.01)和18%±4%(P<0.001,見圖1)。
2.2miR-139在骨肉瘤細胞中表達變化的調控機制
上述qRT-PCR結果表明,miR-139在骨肉瘤細胞中的表達明顯下降,為進一步揭示miR-139表達降低的原因,采用DNA甲基轉移酶抑制劑5-Aza-CdR和組蛋白去乙酰化酶抑制劑TSA處理骨肉瘤細胞,通過qRT-PCR檢測miR-139的表達變化。以DMSO為對照,分別用5 μmol/L的5-Aza-CdR和200nmol/L的TSA處理hFOB 1.19、SOSP-9607、MG-63細胞72 h,提取總RNA后進行qRT-PCR。結果發現:5-Aza-CdR和TSA對hFOB 1.19細胞中miR-139的表達沒有顯著影響(P>0.05),5-Aza-CdR對SOSP-9607和MG-63細胞中miR-139的表達也沒有顯著影響(P>0.05),但TSA能夠顯著促進SOSP-9607和MG-63細胞中miR-139的表達(P<0.01或P<0.001,見圖2)。
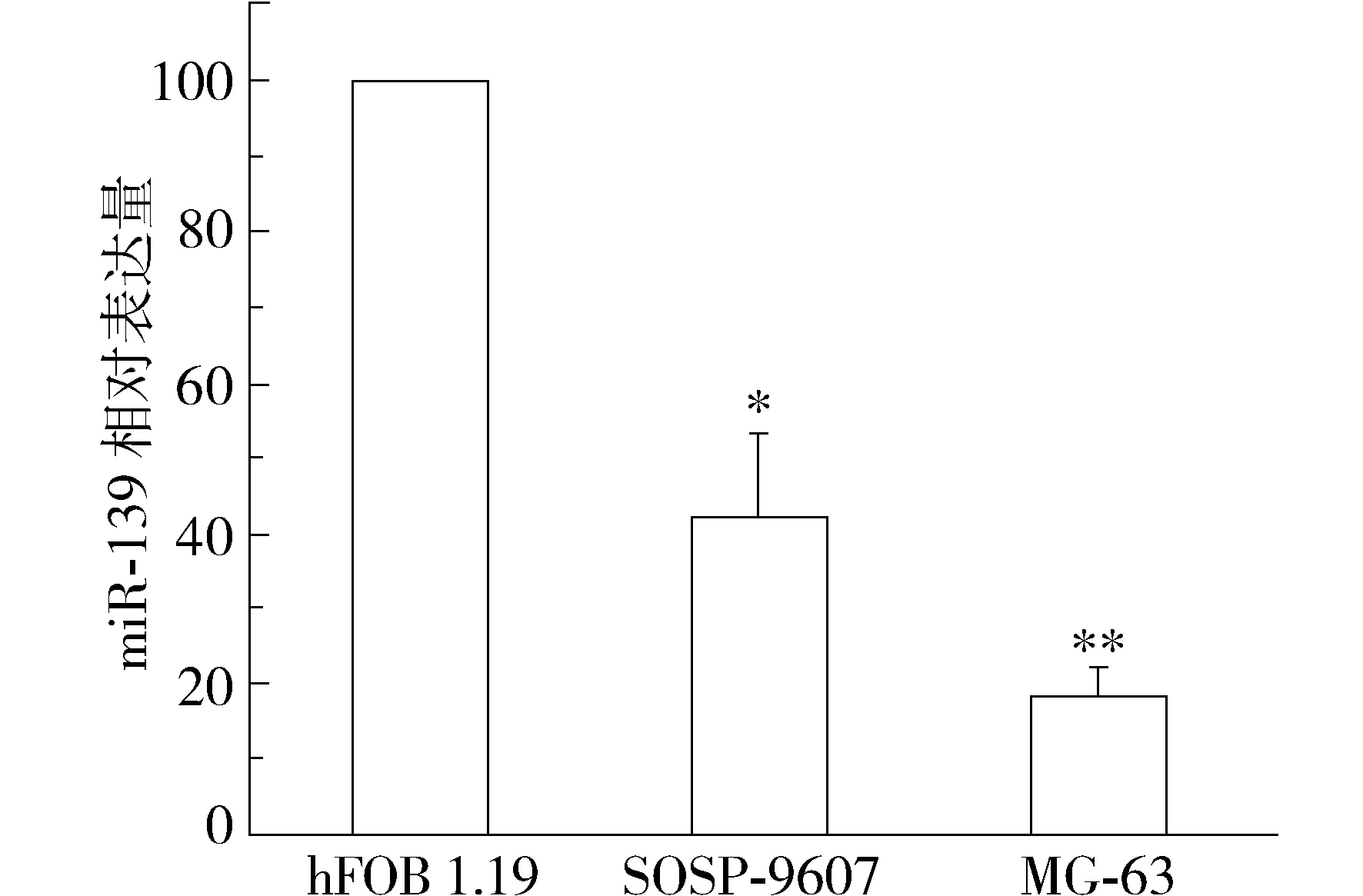
與hFOB 1.19細胞比較,*P<0.01,**P<0.001圖1 qRT-PCR檢測miR-139在骨肉瘤細胞中的表達Figure 1 Expression of miR-139 in osteosarcoma cells detected by qRT-PCR

與DMSO對照組比較,*P<0.01,**P<0.001圖2 5-Aza-CdR和TSA 對骨肉瘤細胞中miR-139表達的影響Figure 2 The effect of 5-Aza-CdR and TSA on miR-139 expression in osteosarcoma cells
2.3轉染miR-139模擬物對骨肉瘤細胞增殖的影響
miR-139是一種具有抑癌作用的miRNA分子[5]。為證實miR-139是否能夠抑制骨肉瘤細胞的增殖,我們合成了miR-139模擬物(mimics),將其轉染入骨肉瘤細胞中,通過MTT實驗檢測細胞增殖能力的變化。與轉染陰性對照(negative control)相比,轉染miR-139模擬物能夠顯著抑制骨肉瘤細胞SOSP-9607的增殖能力(P<0.05,見圖3A),第3,4,5天的抑制率分別為28.9%±13.2%,32.7%±9.1%,29.3%±12.1%。轉染miR-139模擬物同樣顯著抑制了MG-63細胞的增殖能力(P<0.01,見圖3B),第3,4,5天的抑制率分別為41.7%±8.3%,37.3%±8.5%,39.1%±6.3%。

與陰性對照比較,*P<0.05 與陰性對照比較,**P<0.01 A.SOSP-9607細胞 B.MG-63細胞圖3 miR-139對骨肉瘤細胞增殖的影響Figure 3 The effect of miR-139 on osteosarcoma cell proliferation
2.4轉染miR-139模擬物對骨肉瘤細胞凋亡的影響
為分析miR-139是否能夠誘導骨肉瘤細胞凋亡,將miR-139模擬物轉染入骨肉瘤細胞中,轉染后72 h收集細胞,經Annexin Ⅴ-FITC/PI染色后,通過流式細胞術檢測細胞凋亡。結果發現:與陰性對照轉染組比較,轉染miR-139模擬物能夠誘導SOSP-9607和MG-63細胞的凋亡,二者凋亡率分別為8.66%±3.12%和13.3%±2.77%(見圖4),與對照組相比差異有統計學意義(P<0.01或P<0.001,見圖5)。
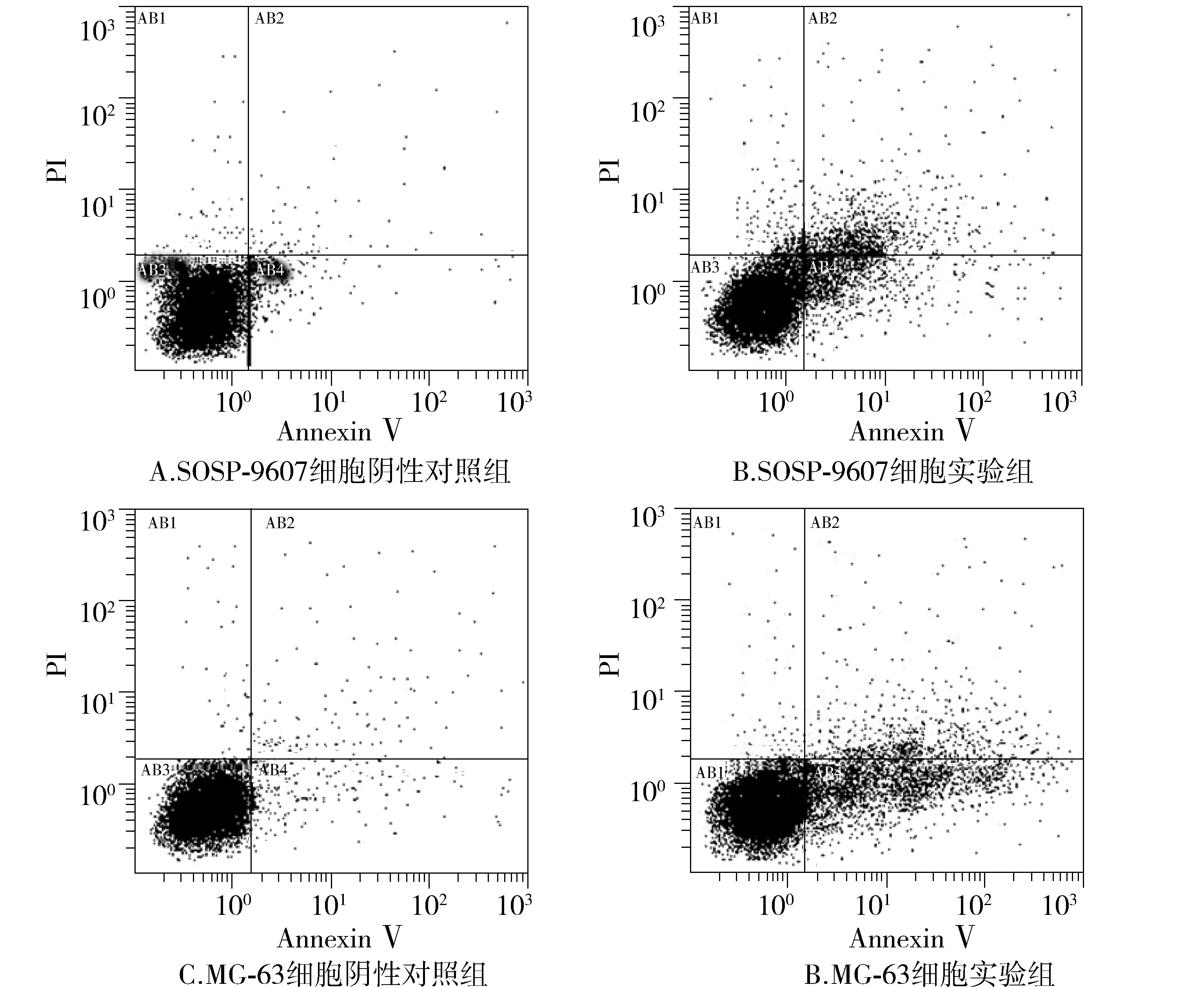
圖4 SOSP-9607和MG-63細胞的 FCM檢測結果Figure 4 The FCM results of SOSP-9607 and MG-63 cell apoptosis

與陰性對照組比較,*P<0.01,**P<0.001圖5 FCM檢測結果的統計分析Figure 5 The statistical analysis of FCM results
2.5轉染miR-139模擬物對骨肉瘤細胞Cyclin D1表達和Caspase-3活化的影響
前述結果表明miR-139能夠抑制骨肉瘤細胞增殖,并誘導其凋亡。為進一步分析miR-139生物學作用的分子機制,采用Western blot檢測了miR-139對骨肉瘤細胞中細胞周期素Cyclin D1表達和Caspase-3活化的影響。結果發現:轉染后72 h,與陰性對照轉染組相比,miR-139模擬物導致SOSP-9607和MG-63細胞中Cyclin D1的表達下降,而活化Caspase-3的表達升高(見圖6)。
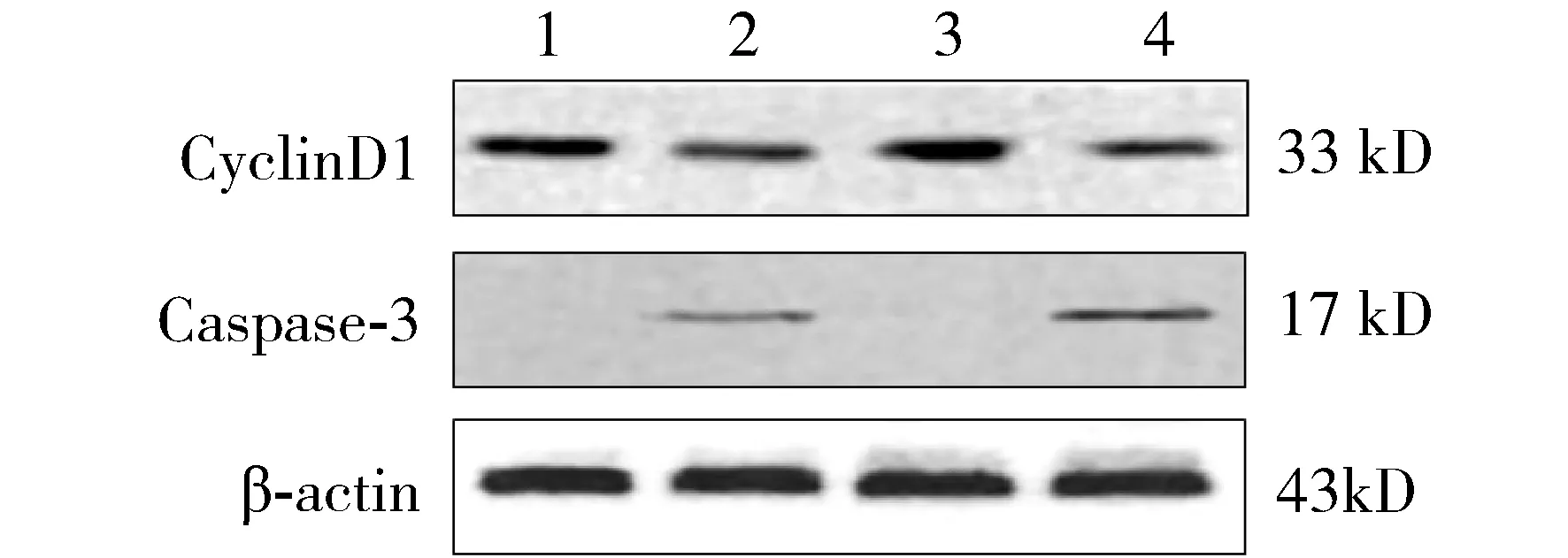
1.SOSP-9607細胞陰性對照組;2.SOSP-9607細胞實驗組;3.MG-63細胞陰性對照組;4.MG-63細胞實驗組圖6 miR-139對骨肉瘤細胞Cyclin D1和活化Caspase-3表達的影響Figure 6 The effect of miR-139 on Cyclin D1 and active Caspase-3 expression in osteosarcoma cells
3 討論
miRNA與腫瘤的發生發展緊密相關,既可扮演癌基因的角色,也可扮演抑癌基因的角色,其在腫瘤組織細胞中的表達變化特征對于腫瘤診斷、治療及預后評估具有重要的參考價值[2]。miR-139是近年新發現的一種抑癌miRNA分子,基因定位于染色體11q13.4。miR-139在肝癌、胃癌、結腸癌、乳腺癌、食管鱗癌、非小細胞肺癌、膠質瘤等多種腫瘤細胞中表達降低,同時證實過表達miR-139能夠抑制這些腫瘤細胞的增殖、遷移、侵襲等惡性生物學表型[5]。盡管已有許多研究證實miR-139作為抑癌基因參與了多種腫瘤的病理進程,但迄今尚無miR-139與骨肉瘤相關性的研究報道。因此,本研究以永生化成骨細胞系hFOB 1.19、骨肉瘤細胞系SOSP-9607及MG-63為研究對象,首先采用qRT-PCR分析了這三種細胞中miR-139的表達狀況,結果發現與永生化成骨細胞系hFOB 1.19相比較,miR-139在SOSP-9607和MG-63骨肉瘤細胞中的表達明顯下降,這提示miR-139可能參與了骨肉瘤的發生發展。
miRNA的編碼序列多位于蛋白質編碼基因的內含子區,因而常與其宿主基因共表達,但有研究表明miR-139具有獨立的啟動子,不僅與其宿主基因PDE2A的表達缺乏相關性,而且具有與宿主基因相反的生物學功能[6,7]。miRNA基因的表觀遺傳學修飾與其表達狀況緊密相關,而DNA的甲基化修飾和組蛋白的乙酰化修飾是最常見的兩種表觀遺傳學修飾方式,前者抑制基因表達而后者促進基因表達[8]。為揭示骨肉瘤細胞中miR-139表達降低與表觀遺傳學修飾的相關性,本研究采用DNA甲基轉移酶抑制劑5-Aza-CdR和組蛋白去乙酰化酶抑制劑TSA分別處理永生化成骨細胞系hFOB 1.19、骨肉瘤細胞系SOSP-9607及MG-63,通過qRT-PCR檢測miR-139的表達變化,結果證實骨肉瘤細胞中miR-139的低表達與DNA的甲基化修飾無關,但與組蛋白的去乙酰化修飾相關。在胃癌、結腸癌等其他腫瘤細胞中的研究同樣證實miR-139的表達水平與組蛋白的去乙酰化修飾密切相關[6,7]。
作為抑癌miRNA分子,許多研究結果表明過表達外源性miR-139能夠抑制腫瘤細胞的增殖能力,并可以誘導腫瘤細胞的凋亡[5]。本研究初步探索了miR-139對骨肉瘤細胞增殖和凋亡的作用,與其他腫瘤中的研究結果類似,發現轉染化學合成的miR-139模擬物能夠顯著抑制骨肉瘤細胞SOSP-9607、MG-63的增殖,并能夠誘導其凋亡。細胞周期素Cyclin D1是調控細胞周期G1期的關鍵蛋白,對細胞周期調控至關重要。大量研究表明,Cyclin D1在多種腫瘤組織細胞中存在過表達,可作為癌基因促進腫瘤的發生發展[9]。不同刺激因素導致的細胞凋亡過程主要由三條通路執行,包括線粒體通路或內源性通路、死亡受體通路或外源性通路、內質網應激通路,其中Caspase-3是所有通路共同的關鍵執行蛋白[10]。因此,為揭示miR-139抑制骨肉瘤細胞增殖及誘導凋亡的機制,本研究采用Western blot分析了miR-139對骨肉瘤細胞中Cyclin D1表達和Caspase-3活化的影響,結果證實miR-139能夠抑制Cyclin D1表達,并誘導Procaspase-3剪切以形成活化型Caspase-3。
綜上所述,本研究發現miR-139在骨肉瘤細胞中呈低表達狀態,這種低表達與DNA的甲基化修飾無關,而是由組蛋白的去乙酰化導致的。過表達外源性miR-139能夠通過下調Cyclin D1的表達而抑制骨肉瘤細胞增殖,同時能夠通過激活Caspase-3而誘導骨肉瘤細胞凋亡。
[1]Isakoff MS,Bielack SS,Meltzer P,etal.Osteosarcoma: Current treatment and a collaborative pathway to success[J].J Clin Oncol,2015,33(27):3029-3035.
[2]Hammond SM.An overview of microRNAs[J].Adv Drug Deliv Rev,2015,87:3-14.
[3]高杰,楊彤濤,裘秀春,等.成骨肉瘤細胞SOSP-9607中miRNA的克隆與驗證[J].癌癥,2007,26(6):561-565.
[4]Sampson VB,Yoo S,Kumar A,etal.MicroRNAs and potential targets in osteosarcoma:Review[J].Front Pediatr,2015,3:69.
[5]Zhang HD,Jiang LH,Sun DW,etal.MiR-139-5p:promising biomarker for cancer[J].Tumour Biol,2015,36(3):1355-1365.
[6]Bao W,Fu HJ,Xie QS,etal.HER2 interacts with CD44 to up-regulate CXCR4 via epigenetic silencing of microRNA-139 in gastric cancer cells[J].Gastroenterology,2011,141(6):2076-2087.
[7]Shen K,Mao R,Ma L,etal.Post-transcriptional regulation of the tumor suppressor miR-139-5p and a network of miR-139-5p-mediated mRNA interactions in colorectal cancer[J].FEBS J,2014,281(16):3609-3624.
[8]Tuna M,Machado AS,Calin GA.Genetic and epigenetic alterations of microRNAs and implications for human cancers and other diseases[J].Genes Chromosomes Cancer,2015:Epub ahead of print.
[9]Musgrove EA,Caldon CE,Barraclough J,etal.Cyclin D as a therapeutic target in cancer[J].Nat Rev Cancer,2011,11(8):558-572.
[10]Zeng W,Wang X,Xu P,etal.Molecular imaging of apoptosis:from micro to macro[J].Theranostics,2015,5(6):559-582.
Effects of miR-139 on osteosarcoma cell proliferation and apoptosis
LI Zhiquan1, MA Long2, DONG Hui3, LI Pu4, WU Yaoping1*
(1DepartmentofOrthopedics,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China;2DepartmentofCardiology, 513thHospitalofChinesePLA;3DepartmentofOrthopedics, 474thHospitalofChinesePLA;4DepartmentofAnesthesiology,TangduHospital,FourthMilitaryMedicalUniversity;*Correspondingauthor,E-mail:fmmuxj_wuyp@sina.com)
ObjectiveTo clarify the expression level of miR-139 in human osteosarcoma cells and its effects on osteosarcoma cell proliferation and apoptosis.MethodsThe expression of miR-139 was detected by qRT-PCR in immortalized osteoblast cell line hFOB 1.19 and osteosarcoma cell lines SOSP-9607 and MG-63. Osteosarcoma cells were treated with 5-Aza-2′-deoxycytidine (5-Aza-CdR) and trichostatin A(TSA), and then miR-139 expression was detected by qRT-PCR. After miR-139 mimics was transfected into osteosarcoma cells, the cell proliferation ability, cell apoptosis rate, Cyclin D1 and active Caspase-3 expression were detected by MTT assay, flow cytometry and Western blot, respectively.ResultsCompared with hFOB 1.19 cells, miR-139 expression was significantly reduced in SOSP-9607 and MG-63 osteosarcoma cells(P<0.01). The expression of miR-139 was not affected by 5-Aza-CdR in SOSP-9607 and MG-63 osteosarcoma cells, while TSA promoted the expression of miR-139 in these cells(P<0.01). The miR-139 mimics was capable of inhibiting the proliferation, inducing cell apoptosis, suppressing Cyclin D1 expression, and promoting the activation of Caspase-3 in SOSP-9607 and MG-63 osteosarcoma cells(P<0.05 orP<0.01).ConclusionThe expression of miR-139 is downregulated in human osteosarcoma cells and its overexpression can inhibit osteosarcoma cell proliferation and induce apoptosis.
osteosarcoma;miR-139;proliferation;apoptosis
陜西省自然科學基礎研究計劃資助項目(2014JM4120)
李志全,男,1976-06生,博士,主治醫師,E-mail:fmmuxj_wuyp@sina.com
2015-12-21
R738
A
1007-6611(2016)03-0232-06
10.13753/j.issn.1007-6611.2016.03.009

