兩個玉米自交系對紋枯病的抗病反應機制初探
戴 浩, 羅麗雅, 張翠蘋, 孫小芳, 龔國淑, 張 敏, 常小麗
(四川農業大學農學院植物病理系, 成都 611130)
?
兩個玉米自交系對紋枯病的抗病反應機制初探
戴浩,羅麗雅,張翠蘋,孫小芳,龔國淑,張敏,常小麗*
(四川農業大學農學院植物病理系, 成都611130)
玉米紋枯病是由立枯絲核菌(RhizoctoniasolaniKühn)引起的一種重要病害。具有優良性狀的自交系是開展玉米抗病品種選育的重要種質資源。本試驗以西南地區兩個優良玉米自交系R08與18-599R為材料,采用人工接種R.solani菌絲融合群AG1-IA,對成株期玉米進行了抗性鑒定,并對病原菌誘導后苗期玉米葉片上的活性氧(ROS)、抗病相關基因(PR1、ZmDREB2A、ZmERF3 和WIP1)表達及細胞壞死情況進行了動態檢測。結果顯示,R08對紋枯病表現為中抗,而18-599R為高感材料;受R.solani侵染后,玉米葉片ROS的積累在R08中較18-599R多;兩個自交系中基因表達量及表達時間存在顯著差異;R08葉片出現顯著的細胞壞死反應,而18-599R相對較輕。本研究表明兩個自交系對R.solani的抗性差異主要體現在相關抗病反應的時間和強度上,這為進一步研究玉米紋枯病抗病機理提供了依據。
玉米;立枯絲核菌;抗病性;活性氧;抗病相關基因
玉米(ZeamaysLinn.)是世界主要的食、飼兼用作物,也是重要的工業原料。在我國,玉米種植面積及產量已超過水稻和小麥,躍居三大作物之首[1]。近年來,由于玉米種植面積連年擴大,各地玉米病害加重,每年因各種病害導致的玉米產量損失達10%以上,嚴重影響了玉米產業發展及國家的糧食安全。其中,玉米紋枯病(maize banded leaf and sheath blight, BLSB)是世界玉米產區廣泛發生、危害嚴重的土傳病害之一,該病自1934年首次在美國南部報道以來,已在中國、印度、日本、南非、法國等國相繼發生[2]。在我國,玉米栽培種植緯度跨度大,地形地貌復雜,耕作栽培制度多樣,導致紋枯病菌群體結構多樣性,但主要為立枯絲核菌(Rhizoctoniasolani),且以菌絲融合群AG1-IA為優勢菌群[3-6],該菌群具有土傳性、寄主范圍廣、適應性強和高致病性等特點[6]。目前,防治玉米紋枯病大多采用減少越冬菌源,選用抗病品種,加強栽培管理并輔以藥劑保護的綜合防治措施,然而,玉米種質資源對紋枯病抗性受環境因素影響較大,年份間抗性存在較大差異,迄今為止,生產上尚無對玉米紋枯病抗性較好的品種[7-8]。因此,深入研究玉米對紋枯病的抗病機制,挖掘或培育具有廣譜、高效、穩定及持久抗病性品種受到越來越廣泛的重視。
植物受到病原菌侵染時,會誘導一系列的抗性反應,包括植物本身的某些結構和化學因子,如細胞壁角質、蠟質、木質素、特殊氣孔結構,以及降解病原菌細胞壁的幾丁質酶、葡聚糖酶、植物保護素和有毒酚類物質;另外,受病原菌誘導產生的一系列組織細胞生理生化反應,如抗氧化物酶激活、活性氧積累、細胞壞死反應及抗病相關基因的表達等[9-10]。研究植物與病原菌互作中的抗病反應信號,對于揭示植物的抗病機制具有重要意義。
玉米自交系18-599R和 R08均具有較高的配合力、遺傳背景單一、高產、抗逆、綜合性狀優良等特性,是西南地區玉米轉基因工程育種研究領域重要的優良受體自交系,但關于其對紋枯病的抗病機制尚不清楚[11-12]。本試驗以18-599R和 R08為研究材料,以紋枯病菌(R.solani) 菌絲融合群AG1-IA為供試菌株,通過AG1-IA接種后,對成株期玉米進行抗性鑒定, 并對接種后不同時間點自交系苗期葉片中的活性氧(ROS)、抗病相關基因表達及細胞壞死情況進行測定,初步研究兩個自交系對紋枯病的抗病機理,為玉米抗紋枯病育種提供依據。
1 材料與方法
1.1材料
供試玉米自交系18-599R和R08由四川農業大學玉米研究所提供;立枯絲核菌(R.solani)融合群菌株AG1-IA由四川農業大學植物病理系實驗室提供。
1.2生化試劑及儀器
RNA提取試劑盒:Trizol?Reagent試劑(Invitrogen, USA)、Trizol-Mate(Tiandz)購自天根公司;反轉錄試劑盒:PrimeScriptTMRT Reagent Kit with gDNA Eraser(TaKaRa),購自上海寶生物公司;PCR試劑盒:Taq PCR Master Mix(BioBasic)購自成都溫江區瑞金特公司;臺盼藍(Trypan blue)、核酸染料、瓊脂糖及其他試劑均購自成都市溫江區博大泰克公司;二氨基聯苯胺DAB(3,3-diaminobenzidine)試劑盒購自Sigma公司;臺式高速冷凍離心機(5424R,Eppendorf)、真空抽濾泵(Vacuubrand CVC2)、PCR基因擴增儀(1000TM Thermal Cycler,Bio-Rad)、電泳儀(DYY-6C型,北京六一儀器廠)、凝膠成像儀(Universal Hood II,Bio-Rad)由四川農業大學農學院植物病理系提供。
1.3試驗方法
1.3.1實驗室育苗及病原菌活化
將自交系18-599R和R08的種子用75%乙醇處理1 min,然后用5%的次氯酸鈉處理10 min,蒸餾水沖洗3~5次,將消毒后的玉米種子置于放有浸潤衛生棉的培養皿中,置于生長溫度25~28℃,相對濕度75%的溫箱中培養催芽,1 d后取出移栽于裝有滅菌基質土的直徑34 cm,高23 cm的花盆中。每個自交系玉米種5盆,每盆種3株玉米。
將處于保存狀態下的AG1-IA接入馬鈴薯葡萄糖瓊脂(又稱PDA)平板培養基上(馬鈴薯200 g,葡萄糖10 g,瓊脂8 g,水1 000 mL),并置于25~28℃恒溫下擴大培養至長滿整個培養皿待用。
1.3.2抗性鑒定及病斑擴展情況觀察
在玉米大喇叭口期對其接種,并于乳熟期進行抗性鑒定。將AG1-IA菌餅接種于玉米第6葉鞘部位,用保鮮膜包扎保濕,置于(25±3)℃,L∥D=16 h∥8 h的人工氣候室內培養,到乳熟期觀察并記錄發病情況,病害分級及抗性評價標準參考黃天述等[8]的方法。病情分級標準如下:0級,全株不發病;1 級,果穗位下第4葉鞘及以下葉鞘發病;3級,果穗位下第3葉鞘及以下葉鞘發病;5級,果穗位下第2葉鞘及以下葉鞘發病;7級,果穗位下第1葉鞘及以下葉鞘發病;9級,果穗位及其以上葉鞘發病。對玉米抗病性評價依據病級劃分為不同抗病類型:免疫(I,0級)、高抗(HR,1級)、抗(R,3級)、中抗(MR,5級)、感(S,7級)和高感(HS,9級)。
病斑擴展情況觀察采用苗期玉米(5~6葉期)離體葉片進行。取苗期玉米上、中、下葉片各1片,剪至長4 cm、寬2 cm的葉段,在葉脈一側接種1個R.solaniAG1-IA菌餅,放于墊有滅菌濾紙并加入少量無菌水的培養皿中,置于(25±3)℃下保濕培養,于接種后0、6、12、24、48、72和96 h記錄病斑擴展面積,計算病斑面積占總葉段面積的百分比,并采用SPSS軟件進行差異顯著性分析。每個時間點各3片葉,試驗重復3次。
1.3.3活性氧的測定
采用1.3.2的方法接種離體葉段,分別于接種后0、6、12、24、48、72、96 h對葉段進行DAB染色。DAB染色法參照前人的方法[13-14],并做了相應調整。取玉米葉段,蒸餾水洗凈后置于15 mL離心管中,加入DAB染液(1 mg/mL,pH 5.8)至完全浸沒葉段,用真空抽濾泵抽濾5 min 后,置于28℃避光保存8 h,隨后光照1 h至顯現紅棕色斑點,棄染液,無菌水漂洗3次洗去浮色后,加入脫色液(含75%乙醇,5%甘油,20%無菌水)并沸水浴直至葉片綠色完全脫去, 重復脫色一次, 樣品在脫色液中置于4℃冰箱內保存,采用顯微鏡拍照,并計算葉段染色面積占總葉段面積的百分比作為活性氧積累量。
1.3.4葉片細胞壞死情況檢測
采用1.3.2的方法,于接種后0、6、12、24、48、72、96 h取玉米葉段,細胞壞死反應檢測方法參照龍書生等[13]的方法,并稍作修改,用蒸餾水洗凈后將其置于培養皿中,加入臺盼藍染液(乳酸、水飽和酚、甘油、1 mg/mL臺盼藍體積比為1∶1∶1∶1)至完全浸沒葉段,28℃下放置4 h。隨后取出葉段, 用無菌水漂洗3次后放入脫色液(含有75%乙醇,20%甘油,5%無菌水)中并沸水浴直至葉片完全褪綠, 棄掉脫色液,并重復脫色一次,最后葉段保存于脫色液中,置于4℃冰箱內直至拍照記錄,并計算葉片染色面積占總葉片面積的百分比。
1.3.5抗病相關基因表達檢測
為了檢測兩個自交系在基因水平上對紋枯病菌AG1-IA的反應差異,本試驗選擇了前人已報道的玉米抗逆相關基因,包括傷害誘導蛋白WIP1 (wound-inducibe protein 1)[15]、病程相關蛋白家族基因PR1(pathogenesis-related protein 1)[15]、包含ERF/AP2結構域的玉米轉錄因子基因ZmDREB2A(ERF/AP2 domain containing transcription factor)[16]和乙烯響應轉錄因子基因ZmERF3(ethylene responsive transcription factor 3)[16]。核糖體小亞基基因18SrRNA作為持家基因,用于基因表達的半定量分析。
試驗采用1.3.2的接種方法,分別于接種后0 、6、12、24、48、72、96 h取3個葉段,用無菌水洗凈,滅菌紙擦干后加入液氮進行混合研磨,取200 mg,參照TRIzol試劑盒說明書提取總RNA。RNA樣品的質量經1.2%瓊脂糖凝膠電泳檢測,并用NanoDrop 2000超微量分光光度計檢測。cDNA的獲得按照反轉錄試劑盒說明進行,反應體系為:1 μg 總RNA,1 μL Anchored Oligo(dT)18 Primer、10 μL 2×TS Reaction Mix、1 μL Fracs Script RT/RI Enzyme Mix、gRNA Remover,用RNase-free Water補足至20 μL 。反應條件為:42℃,30 min;85℃,5 min;4℃,保持。反轉錄獲得的cDNA用ddH2O按1∶20稀釋后待用。
基因表達水平通過半定量RT-PCR(semi-quantitative RT-PCR)檢測。PCR擴增體系包含:12.5 μLTaqPCR Master Mix、9.5 μL 滅菌ddH2O、1 μL primer F、1 μL primer R、1 μL cDNA。反應條件為:94℃預變性5 min;94℃變性30 s,58℃退火20 s,72℃延伸20 s,循環40次;72℃延伸5 min,4℃保持。PCR擴增產物通過溶有核酸染料的2%的瓊脂糖凝膠電泳檢測,拍照,保存。電泳條件:110 V,25 min。所有引物序列見表1(由上海生工合成)。

表1 用于半定量RT-PCR基因表達分析的寡聚核苷酸引物列表
2 結果與分析
2.1自交系18-599R和R08對紋枯病菌的抗性
于玉米乳熟期調查了兩個自交系病情級別并劃分抗性等級,結果表明,18-599R和R08對紋枯病抗性存在差異,18-599R病級為9級,屬高感材料,而R08為5級,屬中抗或耐病材料。
苗期玉米離體葉片接種結果顯示,18-599R在接種后6 h開始,菌餅附近有明顯的菌絲;接種后12 h 內,18-599R開始出現水漬狀,而R08的接種部位均未出現病斑;接種后24 h,18-599R的菌餅附近開始有水漬狀小病斑出現,而R08葉片開始出現水漬狀;接種后48 h,水漬狀病斑面積擴大,且兩個自交系上均大量出現病斑;接種后72 h,葉片上病斑繼續擴大,且18-599R葉片開始出現褪綠;接種96 h后,兩個玉米葉片病斑與相鄰的病斑相連,并出現典型的云紋狀病斑。表明接種后24~48 h 為R.solani侵染階段,48 h 后被侵染的玉米葉片開始大量發病。同時,18-599R的葉片發病嚴重程度高于R08(圖1a)。接種后不同時間點測定的R08葉段上病斑面積占總葉段面積的百分比始終低于18-599R(圖1b),表明R08抗性較強,離體接種與盆栽接種結果一致。
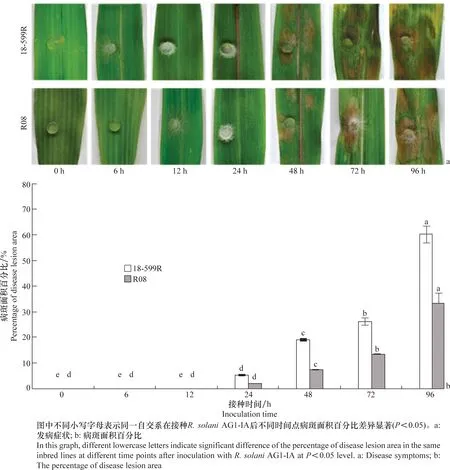
圖1 兩個玉米自交系葉片受紋枯病菌AG1-IA侵染后病斑擴展情況Fig.1 Development of disease lesion induced by Rhizoctonia solani AG1-IA on the leaves of two maize inbred lines
2.2自交系18-599R和R08葉片細胞內ROS積累情況
對18-599R和R08葉片細胞內ROS的測定,結果如圖2所示,兩個自交系在接種后6 h均在葉片上開始出現少量棕色斑點,表明有極少量的活性氧ROS產生;自接種后24 h開始,隨著時間推移,葉片上棕色斑點數量和面積開始增加,表明ROS積累逐漸增多,表現為經DAB染色形成的棕色斑塊較多且顏色較深。在相同時間下,R08葉片產生ROS面積百分比始終大于18-559R,表明自交系R08抗性較18-599R強。
2.3自交系18-599R和R08葉片細胞壞死情況
對18-599R和R08葉片產生的壞死斑測定結果顯示,自交系R08在接種后6 h開始出現少量的藍色斑點,表示葉片細胞壞死開始發生;接種12 h 后,18-559R葉片也開始出現細胞壞死。兩個自交系中,葉片細胞壞死面積隨接種后時間的延長而增加,且在接種后24 h,均大量出現(圖3a)。在相同時間點,18-559R葉片細胞壞死的面積均小于R08(圖3b),可見AG1-IA在自交系R08 葉片上的侵染受到一定限制,且R08抗性較好。

圖2 兩個自交系接種紋枯病菌AG1-IA后葉片中活性氧積累情況Fig.2 ROS accumulation in the leaves of two inbred lines at different time points after inoculation with Rhizoctonia solani AG1-IA

圖3 玉米在接種紋枯病菌AG1-IA后不同時間點葉片細胞壞死情況Fig.3 Cell death in maize leaves at different time points after inoculation with Rhizoctonia solani AG1-IA
2.4自交系18-599R和R08葉片抗病相關基因表達情況
對18-599R和R08的總RNA進行RT-PCR檢測,結果顯示,接種R.solaniAG1-IA后不同時間點,自交系18-599R和R08中持家基因18SrRNA的表達量基本相同(圖4),即為組成型表達,可用作基因表達定量分析的參照基因。
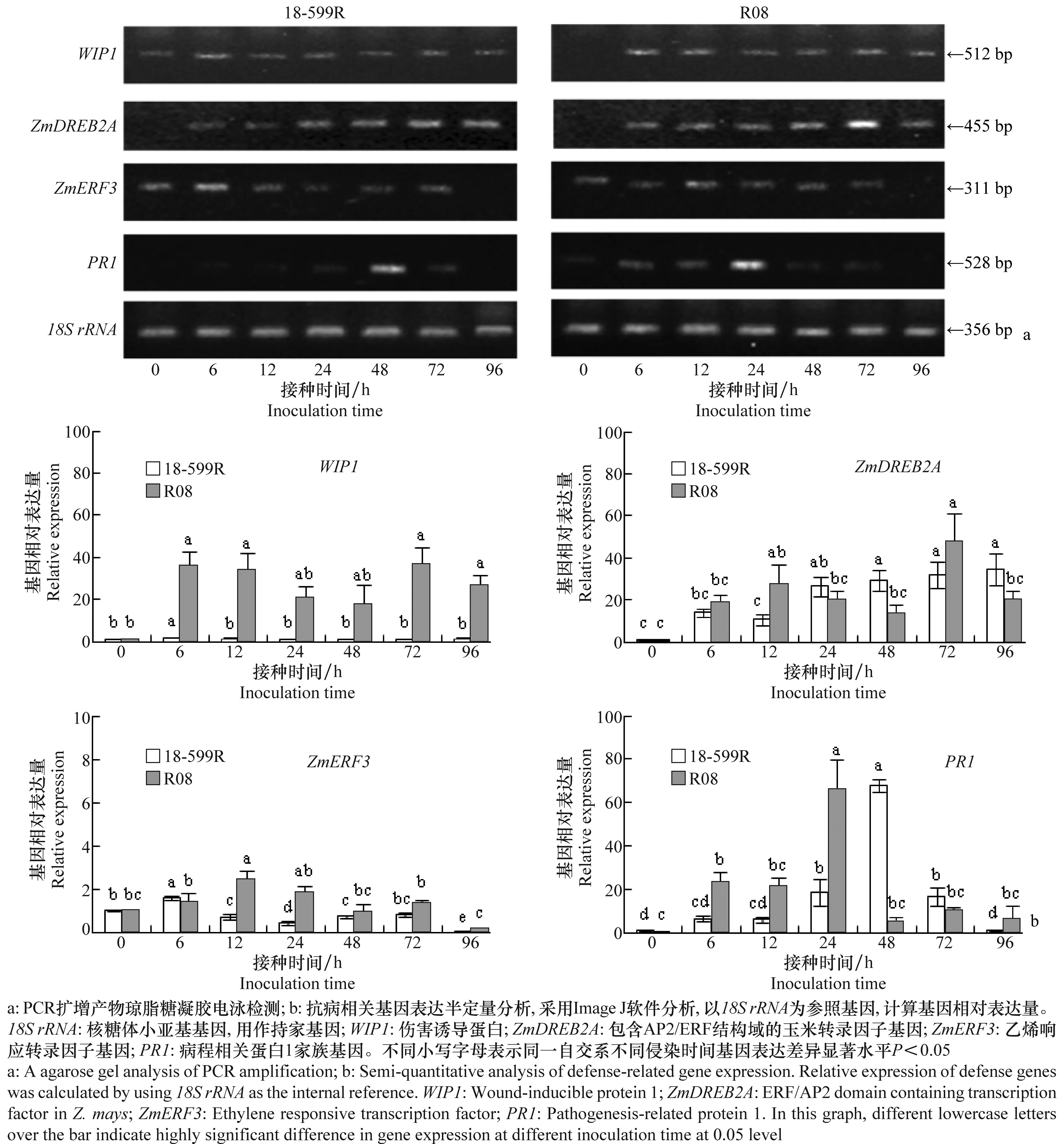
圖4 自交系18-599R 和 R08中抗病相關基因的表達情況Fig.4 Expressions of defense-related genes in 18-599R and R08
PCR擴增產物經瓊脂糖凝膠電泳檢測,如圖4a所示,接種R.solaniAG1-IA后6 h,R08中的WIP1被高水平誘導表達,接種后24 h和48 h其表達量稍有下降,其變化不顯著,而18-599R中WIP1的相對表達量很低,且不同時間點變化不大。對于ZmDREB2A基因,在接種后6 h在R08中迅速且大量表達,隨后略微降低,于72 h又出現一個表達高峰;而在18-599R中,其接種后在6 h時開始被誘導,隨后緩慢增加,于96 h時達到最大。與接種0 h相比,ZmERF3基因于接種后6 h時在18-599R表達量增加1.8倍,其表達量隨時間延長而降低,而在自交系R08中,該基因在12 h時出現表達高峰,與0 h相比表達量達到2.4倍,隨后降低。病程相關蛋白基因PR1在自交系R08接種R.solaniAG1-IA后6 h開始表達,在24 h時表達量最大(66倍),48 h后表達量顯著降低,而18-599R在接種后0 h時PR1基因未表達,接種前期微量表達且緩慢增加,到48 h時表達量最大(68倍),在隨后的72 h和96 h時顯著下降。綜上所述,抗病相關基因在兩個自交系接種后不同時間點均誘導表達,但其表達量存在差異,R08 中3個抗病基因WIP1、ZmDREB2A、ZmERF3和PR1在紋枯病菌AG1-IA接種前期(6~12 h)迅速誘導表達且表達水平高,而18-599R中,基因表達較遲且水平較低(ZmDREB2A,PR1),或被抑制(WIP1,ZmERF3)。
3 討論
本試驗研究了受紋枯病菌融合群菌株AG1-IA侵染后玉米自交系18-599R和R08的抗性差異及抗病相關防御反應,包括ROS的積累、葉片細胞壞死反應及抗病相關基因的表達情況,結果表明,兩個自交系對紋枯病菌表現不同抗性,且病原菌能誘導自交系葉片中ROS產生、葉片細胞壞死反應及抗病相關基因表達,但其抗病差異表現在反應時間和強度。本試驗初步探究了兩個自交系對R.solani的抗病機制,為進一步深入研究玉米對紋枯病抗病機理奠定了基礎。
具有優良性狀的玉米自交系是玉米抗病育種的重要種質資源,本試驗選用的18-599R和R08均為西南地區玉米育種研究領域重要的優良受體自交系,目前已被育成許多新品種,并被廣泛推廣及應用[11-12]。本試驗采用自交系盆栽人工接種法對紋枯病的抗性進行鑒定,結果表明,在相同條件下,兩個自交系對紋枯病菌R.solaniAG1-IA的抗性不同,18-599R為高感材料,R08表現為中抗,這與楊愛國等[17]的研究結果基本一致。與前人的田間抗性鑒定不同,本試驗采用室內人工氣候室盆栽植株進行,創造了病原菌侵染更有利的環境條件,因此發病較重。同時,由于玉米對紋枯病菌的抗性屬于多基因控制的數量性狀抗性[18],這類抗性的表達極易受氣候環境條件(溫度、濕度等)、種植制度、栽培措施等的影響,自交系抗病性受年度間環境相關因素的變化也會造成抗性級別的變化[19]。另外,近年來,由R08育成的玉米品種在西南地區推廣種植,也可能導致紋枯病菌群體結構的變化,加上環境因素變化的影響,使得R08對紋枯病的抗性可能發生變化。
活性氧(ROS)是生物體內與氧代謝有關的含氧自由基和易形成自由基的過氧化物的總稱,主要包括H2O2、OH-和O2-[20]。在正常情況下,植物體內ROS處于動態平衡狀態,一旦遭受外界脅迫,活性氧迅速積累[13-14,20]。大量的研究發現,活性氧的變化與植物抗病性具有密切的相關性[20]。本試驗中,接種R.solani后6 h,R08葉片中ROS(主要是H2O2)迅速產生且隨侵染過程發展不斷增加,而18-599R中ROS的產生則相對遲緩且誘導量較少(圖2),表明ROS變化與自交系對R.solani的抗性有關。
病原菌侵染常誘導植物體內一系列抗病相關基因的表達,并翻譯成抗病蛋白并被轉運到特定部位在病原菌侵入、擴展及定殖等不同階段起作用。本研究選取了前人已研究過的抗病相關基因WIP1[15]、PR1[15]、ZmDREB2A[16]和ZmERF3DREB[16],研究了不同自交系中這些基因表達與對紋枯病抗性之間的關系。WIP1(wound-inducible protein 1)是一個傷害誘導特異蛋白,屬于Bowman-Birk 蛋白酶抑制劑[21],是植物抵抗動物攝食和病原侵染的重要防御蛋白[22]。Chintamanani等[15]研究發現,在抗病基因Rp1-D21玉米突變植株中WIP1基因大量表達,且與玉米抗病相關的過敏性壞死反應密切相關。本試驗中, 自交系R08中WIP1從接種6 h 開始表達,隨后表達雖降低,但一直維持相對較高水平,而在18-599R中在不同接種時間其表達量均很低。ERF(乙烯應答元件結合因子)和DREB均屬于AP2/ERF家族中與植物抗病密切相關的轉錄因子,參與調控低溫、干旱、高鹽等非生物脅迫和病原菌侵染等生物脅迫[23]。研究發現,過量表達AtERF2基因的擬南芥植株對枯萎病、灰霉病等病害的抗性提高[24]。苜蓿中MtERF1基因表達與對R.solani的抗性有關,過量表達MtERF1基因的植株對立枯病等病害的抗性增強[25]。此外,過量表達ERF基因后,也能增強對某一種或幾種病害的抗性[26-27],表明該基因具有一定的廣譜抗病性,有助于培育廣譜抗病性的作物新品種。Nguyen等[16]通過低溫處理玉米后構建抑制消減文庫篩選發現,ZmDREB2A和ZmERF3受低溫、干旱、高溫及鹽脅迫后均能大量表達。本試驗中ZmDREB2A基因在兩個自交系中均從6 h 開始表達,隨著時間的推移,其表達量出現波動,表明除參與植物的抗旱、耐鹽性等非生物脅迫外,也與紋枯病菌侵染的生物脅迫有關系。ZmERF3基因在病原菌侵染6 h后在兩個自交系中均高水平表達,且該基因的表達較為持久,這說明了ZmERF3基因的差異調節可能為不同玉米抗紋枯病所共有的。PR1是病程相關蛋白,具有攻擊病原物、降解細胞壁大分子、降解病原物等多種功能,同時與植物過敏性反應和系統性獲得抗性有關[28-30]。本試驗中,R08中,PR1在接種后6 h開始誘導,24 h表達量最大,隨后降低,表明在侵染前期,表現較強抗性,而18-599R,其PR1基因的表達相對滯后,在接種后48 h表達量最多(圖4),其結果與樂美旺等[31]防御反應基因誘導表達研究結果基本相似,由此可推測R08對紋枯病的抗性反應較早,主要在侵入階段起作用。
寄主植物通過識別并限制病原物的擴展蔓延,常在侵染點誘發局部的細胞壞死反應,對于活體寄生菌或專性寄生菌來說,常表現為過敏性壞死反應(hypersensitive reaction,HR)[13],而對于玉米紋枯病來說,其病原菌(R.solani)是一種非專性致病菌,主要通過分泌各種酶類導致植物細胞壞死,形成壞死斑,并從死細胞中吸收營養。本試驗發現,在葉片相同部位細胞壞死被大量誘導,且在自交系18-599R較R08中表現更明顯,表明R08具有較強的抵御病原菌酶類的能力。同時,葉片細胞壞死部位與ROS產生部位吻合度較高,表明ROS的產生與寄主細胞壞死的發生有著密切聯系,這與王晨芳等[32]的研究結果相似。除了ROS外,van Loon等[33]1970年在煙草花葉病毒(TMV)侵染的煙草葉片中檢測到了與HR細胞壞死相關的蛋白, 被命名為病程相關蛋白(pathogenesis-related proteins,PRs)。這樣,許多抗病反應信號如活性氧ROS[20, 32]、病程相關基因的表達[15, 28-30, 33-35]等抗病信號均與植物細胞壞死反應的產生相關。
另外,本次試驗采用室內盆栽苗進行玉米對紋枯病抗性鑒定,由于R.solaniAG1-IA在室內人工培養條件下不產生無性孢子,侵染靠營養體菌絲和其組織體菌核,因此試驗采用菌餅接種,可能會對病原菌侵入的觀察有一定影響。本試驗對育種中兩個重要的玉米自交系材料和紋枯病菌R.solaniAG1-IA間的抗性反應進行了初步研究,對于玉米與紋枯病的互作機理還有待深入研究。由于作物對紋枯病的抗性是多基因控制的,這方面的研究在水稻上進行的較多、較深入,目前,四川農業大學水稻研究所已經對立枯絲核菌(R.solaniAG1-IA)進行了全基因組測序[36],這也為紋枯病菌致病機理研究提供了重要的信息源。
[1]鄒軍順, 李新果, 馬文峰. 中國玉米種植產業發展現狀分析及政策建議[J]. 糧食科技與經濟, 2014, 39 (1): 13-15.
[2]唐海濤, 榮延昭, 楊俊品. 玉米紋枯病研究進展[J]. 玉米科學, 2004, 12(1): 93-96.
[3]肖炎農, 李建生, 鄭用鏈, 等. 湖北省玉米紋枯病病原絲核菌的種類和致病性[J]. 菌物系統,2002, 21(3): 419-424.
[4]夏海波, 伍恩宇, 于金鳳. 黃淮海地區夏玉米紋枯病菌的融合群鑒定[J]. 菌物學報, 2008, 27(3): 360-367.
[5]牛福芳, 董明明, 趙新蘭, 等. 我國部分地區玉米絲核菌組成及其致病類型分析[J]. 植物保護學報, 2009, 36(4): 289-294.
[6]李菊,夏海波,于金鳳. 中國東北地區玉米紋枯病菌的融合群鑒定[J]. 菌物學報, 2011, 30(3): 392-399.
[7]榮廷昭, 李晚枕, 楊克誠, 等. 西南生態區玉米育種[M]. 北京: 中國農業出版社, 2003: 187-191.
[8]黃天述, 葉華智, 王曉鳴, 等. 玉米種質資源對紋枯病的抗性鑒定與評價[J]. 植物遺傳資源學報, 2005, 6(3): 291-295.
[9]Nürnberger T.Signal perception in plant pathogen defense [J]. Cellular and Molecular Life Sciences, 1999, 55(2): 167-182.
[10]Thordal-Christensen H.Fresh insights into processes of nonhost resistance [J]. Current Opinion in Plant Biology, 2003, 6(4): 351-357.
[11]蘇順宗, 吳玲, 張曉霞, 等. 以玉米自交系18-599為受體的轉基因再生體系優化[J]. 四川農業大學學報, 2013, 31(2): 122-124.
[12]熊堯宇, 李蘆江, 文水清, 等. 玉米自交系08-641不同選擇方向回交改良后代主要性狀的配合力[J]. 玉米科學, 2012, 20(1): 10-14.
[13]龍書生, 曹遠林, 李亞玲, 等. 小麥抗條銹病過敏性壞死反應中的活性氧代謝[J]. 西北農林科技大學學報, 2009, 37(11): 334-336.
[14]張小莉, 王鵬程, 宋純鵬. 植物細胞過氧化氫的測定方法[J]. 植物學報, 2009, 44(1): 103-106.
[15]Chintamanani S, Hulbert S H, Johal G S, et al. Identification of a maize locus that modulates the hypersensitive defense response, using mutant-assisted gene identification and characterization [J]. Genetics, 2010, 184: 813-825.
[16]Nguyen H T, Leipner J, Stamp P, et al. Low temperature stress in maize (ZeamaysL.) induces genes involved in photosynthesis and signal transduction as studied by suppression subtractive hybridization [J]. Plant Physiology and Biochemistry, 2009, 47: 116-122.
[17]楊愛國, 潘光堂, 葉華智, 等. 玉米自交系紋枯病抗性鑒定及抗病資源篩選[J]. 植物保護, 2003, 29(1): 25-28.
[18]Wisser R J, Balint-Kurti P J, Nelson R J.The genetic architecture of disease resistance in maize: a synthesis of published studies [J]. Phytopathology, 2006, 96: 120-129.
[19]趙茂俊. 抗玉米紋枯病種質資源篩選及QTL定位[D]. 成都: 四川農業大學, 2004.
[20]Levine A, Tenhaken R, Dixon R, et al. H2O2from the oxidative burst orchestrates the plant hypersensitive disease resistance response [J]. Cell, 1994, 79: 583.
[21]Rohrmeier T, Lehle L.WIP1, a wound-inducible gene from maize with homology to Bowman-Birk proteinase inhibitors[J]. Plant Molecular Biology, 1993, 22: 783-792.
[22]練云, 劉允軍, 王國英. 玉米受傷誘導基因wip1的啟動子克隆機表達分析[J]. 中國農業科學, 2014, 47(14):2889-2896.
[23]Gutterson N, Reuber T L.Regulation of disease resistance pathways by AP2/ERF transcription factors [J]. Current in Opinion Plant Biology, 2004, 7(4): 465-471.
[24]Pre M, Atallah M, Champion A, et al. The AP2/ERF domain transcription factor ORA59 integrates jasmonic acid and ethylene signals in plant defense [J]. Plant Physiology, 2008, 147 (3): 1347-1357.
[25]Anderson J P, Lichtenzveig J, Gleason C, et al. The B-3 ethylene response factor MtERF1-1 mediates resistance to a subset of root pathogens inMedicagotruncatulawithout adversely affecting symbiosis withRhizobia[J]. Plant Physiology, 2010, 154 (2): 861-873.
[26]Zhang Gaiyuan, Chen Ming, Li Liancheng, et al. Overexpression of the soybean GmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco [J]. Journal of Experimental Botany, 2009,60(13): 3781-3796.
[27]Liang Chen, Zhang Zhengyan, Liang Hongxia, et al. Over expression ofTiERF1 enhances resistance to sharp eyespot in transgenic wheat [J]. Journal of Experimental Botany, 2008, 59 (15): 4195-4204.
[28]Sels J, Mathys J, De Coninck B M, et al. Plant pathogenesis-related (PR) proteins: A focus on PR peptides [J]. Plant Physiology and Biochemistry, 2008, 46(11): 941-950.
[29]van Loon L C.Induced resistance in plants and the role of pathogenesis-related proteins[J]. European Journal of Plant Pathology, 1997, 103(9): 753-765.
[30]Chen Zhixiang, Malamy J, Henning J, et al. Induction, modification, and transduction of the salicylic acid signal in plant defense responses [J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(10): 4134-4137.
[31]樂美旺, 陳實, 潘慶華, 等. 水稻和稻瘟病菌互作中的信號傳導及防御反應基因誘導表達的研究[J]. 植物病理學報, 2007, 37(1): 42-49.
[32]王晨芳. 小麥與條銹病互作過程中活性氧迸發的組織學和細胞化學研究[D]. 楊凌:西北農林科技大學,2008.
[33]van loon L C, van Kammen A.Polyacrylamide disc electrophoresis of the soluble leaf proteins fromNicotianatabacumvar. ‘Samsun’ and ‘Samsun NN’ Ⅱ. Change in protein constitution after infection with tobacco mosaic virus[J]. Virology, 1970, 40: 190-211.
[34]Morris S W, Vernooij B, Titatarn S, et al. Induced resistance responses in maize[J]. Molecular Plant Microbe Interaction, 1998, 11: 643-658.
[35]Mittler R, Vanderauwera S.ROS signaling: the new wave?[J]. Trends in Plant Science, 2011, 16(6): 300-309.
[36]Zheng Aiping, Lin Runmao, Zhang Danhua, et al. The evolution and pathogenic mechanisms of the rice sheath blight pathogen [J]. Nature Communications, 2013, 4:1424.
(責任編輯:田喆)
Preliminary exploration of the defense mechanisms of two maize inbred lines against maize banded leaf and sheath blight
Dai Hao,Luo Liya,Zhang Cuiping,Sun Xiaofang,Gong Guoshu,Zhang Min,Chang Xiaoli
(Department of Plant Pathology, College of Agriculture, Sichuan Agricultural University, Chengdu611130, China)
Maize banded leaf and sheath blight (BLSB) is an important disease caused byRhizoctoniasolaniKühn, and screening and breeding of resistant maize germplasms is one of major strategies for disease control. In this study, after inoculation withR.solaniAG1-IA, the resistance of two inbred maize cultivars R08 and 18-599R was evaluated, and defense responses, including production of reactive oxygen species (ROS), expression of defense-related genes (PR1,ZmDREB2A,ZmERF3 andWIP1) and cell death, were examined on the detached leaves of maize seedlings at different indicated time points. The results showed that R08 was susceptible to AG1-IA, whereas 18-599R was highly susceptible. Reactive oxygen species (ROS) was accumulated in a higher level at indicated time points on the detached leaves of R08 than that of 18-599R.Expression of four defense-related genes was induced differently in timing and aptitude in the two inbred lines. Eventually, cell death appeared significantly in the leaves of R08 as compared to 18-599R.These data indicate that the difference of two maize inbred lines in resistance might be not of qualitative, but of quantitative nature, which provides significant basis for uncovering the resistance mechanism of maize toR.solani.
maize;Rhizoctoniasolani;disease resistance;ROS;defense-related gene
2015-06-14
2015-09-21
四川省教育廳一般項目(13ZB0278);四川省科技支撐計劃項目(2015NZ0040)
E-mail: xl_changkit@126.com
S 435.131
A
10.3969/j.issn.0529-1542.2016.04.005

